MOR分子筛对布洛芬手性转变反应的限域影响
2016-11-25卢宝岩赵晓波杨晓翠梅泽民王佐成
卢宝岩,赵晓波,佟 华,杨晓翠,梅泽民,王佐成
(白城师范学院 材料与设计计算中心,白城 137000)
MOR分子筛对布洛芬手性转变反应的限域影响
卢宝岩,赵晓波,佟 华,杨晓翠,梅泽民,王佐成
(白城师范学院 材料与设计计算中心,白城 137000)
采用量子力学与分子力学组合的ONIOM方法,研究了布洛芬在MOR分子筛12元环孔道限域环境的手性转变.反应通道研究发现:标题反应有7条路径,质子从手性碳的一侧向另一侧迁移可分别以羰基、甲基和羰基联合、羧基以及羧基和苯环联合作桥实现.反应势能面计算发现:在羧基内实现质子迁移后,手性C上的质子以新羰基O为桥迁移到苯环,接着苯环上的质子又以羰基为桥在纸面里迁移到手性碳的手性转变过程是主反应路径.决速步骤是质子从手性碳向新羰基氧的迁移过程,决速步骤吉布斯自由能垒是263.4kJ·mol-1,相对于裸反应决速步骤的能垒287.1kJ·mol-1有明显降低.结果表明:MOR分子筛12元环孔道对布洛芬的手性转变反应具有限域催化作用.
MOR分子筛; 布洛芬; 手性转变; ONIOM方法; 密度泛函; 微扰论; 过渡态
布洛芬(Ibu)的分子式是C13H18O2,根据其旋光性的不同,可分为左旋布洛芬(S-Ibu)和右旋布洛芬(R-Ibu).Ibu在临床上广泛用于治疗风湿性关节炎、强直性脊椎炎和神经炎等疾病.由于Ibu的重要作用,学者们对它进行了广泛的研究.文献[1]研究了在有机溶剂中Ibu的脂肪酶催化对映选择性酯化.文献[2]进行了外消旋Ibu的动力学模拟拆分和实验的研究.文献[3-5]的研究发现,R-Ibu的药理活性、疗效和安全性远远优于S-Ibu,R-Ibu的活性是S-Ibu的160倍,是外消旋体的1.6倍,S-Ibu在生命体内可以缓慢实现旋光异构,由左旋体转变为右旋体.
文献[6-7]的研究发现,孤立条件和水环境下Ibu分子的手性转变反应有4条路径,手性碳上的氢可以羰基和羧基作桥,从手性碳的一侧转移到另一侧,实现手性转变;2个水分子构成的链使决速步的吉布斯自由能垒从裸反应的287.1kJ·mol-1降为152.2kJ·mol-1.文献[8]的研究表明,扶椅型单壁碳纳米管的尺寸可以调控Ibu分子的手性转变能垒和反应路径,随着扶椅型单壁碳纳米管直径的减小,Ibu分子的手性转变反应路径由2条变为1条,决速步的反应能垒逐渐变小.
目前临床上使用的Ibu多数为消旋体,光学纯R-Ibu的价格极其昂贵[9].原因是利用不对称合成方法获得光学纯R-Ibu的成本很高,利用拆分方法获得R-Ibu的同时会产生几乎同等数量的“劣构体”S-Ibu.因此,寻找一个既经济又环保的方法使S-Ibu转化为R-Ibu极其重要.分子筛的价格低廉和绿色环保,研究分子筛对Ibu分子手性转变反应的催化具有实际意义.文献[10]研究了全硅MOR分子筛12元环孔道对α-Ala手性转变反应的限域催化作用.基于文献[8,10]的研究经验,考虑到Ibu分子的线度为1.01nm×0.53nm,MOR分子筛八元环和12元环窗口直径分别为0.26nm×0.57nm和0.65nm×0.70 nm,Ibu分子只能进入12元环,并且对MOR分子筛12元环孔道的组装不会太困难,本工作研究了MOR分子筛12元环孔道对Ibu分子手性转变过程的限域催化.
1 模型的选取与计算研究方法
为了比较充分地考虑孔道限域效应,采用周期性模型把含有12元环和部分8元环直孔道分子筛骨架包括进来,用含有240T的簇模型作为限域催化环境,用氢原子饱和模型截断处的硅原子,并把硅氢键长固定为1.46 nm,如图1(a)所示.
采用QM/MM组合的ONIOM(our own n-layered integrated molecule orbit and molecule mechanics)方法[11],研究标题反应,将分子筛与其内部的反应物等形成的包结物分为两层处理:内层反应底物为QM区,考虑到分子筛和其内部反应底物的长程作用,用CAM(Coulomb-attenuated hybrid exchange-correlation functional)结合DFT的长程校正泛函CAM-B3LYP[12-13]方法,基组采用6-31G(d,p);外层分子筛为MM区,采用分子力学的UFF(universal force field)力场[14]处理,为不使分子筛骨架形变,把外层固定,全参数优化极小点和过渡态[15-16].QM区采用微扰理论的MP2[17-18]方法,在ONIOM(MP2/6-311++G(2df, pd):UFF)理论水平,计算各包结物的单点能,利用Gtotal=ESP+Gtc(Gtotal、ESP和Gtc分别为高水平热校正的总吉布斯自由能、高水平的单点能和吉布斯自由能热校正)计算高水平的总吉布斯自由能,绘制出反应过程的吉布斯自由能势能面.通过对过渡态进行内禀反应坐标(IRC)计算[19],确认过渡态的可靠性.Ibu分子限域在MOR分子筛内的包结物记为Ibu@MOR,其他体系表示法类似.文中计算均采用Gaussian 09软件包[20]完成.
2 结果与讨论
在B3LYP/6-31+G(d, p)水平,优化的单体S型和R型Ibu的几何构型[6],见图1(b)和(c).
通过对图1的分析与计算发现,限域在MOR内的S-Ibu向R-Ibu异构反应通道总体可以分为2个,一个是手性碳上的质子以羰基氧为桥迁移,实现手性转变,我们称之为a通道;第二个是羧基内先实现质子迁移,形成新的羰基,而后手性碳上的质子以新的羰基氧为桥迁移,实现手性转变,我们称之为b通道.下面对2个通道分别进行讨论.
2.1 S_Ibu在a通道不同路径上的手性转变反应机理
S_Ibu限域在MOR内在a通道的手性转变反应可以分为两条路径a1和a2,见图2(第670页,布洛芬分子的纵向与分子筛的纵向相同,并且放在分子筛中间处,以使限域影响充分).
对于a1路径,首先是反应物包结物S-Ibu@MOR,经手性碳上的质子740H直接向羰基氧739O迁移的过渡态a1TS1@MOR,异构成为中间体包结物a1INT1@MOR.此基元反应的反应物S-Ibu@MOR的720C)—740H键长是0.10914nm,a1TS1@MOR的720C与740H的距离为0.15427 nm,说明a1TS1@MOR的720C和740H已经断键,过渡态a1TS1@MOR会产生比较高的能垒.对于a2路径,首先是S-Ibu@MOR,经过手性碳上的质子740H向甲基碳724C与甲基上的质子732H向羰基氧739O的双质子协同迁移过渡态a2TS1@MOR,异构成为中间体包结物a2INT1@MOR.此基元反应的S-Ibu@MOR的724C—732H键长也是0.10914 nm,a2TS1@MOR的720C与740H的距离为0.12219 nm,724C与732H的距离为0.17140 nm,720C与740H和724C与732H均由成键变为断键.a2TS1@MOR断2个C-H键,说明其结构不稳定,具有较高的能量,会产生较高的能垒.
计算表明a1INT1@MOR和a2INT1@MOR为同一构型,即为同一物种,只是原子序号排列不同,他们以后的异构过程相同,我们接着a2INT1@MOR的异构过程(见图2)进行讨论.
a2INT1@MOR的异构又分为2个分路径am和an.am分路径是,a2INT1@MOR经过质子化羧基的732H在纸面里向手性碳720C迁移的过渡态amTS2@MOR,异构为产物包结物am_RP_Ibu@MOR,实现手性转变.an分路径是,a2INT1@MOR经过质子化羧基的732H向甲基碳720C和甲基上的733H在纸面里向手性碳720C双质子协同迁移的过渡态anTS2@MOR,异构为产物包结物an_RP_Ibu@MOR,实现手性转变.这2个基元反应与路径a1和a2的第1个基元反应雷同,这里不做详细说明.
在ONIOM(MP2/6-311++G(2df, pd):UFF)∥ONIOM(CAM-B3LYP/6-31G(d, p):UFF)双理论水平,全参数优化各个驻点包结物,对诸过渡态进行IRC计算,计算高水平下的单点能.各驻点包结物的几何构型和过渡态包结物在虚频下的振动模式见图2,对诸过渡态的频率分析和IRC计算,确认了过渡态的可靠性.各驻点包结物的热校正吉布斯自由能和过渡态虚频(Ima)见表1.驻点包结物的单点能,热校正后的总自由能、选取S-Ibu@MOR的总自由能为零点的相对总自由能亦见表1.
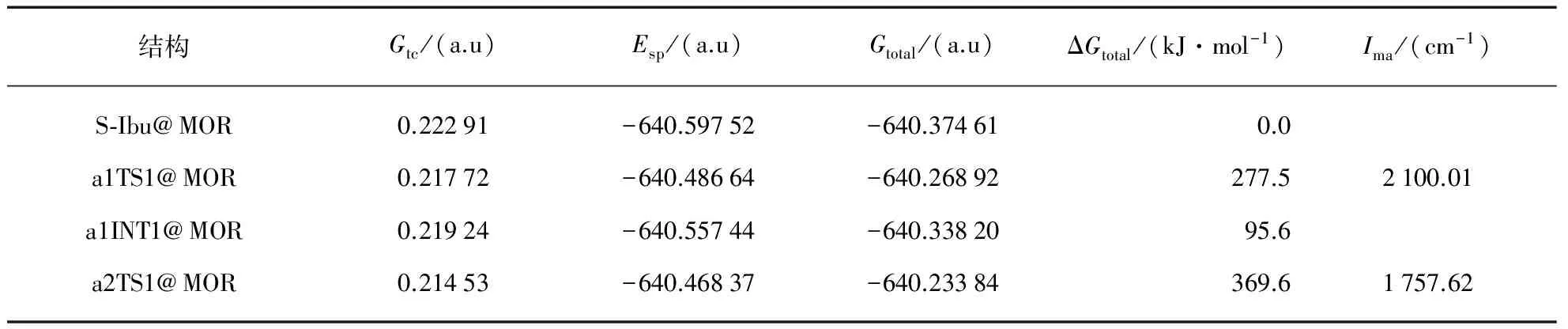
结构Gtc/(a.u)Esp/(a.u)Gtotal/(a.u)ΔGtotal/(kJ·mol-1)Ima/(cm-1)S⁃Ibu@MOR0.22291-640.59752-640.374610.0a1TS1@MOR0.21772-640.48664-640.26892277.52100.01a1INT1@MOR0.21924-640.55744-640.3382095.6a2TS1@MOR0.21453-640.46837-640.23384369.61757.62
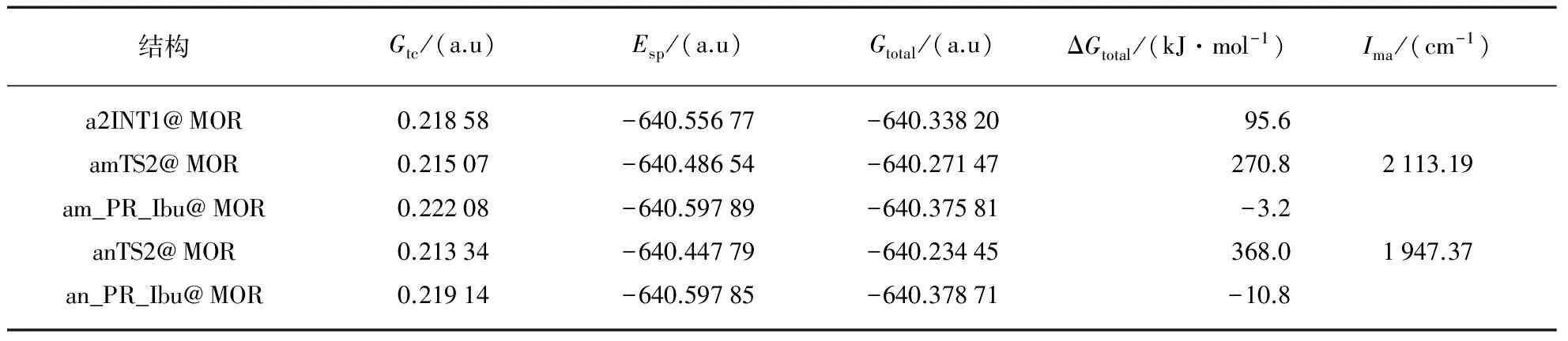
(续表)
根据上面表1的数据,绘制了标题反应在a通道上不同反应路径的吉布斯自由能势能面,见图3.
根据图3可以看出,标题反应a通道的4个反应路径S-Ibu→a1TS1@MOR→a1INT1@MOR→amTS2@MOR→am_PR_Ibu@MOR、S_Ibu→a1TS1@MOR→a1INT1@MOR→anTS2@MOR→an_PR_Ibu@MOR,S_Ibu→a2TS1@MOR→a2INT1@MOR→amTS2@MOR→amP_R_Ibu@MOR,S_Ibu→a2TS1@MOR→a2INT1@MOR→anTS2@MOR→anP_R_Ibu@MOR.比较而言,1路径为优势反应路径,第1步基元反应为决速步骤,能垒为277.5kJ·mol-1,是由手性碳上的H直接向羰基氧739O迁移的过渡态产生的.比计算的裸反应此路径的能垒295.8kJ·mol-1明显降低,说明MOR分子筛对S_Ibu在a通道的旋光异构具有限域催化作用.
2.2 S_Ibu在b通道不同路径上的手性转变反应机理
S_Ibu限域在MOR内,在b通道的手性转变反应历程见图4.首先,反应物包结物S-Ibu@MOR(见图2),经羧基内质子迁移的过渡态bTS1@MOR,741H从738O迁移到739O,异构成产物中间体包结物bINT1@MOR,此时羟基变成了羰基725C—738O,新羰基氧738O有接受质子的能力,便于手性碳720C上的740H向其迁移.此基元反应中的S-Ibu@MOR的738O—741H键长为0.09707nm,bTS1@MOR的738O—741H键长为0.12960nm是断键,bTS1@MOR会产生一定的能垒.由于S-Ibu@MOR的738O—741H键不是很牢,同时739O有孤对电子,具有一定的接受质子的能力,因此,过渡态包结物bTS1@MOR产生的能垒相对来说不会很高.然后,bINT1@MOR经过740H从手性碳720C向新羰基氧738O迁移的过渡态bTS2@MOR,异构成为新的产物中间体包结物bINT2@MOR.bTS2@MOR的720C和740H之间的距离为0.15302nm,是断键,bTS2@MOR会产生较高的能垒.由于bTS2@MOR的720C和740H之间距0.15302nm小于a1TS1@MOR的720C与740H的距离0.15427nm,因此bTS2@MOR产生的能垒会略低于a1TS1@MOR产生的能垒,后面的计算表明,此分析是正确的.
bINT2@MOR以后的反应历程又分为2个路径b1和b2,见图4(第672~673页).
b1路径是bINT2@MOR经740H向苯环上的711C迁移的过渡态b1TS3@MOR,异构成为中间体包结物b1INT3@MOR.此基元反应bINT2@MOR的738O—740H键长为0.096873nm,b1TS3@MOR中的738O—740H键长为0.13023nm,738O—740H由成键变为断键,b1TS3@MOR会产生较高的能垒.接下来从b1INT3@MOR开始又分为2个分路径x和y,记为b1x和b1y,见图4.b1x路径是,b1INT3@MOR经苯环上的716H从711C向738O迁移的过渡态b1xTS4@MOR,异构成为中间体包结物b1xINT4@MOR.此过程是711C—716H从成键变为断键,所以b1xTS4@MOR也会产生不低的能垒;b1xINT4@MOR的二面角720C—725C—738O—716H是10.458°,说明716H在骨架720C—725C—738O平面里侧,具有从纸面里侧向手性碳迁移从而实现手性转变的优势.最后,b1xINT4@MOR经过716H从738O在纸面里向手性碳720C迁移的过渡态b1xTS5@MOR,异构成为产物包结物b1x_P_RIbu@MOR,在b1x路径完成手性转变.此基元反应的b1xINT4@MOR的738O—716H是0.09675nm,b1xTS5@MOR的738O—716H是0.12632nm,738O—716H从成键变为断键,说明b1xTS5@MOR会产生较高的能垒.b1y路径是,b1INT3@MOR经苯环上的716H在纸面里从711C直接向手性碳720C迁移的过渡态b1yTS4@MOR,异构成为产物包结物b1x_P_RIbu@MOR,在b1y路径完成手性转变.b1yTS4@MOR的711C和716H距离为0.17011nm,是断键,即苯环上的711C—716H从成键变为断键,又因为手性碳720C接受质子的能力并不强,因此,过渡态b1yTS4@MOR产生的能垒会很高,后面的计算说明了这一点.
b2路径是,经质子化羧基的741H绕725C—739O轴转动的过渡态b2TS3@MOR,bINT2@MOR异构成为b2INT3@MOR,741H转到了距离手性碳和手性碳上的甲基较近的位置.结构分析表明,741H在b2INT3@MOR构型中的空间位置基本同于732H在a2INT1@MOR构型中的空间位置,计算研究表明b2INT3@MOR以后的异构过程雷同于a2INT1@MOR以后的过程,从略.
在计算a通道的理论水平,全参数优化了b通道各个反应路径的驻点包结物,同样对诸过渡态进行IRC计算,计算高水平下的单点能.得到b通道各个路径各驻点包结物的几何构型和过渡态包结物在虚频下的振动模式,见图4.对诸过渡态的频率分析和IRC计算,确认了过渡态的可靠性.各驻点包结物的吉布斯自由能热校正和过渡态虚频(Ima)见表2.驻点包结物的高水平单点能,热校正的总自由能、选取S-Ibu@MOR的总自由能为零点的相对总自由能亦见表2.
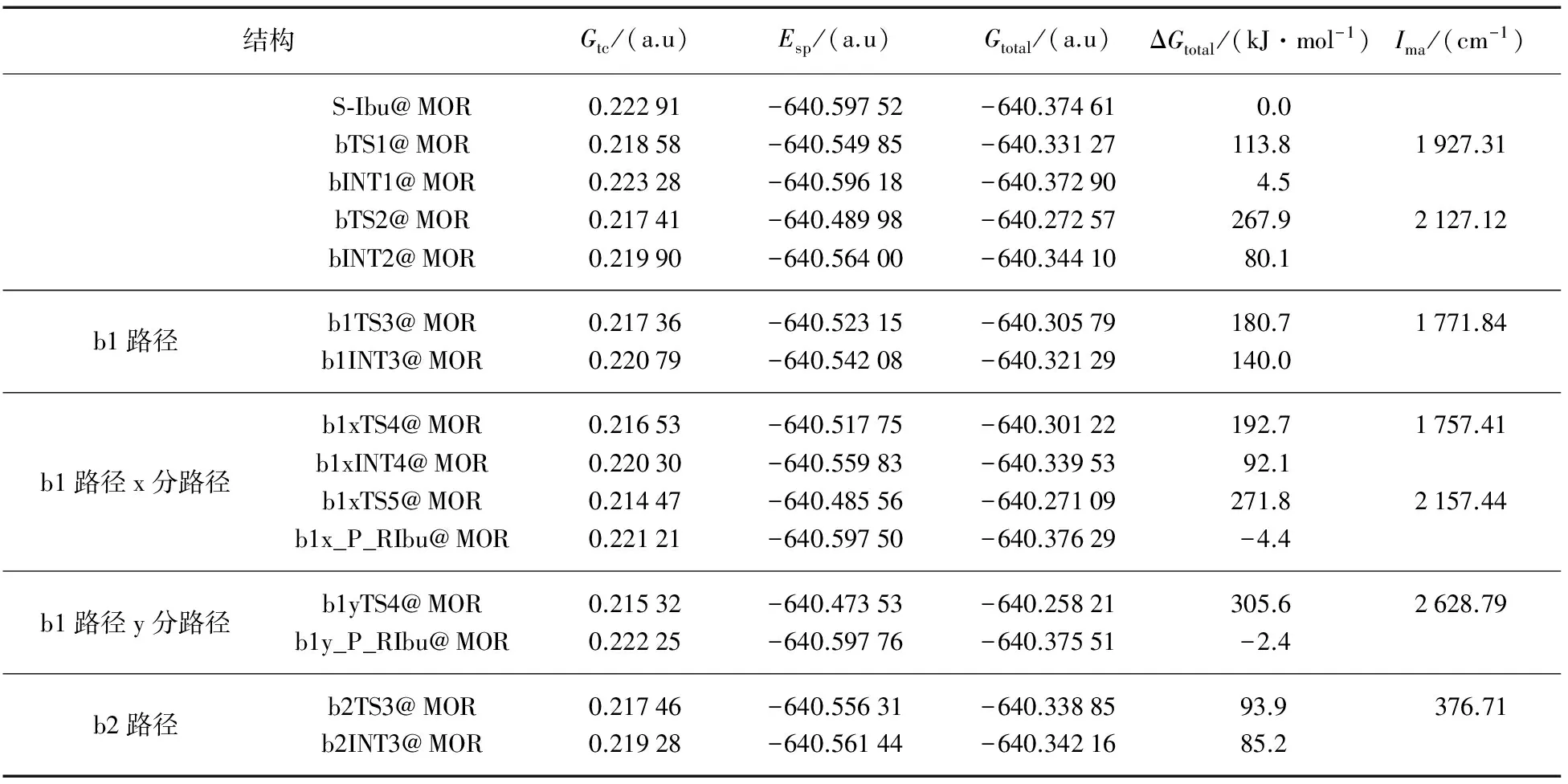
结构Gtc/(a.u)Esp/(a.u)Gtotal/(a.u)ΔGtotal/(kJ·mol-1)Ima/(cm-1)S⁃Ibu@MOR0.22291-640.59752-640.37461 0.0bTS1@MOR0.21858-640.54985-640.33127113.81927.31bINT1@MOR0.22328-640.59618-640.372904.5bTS2@MOR0.21741-640.48998-640.27257267.92127.12bINT2@MOR0.21990-640.56400-640.3441080.1b1路径b1TS3@MOR0.21736-640.52315-640.30579180.71771.84b1INT3@MOR0.22079-640.54208-640.32129140.0b1路径x分路径b1xTS4@MOR0.21653-640.51775-640.30122192.71757.41b1xINT4@MOR0.22030-640.55983-640.3395392.1b1xTS5@MOR0.21447-640.48556-640.27109271.82157.44b1x_P_RIbu@MOR0.22121-640.59750-640.37629-4.4b1路径y分路径b1yTS4@MOR0.21532-640.47353-640.25821305.62628.79b1y_P_RIbu@MOR0.22225-640.59776-640.37551-2.4b2路径b2TS3@MOR0.21746-640.55631-640.3388593.9 376.71b2INT3@MOR0.21928-640.56144-640.3421685.2
依据上面表2的数据,绘制了Ibu限域在MOR分子筛12元环孔道,在b通道不同路径实现手性转变过程的吉布斯自由能势能面示意图,见图5.
从图5可以看出,标题反应在b通道的3个分反应路径上,具有共同的决速步骤bS_INT1@MOR→bTS2@MOR→bINT2@MOR,能垒为263.4kJ·mol-1,是由手性碳上的H向新羰基氧738O迁移的过渡态产生的.比裸反应情况下此路径的决速步能垒287.1kJ·mol-1明显降低,其他势垒相对于裸反应也均有所降低[7],说明MOR分子筛对S_Ibu在b通道的旋光异构具有限域催化作用,可以作为S_Ibu向R_Ibu 异构反应的纳米反应器.综合图3和5可知,b通道的b1路径的b1y分路径是标题反应的最优路径,第2个高能垒是165.6kJ·mol-1,相对于别的路径略低些.
反应通道研究发现:标题反应有7条路径,质子从手性碳的一侧向另一侧迁移可分别以羰基、甲基和羰基联合、羧基以及羧基和苯环联合作桥实现.反应势能面计算发现:标题反应在b通道的S-Ibu→bS-TS1@MOR→bS_INT1@MOR→bTS2@MOR→bINT2@MOR→b1TS3@MOR→b1INT3@MOR→b1yTS4@MOR→b1yP_R-Ibu@MOR的手性转变过程是主反应路径.决速步骤bS_INT1@MOR→bTS2@MOR→bINT2@MOR的能垒为263.4kJ·mol-1,是质子从手性碳向新羰基氧迁移的过渡态产生的,相对于裸反应决速步的能垒287.1kJ·mol-1有明显降低.研究结果表明:MOR分子筛12元环孔道对布洛芬的手性转变反应具有限域催化作用,可以作为Ibu实现手性转变的纳米反应器.
全硅-MOR分子筛对Ibu的手性转变虽然具有一定的限域催化作用,但催化作用并不是十分理想.改性的钛-MOR分子筛对Ibu手性转变的催化、MOR分子筛与其他环境对Ibu手性转变的共催化、铝-MOR分子筛对Ibu手性转变的酸催化以及其他分子筛对Ibu手性转变的催化等研究可能更具理论和实际意义;模型截断处的硅原子用羟基饱和可能更合理;外层分子筛采用半经验am1或从头算的HF方法计算更能体现分子筛与反应物之间的化学作用.相关的工作正在进行中.
[1] AMÉLIE D, MICHAEL T, ROBERT L. Corresponding lipase-catalyzed enantioselective esterification of ibuprofen in organic solvents under controlled water activity [J].EnzymeandMicrobialTechnology, 1998,22(4):212-216.
[2] SUBHASH B, LONG W S. Enzymatic membrane reactor for the kinetic resolution of racemic ibuprofen ester:Modeling and experimental studies [J].ChemicalEngineeringScience, 2004,59(22/23):5061-5068.
[3] 肖方清.右旋布洛芬的制备 [J].中国医药工业杂志,2000,31(11):486-488.
[4] 林文辉.手性药物布洛芬的体内药物动力学研究 [D].沈阳:沈阳药科大学,2004:8-10.
[5] CHENG H, ROGERS J D, DEMETRIADES J L,etal. Pharmacokinetics and bioinversion of ibuprofen enantiomers in humans [J].PharmaceuticalResearch, 1994,11(6):824-830.
[6] 邹晓威,梅泽民,王佐成,等.孤立条件下布洛芬分子手性转变过程的理论研究 [J].原子与分子物理学报,2015,32(2):173-180.
[7] 梅泽民,王佐成,闫红彦,等.水环境下布洛芬分子的手性转变机理 [J].吉林大学学报(理学版),2015,53(2):331-339.
[8] 王佐成,梅泽民,吕洋,等.扶手椅型单壁碳纳米管的尺寸对布洛芬分子手性转变的限域影响 [J].复旦学报(自然科学版),2015,54(2):234-244.
[9] 赵亚华.分子生物学教程 [M].北京:科学出版社,2011:5-6.
[10] 马宏源,王佐成,高峰,等.MOR分子筛12元环孔道对α-丙氨酸手性转变反应的限域影响 [J].复旦学报(自然科学版),2016,55(1):133-144.
[11] SVENSSON M, HUMBEL S, FROESE R D J,etal. ONIOM:A multilayered integrated MO+MM method for geometry optimizations and single point energy predictions. A test for Diels-Alder reactions and Pt(P(t-Bu)3)2+H2oxidtivae addition [J].PhysicalChemistry, 1996,100(50):19357-19363.
[12] KOBAYASHI R, AMOS R D. Erratum to The application of CAM-B3LYP to the charge-transfer band problem of the zincbacteriochlorin-bacteriochlorin complex [J].ChemPhysLetts, 2006,420:106-109.
[13] YIN S W, DAHLBOM M G, CANFIELD P J,etal. Assignment of the Qy absorption spectrum of photosystem-I from thermosynechococcus elongatus based on CAM-B3LYP calculations at the PW91-optimized protein structure [J].PhysChemB, 2007,111(33):9923-9930.
[14] RAPPE A K, CASEWIT C J, COLWELL K S,etal. UFF, a full periodic table force field for molecular mechanics and molecular dynamics simulations [J].JournaloftheAmericanChemicalSociety, 1992,114(25):10024-10053.
[15] GARRETT B C, TRUHLAR D G. Generalized transition state theory. Classical mechanical theory and applications to collinear reactions of hydrogen molecules [J].JournalofPhysicalChemistry, 1979,83(8):1052-1079.
[16] GARRETT B C, TRUHLAR D G. Criterion of minimum state density in the transition state theory of bimolecular reactions [J].TheJournalofChemicalPhysics, 1979,70(4):1593-1598.
[17] 徐光宪,黎乐民,王德民.量子化学(中册) [M].北京:科学技术出版社,1985:962-986.
[18] BINKLEY J S, POPLE J A. Moeller-Plesset theory for atomic ground state energies [J].IntJQuantumChem, 1975,9(2):229-236.
[19] ISHIDA K, MOROKUMA K, KOMORNICKI A. The intrinsic reaction coordinate. An ab initio calculation for HNC→HCN and H-+ CH4→CH4+H-*[J].TheJournalofChemicalPhysics, 1977,66(5):2153-2156.
[20] FRISCH M J, TRUCKS G W, SCHLEGEL H B,etal. Gaussian 09. Revision D.01[CP]. Pittsburgh USA:Gaussian, Inc., Wallingford CT, 2013.
The Confined Effect of the MOR Zeolite on the Chiral Transition Reaction of Ibuprofen Molecules
LU Baoyan, ZHAO Xiaobo, TONG Hua, YANG Xiaocui, MEI Zemin, WANG Zuocheng
(Materials and Design Computing Center, Baicheng Normal College, Baicheng 137000, China)
The chiral transition of ibuprofen molecules confined in the MOR zeolite 12-ring channels was studied by introducing the ONIOM methods using combination of quantum mechanics and molecular mechanics. The study of reaction channel shows that there are seven paths in the title reaction where proton respectively using carbonyl and Methyl/carbonyl groups or carbonyl and carbonyl/benzene ring groups as the transfer bridge from one side to the other of chiral C. Calculations of potential energy surface show that after the implementation of a proton transfer in the carboxyl, the chiral transition,that protons in the chiral C transfer to the benzene ring using the new carbonyl O as the migration bridge, then protons in the benzene ring transfer to chiral C in paper-based using the carbonyl O as the migration bridge, is the main reaction paths. the chiral transition process of chiral carbon is the main reaction path. The protons transfer process from chiral C to the new carbonyl O is the determining step, the gibbs free energy barrier of the step-determining the gibbs free energy barrier of the step-determining step,where protons transfer from chiral C to the new carbonyl O, is 263.4kJ·mol-1, which is significantly lower than the gibbs free energy barrier 287.1kJ·mol-1of the step-determining step of bare reaction. The results show that the MOR zeolite 12-ring channels has a confined catalysis on the chiral transition of ibuprofen molecules.
MOR zeolite; Ibuprofen; chiral transition; Our own n-layered integrated molecule orbit and molecule mechanics methods; density functional theory; perturbation theory; transition state
0427-7104(2016)05-0668-09
2016-05-16
吉林省科技发展计划项目(20160101308JC)
卢宝岩(1960—),男,教授;梅泽民(1963—),男,教授,通讯联系人;E-mail:Zeminmei@163.com;王佐成(1963—),男,副教授,E-mail:wangzc188@163.com.
O 641(O 641.12;O 641.12)
A
