P-cadherin在‘高山美利奴羊’胚胎皮肤毛囊基板形成过程中的表达规律
2016-11-24刘善博岳耀敬郭婷婷王天翔史兆国袁超王喜军刘继刚刘建斌张玲玲郭健牛春娥孙晓萍冯瑞林李范文杨博辉
刘善博,岳耀敬,,郭婷婷,王天翔,史兆国,袁超,王喜军,刘继刚,刘建斌,张玲玲,郭健,牛春娥,孙晓萍,冯瑞林,李范文,杨博辉,
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.中国农业科学院羊育种工程中心,中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050;3.甘肃省绵羊繁育技术推广站,甘肃 张掖 734031)
P-cadherin在‘高山美利奴羊’胚胎皮肤毛囊基板形成过程中的表达规律
刘善博1,岳耀敬1,2,郭婷婷2,王天翔3,史兆国1,袁超2,王喜军3,刘继刚3,刘建斌2,张玲玲2,郭健2,牛春娥2,孙晓萍2,冯瑞林2,李范文3,杨博辉1,2
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.中国农业科学院羊育种工程中心,中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050;3.甘肃省绵羊繁育技术推广站,甘肃 张掖 734031)
【目的】 研究P-cadherin在‘高山美利奴羊’皮肤毛囊(hairfollicle,HF)基板形成过程中的分布及表达情况,初步探讨P-cadherin是否可以作为‘高山美利奴’羊毛囊基板的标记物.【方法】 以90-114 d胎龄的‘高山美利奴羊’腹部皮肤作为材料,通过冰冻切片、HE染色、荧光定量PCR、免疫组化技术研究P-cadherin在毛囊基板形成过程中的表达规律.【结果】 免疫组化结果显示,P-cadherin在胚胎毛囊形成时期的表皮、表皮基底层、真皮、隆突基底层、基板以及毛芽中都呈现阳性表达.荧光定量结果显示,在胎龄90、96、102、108、114 d的相对表达量分别为(0.016 7±0.008 4)(0.113 4±0.052 9)(0.937 8±0.245 3)(0.068 4±0.026 8)(0.062 3±0.045 6).90 d与96 d相比差异显著(P=0.049 3<0.05),96 d与102 d相比差异不显著(P=0.088 9>0.05),102 d与108 d相比差异显著(P=0.023 5<0.05),108 d与114 d相比差异不显著(P=0.512 4>0.05).96 d以后的相对表达量高于90 d的相对表达量.90 d到102 d相对表达量逐渐升高,102 d以后相对表达量逐渐降低,108 d以后相对表达量趋于平稳,但是略高于114 d的相对表达量,有降低的趋势.【结论】初步可以断定P-cadherin可以作为‘高山美利奴羊’毛囊基板的标记物.
甘肃‘高山美利奴羊’;毛囊基板;P-cadherin
影响细毛羊经济效益的主要性状有羊毛的产量、细度、净毛率等,这些性状中产毛量与毛囊的(hair follicle,HF)发育有直接的关系.毛囊是控制毛绒生长的器官.‘高山美利奴羊’次级毛囊形态发生时期已经被确定[1-4].毛囊形态发生开始于基板(placode,P)的形成,基板是间叶细胞凝集于排列整齐的表皮细胞下方形成的一种特殊结构,这些特定的结构之间的相互作用进一步引起基板的生长[5].基板作为毛囊发育的前体器官,其形成过程涉及一系列复杂的表皮和真皮之间的信号通路.目前在毛囊基板形态发生分子机制的研究中,多以多种类型组织(真皮、表皮、毛囊等)混合的皮肤做为起始样本,并未分离出匀质性基板组织,这使得调控基板发生的关键基因生物差异有可能被平均值所掩盖或是被误认做为技术噪音[6],亟需寻找一种基板细胞标志物,以高效分离基板细胞进行基板单细胞功能基因组研究.
目前,P-cadherin常用于人和鼠等毛囊基板形态发生研究中的标志物.P-cadherin属于钙粘素(Cadherin)家族里面的一种,由CDH3编码,其表达受Wnt/β-catenin信号通路的调节.研究结果表明,HF从原始表皮开始进行初始分化时Wnt信号能够促进β-catenin的产生.当胚胎表皮细胞重新定位形成上皮芽胞随后形成成熟的HF时β-catenin/LEF1转录复合物会使E-cadherin的表达量减少.因此,在这个关键时期,间质细胞上皮界面主要含有的是P-cadherin,作为毛发的前体细胞[7-8].目前对于P-cadherin在哺乳动物组织尤其是在人类和小鼠毛囊里面的分布和表达情况已经有了比较深入的研究.其某些表达特性与报道的关于毛囊和表皮标记物的特性有些相似.研究证明,其永恒存在于小鼠表皮,并且在外根鞘(ORS)以及最接近真皮乳头的毛母质细胞(HMCs)和次级毛芽(KCs)中表达[8].有报道显示,P-cadherin在7-8周人类胚胎皮肤中基底层细胞中有表达,但是在上皮细胞中不表达[9].此外,在人类医学的相关研究中证明P-cadhrin与脱发、秃发和多毛症等毛发疾病密切相关[10-11].研究显示,在人类毛囊发育过程中,P-cadhrin是唯一一个在内部毛母质细胞(IHM)表达的钙粘蛋白[8].但P-cadhrin是否是‘高山美利奴羊’毛囊基板的标记物还需进一步研究.
因此,本研究通过实时荧光定量PCR技术和免疫组化技术,研究‘高山美利奴羊’胎儿皮肤HF形态形成过程中基板形成时期P-cadhrin在mRNA水平和蛋白水平的表达情况,初步研究P-cadhrin在‘高山美利奴羊’毛囊基板形态发生中的调控作用,以期为阐明P-cadhrin能否作为‘高山美利奴羊’毛囊基板形态发生调控中的标记物和研究绵羊HF基板形成的分子调控机制研究提供试验数据和理论依据.
1 材料与方法
1.1 试验材料
在甘肃省绵羊繁育技术推广站(原甘肃省皇城绵羊繁育试验场)选择体格均匀的经产2~3岁‘高山美利奴母羊’15只,用同一只种公羊进行人工授精,以人工授精日为第0日,分别于胚胎90、96、102、108、114 d日龄剖取胎儿,每次3只,在其体侧部切取2 cm2的皮肤.0.9%生理盐水冲洗处理后装入冻存管,迅速投入液氮中保存备用.
1.2 试剂和仪器
冰冻切片机(Leica 9500)、显微镜(Leica DM5500),二甲苯、无水乙醇、冰醋酸、甲醇、多聚甲醛、中性树脂、30%蔗糖溶液、30% H2O2、苏木素、伊红、OCT包埋剂,DAB显色剂,1%PBS溶液等试剂均购自福建迈新公司.一抗:P-cadherin SABC即用型试剂盒(BA0674)、二抗:IgG(SA1029)均购自武汉博士德生物工程公司.TRNzol总RNA提取试剂盒(DP405)、Quant One Step RT-PCR kit(KR113)、SuperReal PreMix (SYBR Green)(FP204)购自天根生化科技(北京)有限公司.
1.3 试验方法
1.3.1 样品处理 首先,将新鲜的皮肤组织样在4%多聚甲醛中固定24 h后放在30%的蔗糖溶液中过夜.其次,用梯度酒精脱水.最后,对处理好的组织块进行修块和包埋.
1.3.2 HE染色 对90、96 d的组织进行冰冻切片,寻找基板形成时期的不同形态.将冰冻切片机在-25 ℃提前预冷24 h后对包埋好的组织块进行切片,切片厚度为10 μm,贴片;将贴好的切片自然晾干,在4%多聚甲醛中浸泡30 min进行固定;用PBS冲洗后进行苏木素轻度染色.
1.3.3 免疫组化 将冰冻切片机在-25 ℃提前预冷24 h后对包埋好的组织块进行切片,切片厚度为8 μm,贴片;将贴好的切片自然晾干,在4%多聚甲醛中浸泡30 min进行固定;在30% H2O2+纯甲醇50份混合的溶液中室温浸泡30 min(此步的目的是将内源性过氧化物酶进行灭活),用超纯水洗1-2次;滴加5% BSA封闭液,室温孵育20 min,将多余的封闭液甩去,此步不洗;滴加(1∶75)稀释浓度的小鼠一抗,37 ℃孵育3 h.PBS洗3次,2 min/次;滴加生物素标记的抗小鼠IgG,37 ℃孵育20 min,PBS洗3次,2 min/次;加SABC试剂,37 ℃孵育20 min,PBS洗4次,5 min/次;进行DAB显色,室温下显色5 min;苏木素轻度复染约10 s,蒸馏水冲洗2~3 min;梯度酒精脱水、透明、封片、微镜下观察实验结果、拍片.

1.4 数据分析
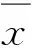
2 结果与分析
2.1 HE染色及免疫组化结果
基板是由间质细胞排列在表皮细胞的下方形成的一种特殊结构,其形成大概分为4个时期:真核细胞在表皮下方均匀排列(图1-A);真核细胞逐渐聚集于表皮下方(图1-B);真核细胞继续聚集形成隆突(图1-C);形成基板(图1-D).免疫组化结果显示P-cadherin在基板形态发生中都有表达.其主要是在表皮(图2-A-a)、真皮(图2-A-b)、表皮中间层(图2-B-a)、表皮基底层(图2-B-b)、隆突底部(图2-C-b)、基板(图2-D-b)中表达.

表1 P-cadherin基因的引物序列
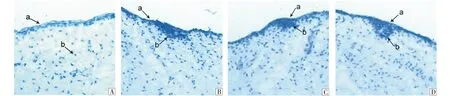
A:a 表皮;b 真皮 (200×);B:a 表皮;b 真皮 (200×);C:a 表皮;b 隆突(200×);D:a 表皮;b 基板 (200×).图1 ‘高山美利奴羊’毛囊基板形成不同时期Fig.1 Different gestational fetal skin follicles substrate of Alpine Merino
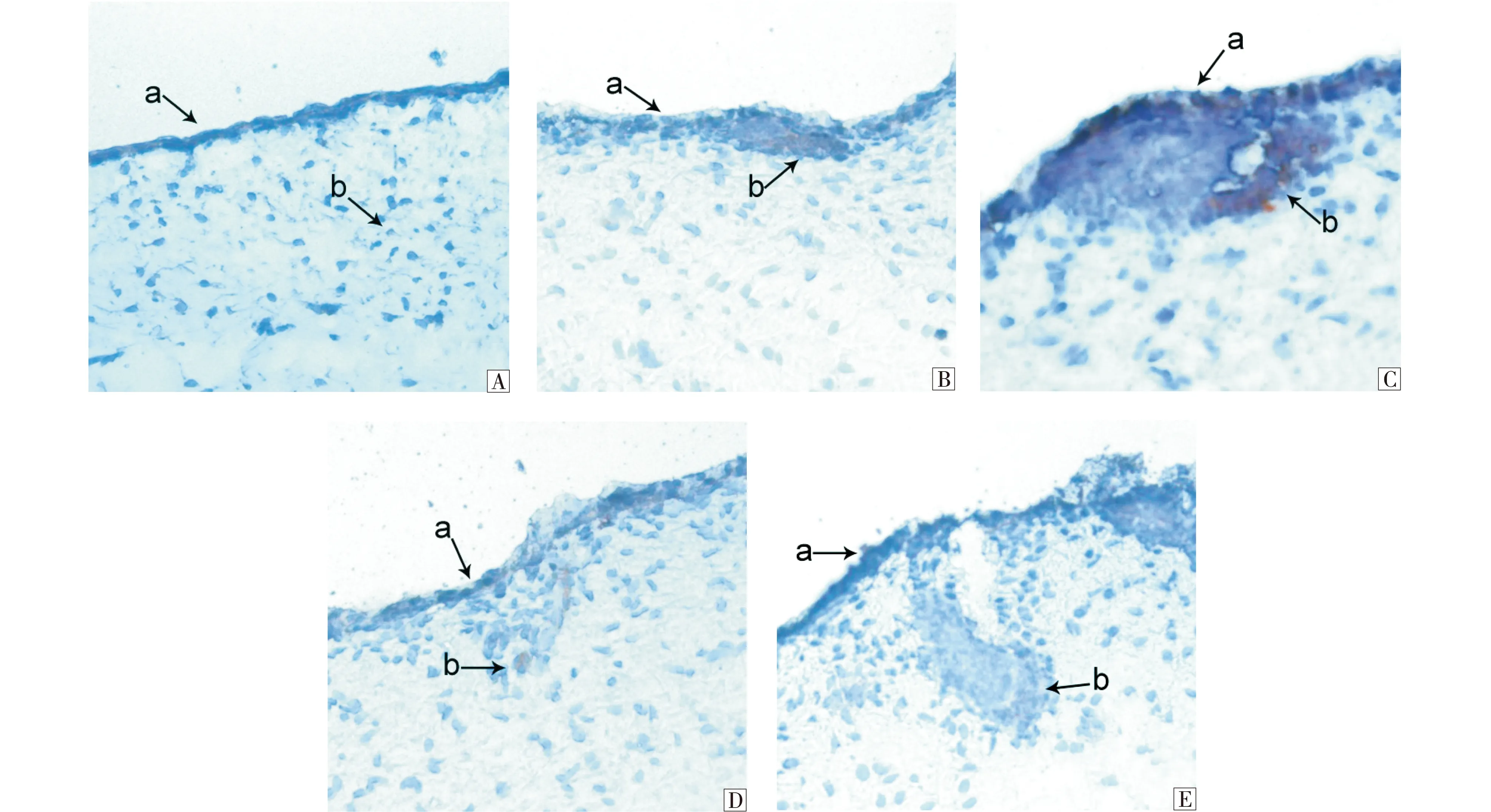
A:a 表皮;b 真皮 (200×) ;B:a 表皮中间层;b 表皮基底层 (400×);C:a 表皮;b 隆突(400×);D:a 表皮;b 基板 (400×);E:a 表皮;b 毛芽.图2 ‘高山美利奴羊’毛囊基板形成不同时期P-cadherin的表达情况Fig.2 The expression patterns of P-cadherin in different gestational fetal skin follicles substrate of Alpine Merino
2.2 荧光定量结果
对荧光定量数据进行SPSS分析,结果显示:在胎龄90、96、102、108、114 d的相对表达量分别为(0.016 7±0.008 4)(0.113 4±0.052 9)(0.937 8±0.245 3)(0.068 4±0.026 8)(0.062 3±0.045 6).90 d与96 d相比差异显著(P=0.049 3<0.05),96 d与102 d相比差异不显著(P=0.088 9>0.05),102 d与108 d相比差异显著(P=0.023 5<0.05),108 d与114 d相比差异不显著(P=0.512 4>0.05).96 d以后的相对表达量都要高于90 d的相对表达量(图3).90 d到102 d相对表达量逐渐升高,102 d以后相对表达量逐渐降低,108 d以后相对表达量趋于平稳,但是略高于114 d的相对表达量,有降低的趋势.
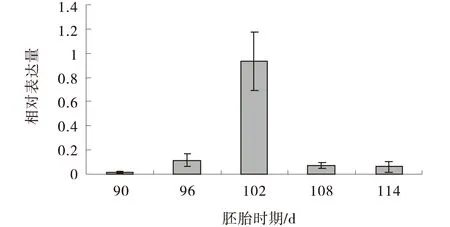
图3 不同胎龄的‘高山美利奴羊’胎儿皮肤毛囊基板中P-cadherin相对表达量Fig.3 The relative expression of P-cadherin in different gestational fetal skin follicle placode of Alpine Merino
3 讨论
本研究通过对‘高山美利奴羊’腹部皮肤进行定点、定量的研究,发现P-cadherin在‘高山美利奴羊’毛囊基板形态发育时期的表皮、真皮、隆突区、隆突基底层、基板和毛钉中都有表达.这与之前报道的在P-cadhrin小鼠表皮组织里面有表达并且是持续表达相符合[13].从荧光定量的结果可以看出从表皮细胞开始聚集到基板形成时期P-cadhrin96 d以后P-adherin的表达量逐渐降低,这与之前所报道的在人类毛发生长周期中期P-cadherin的表达呈现逐渐减弱的趋势相一致[14],证明P-cadherin在表皮终末分化过程中发挥着重要的作用[15].另外,本试验结果中基板形成时期P-adherin的相对表达量(图2)都要明显高于表皮中的表达量(图2),这与报道的人类基板中的表达量明显高于表皮中的表达量相一致[7].
目前,已经报道的一些关于毛囊干细胞和表皮干细胞的标记物具有一定的特征:
1) 在细胞中所处的位置不同:位于细胞膜的有整合素、CD34、CD200和ABCG2(转运蛋白超蛋白家族)等;位于细胞质的有角蛋白和巢蛋白等;位于细胞核的有p63、Tcf3(人类T细胞因子)、Lgr5、Lhx2、Sox9和NFATc1(活化T细胞核因子1)等[16].
2) 特定的表达部位:ABCG2集中表达于表皮基底层和毛囊隆突区[17].Sox9集中表达于毛囊的外根鞘[18].CK14在云南半细毛羊毛囊干细胞中表达,在成纤维细胞中则不表达[19].p63在角膜缘的基底细胞表达但是在角膜表面的短暂增殖细胞则不表达[20].
3) 特定的表达种属:CD34只在小鼠毛囊中表达,但不在人类中表达[21].
4) 不同时期或者不同部位表达量不同:β1整合素在ESCs细胞表面高度表达,但是在细胞有丝分裂后却不表达[22].
从本试验免疫组化结果可以看出在绵羊毛囊基板形成时P-cadherin有一定的表达部位,其集中在表皮、表皮基底层、隆突基底层和基板基底层表达.从荧光定量结果可以看出P-cadherin在毛囊发育的不同时期表达量不同:从90 d间叶细胞开始聚集到96 d基板和毛芽形成,相对表达量显著增加;从102 d初级毛囊产生到108 d形成再分化次级毛囊一直到114 d次级毛囊产生相对表达量逐渐降低,108 d和114 d趋于平稳,但是仍然低于96 d.因此,可以初步断定P-cadherin可以作为‘高山美利奴羊’毛囊基板的标记物.
4 结论
本研究对P-cadherin在‘高山美利奴羊’毛囊基板形态发生过程中的表达变化规律进行了初步研究,得出P-cadherin参与‘高山美利奴羊’毛囊基板形态发生的调控,并且可以初步断定P-cadherin可以作为‘高山美利奴羊’毛囊基板的标记物.
[1] Rogers G E.Biology of the wool follicle:an excursion into a unique tissue interaction system waiting to be re-discovered[J].Exp Dermatol,2006,15(12):931-949
[2] 吴瑜瑜,岳耀敬,郭婷婷,等.中国超细毛羊(甘肃型)胎儿皮肤毛囊发育及其形态结构[J].中国农业科学,2013,46(9):1923-1931
[3] Galbraith H.Fundamental hair follicle biology and fine fibre production in animals[J].Animal,2010,4(9):1490-1509
[4] 赵帅,岳耀敬,郭婷婷,等.Wnt 10 b、β-catennin、FGF18基因在‘甘肃高山细毛羊’胎儿皮肤毛囊中的表达规律研究[J].甘肃农业大学学报,2015,50(5):6-14
[5] Schmidt-Ullrich R.Paus R.Molecular principles of hair follicle induction and morphogenesis[J].Bio Essays,2005(27):247-261
[6] Liu G,Liu R,Li Q,Tang X,et al.Identification of microRNAs in wool follicles during anagen,catagen,and telogen phases in Tibetan sheep[J].PloS One,2013,8(10):e77801
[7] Jamora C,Das Gupta R,Kocieniewski.et al.Links between signal transduction,transcription and adhesion in epithelial bud development[J].Nature,2003,(422):317-322
[8] Muller Rover S,Tokura Y,Welker P,et al.E-and P-cadherin expression during murine hair follicle morphogenesis and cycling[J].Exp Dermatol,1999(8):237-246
[9] Fujita M,Furukawa F,Fujii K,et al.Expression of cadherin cell adhesion molecules during Cell Tissue Res human skin developm-ent:morphogenesis of epidermis,hair follicles and eccrine sweat ducts[J].Arch Dermatol Res,1992 (284):159-166
[10] Bostjancic E,Glavac D.Importance of microRNAs in skin morphogenesis and diseases[J].Acta Dermatovenerologica Alpina Panonica et Adriatica,2008,17(3):95-102
[11] Shimomura Y,Christiano A M.Biology and genetics of hair[J].Annual Review of Genomics and Human Genetics,2010,11:109-132
[12] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C) method[J].Methods,2001,25(4):402-408
[13] Nose A,Takeichi M.A novel cadherin cell adhesion molecule:its expression patterns associated with implantation and organogenesis of mouse embryos [J].Cell Biol,1986,(103):2649-2658
[14] Samuelov L,Sprecher E,Tsuruta D,et al.P-cadherin regulates human hair growth and cycling via canonical Wnt signaling and transforming growth factor-beta2[J].Invest Dermatol,2012,(132):2332-2341
[15] Hines M D,Jin H C,Wheelock M J,et al.Inhibition of cadherin function differentially affects markers of terminal differentiation in cultured human keratinocytes[J].Cell Sci,1999,(112):4569-4579
[16] 倪振洪,邵勇,李玉红.毛囊干细胞标记物的研究进展[J].中国细胞生物学学报,2010,32(1):43-48
[17] Yano S,Ito Y,Fujimoto M,et al.Characterization and localizationof side population cells in mouse skin [J].Stem Cells,2005,23(6):834-841
[18] Vidal V P,Chaboissier M C,Lutzkendorf S,et al.Sox9 isessential for outer root sheath diffrentiation and the formation of the hair stem cell compartment[J].Curr Biol,2005,15(15):1340-1351
[19] 李东江,权国波,杨红远,等.云南半细毛羊毛囊干细胞表面标记物的鉴定[J].遗传育种,2014,34(1):5-7
[20] Pellegrini G,Dellambra E,Golisano O,et al.P63 identfies keratinocyte stem cells[J].Proe Natl Acad Sci USA,2001,98(6):3156-3161
[21] Trempus C S,Morris RJ,Bortner C D.etal.Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marke r CD34 [J].Invest Dermatol.2003,120 (4):501-511
[22] Kaur P,Li A.Adhesive properties of human basal epidermal cells:an annlysis of keratinocyte stem cell,transit amplifying cells,and postmitotic diffrentiating cells[J].Invest Dermatol,2000,114(3):413-420
(责任编辑 李辛)
Expression ofP-cadherinin the process of formation in alpine merino sheep embryo skin follicle placode
LIU Shan-bo1,YUE Yao-jing1,2,GUO Ting-ting2,WANG Tian-xiang3,SHI Zhao-guo1,YUAN Chao2, WANG Xi-jun3,LIU Ji-gang3,LIU Jian-bin2,ZHANG Ling-ling2,GUO Jian2,NIU Chun-e2, SUN Xiao-ping2,FENG Rui-lin2,LI Fan-wen3,YANG Bo-hui1,2
(1.College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Sheep Engineering Breeding Center,Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences,Lanzhou 730050,China;3.Gansu Province Sheep Breeding Technology Promotion Station,Zhangye 734031,China)
【Objective】 To analyze the expression ofP-cadherinon Alpine Merino sheep skin during hair follicle (HF) placode morphogenesis,and to develop a marker of hair follicle placode.【Method】 Gansu Alpine sheep skin from 90 d to 114 d gestational age of on the abdomen was used as material,through the frozen sections,hematoxylin and eosin (HE) staining,fluorescence quantitative PCR and immunohistochemistry of technology to research the expression ofP-cadherinduring hair follicle placode morphogenesis.【Result】P-cadherinwas expressed in the epidermis,the basal layer of the epidermis,dermis,carina basal layer,placode and hair buds during hair follicle placode morphogenesis.The relative expression levels of 90 d,96 d,102,108 d,114 d were (0.008 4±0.016 7)(0.113 4±0.052 9)(0.937 8±0.245 3)(0.068 4±0.026 8)(0.062 3±0.045 6),respectively.There was a significantly different between 90 d and 96 d (P=0.049 3<0.05),and 102 d and 108 d (P=0.023 5<0.05).No significant was found between 96 d and 102 d (P=0.088 9>0.05),and 108 d and 114 d (P=0.512 4>0.05).After 90 d,the relative expression level gradually increased,the relative expression level of 102 d reached the maximum,and the relative expression amount decreased gradually after 102 d,and the relative expression level was stable after 108 d.【Conclusion】P-cadherincan be used as a marker of Alpine Merino sheep hair follicle placode.
Alpine Merino sheep;hair follicle placodes;P-cadherin
刘善博(1988-),男,硕士研究生,研究方向为动物遗传育种与繁殖.E-mail:liushanbo2013@163.com
杨博辉,男,研究员,博士,博士生导师,研究方向为羊的遗传育种.E-mail:yangbh2004@163.com
国家绒毛用羊产业技术体系 “分子育种岗位”(Nycytx-40-3);中国农业科学院“细毛羊资源与育种”创新工程(CAAS-ASTIP-2015-LIHPS);国家自然科学青年基金“基于单细胞测序研究非编码RNA调控绵羊次级毛囊发生的分子机制”(31402057);中央级公益性科研院所基本科研业务费专项资金项目(BRF1610322014006).
2015-09-06;
2016-01-11
S 826.9+1
A
1003-4315(2016)05-0001-06
