氯化锂与碳酸钠反应结晶制备碳酸锂的研究*
2016-11-23陶箴奇张志强毕秋艳牛辉哲李小松青海大学化工学院青海西宁8006青海省经济与信息化委员会
陶箴奇,张志强,毕秋艳,牛辉哲,李小松(.青海大学化工学院,青海西宁8006;.青海省经济与信息化委员会)
氯化锂与碳酸钠反应结晶制备碳酸锂的研究*
陶箴奇1,张志强1,毕秋艳1,牛辉哲1,李小松2
(1.青海大学化工学院,青海西宁810016;2.青海省经济与信息化委员会)
中国主要以矿石为原料生产碳酸锂(Li2CO3),而从锂含量丰富的盐湖卤水中直接生产优质的碳酸锂产品具有广阔的前景。对氯化锂(LiCl)和碳酸钠(Na2CO3)反应结晶生产碳酸锂的过程做了研究,考察了碳酸钠加入量、搅拌速度、温度、氯化锂浓度、添加剂及加料方式对反应结晶过程的影响。得到了较佳的工艺条件:以反加料的方式进行反应,碳酸钠加入量为理论加入量的110%,搅拌速度为400 r/min,反应温度为80℃,c(LiCl)=3.2 mol/L。结果表明,搅拌转速对产品产率的影响不明显,碳酸钠加入量、温度和氯化锂浓度对产品的产率有影响,其中温度和氯化锂浓度的影响显著。加料方式和加入聚丙烯酸(PAA)作为添加剂可以得到不同的产品形貌;搅拌速度、反应温度、LiCl浓度以及PAA作为添加剂对Li2CO3纯度均有一定程度的影响。
反应结晶;碳酸锂;盐湖;添加剂;聚丙烯酸
碳酸锂(Li2CO3)是锂盐工业中十分重要的产品,它可以作为玻璃制造和陶瓷生产过程中的助熔剂和添加剂,也能作为中间原料生产其他锂盐,如用于生产表面弹性波元件材料钽酸锂、铌酸锂单晶等[1-2]。近年来,随着高品质锂盐在新能源和新材料等高新技术领域,尤其是电动汽车领域崭露头角,碳酸锂表现出诱人的应用前景[3-5]。
按原料来源不同,Li2CO3的生产分为矿石提取和盐湖卤水提取[6]。矿石提锂存在高品质锂精矿依赖进口、生产过程能耗高、尾矿以及废水难处理、污染严重等问题。自1996年以来,盐湖卤水提锂逐步成为全球锂工业的主导,目前全球生产的Li2CO3产品中80%来自于盐湖卤水提取。中国是一个多盐湖国家,拥有丰富的盐湖锂资源,但由于技术和条件的限制,中国仍主要通过锂矿石生产Li2CO3。目前,以盐湖卤水提锂制取LiCl,再与Na2CO3反应结晶(沉淀)制取Li2CO3的技术虽然已经工业化,但是普遍存在Li2CO3产率低、产品纯度不高、晶体形貌差和晶体聚结严重等问题。笔者拟通过对LiCl和Na2CO3反应结晶过程的研究,优化反应结晶条件,以提高Li2CO3的产率和产品纯度、改善晶体形貌和减轻晶体聚结。
1 实验
1.1 试剂与仪器
试剂:Na2CO3(分析纯,上海广诺化学科技有限公司),LiCl(青海中信国安科技发展有限公司),聚丙烯酸(PAA,M.W3000,上海阿拉丁生化科技股份有限公司),乙二胺四乙酸二钠(EDTA-2Na,分析纯,烟台市双双化工有限公司),聚乙二醇(PEG,MW6000,上海阿拉丁生化科技股份有限公司)。
仪器:OptiMax型全自动合成工作站、ICAP6300型全谱直读电感耦合等离子体发射光谱仪、电子天平、DHL-A型电脑数显恒流泵、JSM-5610LV型扫描电镜、Milli-Q型超纯水机。
1.2 实验方法
Na2CO3与LiCl溶液进行如下反应:

配制一定浓度的Na2CO3、LiCl溶液,使用砂芯漏斗过滤后装入聚乙烯瓶中备用。量取LiCl溶液加入到全自动合成工作站的反应釜内,精确控制反应釜内的温度和搅拌的转速。使用电脑数显恒流泵以固定的流量向反应釜内加入Na2CO3溶液。加料结束后保持原有的温度和搅拌速度继续反应30 min,再将反应后得到的悬浮液迅速取出并用已经恒重的砂芯漏斗过滤,用热水洗涤数次,在烘箱中干燥后称量计算Li2CO3的产率和纯度。计算公式:

式中,y为Li2CO3的产率,%;m干为过滤烘干后得到的Li2CO3的质量,g;m理为理论上得到的Li2CO3的质量,g;w为Li2CO3的质量分数,%;m(NaCl)为所取Li2CO3样品中NaCl杂质的质量,g;m总为测量时所取Li2CO3样品的质量,g。
2 结果与讨论
2.1 Na2CO3加入量对反应结晶的影响
固定其他条件不变,改变Na2CO3的加入量。分别加入理论量的80%、90%、100%、110%和120%进行实验,结果见图1。由图1可见,Li2CO3的产率随着Na2CO3加入量的增加而增大,这是由于Na2CO3的加入使反应向有利于生成Li2CO3的方向进行,从而使Li2CO3的产率有所上升。Na2CO3的加入量为理论量的100%之前,随着Na2CO3加入量的增加,Li2CO3纯度略有降低。由图2可知,反应结晶导致Li2CO3晶体较小、表面能较大,会产生晶体聚结现象,这可能导致少量的NaCl被包裹进入Li2CO3的聚结体内;随着Na2CO3的加入量超过理论加入量的100%,Li2CO3产品纯度无显著的变化,这说明Li2CO3的聚结体包裹NaCl的能力有限。为了既保证Li2CO3有较高的产率,又不至于Na2CO3的消耗过高,因此选择Na2CO3的加入量为理论加入量的110%。

图1 Na2CO3加入量对反应结晶Li2CO3产率和纯度的影响

图2 Na2CO3与LiCl反应结晶晶体聚结 现象的SEM照片
2.2 搅拌速度对反应结晶的影响
固定其他条件不变,改变搅拌速度。分别在200、300、400、500、600、700、800 r/min下进行实验,结果见图3。由图3可见,当搅拌速度为300 r/min和400 r/min时,Li2CO3的产率略高,其他转速下产率较低。实验结果表明,转速过低不利于Li2CO3向晶体表面扩散,转速过高不利于晶体表面的反应及生长,因此搅拌转速控制在400 r/min较为适宜。当转速超过500 r/min后,产品纯度随着转速的增加而下降。造成这种现象的原因可能是随着转速的上升,输入体系的能量增加,使得大的Li2CO3晶体被破碎生成了小的晶体,并使其表面能增加,导致晶体聚结体的数量有所增加,从而更易夹带NaCl。
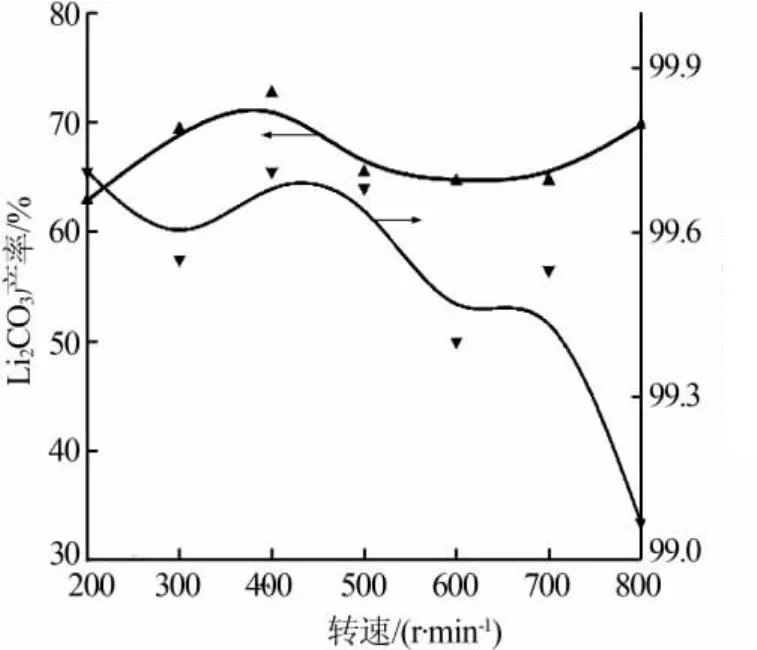
图3 搅拌速度对反应结晶Li2CO3产率和纯度的影响
2.3 温度对反应结晶的影响
固定其他条件不变,改变反应温度。分别在10、20、40、60、70、80、90℃下进行实验,结果见图4。由图4可见,随着温度的上升,Li2CO3的产率增加。Li2CO3具有逆溶解度特性,温度的升高使得溶解度降低。图5为温度对氯化锂反应结晶影响的SEM照片。由图5可知,温度变化可以导致碳酸锂晶体形貌发生变化。在较低温度下,得到的是片状聚结体,而温度较高时,得到了棒状聚结体。片状聚结体更易夹带杂质,这也说明了为何随着温度的增加Li2CO3纯度有所上升。综合考虑,实验选择适宜的温度为80℃。

图4 温度对反应结晶Li2CO3产率和纯度的影响

图5 温度对氯化锂反应结晶影响的SEM照片
2.4 氯化锂浓度对反应结晶的影响
固定其他条件不变,改变LiCl的浓度。分别在0.8、1.6、2.4、3.2、4.0 mol/L下进行实验,实验结果如图6所示。

图6 LiCl浓度对反应结晶Li2CO3产率和纯度的影响
实验结果表明,在0.8~2.4 mol/L时随着LiCl浓度的上升,Li2CO3的产率迅速地增加,当LiCl浓度达到2.4 mol/L之后产率的变化趋于平缓。这是由于随着LiCl浓度的提高使反应向有利于生成Li2CO3的方向进行,使得Li2CO3的产率有所上升。图7为氯化锂浓度对氯化锂反应结晶影响的SEM照片。由图7可知,过高的LiCl浓度使得过饱和度显著增加,导致初级成核的量增加,Li2CO3晶体过小、表面能过大,产生的晶体聚结更严重,从而造成了夹带氯化钠,使得Li2CO3纯度变低。综合考虑,LiCl浓度在3.2 mol/L较为合适。

图7 氯化锂浓度对氯化锂反应结晶影响的SEM照片
2.5 加料方式对反应结晶的影响
实验研究了几种不同加料方式对反应结晶过程的影响,Na2CO3溶液逐渐加入LiCl溶液中命名为常规加料;LiCl溶液加入Na2CO3溶液命名为反向加料;Na2CO3溶液一次性加入LiCl溶液命名为一次性加料。实验结果见图8。由图8可见,采用一次性加料、反向加料的方式对Li2CO3产率的影响较小。一次性加料使Li2CO3的纯度轻微降低,这是由于一次性加料对于常规加料来说有很大的过饱和度,瞬间爆发成核使得NaCl更易被夹杂在产品内。另外实验中发现,加料方式不同会引起晶体形貌的变化,如图9所示。由图9可见,常规加料得到的为棒状的聚结体;反向加料得到的晶体呈现出长条状,且晶体聚结现象更轻;一次性加料得到了球状的小颗粒聚结体。

图8 加料方式对反应结晶Li2CO3产率和纯度的影响

图9 不同条件下Li2CO3产品的SEM照片
2.6 添加剂对反应结晶的影响
添加剂会对结晶过程造成影响[8-9]。实验选取了EDTA-2Na、PAA、PEG作为添加剂,考察了添加剂对Li2CO3产率的影响,结果见图10。由图10可知,PEG的加入对Li2CO3产率的影响不大,而EDTA-2Na、PAA的加入使得Li2CO3产率降低;加入添加剂之后,Li2CO3纯度均有一定程度降低,其中加入PAA时Li2CO3纯度显著降低。

图10 添加剂对反应结晶Li2CO3产率和纯度的影响
图11为PAA作为添加剂得到的Li2CO3产品的SEM照片。对比图9a、9d可以看出,PAA加入使得Li2CO3产品的形貌发生了变化。PAA是一种分散剂,它在晶核表面的吸附,可以降低固液表面张力,从而促进了成核。另一方面,PAA选择性地吸附在晶面上,使得这些晶面的生长受到影响,改变了各晶面的相对生长速度,进而改变了晶体形貌。

图11 PAA作为添加剂得到的Li2CO3产品的SEM照片
3 结论
1)搅拌速度对产品产率的影响不明显,Li2CO3加入量、温度和LiCl浓度能显著影响碳酸锂的产率。较高的反应温度或较高的LiCl浓度可得到较高的Li2CO3产率。
2)搅拌速度、反应温度、LiCl浓度以及PAA添加剂对Li2CO3纯度均有一定程度的影响,较快的搅拌速度和较高的LiCl浓度会导致产品纯度降低,较高的温度使得Li2CO3纯度有所增加;以PAA作为添加剂加入后,Li2CO3的纯度会显著降低。
3)温度、加料方式和PAA作为添加剂可以影响Li2CO3的形貌,低温时会得到片状聚结体,高温下得到的是棒状聚结体,反向加料得到的晶体呈长条状,且晶体聚结现象更轻;一次性加料会得到球状聚结体。实验得到较佳的工艺条件:以反加料的方式进行反应,Li2CO3加入量为理论加入量的110%,搅拌速度为400r/min,反应温度为80℃,LiCl浓度为3.2mol/L。
[1] 张荣国,杨顺林,郭丽萍等.盐湖卤水提锂的研究进展[J].无机盐工业,2005,37(3):1-4.
[2] 祝增虎,朱朝梁,温现明,等.碳酸锂生产工艺的研究进展[J].盐湖研究,2008,16(3):64-72.
[3] U.S.Department of the Interior,U.S.Geological Survey.Mineral commodity summaries 2015[R/OL].(2015-01).[2014-11-15].http∥pubs.er.usgs.gov/publication/70140094.
[4] Albany.Marketresearchreports.biz:Electric vehicles to lead increased demands for lithium carbonate[EB/OL].(2015-01-15).[2015-11-01].http∥www.prweb.com/releases/2015/01/prweb12443973. htm.
[5] Bradley D,Jaskula B.Lithium-For harnessing renewable energy[R/ OL].(2014-05-29).[2014-10-20].http∥pubs.usgs.gov/fs/2014/ 3035/.
[6] 邓姝皓,杨子萱,杨佳逸,等.由扎布耶盐湖粗盐制备高纯碳酸锂新工艺研究[J].无机盐工业,2016,48(4):26-30.
[7] 陈银霞,赵改青,王晓波.聚合物控制碳酸钙晶型、形貌的研究[J].化学进展,2009,21(7):1619-1625.
[8] Watamura H,Marukawa H,Hirasawa I.Polyelectrolyte effects on the crystallization phenomena of the lithium carbonate[J].Journal of Crystal Growth,2013,373(12):111-117.
Study on preparation of lithium carbonate via reactive crystallization from lithium chloride and sodium carbonate
Tao Zhenqi1,Zhang Zhiqiang1,Bi Qiuyan1,Niu Huizhe1,Li Xiaosong2
(1.College of Chemical Engineering,Qinghai University,Xining 810016,China;2.Qinghai Commission of Economy and Information Technology)
China produced lithium carbonate from spodumene mostly.However,producing high quantity lithium carbonate from lithium-rich salt lakes has a vast potential for future development.The preparation process of lithium carbonate by reactive crystallization with sodium chloride and sodium carbonate was studied.The effects of Na2CO3addition,stirring rate,reaction temperature,concentration of LiCl,feeding methods,and additive on the process of reactive crystallization were investigated.The optimal conditions were obtained as follows:back-feeding way was adopted during the reaction,addition of Na2CO3was 110%of theoretical dosage,stirring rate was 400 r/min,reaction temperature was 80℃,concentration of LiCl was 3.2 mol/L.Results showed that stirring rate had slight influence on the yield;addition of Na2CO3,reaction temperature,and concentration of LiCl had affect on the yield;and reaction temperature and concentration of LiCl had an obvious influence. Feeding methods and PAA could change the morphology of Li2CO3;reaction temperature,stirring rate,concentration of LiCl,and PAA all could affect the purity of Li2CO3.
reaction crystallization;lithium carbonate;salt lake;additive;polyacrylic acid
TQ131.11
A
1006-4990(2016)11-0025-04
2016-05-15
陶箴奇(1991— ),男,在读研究生。
张志强
青海省应用基础研究项目(2016-ZJ-702)。
联系方式:qhzhzq@126.com
