赖氨酸辅助高分散金粒子修饰氮掺杂TiO2纳米管催化剂的合成及光催化性能
2016-11-23安会琴于育才吴婷婷李晓峰贺晓凌赵莉芝2黄唯平3
安会琴,于育才,闫 琳,吴婷婷,李晓峰,贺晓凌,赵莉芝2,黄唯平3
(1.天津工业大学环境与化学工程学院,省部共建分离膜与膜过程国家重点实验室,天津300387;2.天津工业大学材料科学与工程学院,天津300387;3.南开大学先进能源材料化学教育部重点实验室,天津300071)
赖氨酸辅助高分散金粒子修饰氮掺杂TiO2纳米管催化剂的合成及光催化性能
安会琴1,于育才1,闫 琳1,吴婷婷1,李晓峰1,贺晓凌1,赵莉芝2,黄唯平3
(1.天津工业大学环境与化学工程学院,省部共建分离膜与膜过程国家重点实验室,天津300387;2.天津工业大学材料科学与工程学院,天津300387;3.南开大学先进能源材料化学教育部重点实验室,天津300071)
通过溶胶⁃凝胶法联合水热合成法制备了氮掺杂TiO2纳米管,并以该纳米管为载体,采用绿色无毒的赖氨酸作为链接剂和螯合剂,一步实现金粒子在TiO2纳米管上的高度分散,制备得到高分散金粒子修饰氮掺杂TiO2纳米管催化剂(Au/N⁃TiO2纳米管).表征了产物的形貌、结构、光学特性及组成,通过紫外光下甲基橙水溶液的光降解率评价产物的光催化活性,讨论了氮掺杂量、金负载量、赖氨酸及焙烧对合成催化剂光催化性能的影响.结果显示,在赖氨酸存在下,金粒子在TiO2纳米管上呈高度分散状态,未发生聚集.且与纯TiO2纳米管相比,Au/N⁃TiO2纳米管显示出更高的光催化活性.Au/N⁃TiO2纳米管的高催化活性是由于氮掺杂后引起的TiO2带隙能窄化、金粒子在载体上的高分散状态及金与TiO2形成的肖特恩势垒引起的低电子⁃空穴复合率共同作用导致的.
二氧化钛纳米管;氮掺杂;金粒子;赖氨酸;光降解甲基橙
二氧化钛(TiO2)作为一种半导体光催化材料,因具有价廉、对环境和人体无害、化学性质稳定、耐光和耐酸碱腐蚀等优点而备受关注,并被广泛应用于光催化领域中[1,2].TiO2纳米管作为TiO2的一种存在形式,具有典型一维中空介孔结构和大比表面积,是理想的光催化材料.特别是其特殊的管状结构和较高的沉降速率等特性赋予其优异的物化属性,与TiO2粉体相比更适合被用作催化剂或催化剂载体[3,4].Kasuga等[5]以TiO2粉体和NaOH为原料,采用水热合成法制备了TiO2纳米管.该方法条件温和,设备简单,成本低廉,且可通过简单的一步反应大量合成,适于产业化规模应用.但纯锐钛矿型TiO2的带隙能约为3.2 eV,只能被太阳光中的紫外线(约占太阳光的5%)激发,光利用率低[6];并且纯TiO2光生电子⁃空穴对(光生载流子)较易复合泯灭,导致光量子效率较低[7].
为提高TiO2的光利用率,人们尝试对TiO2进行掺杂和表面修饰,常用的方法有金属元素掺杂、非金属元素掺杂和半导体复合等.其中非金属掺杂因非金属只进入TiO2晶格,不充当光生载流子复合中心,可有效避免电子⁃空穴对的复合而受到了人们的青睐[8].多种非金属元素(如氮、碳、硫元素等)已被用于掺杂TiO2,如Lacombe等[9]以TiO2纳米溶胶和三乙胺为原料,通过低温溶胶⁃凝胶法制备了氮元素掺杂TiO2,并发现合成样品的光吸收范围发生明显红移;Dionysiou等[10]采用非离子氟化表面活性剂为孔模板剂,通过溶胶⁃凝胶法制备了氮、氟共掺杂TiO2,发现合成样品与纯TiO2相比,禁带宽度
明显减小且光吸收范围向可见光区红移.通过非金属元素掺杂虽然可以提高TiO2的光利用率,但其仍存在光生电子⁃空穴对复合率高的问题,因此,发展一种新型TiO2纳米管基光催化材料,并使其同时兼具高效的光利用率和光生载流子分离率具有重要意义.
将贵金属如Au,Pt等沉积到TiO2上制备TiO2负载型贵金属催化剂是提高TiO2电子⁃空穴分离程度的有效方法[11,12],这是由于贵金属和TiO2之间形成的肖特恩势垒可实现光生电子在TiO2和贵金属之间的高效转移,从而促进光生电子⁃空穴对的有效分离.Iliev等[13]将金粒子负载在TiO2上,有效提高了TiO2的光催化活性;我们[14]曾将Pt光沉积到TiO2纳米管上制备Pt/TiO2纳米管催化剂,发现该催化剂与纯TiO2纳米管相比表现出较高的光催化性能.但由于通常物理负载方法如浸渍法、原位还原法和沉积法等得到的贵金属粒子易发生聚集,致使其尺寸变大,而贵金属纳米粒子的尺寸大小是影响材料催化性能的重要因素之一[7],通常情况下,贵金属尺寸越小(≤5 nm)其催化性能越高[15].通过使用有机物作为链接剂对载体修饰使其表面富含官能团,进而利用载体表面官能团与贵金属之间的化学键作用可将贵金属粒子高分散地负载到载体表面.常用的有机链接剂有硅烷偶联剂、乙二胺等[16,17],但该方法多分2步进行,较为复杂繁琐,且合成过程中有毒试剂的使用制约了其进一步发展.因此,寻求一种简单、高效、绿色环保的负载型贵金属催化剂制备方法至关重要.赖氨酸作为人体所需的氨基酸之一,含有NH2和COOH 2种官能团,可同时作为链接剂和螯合剂.作为螯合剂,赖氨酸吸附于贵金属粒子表面可阻止小尺寸金粒子进一步团聚长大,螯合了金粒子的赖氨酸链接于载体表面,一步实现贵金属在载体上的高分散负载.Zhong等[18]采用赖氨酸实现了金纳米粒子的自组装;Zhang等[19,20]通过赖氨酸辅助一步制备了Au/α⁃Fe2O3,Pt/α⁃Fe2O3等催化剂,证实了该方法具有通用性.
本文通过溶胶⁃凝胶法联合水热合成法制备了氮掺杂TiO2纳米管,通过赖氨酸辅助将金粒子一步负载到氮掺杂TiO2纳米管上,得到高分散金粒子修饰氮掺杂TiO2纳米管催化剂(Au/N⁃TiO2纳米管).结果显示,经由赖氨酸辅助,金粒子在载体上呈高分散状态,未发生聚集,与纯TiO2纳米管相比,Au/N⁃TiO2纳米管显示出更高的光催化活性.
1 实验部分
1.1 试剂与仪器
钛酸四丁酯[Ti(OC4H9)4],天津市科密欧化学试剂有限公司;氢氧化钠(NaOH),天津市化学试剂三厂;无水乙醇(C2H5OH),天津市北联精细化学品开发有限公司;氯金酸(HAuCl4·4H2O),天津佳烨贵研科技有限公司;甲基橙(C14H14N3NaO3S,MO)、赖氨酸(C6H14N2O2)和硼氢化钠(NaBH4),天津市光复精细化工研究所;尿素[CO(NH2)2]和冰醋酸(CH3COOH),天津市光复科技发展有限公司.以上试剂均为分析纯;实验用水为普通蒸馏水.
Tecnai G2F20型透射电子显微镜(TEM,美国FEI公司);K⁃Aepna型X射线光电子能谱仪(XPS,美国ThermoFisher科技公司);D/Max⁃2500型X射线衍射仪(XRD,Cu Kα辐射源,日本理学公司);UV⁃2700型紫外⁃可见吸收光谱仪(UV⁃Vis,日本岛津公司).
1.2 氮掺杂TiO2纳米管的制备
通过溶胶⁃凝胶法联合水热合成法制备氮掺杂TiO2纳米管.首先,通过溶胶⁃凝胶法合成氮掺杂TiO2粉体.具体过程为:将钛酸四丁酯和无水乙醇按体积比1∶4配制成溶液A;将蒸馏水、无水乙醇和冰醋酸按体积比1∶1∶0.5配制溶液B,在溶液B中加入不同量的尿素以制备不同氮掺杂量的TiO2粉体;在搅拌状态下将溶液A滴加至溶液B中,混合后的溶液记为溶液C.将溶液C于室温下搅拌陈化12 h得到凝胶,所得凝胶在80℃烘箱中干燥12 h,并于空气中焙烧3 h,得到锐钛矿相氮掺杂TiO2粉体.合成粉体中的含氮量由氮的质量与催化剂总质量相除得到,具体掺氮量(质量分数)分别为0.5%,1.0%和2.0%.为便于对比,在不加尿素的条件下经由上述过程制备得到纯TiO2粉体.
然后,采用Kasuga水热合成法[5]制备氮掺杂TiO2纳米管.具体制备过程如下:称取约1.5 g上述制备的氮掺杂TiO2粉体于80 mL NaOH溶液中(浓度为10 mol/L),搅拌均匀后转移至100 mL带有聚四氟乙烯内衬的不锈钢反应釜中,于150℃反应12 h.将得到的白色沉淀物离心,水洗至中性后,通过
稀硝酸酸化12 h,再水洗至中性,于80℃烘干,并于马弗炉中在300℃下焙烧2 h,即得到氮掺杂TiO2纳米管.氮掺杂TiO2纳米管中含氮量与所用氮掺杂TiO2粉体一致,分别为0.5%,1.0%和2.0%.同样,为便于对比,由纯TiO2粉体经水热合成过程制备得到纯TiO2纳米管.
1.3 Au/N⁃TiO2纳米管的制备
称取0.2 g氮掺杂TiO2纳米管于20 mL蒸馏水中,向其中依次加入一定量的HAuCl4水溶液(0.0096 mol/L)和赖氨酸溶液,实验过程中HAuCl4与赖氨酸的摩尔比始终保持1∶1.将得到的混合液搅拌、超声0.5 h后,向其中加入过量新配制的NaBH4溶液(0.1 mol/L),以使HAuCl4完全被还原成金粒子.继续搅拌2 h后,将得到的产物离心,并用去离子水反复水洗至检测不出Cl-(Cl-通过AgNO3检测),再于80℃烘干并于300℃焙烧2 h得到Au/N⁃TiO2纳米管.实验过程中通过改变HAuCl4水溶液的加入量调节Au/N⁃TiO2纳米管的金负载量(质量分数)分别为2.0%、3.0%和4.0%.另外,为便于对比,分别在不加尿素及无赖氨酸的条件下经由上述过程制备得到Au/TiO2纳米管及Au/N⁃TiO2纳米管.
1.4 光催化性能评价
光催化性能评价实验在自制光反应装置[12]中进行.具体过程为:将0.05 g光催化剂分散于110 mL甲基橙水溶液(约20 mg/L)中,于黑暗环境中搅拌30 min,以使催化剂与甲基橙溶液达到吸附⁃解吸平衡;开启300W的高压汞灯进行光照,在规定的光照时间段移取定量混合液于离心管中,离心、定容后,通过紫外⁃可见分光光度计在463.8 nm波长处测定甲基橙的吸光度(甲基橙的最大吸收波长为463.8 nm),得到甲基橙吸光度与时间的变化曲线.
2 结果与讨论
2.1 催化剂的表征
图1为高分散金粒子在氮掺杂TiO2纳米管上沉积过程的示意图.赖氨酸在整个合成过程中既是链接剂又是螯合剂.当氯金酸经由硼氢化钠还原形成小尺寸金粒子时,赖氨酸首先通过自身官能团—NH2与Au的螯合作用吸附于金粒子的表面,之后吸附了金粒子的赖氨酸再经由本身官能团—COOH与TiO2纳米管的相互作用链接于氮掺杂TiO2纳米管的表面,得到高分散金粒子修饰的氮掺杂TiO2纳米管(Au/N⁃TiO2纳米管).在整个合成过程中,赖氨酸通过形成化学键存在于纳米管与金粒子之间,有效避免了金粒子之间的聚集,从而使金粒子得以高分散地存在于纳米管表面.该方法不仅简单、快速,而且在合成过程中未使用任何有毒试剂,因此具有绿色、环保的特性.

Fig.1 Procedure for the deposition of Au on N⁃doped TiO2nanotubes by the assist of lysine
图2为TiO2纳米管及不同氮含量TiO2纳米管于300℃焙烧后的XRD谱图.由图2可见,所有样品均显示锐钛矿型TiO2(JCPDSNo.21⁃1272)的衍射峰,且氮掺杂后并无相关衍射峰出现,这可能是由于氮在TiO2上呈高度分散状态或氮进入TiO2晶格的间隙位置所致[21],相似的结论在N/C以及S掺杂的TiO2中已被报道[22,23].
当金粒子沉积在氮掺杂TiO2纳米管上时,与纯TiO2纳米管及氮掺杂TiO2纳米管相比,其衍射峰发生明显变化(图3),在2θ=44.2°,64.6°和77.5°处出现了与金的(200),(220)和(311)晶面相对应的衍射峰,说明通过赖氨酸辅助金粒子已修饰到氮掺杂TiO2纳米管上.
为了分析合成催化材料的组成及化学状态,对其进行了XPS表征,结果如图4所示.图4(A)出现了Ti,O,N,C,Au元素的典型特征峰,表明合成的催化剂中存在氮、金及赖氨酸.图4(B)为Ti2p的高分辨谱图,图中电子结合能位于458.6和464.4 eV处的峰分别对应于Ti4+的Ti2p3/2和Ti2p1/2,与文献
[24]报道结果相吻合.图4(C)为氮的高分辨谱图,图中399.6 eV处的峰与N—Ti—O结构相对应,这是由于在合成过程中氮元素进入TiO2晶格间隙或取代TiO2晶格中的氧阴离子形成相应结构所致[22,25].当金粒子沉积在纳米管上时,其高分辨谱图在83.4和87.0 eV处出现了特征峰[图4(D)],归属于单质态Au的Au4f7/2和Au4f5/2[19].但其Au4f7/2的峰位置与体相金(84.0 eV)相比发生了0.6 eV的负位移,这是由于金粒子与纳米管载体的强相互作用所致,而这种强相互作用通常在催化活性中具有重要的作用.合成催化剂中碳的高分辨谱图如图4(E)所示,在281 eV处并未出现与Ti—C键相对应的峰,说明赖氨酸中的碳并没有以离子掺杂的形式进入TiO2晶格[26].在图4(E)中拟合得到的3个峰中,位于284.7 eV处的峰与C—C和C—H键相对应,而286.4和288.6 eV处的峰分别归属于C—O和键是由于TiO2纳米管上的—OH键与赖氨酸上的—COOH发生酯化反应生成的,说明螯合了金粒子的赖氨酸已锚定于TiO2纳米管上.在O1s的高分辨谱图[图4(F)]中于529.9 eV处出现了与Ti—O—C键相对应的峰[28],而Ti—O—C键正是由TiO2纳米管上的—OH键与赖氨酸上的—COOH反应所致.XPS结果表明,通过赖氨酸辅助将高分散金粒子修饰到了氮掺杂TiO2纳米管上.

Fig.2 XRD patterns of TiO2nanotubes(a)and N⁃doped TiO2nanotubes with different N contents(b,c)
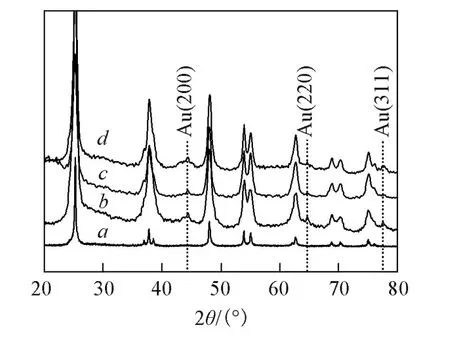
Fig.3 XRD patterns of TiO2nanotubes(a)and 1.0%N⁃doped TiO2nanotubesw ith different Au loadings(b—d)
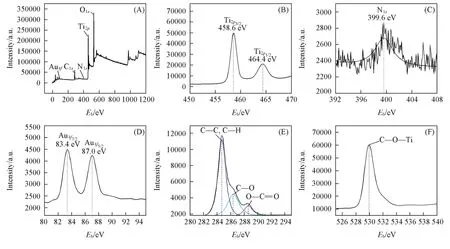
Fig.4 W ide XPS spectrum of Au/N⁃TiO2nanotubesw ith 1.0%N and 3.0%Au loading(A)and high resolution XPS spectra for Ti2p(B),N1s(C),Au4f(D),C1s(E)and O1s(F)
合成催化材料的TEM和HRTEM照片如图5所示.纯TiO2纳米管约几百纳米长,为两端开口的卷曲结构[14,23];而氮掺杂后的纳米管与纯TiO2纳米管结构及形貌相似[图5(A)和(B)],说明掺杂后的氮元素只进入了TiO2的晶格而并未引起其管状结构的改变.当通过赖氨酸辅助将金粒子沉积到氮掺杂TiO2纳米管上时,从其高倍TEM照片[图5(C)]可以看到许多直径约为5 nm的黑色粒子均匀地分布于纳米管上,呈高度分散状态,未发生聚集.这些黑色粒子为被硼氢化钠还原后通过赖氨酸锚定于纳米管上的金粒子.当合成过程中无赖氨酸存在时,金粒子的尺寸与合成过程中赖氨酸存在时相比显著增大[图5(D)],这是由于金粒子聚集引起了团聚.根据文献[7,15]报道,对于负载型贵金属催化剂,贵金属粒子尺寸是影响催化剂活性的重要因素之一,通常情况下,贵金属粒子尺寸越小,催化剂活性越优异.本文通过赖氨酸同时作为螯合剂和链接剂使小尺寸金粒子高分散地存在于载体上,对于合成材料催化活性的提高具有重要意义.

Fig.5 HRTEM(A)and TEM(B)images of 1.0%N⁃TiO2nanotubes and HRTEM images of Au/N⁃TiO2nanotubes with 1.0%N and 3.0%Au loading in the presence(C)and absence(D)of lysine
图6为300℃焙烧后的TiO2纳米管及氮掺杂TiO2纳米管的UV⁃Vis光谱图.可以看出,与纯TiO2纳米管相比,氮掺杂TiO2纳米管的光吸收范围发生红移.将紫外⁃可见光谱曲线线性外推可知,氮掺杂TiO2纳米管的禁带宽度Eg约为2.92 eV,小于纯锐钛矿型TiO2的禁带宽度(3.2 eV).在氮掺杂过程中,氮元素进入TiO2晶格,这些掺杂元素的p轨道与TiO2中氧元素的p轨道在价带附近发生交叠[29],进而在TiO2的价带与导带之间产生一个新的杂化带,从而使氮掺杂TiO2纳米管的带隙能比纯TiO2窄得多.氮掺杂TiO2纳米管的窄禁带宽度在使其高效吸收光的同时,也有利于电子从价带激发到导带,促使更多电子⁃空穴对的生成,从而导致合成催化材料具有较高的光催化性能.
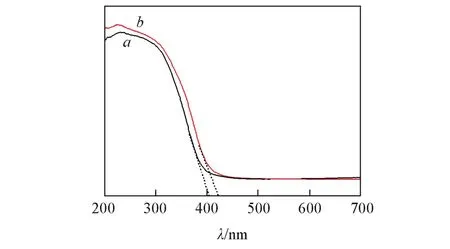
Fig.6 UV⁃Vis absorption spectra of TiO2nanotubes(a)and 1.0%N⁃doped TiO2 nanotubes(b)
2.2 催化材料的光催化性能
2.2.1 氮掺杂量对样品光催化性能的影响 图7(A)为不同氮掺杂量的TiO2纳米管的光催化曲线.可以看出,氮掺杂量对样品光催化活性影响较大,当氮掺杂量为1.0%时,氮掺杂TiO2纳米管的光催化活性达到最佳,远优于纯TiO2纳米管[图7(B)].
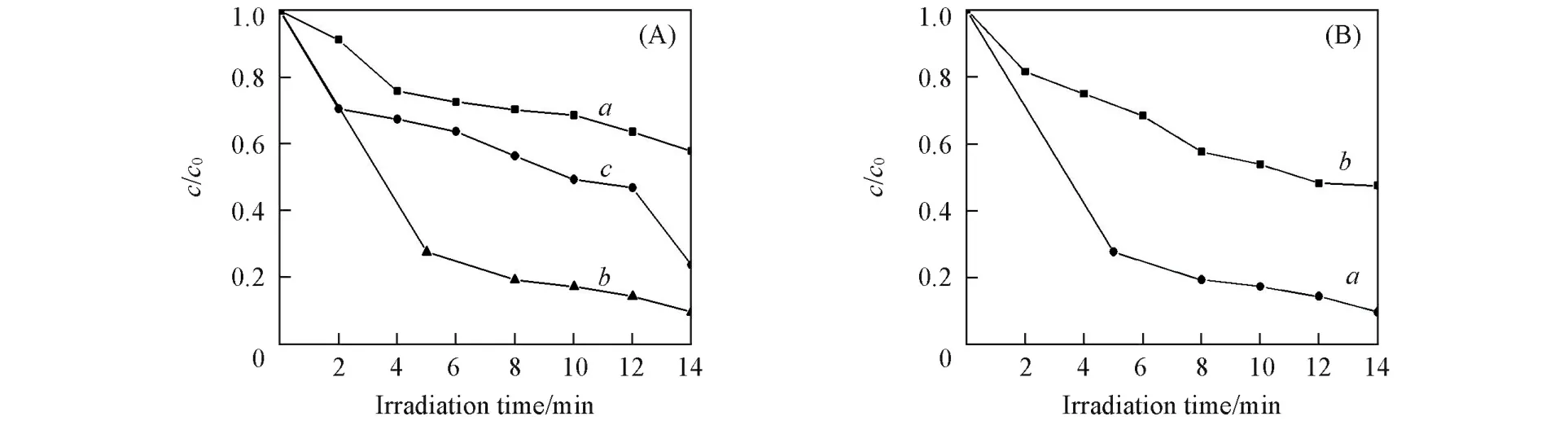
Fig.7 Photocatalytic activity of N⁃doped TiO2nanotubes with different N contents(A)and compari⁃son of photocatalytic activities of 1.0%N⁃doped TiO2nanotubes(a) and pure TiO2nanotubes(b)(B)toward MO degradation
与纯TiO2纳米管相比,氮掺杂TiO2纳米管的较高光催化活性是由于掺杂后的氮元素进入TiO2晶格引起的.在半导体光催化过程中,光激发诱导半导体价带电子跃迁至导带,并在价带产生带正电荷的空穴,电子和空穴分别迁移至半导体表面,进而与吸附于表面的物质发生氧化还原反应,最终实现分解有机污染物的目的.可见,使光催化材料具有高效的吸光率进而促进更多的电子空穴分离有利于光催化材料性能的提高.对于纯TiO2纳米管,其带隙能约为3.2 eV(锐钛矿),只能被太阳光中的紫外线部分激发,光利用率较低.对其进行氮掺杂后,进入TiO2晶格的氮元素的p轨道与TiO2中氧元素的p轨道发生交叠,在TiO2的价带与导带之间产生一个新的杂化带,从而使氮掺杂TiO2纳米管的带隙能比纯TiO2纳米管窄得多.因此,氮掺杂TiO2纳米管的光利用率较纯TiO2高,故而能促进更多的电子⁃空穴对产生,具体示意图如图8所示.

Fig.8 Schematic diagram of N⁃doped TiO2nanotubes after light activation
2.2.2 金负载量对样品光催化性能的影响 图9为不同金负载量Au/N⁃TiO2纳米管(氮掺杂量为1.0%)的光催化性能曲线.可以看出,随着金负载量的递增,Au/N⁃TiO2纳米管的光催化活性呈先增强后减弱的趋势.当金负载量为3.0%时,Au/N⁃TiO2纳米管的光催化活性达到最佳,甲基橙溶液在光照2 min时几乎被完全降解,远远优于纯 TiO2纳米管和氮掺杂TiO2纳米管对甲基橙的光降解效果(图7).可见,对TiO2纳米管进行氮掺杂和金负载后,二者的协同作用使Au/N⁃TiO2纳米管具有较高的光催化活性.
当通过氮元素掺杂使TiO2的吸光率得到优化后,减少电子⁃空穴对的复合则成为提升TiO2光催化性能亟待解决的关键问题.当将金粒子沉积到TiO2纳米管上时,金粒子与TiO2形成肖特恩势垒,从而使金粒子可以高效地捕获光生电子[30,31],实现电子⁃空穴对的有效分离.具体过程为:TiO2经紫外光照产生电子⁃空穴对,产生的电子⁃空穴对极易复合,从而导致光量子效率较低.当将金粒子沉积到TiO2上时,如图10所示,TiO2价带上的光生电子在能级差的驱使下转移至金粒子表面,从而导致光生电子⁃空穴复合率的降低,有效提高了光量子效率.随后,迁移至催化剂表面的电子和空穴分别与吸附的氧和水反应生成·OH自由基,·OH自由基的氧化电极电位为2.80 V,具有强氧化性,可使有机污染物完全降解,生成CO2,H2O和其它无机小分子.当金的负载量为3.0%时,其光催化活性最高,可能
是由于在该负载量时光生电子⁃空穴对的分离达到最佳状态;当金的负载量小于3.0%时,催化剂经光激发产生的电子⁃空穴对未被充分分离;继续增加金粒子的负载量,吸附于TiO2表面的金粒子会阻碍部分光的吸收或占据催化剂表面的部分活性中心,从而导致光催化活性下降.
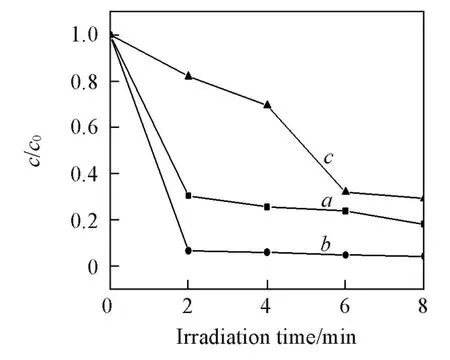
Fig.9 Photocatalytic activity of Au/N⁃TiO2nano⁃tubes(1.0%N)with different Au contents
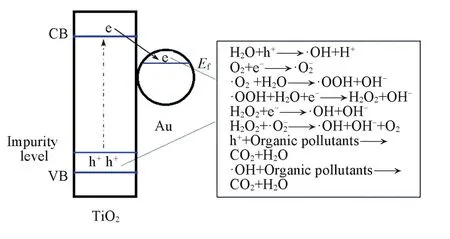
Fig.10 Schematic diagram for the charge separa⁃tion and photodegradation of Au/N⁃TiO2nanotubes(E f:Ferm i energy)
2.2.3 赖氨酸对样品光催化性能的影响 为了研究赖氨酸对催化材料光催化性能的影响,分别在有、无赖氨酸的条件下制备了Au/N⁃TiO2纳米管,并研究了其对甲基橙的光降解率,结果如图11所示.可以看出,在赖氨酸存在下制备的Au/N⁃TiO2纳米管的光催化活性远优于无赖氨酸存在时制备的Au/N⁃TiO2纳米管,这是由于赖氨酸存在时金粒子在纳米管上的高分散状态导致的.通常情况下,贵金属尺寸越小,其催化性能越高,当贵金属粒子的尺寸≤5 nm时,催化剂呈现较高的催化活性[15].本文采用赖氨酸同时作为链接剂和螯合剂,当小尺寸金粒子经硼氢化钠还原产生时,赖氨酸优先吸附于金粒子表面,有效避免了金粒子间的团聚;随后,吸附了金粒子的赖氨酸锚定于纳米管表面,实现了金粒子在载体上的高度分散.

Fig.11 Photocatalytic activity of Au/N⁃TiO2nano⁃tubes with 1.0%N and 3.0%Au loading synthesized in the presence(a) and absence(b)of lysine
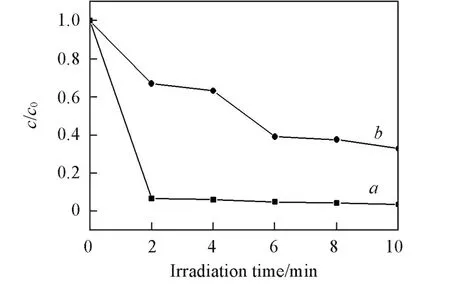
Fig.12 Photocatalytic activity of Au/N⁃TiO2nano⁃tubes with 1.0%N and 3.0%Au loading calcined at 300℃(a)and w ithout calcina⁃tion(b)
2.2.4 焙烧对样品光催化性能的影响 图12给出了Au/N⁃TiO2纳米管未经300℃焙烧及300℃焙烧后的光催化性能曲线.可见,经300℃焙烧后,Au/N⁃TiO2纳米管的光催化降解率远远优于未焙烧样品的,说明焙烧对Au/N⁃TiO2纳米管光催化性能的提升具有重要作用.这是由于经300℃焙烧后,贵金属金粒子与载体之间的相互作用加强,有利于光生电子在二者之间的传递,促进电子⁃空穴分离,进而有益于材料催化性能的增强,因此300℃焙烧后的Au/N⁃TiO2纳米管具有较高的光催化降解率.
3 结 论
以溶胶⁃凝胶法联合水热合成法制备了氮掺杂TiO2纳米管,并以其为载体,采用绿色无毒的赖氨酸为链接剂和螯合剂,一步将高分散金沉积到氮掺杂TiO2纳米管上,制备得到Au/N⁃TiO2纳米管催化
剂.该方法不仅简单快速、绿色环保,而且可有效实现金粒子在载体上的高度分散.紫外⁃可见光谱结果表明,氮掺杂后TiO2的带隙能变窄,有利于光的吸收.TEM和XPS结果表明,经赖氨酸辅助,金粒子高分散地分布在载体上,且和载体之间存在强相互作用.光催化性能测试结果显示,相比于纯TiO2纳米管,Au/N⁃TiO2纳米管具有较高的光催化活性,这是由氮元素和金粒子对TiO2的双重修饰作用所致.讨论了氮掺杂量、金负载量、赖氨酸及焙烧等因素对合成催化剂光催化性能的影响,发现在赖氨酸存在条件下,氮元素掺杂量为1.0%,金粒子负载量为3.0%时,经300℃焙烧后的Au/N⁃TiO2纳米管显示出较高的光降解率,光照2 min时甲基橙几乎被100%降解.
[1] Liu X.,Chen Y.,Rao S.H.,Pang G.S.,Chem.Res.Chinese Universities,2015,31(5),688—692
[2] Widchaya R.,Araya T.,Ratchaneekorm W.,Chem.Res.Chinese Universities,2014,30(1),149—156
[3] Shi Y.K.,Hu X.J.,Zhu B.L.,Zhang S.M.,Huang W.P.,Chem.Res.Chinese Universities,2015,31(5),851—857
[4] An H.Q.,Zhu B.L.,Wu H.Y.,Zhang M.,Wang S.R.,Zhang S.M.,Wu.S.H.,HuangW.P.,Chem.J.Chinese Universities,2008,29(3),439—444(安会琴,朱宝林,吴红艳,张明,王淑荣,张守民,吴世华,黄唯平.高等学校化学学报,2008,29(3),439—444)
[5] Kasuga T.,Hiramatsu M.,Hoson A.,Sekino T.,Niihara K.,Langmuir,1998,14(12),3160—3163
[6] Valentin C.D.,Finazzi E.,PacchioniG.,Selloni A.,Livraghi S.,PaganiniM.C.,Giamello E.,Chem.Phys.,2007,339(1—3),44—56
[7] Iliev V.,Tomova D.,Bilyarska L.,Tyuliev G.,J.Mol.Catal.A,2007,263(1/2),32—38
[8] Yu Y.,Wu H.H.,Zhu B.L.,Wang S.R.,Huang W.P.,Wu S.H.,Zhang S.M.,Catal.Lett.,2008,121(1),165—171
[9] Cantau C.,Pigot T.,Dupin J.,Lacombe S.,J.Photoch.Photobio.A,2010,216(2/3),201—208
[10] Pelaez M.,de la Cruz A.A.,Stathatos E.,Falaras P.,Dionysiou D.D.,Catal.Today,2009,144(1/2),19—25
[11] Zhu B.L.,Li K.R.,Feng Y.F.,Zhang S.M.,Wu S.H.,HuangW.P.,Catal.Lett.,2007,118(1),55—58
[12] An H.Q.,He X.L.,Li J.Q.,Zhao L.Z.,Chang C.,Zhang S.H.,Huang W.P.,New J.Chem.,2015,39(6),4611—4623
[13] Iliev V.,Tomova D.,Todorovska R.,Oliver D.,Petrov L.,Todorovsky D.,Uzunova⁃Bujnova M.,Appl.Catal.A:Gen.,2006,313(2),115—121
[14] An H.Q.,Zhou J.,Li J.X.,Zhu B.L.,Wang S.R.,Zhang S.M.,Wu S.H.,HuangW.P.,Catal.Commun.,2009,11(3),175—179
[15] Hashmi A.S.K.,Hutchings G.J.,Angew.Chem.Int.Ed.,2006,45(47),7896—7936
[16] Wen D.,Guo S.J.,Zhai J.F.,Deng L.,Ren W.,Dong S.J.,J.Phys.Chem.C,2009,113(30),13023—13028
[17] Guo S.J.,Dong S.J.,Wang E.K.,J.Phys.Chem.C,2009,113(14),5485—5492
[18] Zhong Z.Y.,Lin J.,Teh S.P.,Teo J.,Dautzenberg F.M.,Adv.Funct.Mater.,2007,17(8),1402—1408
[19] Zhang J.,Liu X.,Wang L.,Yang T.,Guo X.,Wu S.,Wang S.,Zhang S.,J.Phys.Chem.C,2011,115(13),5352—5357
[20] Zhang J.,Liu X.H.,Guo X.Z.,Wu S.H.,Wang S.R.,Chem.Eur.J.,2010,16(27),8108—8116
[21] Wang Z.P.,CaiW.M.,Hong X.T.,Zhao X.L.,Xu F.,Cai C.G.,Appl.Catal.B,2005,57(3),223—231
[22] Chen Y.,Zhang S.,Yu Y.,Wu H.,Wang S.,Zhu B.,Huang W.,Wu S.,J.Disper.Sci.Technol.,2008,29(2),245—249
[23] An H.Q.,Hu X.J.,Zhu B.L.,Song J.J.,Zhao W.L.,Zhang S.M.,Huang W.P.,Mater.Sci.⁃Poland,2013,31(4),531—542
[24] Sun L.,Zhao Z.,Zhou Y.,Liu L.,Nanoscale,2012,4(2),613—620
[25] Sathish M.,Viswanathan B.,Viswanath R.P.,Gopinath C.S.,Chem.Mater.,2005,17(25),6349—6353
[26] Zhao L.,Chen X.,Wang X.,Zhang Y.,Wei W.,Sun Y.,Antonietti M.,Titirici M.M.,Adv.Mater.,2010,22(30),3317—3321
[27] Xiang Q.,Yu J.,Jaroniec M.,Nanoscale,2011,3(9),3670—3678
[28] Wang W.S.,Wang D.H.,Qu W.G.,Lu L.Q.,Xu A.W.,J.Phys.Chem.C,2012,116(37),19893—19901
[29] Yang X.X.,Cao C.D.,Erickson L.,Hohn K.,Maghirang R.,Klabunde K.,Appl.Catal.B,2009,91(3/4),657—662
[30] Mubeen S.,Lee J.,Singh N.,Kramer S.,Stucky G.D.,Moskovits M.,Nat.Nanotechnol.,2013,8,247—251
[31] McFarland E.W.,Tang J.,Nature,2003,421(6923),616—618
Synthesis of Highly Dispersed Au Nanoparticles Modified N⁃Doped TiO2Nanotubes by the Assist of Lysine and Their Photocatalytic Activity†
AN Huiqin1∗,YU Yucai1,YAN Lin1,WU Tingting1,LIXiaofeng1,HE Xiaoling1,ZHAO Lizhi2,HUANGWeiping3∗
(1.School of Environmental and Chemical Engineering,State Key Laboratory of Separation Membranes and Membrane Processes,Tianjin Polytechnic University,Tianjin 300387,China;2.School ofMaterials Science and Engineering,Tianjin Polytechnic University,Tianjin 300387,China;3.Key Laboratory ofAdvanced Energy Materials Chemistry,Ministry of Enducation,Nankai University,Tianjin 300071,China)
N⁃doped TiO2nanotubeswere synthesized by the combination of sol⁃gel and hydrothermalmethods firstly;and then Au nanoparticleswere deposited on the N⁃doped TiO2nanotubes by a simple one⁃pot process with lysine as both the linker and capping agent.Themorphology,structure,optical absorption and composi⁃tion of the sampleswere characterized bymeans of TEM,XRD,UV⁃Vis and XPS.The photodegradation rates ofmethyl orange under UV light irradiation were used to evaluate the photocatalytic activities of samples.The effects of N content,Au content,lysine and calcination on the photocatalytic activities of Au/N⁃doped TiO2nanotubeswere discussed.The results exhibit that Au nanoparticles capped by lysine are highly dispersed on the supportwithout any aggregation and the obtained sample exhibits higher photocatalytic activity in compari⁃son with pure TiO2nanotubes.The improved photocatalytic activity is attributed to the narrower band gap of N⁃doped TiO2,the high dispersion of Au nanoparticles and the reduced recombination of photogenerated electrons and holes caused by the formation ofmetal⁃semiconductor Schottky junction between Au and TiO2. Keywords TiO2nanotube;N doping;Au nanoparticle;Lysine;Photodegradation ofmethyl orange
O644;O611.4
A
10.7503/cjcu20160377
(Ed.:S,Z,M)
†Supported by the National Natural Science Foundation of China(Nos.21501131,21373120),the National Training Program of Innovation and Entrepreneurship for Undergraduates of Tianjin Polytechnic University,China(No.201510058021)and the Science and Technology Corre⁃spondent Project of Tianjin,China(No.15JCTPJC57500).
2016⁃05⁃26.
日期:2016⁃10⁃20.
国家自然科学基金(批准号:21501131,21373120)、天津工业大学国家级大学生创新创业训练计划项目(批准号:201510058021)和天津市科技特派员项目(批准号:15JCTPJC57500)资助.
联系人简介:安会琴,女,博士,讲师,主要从事无机功能材料合成研究.E⁃mail:anhuiqinhebei@163.com黄唯平,男,博士,教授,主要从事无机合成及材料催化研究.E⁃mail:hwp914@nankai.edu.cn
