万古霉素手性膜拆分D,L⁃苯甘氨酸及手性拆分机理
2016-11-23袁黎明,苏莹秋,段爱红等
万古霉素手性膜拆分D,L⁃苯甘氨酸及手性拆分机理
以万古霉素和1,6⁃己二异腈酸酯为单体,通过界面聚合法在聚砜基膜上制备了万古霉素手性高分子膜.利用红外光谱及扫描电子显微镜对该膜进行了表征.将其用于青霉素及头孢菌素类药物的重要中间体苯甘氨酸的手性拆分,通过优化单体摩尔比、界面聚合时间及外消旋体溶液浓度等分离参数,可达到超过70% 的D⁃苯甘氨酸对映体过剩值的手性分离.通过比较研究手性膜吸附、固相萃取、膜色谱、膜渗析和膜超滤过程,发现手性膜上优先吸附的对映体L⁃苯甘氨酸并不是各种模式下优先透过的对映体,结合外消旋体的缔合特性,提出了“吸附⁃缔合⁃扩散”的手性膜分离机理.
万古霉素;D,L⁃苯甘氨酸;手性膜;分离机理
在约2000种常规药物中,还有近500种是以外消旋体混合物的形式存在.这些外消旋体药物通常一种对映体有药效,或者具有相反的药效,甚至具有毒副作用.将这些外消旋体药物拆分或者转化成为单一的手性药物,是目前药物研究的前沿课题之一.此外,手性分离在生命、化学、农业及材料等领域也具有非常广泛的用途[1~4].
在众多的手性分离方法中,膜的手性分离具有节能、环保、成本低以及容易工业化生产等优点.但自1986年第一篇有关手性固膜的研究被报道以来[5],至今仍无商品化的手性膜出售,其工业化应用也尚未实现[6].近年来,关于手性膜不断有新的研究报道出现[7~16],在新材料方面主要包括手性金属⁃有机骨架材料和手性笼等,在膜制备方法上也出现了手性无机膜和无机有机混合膜等[17~23].
大环抗菌素是优良的手性识别材料,已被用于手性识别的多个领域[6].青霉素及头孢菌素类是非常重要的抗菌类药物,D⁃苯甘氨酸是生产氨苄西林、依匹西林、匹氨西林、头孢氨苄、头孢拉定和头孢克洛等必不可少的原料.但苯甘氨酸是非天然氨基酸,一般通过合成得到其外消旋体,然后经过手性拆分获得D⁃苯甘氨酸.本文将万古霉素制备成手性复合膜用于苯甘氨酸的手性拆分,得到了良好的D⁃苯甘氨酸的分离效果.迄今,尚未见将大环抗菌素手性选择剂用作手性膜或用手性膜拆分苯甘氨酸的报道.意外的是,在该手性拆分过程中,我们观察到在手性膜上优先吸附的L⁃苯甘氨酸对映体并不是各种膜分离模式下优先透过的对映体D⁃苯甘氨酸,并结合苯甘氨酸外消旋体的缔合特性,提出了“吸附⁃缔合⁃扩散”的手性膜拆分机理.
1 实验部分
1.1 试剂与仪器
D,L⁃苯甘氨酸(比利时Acros公司);1,6⁃己二异腈酸酯[Alfa Aesar(中国)化学有限公司];万古霉素(苏州法姆医药科技有限公司);聚砜超滤膜(贵阳时代沃顿科技有限公司);其余试剂均为分析纯;原料液由纯水配制.
高效液相色谱仪(HPLC,配有Waters 515恒流泵和Waters 2489紫外检测器,美国Waters公司);
N2000型色谱工作站(浙江大学智达信息工程有限公司);CROWNPAK CR(-)手性色谱柱(150 mm× 4.6 mm i.d.,日本Daicel公司);膜渗析装置(自制,有效膜面积3.3 cm2);BRUKER TENSOR 27型傅里叶红外光谱仪(德国Bruker公司);S⁃3000N型扫描电子显微镜(日本日立公司);Bruker Smart CCD X射线单晶衍射仪(德国Bruker公司)
1.2 万古霉素膜的制备
将聚砜膜用纯水浸泡24 h后,置于万古霉素溶液中浸泡24 h,取出聚砜膜沥干,然后于20℃下与异腈酸酯的正庚烷溶液进行界面聚合30 s,聚合时加入催化剂三乙胺.聚合反应完毕,用正庚烷洗涤膜上剩余的单体原料,再于100℃加热20 min,最后用纯水洗净万古霉素复合膜,放入4℃的纯水中保存备用.
1.3 苯甘氨酸的渗析实验
将制备的复合膜固定在自制的膜渗析装置中,该装置以浓度差为驱动力.膜正面一侧为10 mL 0.1 mg/mL的D,L⁃苯甘氨酸溶液,另一侧为10mL纯水.渗析实验在室温下进行,渗析一定时间后,取出纯水一侧的溶液,用HPLC检测透过情况.所有膜均只使用1次.
1.4 色谱分析
采用高效液相色谱和CROWNPAK CR(-)手性色谱柱测定D,L⁃苯甘氨酸原料液和透过相中的D⁃和L⁃对映体的含量.色谱条件:流动相为pH=1的HClO4溶液,流速0.4mL/min,柱温25℃,检测波长254 nm,每次进样量为20μL.
D,L⁃苯甘氨酸的对映体过剩值[e.e.(%)]根据下式计算:

式中:Ar和As分别为透过液中D⁃和L⁃对映体的峰面积.
2 结果与讨论
2.1 万古霉素的红外光谱测定
图1为万古霉素和万古霉素手性膜的FTIR光谱图.
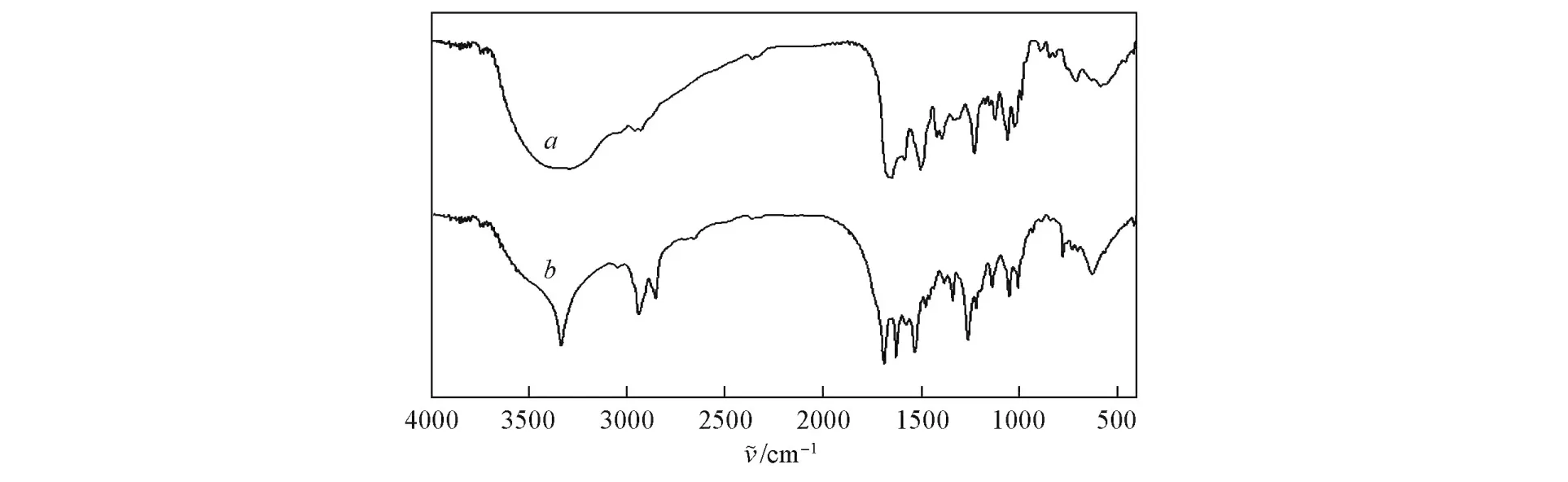
Fig.1 FTIR spectra of vancom ycin(a)and vancomycin membrane(b)
由图1谱线b可以看出,其在3337.48 cm-1处的吸收峰减弱,在2942.97,2856.07和1690.99 cm-1处的吸收峰增强,说明万古霉素中的—NHY基团主要与1,6⁃己二异腈酸酯中的基团发生了反应,反应方程式如下:
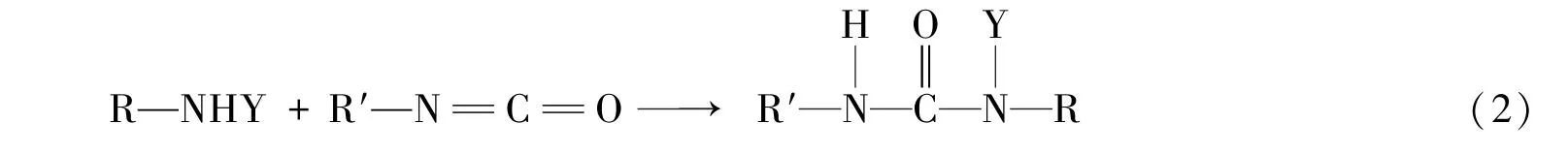
2.2 膜的SEM分析
图2为聚砜基膜与万古霉素复合膜的SEM照片,可见复合膜表面平整光滑,但从膜的截面照片可见,其表面附着了一层薄膜,表明高分子聚合物已聚合在聚砜基膜表面上.

Fig.2 SEM images of top surface(A,C)and cross⁃section(B,D)of polysulfonemembrane(A,B)and enantioselective compositemembrane(C,D)
2.3 1,6⁃己二异腈酸酯与万古霉素的摩尔比对手性分离性能的影响
以不同的单体摩尔比制备的万古霉素复合膜对苯甘氨酸的手性分离性能不同.由图3可见,当1,6⁃己二异腈酸酯与万古霉素的摩尔比从0.93增加到6.3时,苯甘氨酸的对映体过剩值先增大然后减小,二者摩尔比为2.2时达最大值.这是因为不同的单体比例将会影响复合膜皮层的化学结构.另外,通过手性高效液相色谱分析得知,在整个分离过程中,D⁃苯甘氨酸总是优先透过.
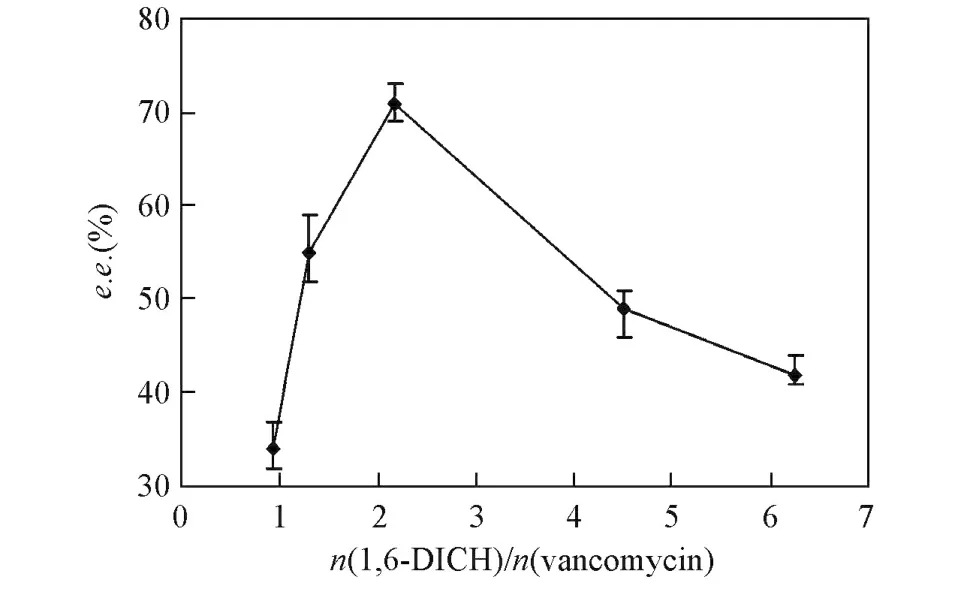
Fig.3 Enantiomeric excess[e.e.(%)]at different molar ratios of 1,6⁃diisocyanatohexane to vancomycin
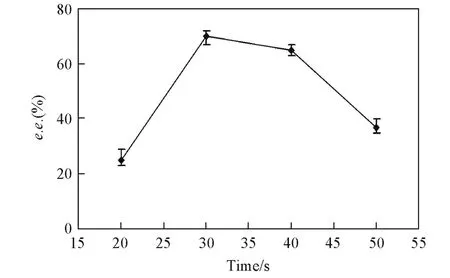
Fig.4 Enantiomeric excess[e.e.(%)]at different time of interfacial polymerization
2.4 界面聚合时间对手性分离性能的影响
膜的界面聚合时间也将直接影响复合膜的表面皮层结构.图4示出了界面聚合时间对手性分离性能的影响,可见,苯甘氨酸的对映体过剩值随界面聚合时间的变化次序为30 s>40 s>50 s>20 s.当聚合时间为30 s时,可以得到超过70%的苯甘氨酸的对映体过剩值.小于或者大于该界面聚合时间,都将直接影响其手性分离效果.
2.5 苯甘氨酸浓度对膜分离性能的影响
图5示出了苯甘氨酸浓度对万古霉素复合膜手性分离性能的影响.由图5可见,当外消旋体浓度从0.1 mg/mL增加到0.4 mg/mL时,膜的手性选择性明显降低.这是因为当外消旋体的浓度较高时,
越来越多的手性活性位点将被另一个对映体掩盖,同时一个对映体也将影响另一个对映体的选择性扩散.
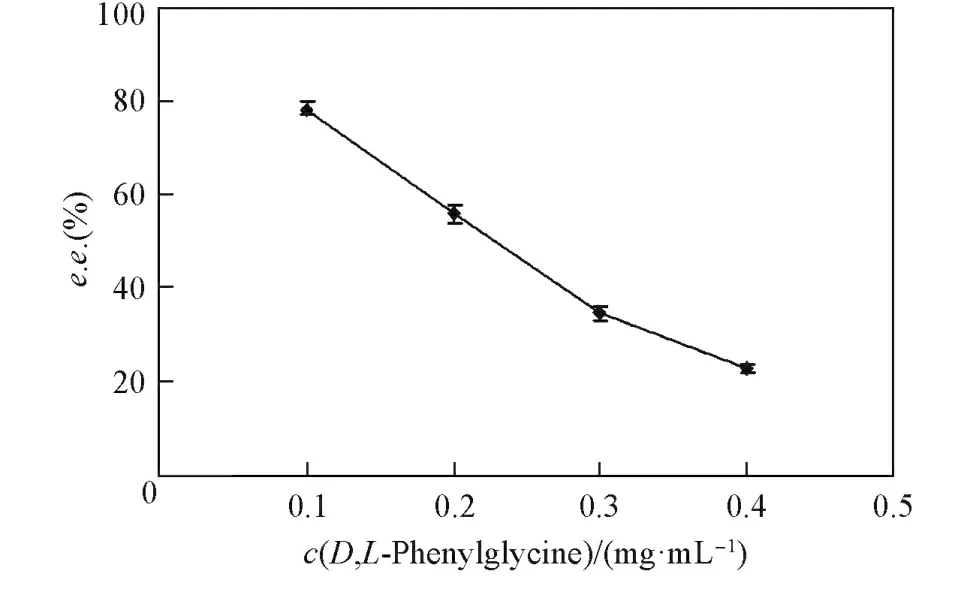
Fig.5 Enantiom eric excess[e.e.(%)]at different feed concentrations
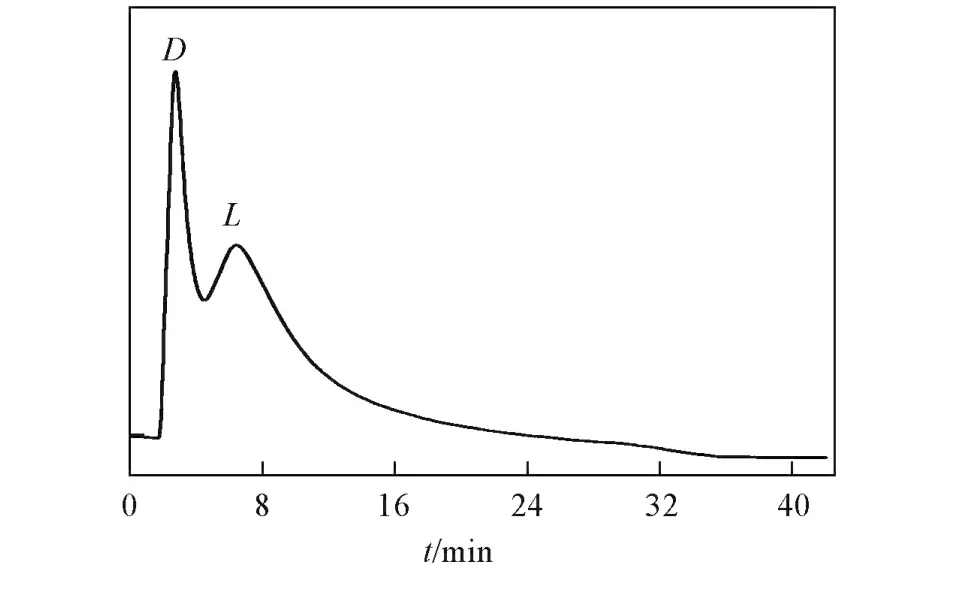
Fig.6 Membrane chrom atogram of D,L⁃phenylglycine
2.6 万古霉素复合膜的手性分离机理
为了研究万古霉素复合膜的手性分离机理,将完成苯甘氨酸外消旋体渗析后的膜取出沥干,用纯水冲洗该复合膜的正表面,冲洗液浓缩后用手性高效液相色谱测定.结果表明,该膜表面优先吸附L⁃苯甘氨酸,且L⁃苯甘氨酸的对映体过剩值为53%.由于优先吸附的对映体不是优先渗析过去的对映体D⁃苯甘氨酸,该实验现象引起了我们的兴趣.我们按照万古霉素膜的制备方法,将该膜界面聚合于直径为5μm的色谱硅胶表面,然后用于苯甘氨酸外消旋体溶液的固相萃取.手性分析结果表明,仍然是L⁃苯甘氨酸被优先吸附,且L⁃苯甘氨酸的对映体过剩值为29%.为了证明在该界面聚合条件下,能够生成万古霉素⁃异腈酸酯复合膜,分别对聚合反应前后的硅胶进行了元素分析,分析结果为硅胶中N,C和H含量分别为<0.1%,<0.1%和0.44%,万古霉素⁃异腈酸酯固相萃取剂中N,C和H含量分别为3.00%,18.73%和2.90%,证实了万古霉素⁃异腈酸酯复合膜的生成.
将该万古霉素复合膜固定在自制的膜色谱装置上(有效膜面积为3.3 cm2),取代高效液相色谱中的手性分离柱,以纯水为流动相,设定流速为0.2 mL/min,温度控制在25℃,对苯甘氨酸的外消旋体进行拆分,图6示出了该膜色谱对苯甘氨酸的手性分离结果.在该膜色谱中,D⁃苯甘氨酸优先流出色谱膜,而L⁃苯甘氨酸后流出.实验中还利用0.5 MPa的压力为推动力[11,12],在超滤模式下进行了该万古霉素膜对苯甘氨酸的手性拆分.结果表明,在0.1 mg/mL的D,L⁃苯甘氨酸原料液浓度下,优先透过的仍是D⁃苯甘氨酸,且其对映体过剩值为23%.
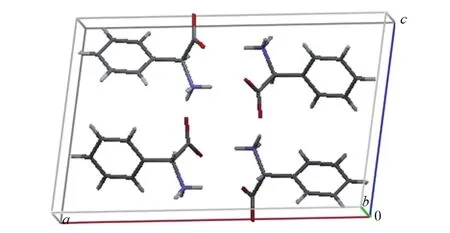
Fig.7 Single crystal structure of D,L⁃phenylglycine
由上面的实验可知,不管是以聚砜或者是以硅胶为支撑体,制得的万古霉素膜优先吸附的均为L⁃苯甘氨酸;但是不管是膜色谱、膜渗析或者膜超滤,为什么优先透过的是D⁃苯甘氨酸呢?众所周知,外消旋体在晶体状态下可产生3种情况:一种是外消旋混合物,另一种是外消旋化合物,第三种是外消旋固体溶液.前者是2个纯对映体晶体的物理状混合物,约占整个外消旋体的8%;第二种是2种对映异构体等量和有序地排列在同一晶体中;第三种是第二种的一种特殊情况,2种对映异构体以非等量无序地存在于晶体中.我们将苯甘氨酸外消旋体以水为溶剂进行重结晶,对所得单晶进行单晶X射线衍射分析,其晶胞结构如图7所示.由图7可见,在D,L⁃苯甘氨酸的晶胞结构中,D⁃苯甘氨酸和L⁃苯甘氨酸存在1∶1的严格比例,并且D⁃苯甘氨酸和L⁃苯甘氨酸之间有规律的相间排列.
万古霉素分子结构中有7个肽和5个芳环构成了三环糖肽.万古霉素包含19个立体中心、9个羟基、2个氨基、7个酰胺基团和2个氯原子.整个分子呈现出一个“半固定篮”结构,其在手性识别中起到重要作用.因此,在万古霉素手性高分子膜的拆
分机理中,该膜表面对L⁃苯甘氨酸具有较强的选择性吸附作用,在万古霉素膜的表面首先形成了一层较稳定的L⁃苯甘氨酸吸附层;然后,由于苯甘氨酸倾向于形成外消旋化合物的固有特性,使D⁃苯甘氨酸选择性地缔合在L⁃苯甘氨酸吸附层的表面;而由于D⁃苯甘氨酸缔合层与L⁃苯甘氨酸吸附层作用力较弱,且存在浓度梯度的原因,致使D⁃苯甘氨酸优先透过了万古霉素复合膜.该手性膜分离可能的机理可以简述为“吸附⁃缔合⁃扩散”机理,如Scheme 1所示.
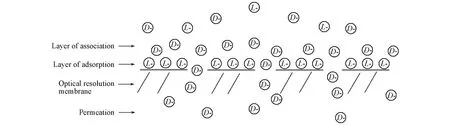
Scheme 1 Chiral separation mechanism of the“adsorption⁃association⁃diffusion”in optical resolution ofmembrane
3 结 论
所制备的万古霉素手性复合膜可用于苯甘氨酸外消旋体的拆分,手性选择性可受界面聚合单体摩尔比、聚合反应时间以及原料液浓度等的影响.在制膜过程中,当选择1,6⁃己二异腈酸酯与万古霉素的摩尔比为2.2,界面聚合反应时间为30 s,渗析过程中对羟基苯甘氨酸外消旋体原料液的浓度为0.1 mg/mL时,可以获得超过70%的对映体过剩值.该手性拆分过程的机理可简述为“吸附⁃缔合⁃扩散”原理.
[1] Lakshmi B.B.,Martin C.R.,Nature,1997,388,758—760
[2] Sun B.H.,Zhao Y.,Hai L.,Guo L.,Wu Y.,Chem.J.Chinese Universities,2016,37(3),493—497(孙宝厚,赵毅,海俐,郭丽,吴勇.高等学校化学学报,2016,37(3),493—497)
[3] Shen G.Y.,Gao Y.,Zhang A.Q.,Cui J.,DaiD.S.,Chem.J.Chinese Universities,2015,36(5),881—885(申刚义,高妍,张爱芹,崔箭,戴东升.高等学校化学学报,2015,36(5),881—885)
[4] Xie R.,Chu L.Y.,Deng J.G.,Chem.Soc.Rev.,2008,37,1243—1263
[5] Osad Y.,Ohta F.,Mizumoto A.,Takase M.,Kurimura Y.,J.Chem.Soc.Japan,1986,7,866—872
[6] Yuan L.M.,Chiral Recognition Materials,Science Press,Beijing,2010,26—29(袁黎明.手性识别材料.北京:科学出版社,2010,26—29)
[7] Cheng B.P.,Li L.S.,Zhou R.D.,Li L.,Zhang H.F.,Chem.J.Chinese Universities,2015,36(5),872—880(程彪平,李来生,周仁丹,李良,张宏福.高等学校化学学报,2015,36(5),872—880)
[8] Xie S.M.,Zhang Z.J.,Yuan L.M.,Chem.J.Chinese Universities,2014,35(8),1652—1657(谢生明,张泽俊,袁黎明.高等学校化学学报,2014,35(8),1652—1657)
[9] Higuchi A.,TamaiM.,Ko Y.A.,Tagawa Y.I.,Wu Y.H.,Freeman B.D.,Bing J.T.,Chang Y.,Ling Q.D.,PolymerReviews,2010,50(2),113—143
[10] Zhao M.,Xu X.L.,Jiang Y.D.,Sun W.Z.,Wang W.F.,Yuan L.M.,J.Membr.Sci.,2009,336,149—153
[11] Xie S.M.,Wang W.F.,Ai P.,Yuan L.M.,J.Membr.Sci.,2008,321,293—298
[12] Xiong W.W.,Wang W.F.,Zhao L.,Song Q,Yuan L.M.,J.Membr.Sci.,2009,328,268—272
[13] Dai R.J.,Su C.L.,Wu H.Y.,Deng Y.L.,Trans.Beijing Inst.Technol.,2008,28(6),557—557(戴荣继,苏彩莲,武海燕,邓玉林.北京理工大学学报,2008,28(6),557—557)
[14] Tian F.Y.,Zhang J.H.,Duan A.H.,Wang B.J.,Yuan L.M.,J.Membr.Sep.Tech.,2012,1(2),72—78
[15] Wang W.J.,Dong X.L.,Nan J.P.,Jin W.Q.,Hu H.Q.,Chen Y.F.,Jiang J.W.,Chem.Commun.,2012,48,7022—7024
[16] Wang J.Y.,Xu Z.L.,Wu P.,Yi S.J.,J.Membr.Sci.,2009,331,84—90
[17] Bushell A.F.,Budd P.M.,Attfield M.P.,Jones J.T.A.,Hasell T.,Cooper A.I.,Bernardo P.,Bazzarelli F.,Clarizia G.,Jansen J. C.,Angew.Chem.Int.Ed.,2013,52,1253—1256
[18] Weng X.,Baez J.E.,Khiterer M.,Hoe M.Y.,Bao Z.,Shea K.J.,Angew.Chem.Int.Ed.,2015,54,11214—11218
[19] Liu Y.,Li P.,Xie L.,Fan D.Y.,Huang S.S.,J.Membr.Sci.,2014,453,12—17
[20] Singh K.,Devi S.,Bajaj H.C.,Ingole P.,Choudhari J.,Bhrambhatt H.,Sep.Sci.Tech.,2014,49,2630—2641
[21] Sueyoshi Y.,Utsunomiya A.,Yoshikawa M.,Robertson G.P.,Guiver M.D.,J.Membr.Sci.,2012,401/402,89—96
[22] Kang Z.X.,Xue M.,Fan L.L.,Ding J.Y,Guo L.J.,Gao L.X.,Qiu S.L.,Chem.Commun.,2013,49,10569—10571
[23] Ingole P.G.,Bajaj H.C.,Srivastava D.N.,Rebary B.,Singh K.,Sep.Sci.Tech.,2013,48,1777—1787
袁黎明,苏莹秋,段爱红,郑 莹,艾 萍,谌学先
(云南师范大学化学化工学院,昆明650500)
Optical Resolution of D,L⁃Phenylglycine and Chiral Separation Mechanism Using an Enantioselective Membrane of Vancom ycin†
YUAN Liming∗,SU Yingqiu,DUAN Aihong,ZHENG Ying,AIPing,CHEN Xuexian
(Faculty ofChemisty and Chemical Engineering,Yunnan Normal University,Kunming 650500,China)
Using vancomycin and 1,6⁃diisocyanatohexane as the monomers,an enantioselective composite membrane was prepared by interfacial polymerization on a polysulfone support and was analyzed by Fourier transform infrared spectroscopy and scanning electronmicroscopy.The compositemembranewas used for enan⁃tioseparation of D,L⁃phenylglycine which is an indispensable reagent in the syntheses of penicillins and cepha⁃losporins.By optimizing themolar ratio of vancomycin and 1,6⁃diisocyanatohexane,the time of polymerization and the feed concentration of the racemate,an enantiomeric excess[e.e.(%)]of over 70%D⁃phenylglycine could be obtained.Comparing themembrane adsorption,solid extraction,membrane chromatography,dialysis and ultrafiltration of vancomycin optical resolutionmembrane,the L⁃phenylglycinewas prior adsorbed,while,the D⁃phenylglycine was first permeated themembrane.Based on the association characteristic of racemate of D,L⁃phenylglycine,we suggested,in the first time,that the enantioseparation mechanism ofmembrane was “adsorption⁃association⁃diffusion”.
Vancomycin;D,L⁃Phenylglycine;Optical resolution membrane;Enantioseparation mechanism
O652.6
A
10.7503/cjcu20160460
(Ed.:N,K)
†Supported by the National Natural Science Foundation of China(Nos.21365025,21265026,21165022).
2016⁃06⁃30;
日期:2016⁃10⁃19.
国家自然科学基金(批准号:21365025,21265026,21165022)资助.
联系人简介:袁黎明,男,博士,教授,主要从事手性分离方面的研究.E⁃mail:yuan_limingpd@126.com
