分离自木霉菌Trichoderma sp.的新型化合物Trichoderol A及绝对构型的确定
2016-11-23许兰兰赵齐齐王景晨王慧君朱华结
许兰兰,赵齐齐,俞 和,2,王景晨,王慧君,杨 芹,朱华结,李 艳
(1.药物化学与分子诊断教育部重点实验室,河北省药物质量分析控制重点实验室,河北大学药学院,保定071002;2.机械工业分析仪器产品质量监督检测中心,北京100095;3.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650204)
分离自木霉菌Trichoderma sp.的新型化合物Trichoderol A及绝对构型的确定
许兰兰1,赵齐齐1,俞 和1,2,王景晨1,王慧君1,杨 芹1,朱华结1,李 艳3
(1.药物化学与分子诊断教育部重点实验室,河北省药物质量分析控制重点实验室,河北大学药学院,保定071002;2.机械工业分析仪器产品质量监督检测中心,北京100095;3.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650204)
采用经典柱色谱方法从土壤真菌木霉菌Trichoderma sp.中分离得到1个新的化合物,为长链不饱和醇类.运用核磁共振及质谱等手段确定了化合物的平面结构,再结合电子圆二色谱(ECD)、旋光(OR)及量子化学方法计算确定其绝对构型.结果表明,该新化合物为Trichoderol A(1).活性测试结果显示,该化合物对3株致病菌具有一定程度的抗菌活性(MIC=25μmol/L).
Trichoderma sp.;电子圆二色光谱;旋光;矩阵模型;抗菌活性
天然产物绝对构型的确定是一个重要的研究课题,很多天然产物因其不易结晶或收率甚微而无法用单晶X射线衍射(X⁃ray)以及Mosher反应等物理、化学方法确定其绝对构型[1~3].电子圆二色光谱(ECD)有效地解决了这一问题[4],而且随着量子化学的发展,ECD计算结果的精度越来越高,已成为天然产物绝对构型确定的重要手段[5~9].
前文[8]从土壤真菌Trichoderma sp.发酵物中分离提取出1个新化合物,本文在此基础上改变发酵条件再次培养,又分离得到1个新的化合物Trichoderol A(1),该类化合物为长链不饱和醇类线型分子.利用电子圆二色光谱确定了线性分子化合物1的绝对构型.
1 实验部分
1.1 试剂与仪器
所用试剂均为市售分析纯产品.菌株来自河北大学校园内的土壤筛选出的真菌,经由北京三博远志技术有限责任公司鉴定为木霉菌(Trichoderma sp.),该菌株的编号为SF⁃2(见本文支持信息表S1),NCBI基因Bank号为KX462885.
MOS⁃450型圆二色光谱仪(ECD,法国Bio⁃Logic公司);AA⁃55系列全自动旋光仪(英国Optical Activity公司);AvanceⅢ600 MHz核磁共振仪(TMS为内标,德国Bruker公司);Micromass Q⁃TOF ESI⁃MS型质谱仪(美国Waters公司);Agilent Accurate⁃Mass⁃Q⁃TOF ESI⁃MS 6520型高分辨质谱仪(美国Agilent公司);紫外分光光度计(北京恒通瑞利公司);LC⁃20A循环半制备色谱仪(日本岛津公司);全波长酶标仪(美国Thermo公司);正相柱色谱硅胶(青岛海洋化工有限公司);凝胶Sephadex LH⁃20(美国Pharmacia公司);C18反相填料(日本YMC公司);GF254薄层色谱用硅胶(烟台化学工业研究所).
1.2 实验过程
1.2.1 真菌培养 人工海水配比:将 NaCl(24.5 g/L),Na2SO4(3.9 g/L),KCl(0.7 g/L),KBr
(0.1 g/L),SrCl2(0.02 g/L),MgSO4·6H2O(5.0 g/L),CaCl2·H2O(1.1 g/L),NaHCO3(0.2 g/L),H3BO3(0.02 g/L)及NaF(0.004 g/L)混合,用蒸馏水定容至1 L,pH=7.5.
Ⅰ型培养基配比:将甘露醇(20 g/L),酵母膏(3 g/L),麦芽糖(20 g/L),味精(5 g/L),葡萄糖(10 g/L),蛋白胨(5 g/L)及土豆(200 g/L)熬成汁,用人工海水定容至1 L,调节pH=6.0.将菌种在Ⅰ型培养基中培养,共发酵100 L,于28℃,120 r/min摇床恒温培养21 d.
1.2.2 化合物的提取和分离 将发酵产物用布氏漏斗抽滤,并将菌丝体与发酵液分离.将发酵液减压浓缩至10 L,然后用等体积的乙酸乙酯萃取多次至无色,菌丝体同样用乙酸乙酯等体积提取并减压浓缩,将两者合并得到35.0 g浸膏.对所得浸膏进行硅胶柱层析:用80~100目硅胶拌样,200~300目硅胶装柱,以二氯甲烷/甲醇(体积比分别为100∶0,100∶1,80∶1,50∶1,30∶1,15∶1,10∶1,5∶1,1∶1 和0∶1)溶液为流动相进行梯度洗脱,共得8个组分Fr.1~Fr.8.组分Fr.5依次通过Sephadex⁃LH⁃20(甲醇)、硅胶柱[V(二氯甲烷)∶V(甲醇)=30∶1]、ODS柱[V(甲醇)∶V(水)=4∶1]及高效液相色谱[V(甲醇)∶V(水)=4∶1]分离,得到化合物1(12.0 mg).
1.2.3 肿瘤细胞毒活性测试 采用MTT法[10]对化合物1进行肿瘤细胞毒活性检测.所测试的5种肿瘤细胞分别为白血病细胞(HL⁃60)、肝癌细胞(SMMC⁃7721)、肺癌细胞(A⁃549)、乳腺癌细胞(MCF⁃7)和结肠癌细胞(SW480),以顺铂(MW 300)和紫杉醇(Taxol)作为阳性对照.
1.2.4 抗菌活性测试 采用96孔板2倍稀释法[11]对化合物1进行了抗菌活性测试,3株测试菌株分别为恶臭假单孢杆菌(Pseudomonas putida)、巴西诺卡菌(Nocardia brasiliensis)和嗜根库克菌(Kocuria rhizophila),以环丙沙星作为阳性对照.测定最小抑菌浓度MIC(μmol/L).
2 结果与讨论
2.1 化合物结构解析
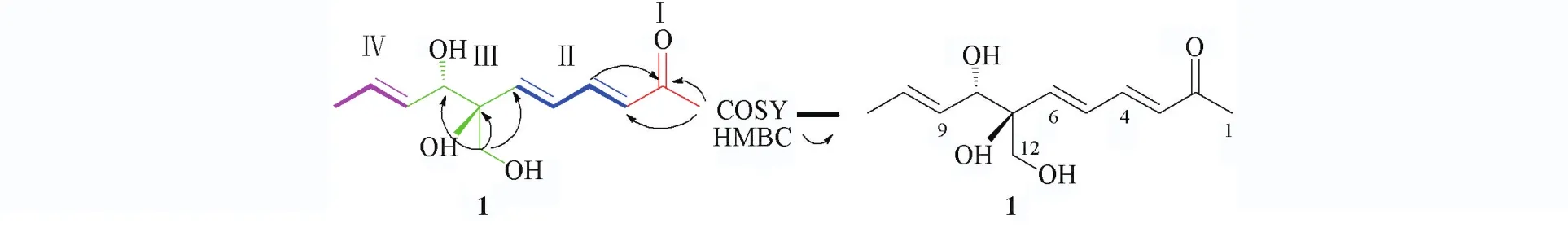
Fig.1 Structure of com pound 1 and key HMBC and COSY of compound 1
化合物1的绝对构型通过比较圆二色光谱(ECD)实验值与计算值来确定.该分子存在2个手性中心,那么理论上的绝对构型可能有4种,所以只需运用量子化学理论[12~17]计算其中2种构型(2组对
应异构体分别取其中1种)并对比实验谱图,便可确定化合物1的绝对构型.首先,利用软件通过分子动力学力场MMFF94S方法[18]对分子(7R,8S)⁃1和(7S,8S)⁃1进行构象搜索,分别得到68和94个能量最低构象(ΔE=0~10.224 kJ/mol),对2组构象分别在B3LYP/6⁃311+G(d)基组[19]水平上进行优化计算,对优化后的能量在0~3.0 kJ/mol的29个构象[(7R,8S)⁃1构象19个,(7S,8S)⁃1构象10个]在气相条件下用B3LYP/6⁃311++G(2d,p)基组[19]分别进行ECD及OR计算[20],OR计算结果分别为+198.81和+103.05,与实测值相符,说明另外2种构型与实测值相反,结果为这2种构型之一.再运用玻尔兹曼加合来拟合ECD谱图,通过比对实验ECD谱与计算ECD谱(图2)发现,化合物构型为(7R,8S)⁃1与实验更吻合;同时对比碳谱实验值与计算值(表2),结果显示这2种构型相似度区别不大,但13C NMR谱结果不能作为有效证据;再利用矩阵模型[3,5,21]用于计算C8的绝对构型.在此类结构中,由于对旋光值正负号起决定作用的是C8,因此使用矩阵计算了C8的特征值.其结果是在其构型为S
时,其det(D)值(矩阵中行列式的特征值即旋光值)为+8.47.由于该化合物的实测旋光值为+25,因此,其C8的绝对构型应该为S构型,这与ECD的结论一致.结合OR,ECD与矩阵模型数据分析表明,化合物1的绝对构型为(7R,8S).化合物1的核磁共振谱、质谱图见图S1~S7(见本文支持信息),其计算ECD数据和实测ECD数据见表S2(见本文支持信息).

Table 11H NMR,13C NMR and HMBC datas of com pound 1
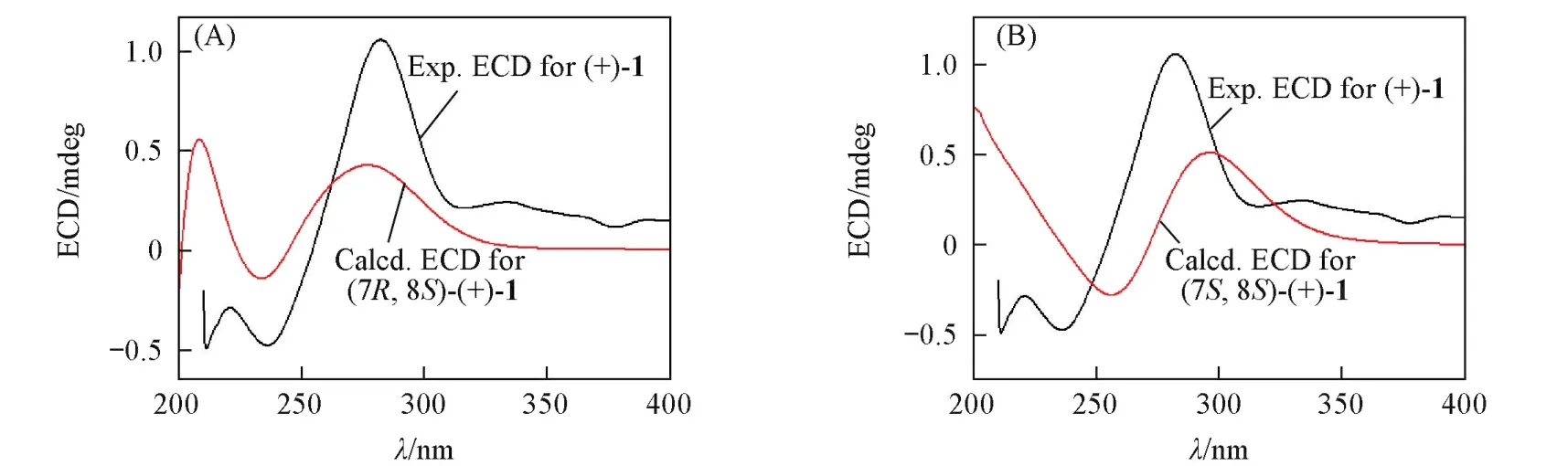
Fig.2 Com parison of predicted ECD with experimental ECD for(+)⁃1
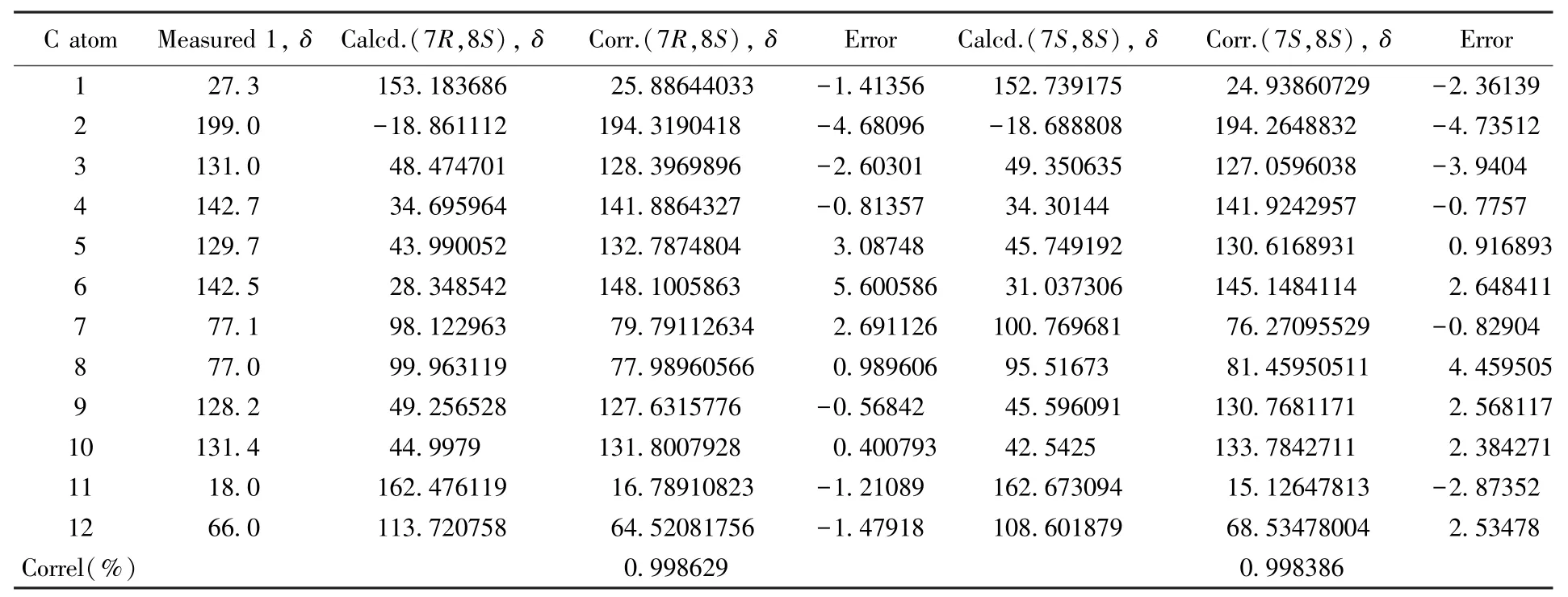
Table 2 Calculated13C NMR data for(7R,8S)⁃1 and(7S,8S)⁃1
2.2 肿瘤细胞毒活性
化合物1的抗肿瘤细胞毒活性检测结果如表3所示,可见,其未表现出明显的肿瘤生长抑制活性.

Table 3 Antitumor activities of com pound 1
2.3 抗菌活性
测定了化合物1分别对恶臭假单孢杆菌(P.putida)、巴西诺卡菌(N.brasiliensis)和嗜根库克菌(K.rhizophila)的活性.测试结果表明,化合物1对3株致病菌均有一定的抗菌活性,MIC值均为25 μmol/L,而阳性对照药环丙沙星对3株致病菌的MIC值分别为0.625,0.313和0.625μmol/L.
3 结 论
从木霉菌Trichoderma sp.中分离到1个新的长链不饱和醇类化合物,通过ECD,OR实验值与量子计算结果对比,最终确定Trichoderol A(1)的绝对构型为(7R,8S),说明量子化学计算在链状分子绝对构型上具有一定的应用价值.化合物1的生物活性测试结果表明,其对5种肿瘤细胞未表现出明显的肿瘤生长抑制活性(均为IC50>40μmol/L),对3株致病菌均有一定的抗菌活性(MIC=25μmol/L).
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160499.
[1] Sami S.,Mohamed B.,Tahar M.,Chem.Res.Chinese Universities,2015,31(5),693—698
[2] Berova N.,Polavarapu P.L.,Nakanish K.,Woody R.W.,Comprehensive Chiroptical Spectrascopy,John Wiley&Sons,Hoboken,2011,115—146
[3] Zhu H.J.,Organic Stereochemistry⁃experimental and ComputationalMethods,Wiley⁃VCH,Verlag GmbH&Co.KGaA,Weinheim,2015,1—312(朱华结.有机立体化学实验和方法计算,魏因海姆:威利出版社,2015,1—312)
[4] Wang H.,Wang J.,Wu X.,Shen H.Y.,Luo Y.,Dai H.F.,MeiW.L.,Chem.Res.Chinese Universities,2015,31(1),38—43
[5] Zhu H.J.,Modern Organic Stereochemistry,Science Press of China,Beijing,2009,1—315(朱华结.现代有机立体化学,北京:科学出版社,2009,1—315)
[6] Ding S.S.,Zhang C.C.,ShiW.S.,Liang M.M.,Yang Q.,Zhu H.J.,Li Y.,Tetrahedron Lett.,2016,57,75—79
[7] Zhu H.J.,LiW.X.,Hu D.B.,Wen M.L.,Tetrahedron,2014,70,8236—8243
[8] Yu H.,LiW.X.,Wang J.C.,Yang Q.,Wang H.J.,Zhang C.C.,Ding S.S.,Li Y.,Zhu H.J.,Tetrahedron,2015,71,3491—3494
[9] Gao T.,Cai S.Y.,Xu L.L.,Cao F.,Zhu H.J.,Chem.J.Chinese Universities,2016,37(7),1282—1286(高彤,蔡思源,许兰兰,曹飞,朱华结.高等学校化学学报,2016,37(7),1282—1286)
[10] Pierce C.G.,Uppuluri P.,Tristan A.R.,Wormley F.L.Jr.,Mowat E.,Ramage G.,Lopez⁃Ribot J.L.,Nat Protoc.,2008,3,1494—1500
[11] Zhang N.,Chen Y.,Jiang R.,Li E.,Chen X.,Xi Z.,Guo Y.,Liu X.,Zhou Y.,Che Y.,Jiang X.,Autophagy.,2011,7,598—612
[12] Andzelm J.,Wimmer E.,J.Chem.Phys.,1992,96,1280—1303
[13] Wodrich M.D.,Corminboeuf C.,Schreiner P.R.,Fokin A.A.,Schleyer P.V.R.,Org.Lett.,2007,9,1851—1854
[14] Becke A.D.,J.Chem.Phys.,1996,104,1040—1046
[15] Johnson B.G.,Fisch M.J.,J.Chem.Phys.,1994,100,7429—7442
[16] Stratmann R.E.,Burant J.C.,Scuseria G.E.,Frisch M.J.,J.Chem.Phys.,1997,106,10175—10183
[17] Johnson B.G.,Frisch M.J.,Chem.Phys.Lett.,1993,216,133—140
[18] Thomas A.H.,J.Comput.Chem.,1999,20,720—729
[19] Baker J.,J.Comput.Chem.,1993,14,1085—1100
[20] Zhu H.J.,Liu L.,Yang Q.,Chem.J.Chinese Universities,2015,36(8),1559—1562(朱华结,刘莉,杨芹.高等学校化学学报,2015,36(8),1559—1562)
[21] Zhu H.J.,Ren J.,Pittman C.U.,Tetrahedron,2007,63,2292—2314
Absolute Configuration Determ ination of One New Compound Trichoderol A from Trichoderma sp.Fungus†
XU Lanlan1,ZHAO Qiqi1,YU He1,2,WANG Jingchen1,WANG Huijun1,YANG Qin1,ZHU Huajie1∗,LIYan3
(1.Key Laboratory ofMedicinal Chemistry and Molecular Diagnosis,Ministry ofEducation,Key Laboratory of Pharmaceutical Quality Control ofHebei Province,College of Pharmaceutical Sciences,Hebei University,Baoding 071002,China;2.Machinery Industry Analytical Industry Quality Supervision and Testing Centre,Beijing 100095,China;3.State Key Laboratory of Phytochemistry and Plant Resources in West China,Kunming Institute ofBotany,Kunming 650204,China)
One new compound,trichoderol A(1),was isolated from cultures of the fungus Trichoderma sp. The structure of compound 1 was established bymeans of NMR and mass spectrometry.The absolute configura⁃tion(AC)was determined by means of comparing experimental electronic circular dichroism(ECD)and optical rotation(OR)of compound 1 with the calculated ECD and OR data of compound 1 using quantum methods,also usingmatrix model.Compound 1 was evaluated for antibacterial activities against three species of pathogenic bacteria,and the results showed that compound 1 had weak antibacterial activities(MIC=25μmol/L).
Trichoderma sp.;Electronic circular dichroism;Optical rotation;Matrix;Antibacterial activity
O629.9
A
10.7503/cjcu20160499
(Ed.:P,H,Y,K)
†Supported by the 2012 Giant Project of Hebei Province,China,the Science and Technology Support Project of Baoding,China(No. 15ZN020),the Scientific Research Foundation of Hebei Educational Committee,China(No.QN2016177)and the National Natural Science Foun⁃dation of China(No.41606174).
2016⁃07⁃13.
日期:2016⁃09⁃26.
2012河北省巨人计划、保定市科技支撑项目(批准号:15ZN020)、河北省教育厅资助科研项目(批准号:QN2016177)和国家自然科学基金(批准号:41606174)资助.
联系人简介:朱华结,男,博士,教授,博士导师,主要从事手性药物化学研究.E⁃mail:jackzhu2002@sina.com
