基于糖基化反应及自组装法制备大豆分离蛋白⁃可溶性大豆多糖核壳结构纳米凝胶
2016-11-23冯纪璐齐军茹刘倩茹
冯纪璐,齐军茹,刘倩茹
(华南理工大学食品科学与工程学院,淀粉与植物蛋白深加工教育部工程研究中心,广州510640)
基于糖基化反应及自组装法制备大豆分离蛋白⁃可溶性大豆多糖核壳结构纳米凝胶
冯纪璐,齐军茹,刘倩茹
(华南理工大学食品科学与工程学院,淀粉与植物蛋白深加工教育部工程研究中心,广州510640)
结合大分子拥挤环境下的糖基化反应与自组装两步法,制备了安全而新型的具有核壳结构的纳米凝胶.首先,通过水相体系中的Maillard反应使亲水性大豆多糖(SSPS)共价连接到大豆分离蛋白(SPI)上形成两亲性嵌段共聚物;然后,在疏水聚集及静电吸引作用力的驱动下诱导接枝共聚物自组装形成SPI⁃SSPS纳米凝胶.原子力显微镜与透射电子显微镜分析表明,SPI⁃SSPS纳米凝胶为分布均匀、具有核壳结构的球形粒子,以亲水性的SPI为壳,以交联的SSPS为核;利用圆二色光谱法与荧光光谱法表征了SPI⁃SSPS纳米凝胶的结构,结果表明,SPI⁃SSPS纳米凝胶中蛋白的三级结构发生改变,疏水基团暴露于蛋白表面使纳米凝胶内部形成疏水微区,有利于荷载疏水性药物;稳定性实验结果表明,所制备的SPI⁃SSPS纳米凝胶具有环境稳定性,在一定的pH值与生理离子强度范围内粒子基本不变,于4℃能稳定储藏120 d以上.因此,SPI⁃SSPS纳米凝胶在生物医药领域具有广阔的应用前景.
纳米凝胶;Maillard反应;自组装;疏水聚集;静电作用;大豆分离蛋白;可溶性大豆多糖
纳米凝胶具有优异的尺寸效应、较高的负载能力及稳定性,从而可实现药物的靶向输送[1].目前,制备纳米凝胶的材料主要为聚异丙基丙烯酰胺和聚丙烯酸等合成的高分子,但由于聚异丙基丙烯酰胺和聚丙烯酸具有一定的毒性与生物不相容性,限制了其在实际生产中的应用[2].蛋白质与多糖是两大类来源广泛的天然大分子,具有较好的生物相容性与降解性,有利于制备环境友好的纳米凝胶[3]. Yu等[4]利用蛋白与多糖在水溶液中的静电相互作用制备了壳聚糖⁃白蛋白纳米凝胶,此类纳米凝胶由于缺少表面修饰而具有pH敏感性,其二次聚集现象不利于纳米凝胶的负载与输送.研究发现,两亲性的嵌段共聚物能在水相中自组装形成核壳结构的稳定纳米粒子[5~7],因此利用共价键结合的蛋白多糖复合物自组装构建纳米粒子具有良好的前景.
基于Maillard反应(糖基化反应或羰氨反应)的蛋白质改性方法是一种安全有效的方法.通过自发的羰氨反应可使还原性多糖的羰基末端共价连接到蛋白的ε⁃或α⁃氨基上,从而形成两亲性接枝共聚物[8].Maillard反应通常分为干热法与湿热法.干热法形成的接枝共聚物具有接枝度高及功能特性优越等特点[9].
目前已有利用Maillard干热反应制备稳定纳米粒子的报道[10~13].Wu等[10]利用糖基化产物及其水解物通过反溶剂法制备大豆7S球蛋白⁃葡聚糖纳米粒子,但交联剂戊二醛⁃乙醇溶液具有一定的毒性. Yi等[11]通过均质⁃溶剂挥发法制备包埋有β⁃胡萝卜素的β⁃乳球蛋白⁃葡聚糖纳米粒子,此法不仅操作繁琐,而且容易残留有机溶剂(乙酸乙酯).Feng等[12]利用Maillard干热产物通过自组装法制备了具有高度稳定性的纳米凝胶,但由于干热法存在反应时间长及反应程度不可控等缺点,不利于工业化生产[14].为了解决这一问题,湿热法被用于糖基化产物的制备,研究发现,Maillard湿热反应能明显缩短
反应时间,从而将反应限制在初级阶段[15].但在传统的水相体系中,蛋白质在高温条件下发生变性和聚集,导致产物的接枝度较低,使Maillard反应始终不能有效地在水相中进行.为了突破瓶颈,“大分子拥挤环境”的概念被引入了湿热反应[14,16],利用大分子在高浓度环境下的反应遵循分子排斥容积理论及蛋白在拥挤体系中构型趋于稳定的理论指导[17,18],制备出变性及聚集程度较低而接枝程度较高的接枝共聚物.目前,基于大分子拥挤环境下Maillard反应制备纳米凝胶的研究尚未见报道.
本文利用Maillard湿热反应及自组装两步法构建纳米凝胶体系,即通过Maillard反应使可溶性大豆多糖(SSPS)共价接枝到大豆分离蛋白(SPI)上,形成两亲性共价接枝聚合物大豆分离蛋白⁃可溶性大豆多糖接枝聚合物(SSC),在疏水作用力及静电吸引力的驱动下诱导其自组装形成SPI⁃SSPS纳米凝胶.利用透射电子显微镜(TEM)及圆二色光谱(CD)法表征了SPI⁃SSPS纳米凝胶的形貌及结构.并对其环境稳定性进行了测定,以期在食品医药领域的实际应用中起到指导作用.
1 实验部分
1.1 试剂与仪器
低温脱脂豆粕,山东省高唐蓝山集团总公司;可溶性大豆多糖[SSPS,含粗蛋白6.3%(质量分数),粗脂肪0.7%,灰分7.4%及水分5.6%],福建味博食品有限公司;8⁃苯胺基⁃1⁃萘磺酸(ANS),美国Sigma⁃Aldrich公司;其它生化试剂均为国产分析纯.
Nano⁃ZS型激光动态粒度扫描(DLS)仪,英国Malvern公司;H⁃7650型透射电子显微镜(TEM),日本Hitachi公司;Multimode 8型扫描探针显微镜(SPM),美国Bruker公司;Himac CR 22G型高速冷冻离心机,日本Hitachi公司;Alpha⁃4型冷冻干燥机,德国Christ公司;F⁃7000型荧光分光光度计,日本Hitachi公司.
1.2 实验过程
1.2.1 SPI的制备 采用碱溶酸沉法[19]从低温脱脂豆粕中提取SPI.根据杜马斯燃烧法(N=5.71)测得SPI的蛋白质量分数为(85.40±0.32)%.
1.2.2 共价接枝聚合物SSC的制备 将质量比为1∶1的SPI与SSPS溶解于去离子水中,使其质量分数为20%,室温下搅拌4 h使其完全溶解并调节溶液pH至7.0,于4℃静置12 h使其充分水解;将溶液于60℃反应24 h,然后于4℃透析24 h,每隔4 h更换去离子水;透析后溶液于20℃离心(10000g,30 min),取上清液冷冻干燥,所得粉末即为SSC.
1.2.3 SPI⁃SSPS纳米凝胶的制备 将0.1 g SSC粉末溶于200 mL去离子水中,室温下磁力搅拌30 min,用0.1 mol/L HCl溶液调节pH值至3.8~5.8并平衡5 min,于90℃的水浴中孵育60 min,得到SPI⁃SSPS纳米凝胶.
2 结果与讨论
2.1 SSC的形成与表征
高分子量的SSPS不仅作为反应试剂在水相体系中与SPI发生共价接枝反应,而且作为拥挤试剂为糖基化反应提供一个拥挤的环境.
电泳图谱是鉴定Maillard型接枝共聚物形成的重要手段,分离胶顶部或浓缩胶界面多分散性条带的出现说明形成高分子量物质[20].图1(A)为蛋白染色图谱.条带1清晰地显现了SPI的5个特征谱带:大豆7S球蛋白的α′,α和β亚基谱带与大豆11S球蛋白的酸性(a)及碱性(b)亚基谱带.蛋白与多糖的混合物条带(条带2)与SPI条带无明显差异,说明单纯加入SSPS对电泳图谱没有影响.但接枝共聚物条带(条带3)中谱带显色明显变浅,表明SPI中所有的α′,α亚基与大部分的β,a和b亚基参与了糖基化反应.糖染色图谱用于表征糖基化产物的形成[21],如图1(B)所示,SPI与混合物条带均为空白条带,而条带3中高分子量区出现了明显的谱带,表明SPI与SSPS以共价键的形式结合,形成了高分子量的接枝共聚物.此外,在蛋白染色及糖染色图谱各条带样品蛋白含量相同的条件下,条带3在糖染色图谱的高分子量区显色较深,而在蛋白染色图谱中显色较浅,说明共价接枝于SPI上的SSPS比
例较高[22],即产物的接枝程度较高.

Fig.1 Electrophoresis profiles with protein staining (A)and carbohydrate staining(B)

Fig.2 Intrinsic fluorescence spectra of SPI(a),SPI/SSPSm ixture(b)and SSC(c)
褐变是Maillard反应的重要特征,褐变的发生伴随着有色物质的形成,而荧光物质被认为是有色物质的前体物[21],因此通过对比反应前后物质的荧光强度可进一步分析糖基化程度.内源荧光光谱如图2所示.与SPI和混合物相比,糖基化产物的最大发射波长(λmax)发生蓝移且荧光强度显著增强,与文献[16]报道结果一致,表明在大分子拥挤体系中SPI的糖基化程度较高,即糖基化反应产物的接枝度较高.
2.2 SPI⁃SSPS纳米凝胶的构建及表征
自组装法是构建单分散性纳米粒子绿色而有效的方法,在次级键作用力的驱动下,两亲性的嵌段共聚物在水溶液中通过自组装形成具有核壳结构的纳米粒子,疏水性嵌段自发形成内核,亲水性嵌段自发形成外壳[23].
研究发现,纳米粒子在等电点附近具有较高的荷载效率[24],因此探讨在SPI等电点(pH=4.5)附近不同pH值对SPI⁃SSPS纳米凝胶制备的影响,结果示于图3.可以看出,在pH值为3.8~5.8范围内均可制备出粒径分布较窄的平均表观流体力学直径(Dh)为125.5~150.6 nm的SPI⁃SSPS纳米凝胶,其中在pH=3.8时所制备的纳米凝胶多分散性指数(PDI)最小,即纳米粒子尺寸最为均一.蛋白质主要依靠排斥作用(主要为静电排斥)与吸引作用(主要为疏水聚集)两种非共价键作用力维持构象的稳定.当蛋白在等电点附近受热时所带电荷较少而使蛋白间静电排斥作用较小,在疏水作用的驱使下蛋白趋于聚集、交联并发生凝胶化,但共价接枝的SSPS发挥其空间位阻效应,阻止SPI的宏观聚集并形成粒径均一的纳米凝胶.此外,在pH=3.8时SPI带正电荷而SSPS带负电荷,两者间静电吸引作用促进了蛋白与多糖之间的自组装.
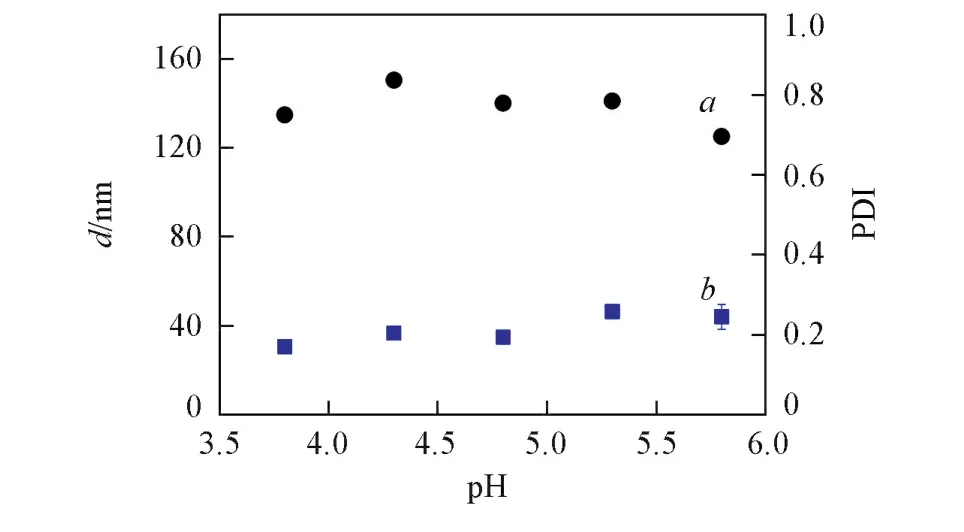
Fig.3 Effect of pH on size(a)and PDI values(b) of the fabrication of SPI⁃SSPS nanogels
利用DLS与AFM探讨纳米凝胶的形成过程(图4和图5).SPI呈球形状态,部分蛋白由于自身聚集而形成大的颗粒,其Dh为(95.57±0.68)nm.SSPS由于缺少表面活性剂对糖链的展开而大致呈椭圆形,其Dh为(197.4±2.4)nm,粒径分布不均匀(PDI=0.430).大分子拥挤环境下的糖基化反应使SSPS接枝到SPI上从而形成密集的聚集体,颗粒形状不规则,样品分布不均匀.而聚集体进一步在水相体系中自组装形成了分散性好、粒径均匀、球形完整的纳米粒子,其Dh为(143.1±1.4)nm,PDI为0.186,表明形成单分散性的SPI⁃SSPS纳米凝胶.经过SSPS改性的纳米凝胶的亲水性得到明显改善.同时高分子量多糖的立体位阻效应与粒子间多糖的静电排斥作用可有效地保持SPI⁃SSPS纳米凝胶的分散稳定性,即SSPS在SPI⁃SSPS纳米凝胶体系中起界面稳定剂的作用.
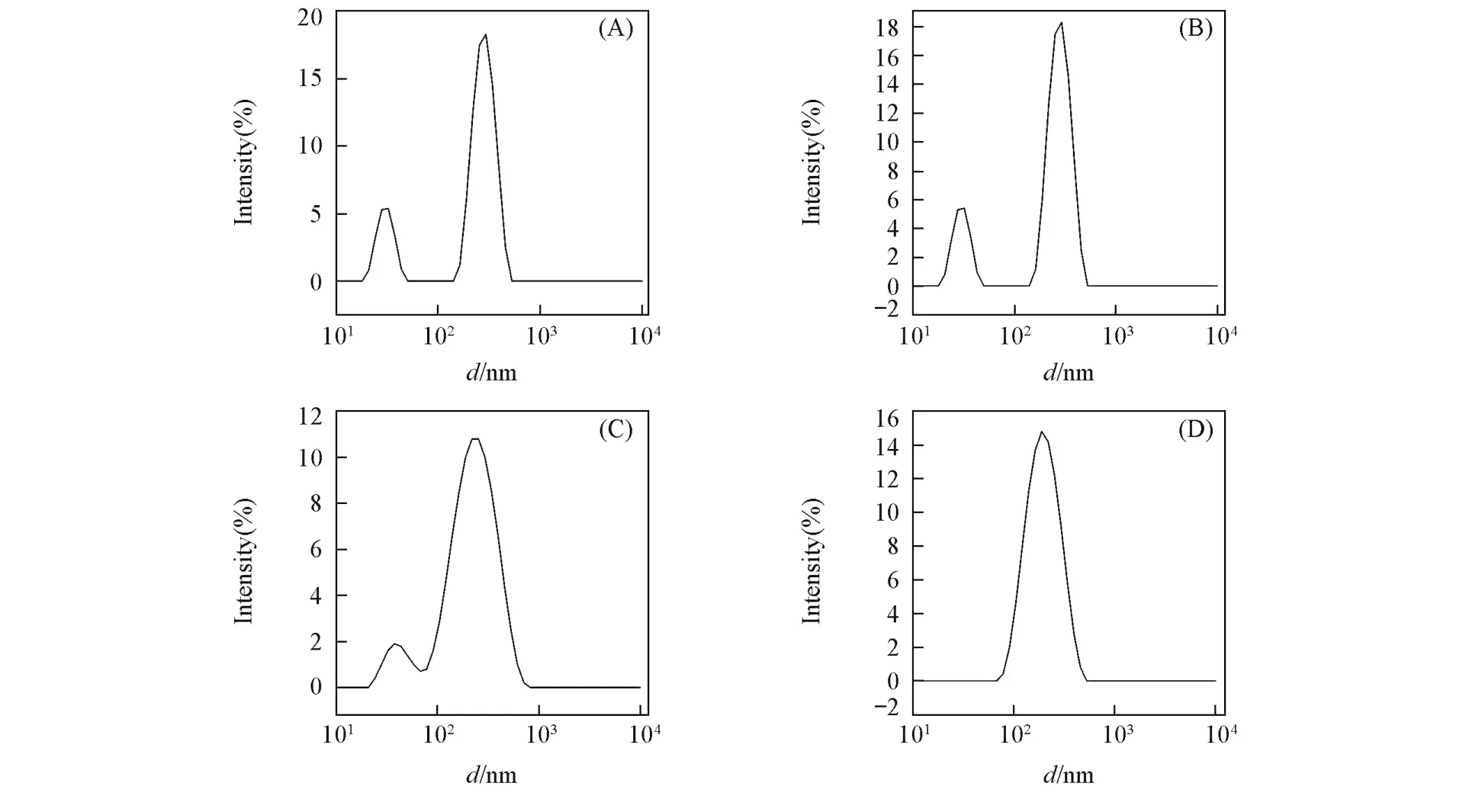
Fig.4 DLS resu lts of SPI(A),SSPS(B),SSC(C)and SPI⁃SSPS nanogels(D)

Fig.5 AFM images of SPI(A),SSPS(B),SSC(C)and SPI⁃SSPS nanogels(D)
2.3 纳米凝胶的结构
图6给出纳米凝胶的TEM照片.由图6可见,纳米凝胶具有核壳结构,显色较深的为亲水性的SSPS外壳,而显色较浅的是疏水性SPI内核.推测由于外壳多糖的结构较为疏松而内核蛋白的结构较为紧密,采用磷钨酸染色时难以进入内核复染,因此TEM照片中纳米凝胶外壳呈现黑色而内核呈现灰白色.此外,从图6中观察到纳米凝胶的粒径约为45 nm,而DLS测得该纳米凝胶的Dh为(143.6± 0.7)nm,这是由于TEM制样过程中样品干燥而使
粒子内部水分挥发从而导致粒子体积收缩,即所制备的纳米凝胶具有较高的溶胀比.
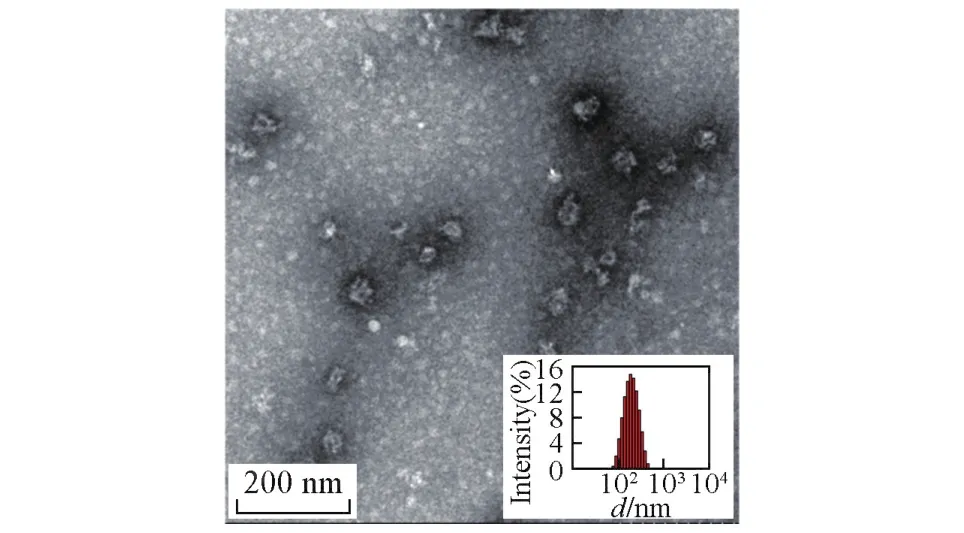
Fig.6 TEM image of SPI⁃SSPS nanogels
图7给出SPI、SPI/SSPS混合物、SSC与SPI⁃SSPS纳米凝胶的CD光谱.蛋白在近紫外区的圆二色性可以反映其侧链基团苯丙氨酸(260~270 nm)、酪氨酸(275~282 nm)、色氨酸(290~305 nm)微环境的变化,进而分析蛋白质三级结构的精细变化.由图7可见,SPI/SSPS混合物的CD光谱与SPI没有明显区别,表明单纯加入SSPS不会对蛋白三级结构造成影响.但SSC与SPI⁃SSPS纳米凝胶的CD光谱在苯丙氨酸及酪氨酸(260~282 nm)信号范围内均出现较大的波动且CD光谱信号增强,这是因为蛋白肽链受热振荡导致其次价键遭受破坏,从而发生一定程度的伸展,埋藏于分子内部的苯丙氨酸及酪氨酸暴露于肽链表面,使蛋白质的三级结构发生明显改变.通过测定蛋白的表面疏水性可进一步分析疏水基团的暴露情况.混合物的表面疏水性与SPI相比没有本质差异(p<0.05),表明游离的多糖对蛋白的表面疏水性没有影响.SPI在大分子环境下接枝到SSPS上后表面疏水性显著降低,一方面由于蛋白质肽链的伸展打破了蛋白质自身的亲⁃疏水平衡,分子内部的疏水基团暴露,另一方面由于接枝了亲水性强的多糖使蛋白肽链的亲水基团数目增加,且高分子量的多糖对蛋白的疏水基团具有一定的屏蔽作用,使接枝共聚物的表面疏水性下降,进一步证明SPI的亲水性能得到较大的改善.与接枝共聚物相比,SPI⁃SSPS纳米凝胶的表面疏水性显著增加,推测在进一步加热自组装的过程中,SPI的肽链由于发生剧烈的热振荡使其次价键受破坏,即导致疏水键进一步暴露于蛋白表面,从而导致蛋白表面疏水性增强.结合TEM分析结果可知,疏水聚集作用是自组装的主要驱动力,SPI表现出较强的疏水性而蜷缩在内核,其疏水侧链的进一步打开使纳米凝胶内部形成疏水微区.
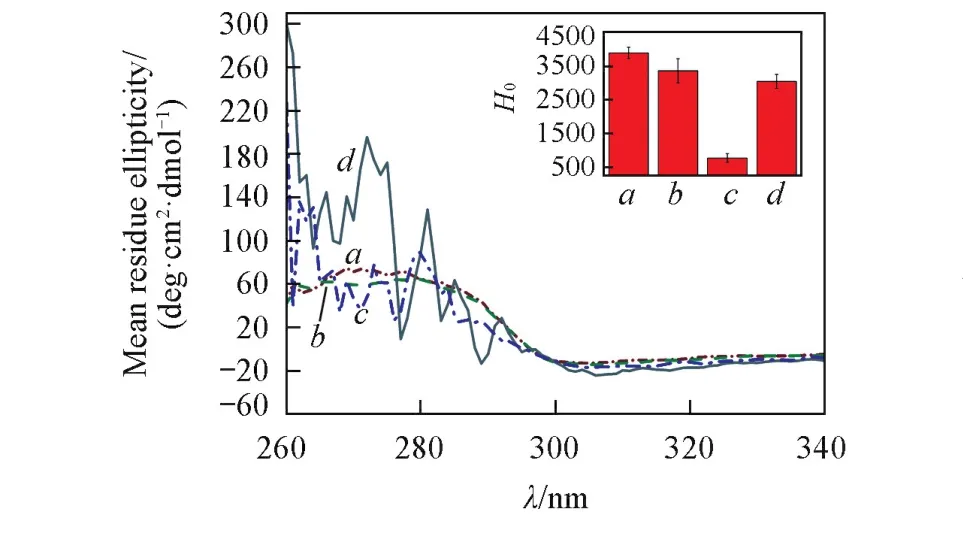
Fig.7 Near⁃ultraviolet CD spectra of SPI(a),SPI/SSPSm ixture(b),SSC(c)and SPI⁃SSPS nanogol(d)
2.4 SPI⁃SSPS纳米凝胶的稳定性
由聚电解质通过静电相互作用自组装形成的纳米凝胶由于缺少表面修饰而具有pH依赖性[4],从而限制了其在较宽pH值范围内的应用.本文制备的SPI⁃SSPS纳米凝胶的表面由于经过亲水修饰,在pH=2~10范围内均未出现二次聚集现象,而且其粒径能维持在一定范围内(图8),具有较强的pH稳定性.此种独特的pH稳定性得益于纳米凝胶核内交联的SPI与外层SSPS的空间位阻效应及静电排斥作用.一方面,在SPI等电点附近,SPI⁃SSPS纳米凝胶粒子间的SPI由于缺乏静电排斥而趋于相互聚集,但外壳带负电荷的SSPS屏蔽了核内的蛋白并发挥其立体效应从而阻止纳米粒子的聚集;另一方面,远离等电点时,纳米凝胶核内的SPI带有相同的电荷而倾向于解离,但蛋白分子间交联的网络结构使其保持稳定状态.

Fig.8 Dh(a)and PDI values(b)of SPI⁃SSPS nanogels at pH=2—10
纳米凝胶仅具备pH稳定性并不能满足其在人体内应用的基本要求,因此进一步研究SPI⁃SSPS纳米凝胶在生理离子强度下的稳定性.研究发现,SPI⁃SSPS纳米凝胶在0~200 mmol/L NaCl溶液中的粒径没有明显的变化(图9),具有较高的NaCl稳定性.此外,由于SPI⁃SSPS纳米粒子表面为带负电荷的多糖,NaCl溶液的加入使带正电荷的钠离子吸附于SPI⁃SSPS纳米凝胶的表面,从而中和其表面电荷以屏蔽粒子间的静电相互作用.由于粒子间缺少静电排斥作用会趋于聚集,但所制备的SPI⁃SSPS纳米凝胶溶液能保持稳定,表明静电相互作用并不是维持纳米凝胶稳定的唯一因素.
SPI⁃SSPS纳米凝胶在4℃下储藏120 d时的粒径分布基本不变(图10),表明SPI⁃SSPS纳米凝胶
处于热力学平衡状态,具备长期储存的稳定性,对其实际应用具有较高的价值.
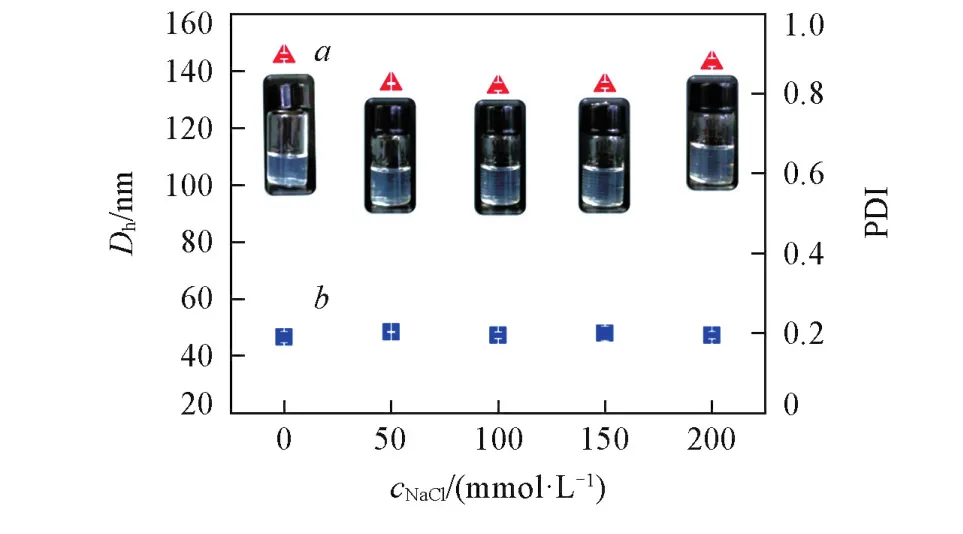
Fig.9 Dh(a)and PDI values(b) of SPI⁃SSPS nanogels with different NaCl concentrations
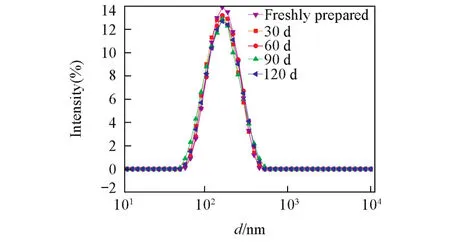
Fig.10 Size distribution of nanogels that stored for various times
3 结 论
采用Maillard反应及自组装两步法构建大豆分离蛋白⁃可溶性大豆多糖纳米凝胶.以大分子拥挤环境作为反应介质,通过可溶性大豆多糖与大豆分离蛋白在水相体系中的Maillard反应制备两亲性接枝共聚物;在SPI等电点附近对共聚物进一步热处理使其在疏水聚集作用及静电吸引作用的诱导下自组装形成具有核壳结构的纳米凝胶,熵的驱动使疏水性较强的SPI自发聚集成内核,亲水性较强的SSPS自发包覆在外层.形貌学分析结果显示,纳米凝胶为分布均匀的具有明显核壳结构的球形粒子,圆二色谱及表面疏水性测试结果表明,纳米凝胶中蛋白的空间构象发生了转变,疏水侧链的暴露导致内核疏水微区的生成,进而有利于通过疏水相互作用对疏水性药物进行包埋与运载.所制备的纳米凝胶在较宽的pH值范围及一定的离子强度下均不发生解离或聚集,并且其粒径能维持在一定范围内;在4℃下储藏120 d粒径分布基本不变,具有较高的储藏稳定性.纳米凝胶的核壳结构与高度稳定性使其在生物医药领域具有广阔的应用前景.
[1] Nuruzzaman M.,Rahman M.M.,Liu Y.,Naidu R.,J.Agric.Food Chem.,2016,64(7),1447—1483
[2] Li Z.Z.,Zhou S.Y.,Dou H.J.,Sun K.,Chem.J.Chinese Universities,2014,35(7),1608—1614(李祯珍,周淑彦,窦红静,孙康.高等学校化学学报,2014,35(7),1608—1614)
[3] Shen J.M.,Xu L.,Lu Y.,Cao H.M.,Xu Z.G.,Chen T.,Zhang H.X.,Int.J.Pharmaceut.,2012,427(2),400—409
[4] Yu S.,Hu J.,Pan X.,Yao P.,Jiang M.,Langmuir,2006,22(6),2754—2759
[5] Ho K.M.,LiW.Y.,Lee C.H.,Yam C.H.,Gilbert R.G.,Li P.,Polymer,2010,51(15),3512—3519
[6] Torchilin V.P.,J.Control Release,2001,73(2),137—172
[7] Wang D.,Wang X.,Prog.Polym.Sci.,2013,38(2),271—301
[8] Kato A.,Minaki K.,Kobayashi K.,J.Agric.Food Chem.,1993,41(4),540—543
[9] Shepherd R.,Robertson A.,Ofman D.,Food Hydrocolloids,2000,14(4),281—286
[10] Wu N.N.,Zhang J.B.,Bin T.,He X.T.,Yang J.,Guo J.,Yang X.Q.,J.Agric.Food Chem.,2014,62(52),12678—12685
[11] Yi J.,Lam T.I.,Yokoyama W.,Cheng L.W.,Zhong F.,J.Agric.Food Chem.,2014,62(35),8900—8907
[12] Feng J.L.,Qi J.R.,Yin S.W.,Wang J.M.,Guo J.,Weng J.Y.,Liu Q.R.,Yang X.Q.,J.Agric.Food Chem.,2015,63(26),6075—6083
[13] Li J.,Yu S.,Yao P.,Jiang M.,Langmuir,2008,24(7),3486—3492
[14] Zhu D.,Damodaran S.,Lucey J.A.,J.Agric.Food Chem.,2008,56(16),7113—7118
[15] Wittayachai L.,Soottawat B.,Munehiko T.,Food Chem.,2007,100(2),669—677
[16] Zhuo X.Y.,Qi J.R.,Yin S.W.,Yang X.Q.,Zhu J.H.,Huang L.Y.,J.Sci.Food Agric.,2013,93(2),316—323
[17] Zimmerman S.B.,Minton A.P.,Annu.Rev.Biophys.Biomol.Struct.,1993,22(1),27—65
[18] Ellis R.J.,Trends Biochem.Sci.,2001,26(10),597—604
[19] Iwabuchi S.,Yamauchi F.,J.Agric Food Chem.,1987,35(2),200—205
[20] Kato A.,Mifuru R.,Matsudomi N.,Kobayashi K.,Biosci.Biotechnol.Biochem.,1992,56(4),567—571
[21] Zhou H.,Sun X.,Zhang L.,Zhang P.,Li J.,Liu Y.N.,Langmuir,2012,28(41),14553—14561
[22] Weng J.Y.,Qi J.R.,Yin S.W.,Wang J.M.,Guo J.,Feng J.L.,Liu Q.R.,Zhu J.H.,Yang X.Q.,Food Chem.,2016,196(4),1264—1271
[23] Riess G.,Prog.Polym.Sci.,2003,28(7),1107—1117
[24] Joye I.J.,McClements D.J.,Curr.Opin.Colloid In.,2014,19(5),417—427
Fabrication of Soy Protein Isolate⁃soluble Soy Polysaccharide Core⁃shell Nanogels via Maillard Reaction and Self⁃assembly†
FENG Jilu,QIJunru∗,LIU Qianru
(Engineering Research Center ofStarch and Vegetable Protein Processing,Ministry ofEducation,School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
A“two⁃step”method,which involved Maillard reaction in macromolecular crowding environment and self⁃assembly approach,has been adopted to fabricate the novel and safe core⁃shell nanogels.First,am⁃phiphilic graft copolymers were synthesized by soluble soy polysaccharide(SSPS)covalently attaching to soy protein isolate(SPI)via Maillard wet⁃heating reaction.Second,the resultant conjugates(SSC)were induced by both hydrophobic and electrostatic interaction to self⁃assemble soy protein isolate⁃soluble soy polysaccharide (SPI⁃SSPS)nanogels.Microscopic technology indicated that the SPI⁃SSPS nanogels were well⁃separated and spherical in shape with obvious core⁃shell structures:the hydrophilic soy polysaccharide constituted the shell and the cross⁃linked soy protein constituted the core.Spectroscopy investigation revealed that the tertiary structure of protein in nanogels was changed and the non⁃polar groups were exposed to the surface of soy protein to develop the hydrophobic compartments in the core of SPI⁃SSPS nanogels,which might offer a promising potential for drugs encapsulating via hydrophobic attraction.The SPI⁃SSPS nanogels exhibited remarkable stability against pH and NaCl concentration change,and they were pretty stable against 120 d storage at4℃.All of these valuable properties provide a great potential for practical application in the field of biomedicine.
Nanogel;Maillard reaction;Self⁃assembly;Hydrophobic attraction;Electrostatic interaction;Soy protein isolate;Soluble soy polysaccharide
O629.7;O629.12
A
10.7503/cjcu20160364
(Ed.:W,Z)
†Supported by the National Natural Science Foundation of China(No.31370036)and the Fundamental Research Funds for the Central Univer⁃sities,China(No.2015Z2119).
2016⁃05⁃20.
日期:2016⁃10⁃09.
国家自然科学基金(批准号:31370036)和中央高校基本科研业务费专项资金(批准号:2015Z2119)资助.
联系人简介:齐军茹,女,博士,教授,主要从事蛋白物性修饰及功能性多糖研究.E⁃mail:jrqi@scut.edu.cn
