复发难治B系淋巴瘤CAR-T治疗后细胞因子变化
2016-11-21蒋卉男王洪涛李迎春刘卓刚
蒋卉男,王洪涛,李迎春,张 欢,刘卓刚
复发难治B系淋巴瘤CAR-T治疗后细胞因子变化
蒋卉男,王洪涛,李迎春,张 欢,刘卓刚*
目的 分析于我中心行CAR-T治疗患者治疗前后细胞因子变化,评估相关细胞因子在免疫治疗中的作用及相关机制。方法 分别在复发难治B系淋巴瘤患者CAR-T细胞回输前及回输后4、7、14 d采集外周血,利用流式细胞术监测患者相关细胞因子(Th1、Th17、Foxp3、TNF-α、TGF-β、IL-10、IFN-γ、T抑制细胞、NK细胞及CRP)水平,分析变化趋势。结果 4次CAR-T细胞回输数目分别为:8×107、10×107、9.6×107、10×107。CAR-T细胞回输前及回输后4、7、14 d,Th1、Th17及CRP变化趋势与临床疗效相关,NK细胞、CD8+细胞未见明显相关性,而Tregs细胞作用尚未明确。结论 应用CAR-T细胞回输后,Th1、Th17相关效应性T细胞细胞因子上升趋势与临床疗效密切相关,NK细胞、CD8+T细胞未见明显相关性,而Tregs细胞作用尚未明确。关于CAR-T治疗前后序贯治疗、移植与CAR-T治疗的关系,是否可以应用细胞因子制剂促进CAR-T细胞的扩增与效应,仍有待进行相关大样本临床研究。
复发难治B系淋巴瘤;CAR-T;细胞因子
0 引言
嵌合抗原受体转导的T细胞(Chimeric antigen receptor T cells,CAR-T)是一类能够同时具有抗体特异性靶向识别的特点以及T细胞强大的效应机制的基因工程细胞。鉴于CAR-T不依赖MHC限制性、无需抗原呈递、双信号系统激活、共刺激作用等特点,避开传统肿瘤耐受机制,可用于化疗耐药、酪氨酸激酶抑制剂耐药以及造血干细胞移植后复发、供者细胞输注无效的病例。CAR 由胞外特异性肿瘤抗原识别区、铰链、跨膜区及胞内信号传导域4个部分组成。其中,胞外特异性肿瘤抗原识别区结合了针对肿瘤细胞抗原特异性抗体的抗原识别区的重链及轻链,能够直接识别肿瘤相关抗原,进而通过胞内信号域传导信号、活化效应T细胞产生特异性抗肿瘤效应。CAR通过基因工程的方法表达于T细胞表面,通过体外扩增后过继输注给患者体内的疗法称为CAR-T疗法。活化后的CAR-T细胞能够分泌多种细胞因子对抗肿瘤微环境中的免疫抑制,从而提高T细胞的抗肿瘤效应。CAR-T作为新兴免疫治疗方法从开展以来就受到了国内外的广泛关注,其疗效评估更是广大研究者的讨论热点。我中心拟评估复发难治B系淋巴瘤患者CAR-T治疗后相关细胞因子表达对肿瘤细胞的影响,同时研究其作用机制,进而指导临床治疗。
1 研究对象
患者,男,41岁,于2013年10月发现双侧颈部肿大,伴盗汗、纳差,行骨髓穿刺术及左侧颈部淋巴结活检术,确诊慢性淋巴细胞白血病转化为非霍奇金淋巴瘤(弥漫大B细胞型,非生发中心型)Ritcher综合征Ⅳ期B组IPI4分。行PET-CT示病灶侵及双侧颈部、双侧颌下、双侧锁骨上淋巴结、双侧腋窝淋巴结,鼻咽、右侧咽旁间隙、纵隔、双肺门淋巴结、胰腺后方、腹主动脉淋巴结、双侧盆壁、双侧腹股沟淋巴结,SUV介于2.4~6.3,并有骨髓浸润,SUVmax=4.5。行R-CHOP方案化疗5个周期(第1次应用美罗华后包块明显减小),第3周期化疗前复查骨髓象有核细胞形态未见明显异常,疗效判定为PR。后行HyperCVAD-MA方案2个周期,出现Ⅳ度骨髓抑制;R-GEMOX方案2个周期,GEMOX方案1个周期。之后于2014年10月腋下新发包块提示疾病复发,行美罗华联合化疗2个周期,无好转,再次行PET-CT检查,提示:右腋窝多枚肿大淋巴结,FDG代谢水平异常升高,较大者3.0 cm×1.7 cm,SUVmax=5.6;双肺下叶FDG高代谢灶,SUVmax=4.6,考虑淋巴瘤浸润;左侧髂骨及骶骨近左侧骶髂关节处局部骨质呈FDG异常高代谢,SUVmax=5.8;部分小肠、乙状结肠及直肠肠壁略厚,肠壁及肠腔内FDG代谢水平较高,SUVmax=8.7。
2015年3月患者为行CAR-T细胞治疗前往我中心诊治。患者入院时右侧腋下触及肿大淋巴结,质硬,无触痛,大小约17 cm,无活动性,其余查体无明显异常,周身疼痛明显。该患者分别于2015年3月10日、3月13日、5月12日、5月19日于我中心输注CD19标靶的CAR-T细胞,回输前3 d予FC方案预处理。具体用药:氟达拉滨30 mg/m2(3d),环磷酰胺150 mg/m2(d2~d3),回输细胞量分别为:8×107、10×107、9.6×107、10×107。患者于第1次回输后第4天即发现腋下包块明显减小,回输后第8天出现高热,体温超过39 ℃,予退热栓退热,伴腹泻2 d及咽喉部不适,对症处理后上述症状好转。第3次回输后第8天出现发热,最高38 ℃,伴咽喉部不适,发热1 d后症状好转。4次细胞回输后患者于2015年6月8日再次行PET-CT提示,原腋窝FDG高代谢淋巴结本次扫面明显减小,SUVmax=1.2;原双肺下叶近胸膜下类圆形FDG高代谢灶,本次扫描消失;原髂骨、骶骨及骶髂关节处FDG高代谢灶,本次扫描明显减低,SUVmax=3.1。行骨髓穿刺术提示,未见淋巴瘤细胞,评估患者疗效达到PR。之后患者于2015年8月在我院行自体造血干细胞移植,现患者状态平稳,病情控制稳定,生活质量良好。
2 方法
本中心分别于患者CAR-T细胞回输前及回输后4、7、14 d采集外周血,利用流式细胞术监测患者相关细胞因子水平。
3 结果
患者4次CAR-T细胞输注数量见表1,流式细胞术监测细胞因子水平变化见表2。

表1 患者4次输注CAR-T细胞数量
由表2可见,Th1、Th17相关效应性T细胞细胞因子及CRP变化趋势与临床疗效相关,NK细胞、CD8+细胞未见明显相关性,而Tregs细胞作用尚未明确。
4 讨论
肿瘤相关的免疫治疗在近几年的肿瘤治疗中取得了突飞猛进的进展。肿瘤微环境的免疫平衡理论受到关注,免疫增强因子的减少与免疫抑制因子的增多成为肿瘤发生发展的重要因素,并由此产生了靶向治疗肿瘤的新方法。
近年来,CAR-T在免疫治疗中的作用得到学者的关注。CAR-T治疗后GM-CSF的表达[1],联合IFN-r、IL-6、CRP,肿瘤大小,已被证实为评估CAR-T疗效的重要依据。我中心通过1例治疗成功CAR-T患者案例得出初步结论,应用CAR-T细胞回输后,Th1、Th17相关效应性T细胞细胞因子上升趋势与临床疗效密切相关,NK细胞、CD8+T细胞未见明显相关性,而Tregs细胞作用尚未明确。
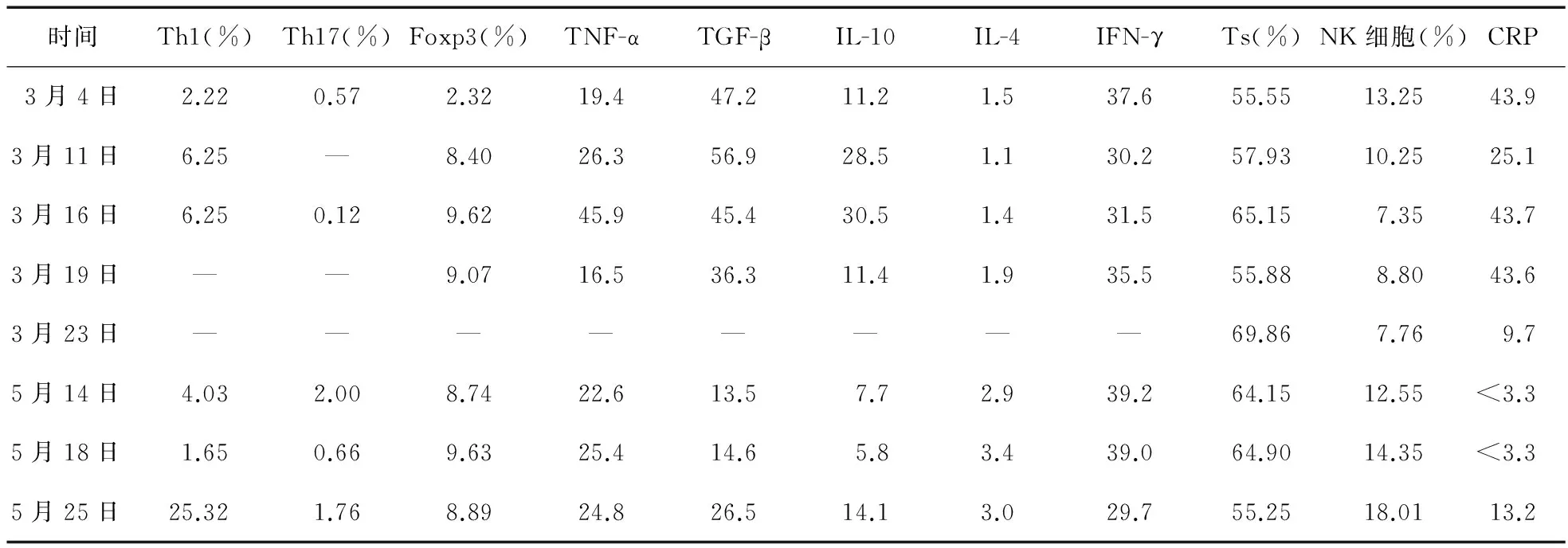
表2 CAR-T输注前后细胞因子监测
注:—由于外周血中细胞含量少,通过流式细胞术检测未获得
研究显示,T细胞通过不同的分化途径生成不同T细胞,产生特殊性能。CD4+T细胞亚群中[2],Thl主要分泌IL-2、IFN-γ和 TNF等,Th2主要分泌IL-4、IL-5、 IL-10、IL-13等。正常稳态下,机体 Th1/Th2 处于平衡状态,若平衡失调则称为Th1/Th2漂移。在血液系统恶性肿瘤中,免疫格局多偏向 Th2,削弱Th1,有助于肿瘤细胞的免疫逃逸[3]。若能通过免疫治疗逆转这种漂移状态,则可以对肿瘤细胞起到强有力的杀伤作用[4-5]。本研究中,针对复发难治B系肿瘤患者,T细胞无法正常启动、维持对肿瘤细胞及其他抗原的免疫应答。因此,将经过基因工程处理的CAR-T细胞回输至患者体内,成功启动免疫反应,可以克服体内原有T细胞的功能缺陷,从而起到肿瘤杀伤作用。
CAR-T疗法在产生肿瘤细胞杀伤作用的同时,也会因为细胞因子的过度释放导致细胞因子风暴的发生。此时,患者可能会发生高热、呼吸困难、急性呼吸窘迫综合征、严重心律失常,甚至多器官功能衰竭。已有研究表明,CD19CAR-T可以产生剂量相关性急性细胞毒性作用,而且高水平分泌Th2可以诱导肉芽肿反应,从而产生慢性的细胞毒效应[6]。目前,已有研究发现,细胞因子风暴多与IL-6及IFN-γ等细胞因子的高循环水平相关。症状多于开始输注细胞的数分钟至数小时出现,症状出现的机会及严重程度与前期诱导药物、机体免疫细胞活化程度及肿瘤负荷密切相关。在患者出现上述症状时,及时地判断及处理尤为关键。主要的处理措施包括:①对症治疗:控制体温在39 ℃以下,对于出现循环衰竭患者,注意循环支持及肾功能保护;②拮抗剂使用:出现低氧血症的患者,可以给予TNFα拮抗剂及IL-6拮抗剂,用药时注意低剂量起始,密切观察药物的后续免疫抑制作用;③处理肿瘤溶解综合征:注意监测患者血象、尿酸、肾功能及相关系统征象,水化、碱化治疗。此外,同时,目前已有小分子制剂作为CAR-T细胞的自杀制剂应用于临床,对于危及生命的细胞因子风暴反应或者长期B细胞功能缺陷的患者,可以应用该制剂撤除体内CAR-T,终止CAR-T免疫反应。
在CAR-T产生的免疫反应中,Tregs是具有免疫调节功能的T细胞,能够在免疫应答负调节以及自身免疫耐受中发挥重要作用。近年研究发现[5],肿瘤发生免疫逃逸的重要机制之一是Tregs对抗肿瘤免疫应答的抑制作用。因此,降低肿瘤患者体内Tregs的表达或降低其活性可能提高免疫治疗的疗效。且已有研究表明,在弥漫大B细胞淋巴瘤患者中,高水平的Tregs细胞与CD4/CD8比值较低、不成熟树突状细胞增多正相关,预示不良预后[7];另有研究证实,在慢性淋巴细胞白血病、急性髓细胞白血病患者中,Tregs可以作为量化预后的指标[8],代表Tregs的CD4、CD25、CD127在常规实验室即可化验,其高低与患者预后、化疗达到CR的时间成正比。目前,已有研究者重点研究利用Tregs细胞提供的微环境,在继免疫治疗自身免疫疾病和异基因造血干细胞移植后出现的排斥反应。同时,在肿瘤治疗方面,已经出现可以改变Tregs介导的局部免疫抑制微环境的方法,如抑制可以促进Tregs分化的吲哚胺2,3-双加氧酶1(IDO),从而逆转Tregs在肿瘤患者细胞中的增殖。
NK细胞是机体固有免疫反应中重要的效应细胞,与抗肿瘤、抗病毒感染和免疫调节密切相关。NK细胞具有无需抗原致敏直接杀伤肿瘤细胞的作用[9]。其中,NKG2D是NK细胞产生杀伤作用的关键的活化型受体,其能够识别肿瘤细胞过表达的NKG2D配体。Parkhurst等[10]研究发现,肿瘤患者自身的NK细胞具有和健康人相似的增殖性,但是这些细胞仅低水平表达NKG2D,并且需要外源IL-2二次活化,对肿瘤转归无明显作用。Bachanova等[11]前期研究也证实了自体NK细胞对于肿瘤患者并无临床疗效。目前并没有相关研究证实NK细胞与CAR-T作用前后的变化及相关意义。
肿瘤免疫治疗虽然在近年来成为研究的热点,但仍存在许多亟待解决的问题。免疫治疗疗效的评估及相关辅助用药、治疗机制仍尚不明确。本中心目前接受CAR-T治疗的患者例数仍有限,尚不足以形成细胞因子评估预后量化标准,有待结合多中心治疗结果系统评价。关于CAR-T治疗的前后序贯治疗、移植与CAR-T治疗的关系、是否可以应用细胞因子制剂促进CAR-T细胞的扩增与效应仍有待进行相关大样本临床试验,从而得出统计学数据,指导临床治疗方案的确定。
志谢:感谢北京美康优娃生物科技有限公司为我中心提供CAR-T细胞制备的技术支持。
[1] Lorentzen CL,Straten PT.CD19-chimeric antigen receptor T cells for treatment of chronic lymphocytic leukaemia and acute lymphoblastic leukaemia[J].Scand J Immunol,2015,82(4):307-319.
[2] Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[3] Feng P,Yan R,Dai X,et al.The alteration and clinical significance of Th1/Th2/Th17/Treg cells in patients with multiple myeloma[J].Inflammation,2015,38(2):705-09.
[4] Guo JR,Xu F,Jin XJ,et al.Impact of allogenic and autologous transfusion on immune function in patients with tumors[J].Asian Pac J Cancer Prev,2014,15(1):467-474.
[5] Jensen SM,Twitty CG,Maston LD,et al.Increased frequency of suppressive regulatory T cells and T cell-mediated antigen loss results in murine melanoma recurrence[J].J Immunol,2012,189(2):767-776
[6] Cheadle EJ,Sheard V,Rothwell DG,et al.Differential role of Th1 and Th2 cytokines in autotoxicity driven by CD19-specific second-generation chimeric antigen receptor T cells in a mouse model[J].J Immunol,2014,192(8):3654-3665.
[7] Chang C,Wu SY,Kang YW,et al.High levels of regulatory T cells in blood are a poor prognostic factor in patients with diffuse large B-cell lymphoma[J].Am J Clin Pathol,2015,144(6):935-944.
[8] Dasgupta A,Mahapatra M,Saxena R.A study for proposal of use of regulatory T cells as a prognostic marker and establishing an optimal threshold level for their expression in chronic lymphocytic leukemia[J].Leuk Lymphoma,2015,56(6):1831-1838.
[9] Cai LL,Yang Y,Yang B,et al.Short-term curative efficacy of autologous cytokine induced killer cells combined with low-dose il-2 regimen containing immune enhancement by thymic peptide in elderly patients with B-cell chronic lymphocytic leukemia[J].J Exp Hematol,2012,20(3):564-570.
[10]Parkhurst MR,Riley JP,Dudley ME,et al.Adoptive transfer of autologous natural killer cells leads to high levels of circulating natural killer cells but does not mediate tumor regression[J].Clin Cancer Res,2011,17(19):6287-6297.
[11]Bachanova V,Miller JS.NK cells in therapy of cancer[J].Crit Rev Oncol,2014,19(1-2):133-141.
Changes in cytokines after CAR-T treatment for relapsed and refractory B-cell lymphoma
JIANG Hui-nan,WANG Hong-tao,LI Ying-chun,ZHANG Huan,LIU Zhuo-gang*
(Department of Hematology,Shengjing Hospital of China Medical University,Shenyang 110020,China)
Objective To investigate the effect and mechanism of the changes in cytokines after CAR-T treatment for relapsed and refractory B-cell lymphoma.Methods The blood of patients with refractory and relapsed B-cell lymphoma was collected before and at 4,7,14 d after CAR-T.The changes in cytokines were detected by flow cytometry.Results The number of the CAR-T cells was 8×107,10×107,9.6×107and 10×107,respectively.The changes in Th1,Th17 and CRP were related to the clinical efficacy,while no relationship was found between NK cells and CD8+cells,and the effect of Tregs was still not clear.Conclusion The upward of levels of Th1,Th17 and CRP is related to the clinical efficacy,while NK cells and CD8+cells has no relationship with it,and the relationship of Tregs with clinical efficacy is still not clear.Clinical trials with large sample size should be performed to clarify the relationship of sequential therapy before and after CAR-T and transplantation with CAR-T,and whether cytokines can promote the amplification efficiency.
Refractory and replased B-cell lymphoma;CAR-T;Cytokines
2016-01-20
中国医科大学附属盛京医院血液科,沈阳 110020
*通信作者
10.14053/j.cnki.ppcr.201610017
