活性污泥法降解三溴苯酚
2016-11-21孙贤波刘勇弟邬莎娜
顾 雍, 孙贤波, 刘勇弟, 邬莎娜, 陈 强, 陈 颖
(华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237)
活性污泥法降解三溴苯酚
顾 雍, 孙贤波, 刘勇弟, 邬莎娜, 陈 强, 陈 颖
(华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237)
为探究三溴苯酚(TBP)在活性污泥系统中的降解过程,采用驯化活性污泥的方法,考察了初始浓度、pH、温度、外加碳源、重金属及络合剂对活性污泥降解三溴苯酚的影响。研究表明,当三溴苯酚质量浓度为10~50 mg/L时,降解过程符合零级动力学。活性污泥对三溴苯酚的比基质吸附速率qbd随pH增大而减小,且当pH为7.0~8.0时,有利于生物降解。苯酚和双酚A作为外加碳源时对三溴苯酚的降解产生抑制作用。Cu2+和Ni2+的存在也抑制了三溴苯酚的降解,且Ni2+的抑制效应要强于Cu2+。柠檬酸作为络合剂通过降低水相中游离金属离子的浓度可以减弱重金属对活性污泥的抑制作用,当Cu2+与柠檬酸物质的量之比为1∶4时,Cu2+的抑制效应完全可以清除。
三溴苯酚; 外加碳源; 重金属; 络合剂
卤代芳香烃由于其毒性、持久性和生物富集性而对环境产生危害[1],其中溴代酚类物质可以通过食物链富集进入人体[2]。在溴代酚类物质中,三溴苯酚(TBP)作为一种重要的阻燃剂中间体而被广泛应用[3],其在水体和土壤中已被检测到[4],甚至在血液中也能检测到相当高浓度的三溴苯酚[5]。目前国内外对于三溴苯酚的生物处理技术研究主要集中于降解菌的筛选和分离,以期获得三溴苯酚的高效降解菌,例如Desulfovibriostrain[6]和Bacillussp.GTZ[7]。其次,在筛选所得降解菌的基础上研究混合菌株的协同效应对三溴苯酚降解的影响[8-9]。然而通过好氧活性污泥实现三溴苯酚的脱溴和降解研究并不多见,作为最为传统同时也是应用范围最广的生物处理技术,有必要对活性污泥降解三溴苯酚及其影响因素进行研究。
本文考察了活性污泥系统三溴苯酚的降解动力学,并考察了三溴苯酚初始质量浓度、pH、温度、外加碳源、重金属和络合剂的掩蔽作用对活性污泥系统下三溴苯酚降解动力学的影响。
1 实验部分
1.1 试剂
三溴苯酚(纯度>98%)和双酚A(纯度>99%)购自上海泰坦公司,其余药品均为分析纯,由上海凌峰化学试剂有限公司提供。
1.2 污泥的培养与驯化
所用污泥取自上海某污水处理厂,污泥用自来水清洗3次然后曝气24 h,之后注入完全混合式反应器(CSTR)中,反应器如图1所示。完全混合式反应器由两部分组成:曝气区和沉降区,体积分别为2 L和1 L。水力停留时间(HRT)和污泥龄(SRT)分别控制在8 h和7 d。采用梯度驯化的方式,依次提高三溴苯酚的质量浓度,完全混合式反应器稳定运行3个月。配制的模拟废水由营养物质、微量元素和碱组成以满足微生物生长的需求,元素质量比m(C)∶m(N)∶m(P)=100∶5∶1,在驯化系统稳定状态下,进水中三溴苯酚的质量浓度为200 mg/L,最终配水组成如表1所示。在驯化过程中,温度(T)、溶解氧(DO)、污泥质量浓度(MLSS)、污泥沉降比(SV)和污泥容积指数(SVI)作为日常监测污泥性状的指标。活性污泥系统稳定运行,出水中三溴苯酚的质量浓度低于检测线,出水化学需氧量COD稳定在50 mg/L左右,表明活性污泥系统驯化完成且运行稳定,活性污泥可以作为批次实验的泥源进行后续实验。
1.3 实验仪器
LC-10ATV型高效液相色谱,日本岛津公司;ICS-1000型离子色谱,美国戴安公司;PB-10型pH计,德国赛多利斯公司;SPX-250B-D型振荡培养箱,上海博迅实业公司;BT100-1F型蠕动泵,保定兰格恒流泵有限公司。

图 1 完全混合式反应器Fig.1 CSTR表1 合成废水配水表Table 1 Composition of synthetic effluent

CompoundMassconcentration/(mg·L-1)KHC8H4O4360NH4Cl180TBP200NaHCO3400KH2PO474CaCl20.73FeCl3·6H2O0.45MgCl2·6H2O1.33MnSO4·H2O0.30
1.4 分析方法
三溴苯酚测定采用高效液相色谱法,色谱条件:甲醇与水体积比为80∶20,流速1 mL/min,进样量10 μL,柱温40 ℃,检测波长278 nm;溴离子测定采用离子色谱法,淋洗液Na2CO3(9 mmol/L,1 mL/min);污泥质量浓度的测定方法采用质量法。
1.5 实验方法
采用批次实验的方法,三溴苯酚降解实验步骤如下:取驯化污泥40 mL,12 000 r/min离心5 min,弃去上清液,将残留污泥加入预先配置的三溴苯酚溶液(溶液的温度,三溴苯酚初始质量浓度,pH,重金属离子浓度和络合剂的投加量根据具体实验条件而定),泥水混合液的体积为200 mL,置于恒温振荡培养箱中(除考查温度影响外,均设置于25 ℃),以200 r/min的转速振荡反应。定时取样5 mL于离心管中,混合液采用4 000 r/min离心10 min后取上清液测定相关指标。
在批次实验的基础之上采用FBR法[10]:用蠕动泵以1.25 mL/min的流速将质量浓度为1 000 mg/L的三溴苯酚培养液连续输入1 L生化反应器中,25 ℃恒温培养,磁力搅拌混合并曝气供氧,定时取样,混合液采用4 000 r/min离心10 min后取上清液,测定水相中三溴苯酚的质量浓度。由水相中三溴苯酚质量浓度的增加得到生化反应器中残留三溴苯酚的增加速率Q(TBPres) (mg/min),结合三溴苯酚的投加速率Q(TBPin) (mg/min),便可得到相应条件下三溴苯酚的利用速率Qmax(mg/min)。兼顾考虑吸附和降解对三溴苯酚去除过程的贡献及MLSS的影响,得到比基质利用速率qmax(d-1)、比基质降解速率qbio(d-1)和比基质吸附速率qbd(d-1)存在如下关系:
(1)
2 结果与讨论
2.1 活性污泥系统下三溴苯酚的降解动力学及其降解与脱溴的关系
三溴苯酚初始质量浓度为10 mg/L时三溴苯酚的降解和脱溴情况如图2所示(活性污泥质量浓度为600 mg/L)。在活性污泥系统中,三溴苯酚的降解动力学过程可以用Monod方程来描述:
(2)
其中:v表示比降解速率;S表示基质浓度;Ks表示半饱和常数。由方程可知三溴苯酚的降解速率同时受到半饱和常数和基质浓度的影响,当基质浓度S>>Ks时,降解动力学过程可以简化为零级动力学过程。李娟英[11]研究表明处于贫营养状态下活性污泥降解苯胺的Ks=0.09 mg/L,驯化所得的微生物菌群具有贫营养细菌的特性[12],降解过程符合零级动力学过程。本活性污泥系统中的污泥驯化稳定后长期处于贫营养状态(稳态下三溴苯酚的质量浓度低于检出限),具备上述特性,因此采用零级动力学对三溴苯酚的降解过程进行描述,同时考虑到三溴苯酚作为酚类物质具有疏水性,因此活性污泥接触三溴苯酚的初始阶段,三溴苯酚的去除应当包括生物吸附和生物降解,前期活性污泥对双酚A的吸附研究表明20 min内可以基本达到吸附平衡[13],因此对20 min后的数据点采用零级拟合,当三溴苯酚初始质量浓度为10 mg/L时,得到的结果为ρ(TBP)= -0.116t+9.4 (R2=0.998),拟合结果的线性程度较好,则三溴苯酚在pH=7.0和温度为25 ℃下qbio为0.28 d-1。同时比较三溴苯酚降解和脱溴可知,三溴苯酚的降解量越大则降解过程中的脱溴量越大,表明脱溴是三溴苯酚降解过程中的一个重要步骤。同时,80 min内三溴苯酚降解基本完全,而溴离子的质量浓度则在80 min后继续增加,最终100 min内的脱溴量(7.26 mg/L)与10 mg/L的三溴苯酚理论含溴量(7.25 mg/L)相近,表明活性污泥会对三溴苯酚的溴代中间产物继续进行脱溴降解,降解过程中基本完全脱溴。
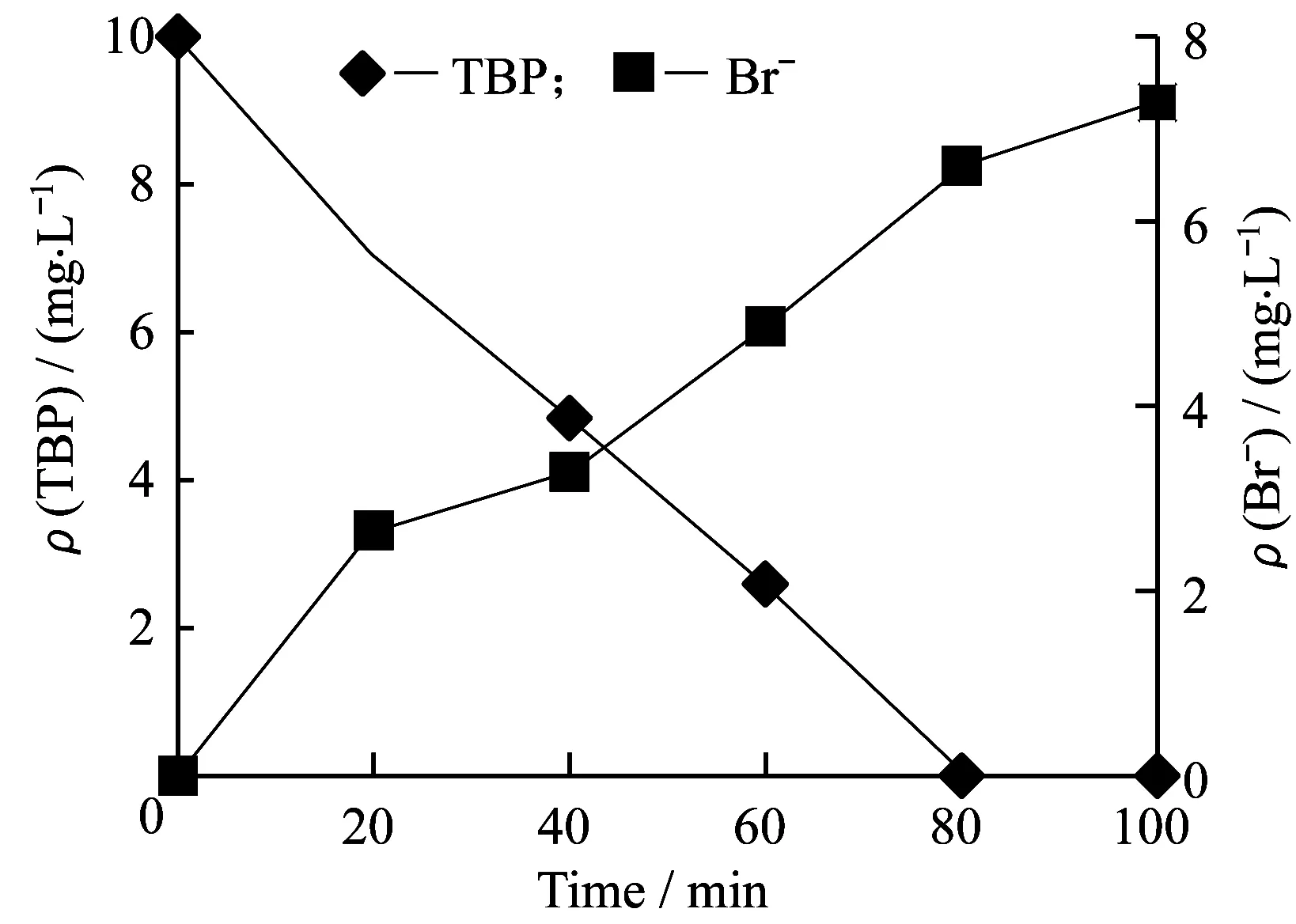
图2 活性污泥系统三溴苯酚降解和脱溴随时间变化曲线Fig.2 Degradation and debromination curves of TBP in activated sludge system
2.2 三溴苯酚的初始质量浓度对活性污泥降解三溴苯酚的影响
三溴苯酚作为内分泌干扰物和持久性有机污染物具有生物毒性[14]。考察三溴苯酚的质量初始浓度对驯化过的活性污泥降解三溴苯酚的影响,从而考察三溴苯酚在高质量浓度下是否对驯化过的活性污泥存在抑制作用。图3所示为不同三溴苯酚初始质量浓度下活性污泥去除三溴苯酚的比降解速率图,初始反应条件为pH=7.0,活性污泥质量浓度600 mg/L,温度(25±1) ℃。由图3可知,三溴苯酚质量浓度为10~50 mg/L时,qbio几乎不受质量浓度变化的影响;但当三溴苯酚的质量浓度增加到80 mg/L时,qbio明显减小,可见高质量浓度的三溴苯酚会对活性污泥产生毒性作用,从而影响污泥的降解活性。

图3 不同三溴苯酚初始质量浓度下活性污泥 去除三溴苯酚的比降解速率Fig.3 Specific degradation rate of TBP in activated sludge system under different initial concentrations
2.3 pH对活性污泥降解三溴苯酚的影响
pH会影响生物活性,同时会改变三溴苯酚在水中的存在形态以及污泥的表面电荷,从而影响三溴苯酚与活性污泥间的相互作用。本文考察不同的pH对活性污泥降解三溴苯酚的影响,如图4所示。反应条件为三溴苯酚质量浓度10 mg/L,活性污泥质量浓度260 mg/L,温度(25±1) ℃。活性污泥对三溴苯酚的去除过程是由污泥吸附和污泥降解两部分共同组成的。由图4可知,pH为6.0、7.0、8.0、9.0下,qbio表现为先增大后减小,且pH=8.0时活性污泥具有最大的qbio,污泥的降解活性最好。鉴于三溴苯酚高质量浓度下存在毒性作用,而在10~50 mg/L范围内对降解过程没有影响,因此生态处理技术FBR法测定时间定为50 min,FBR实验结果如表2所示,pH为6.0、7.0、8.0、9.0时qmax依次减小,由qmax和qbio可得pH为6.0、7.0、8.0、9.0时的qbd为1.00、0.81、0.69、0.03 d-1,由此可知酸性条件下有利于污泥吸附,并且qbd随着pH的上升而减小。

图4 不同pH条件下活性污泥降解三溴苯酚的比降解速率Fig.4 Specific degradation rate of TBP in activated sludge system under different pH values表2 FBR法测定实验结果Table 2 Results of FBR experiments

pHQ(TBPin)/(mg·min-1)Q(TBPres)/(mg·min-1)ρ(MLSS)/(mg·L-1)qmax/d-16.01.250.9973301.227.01.250.9933301.108.01.251.0483100.999.01.251.1813300.30
2.4 温度对活性污泥降解三溴苯酚的影响
活性污泥降解有机物具有其适应的温度范围,温度过高和过低都会影响污泥的活性。本文考察了活性污泥在15~45 ℃条件下温度对qbio的影响,如图5所示。初始反应条件为活性污泥质量浓度300 mg/L,三溴苯酚质量浓度10 mg/L,pH=7.0。由图5可知,活性污泥在35 ℃时的降解活性明显提升,表明在15~35 ℃的温度范围生物降解过程符合一般酶促反应的规律,升高温度有利于反应速率的加快,但当温度升高至45 ℃时,qbio显著减小,主要是由于蛋白质对温度敏感,随着温度的升高会发生不可逆的破坏,从而导致微生物的死亡。

图5 不同温度下活性污泥去除三溴苯酚的比降解速率Fig.5 Specific degradation rate of TBP in activated sludge system under different temperatures
2.5 外加碳源对活性污泥降解三溴苯酚的影响
有机碳源可能会为三溴苯酚的降解过程提供额外的能量,从而影响三溴苯酚的降解过程[15-16]。本文考察了葡萄糖、双酚A和苯酚作为外加碳源对三溴苯酚降解过程的影响,如图6、图7所示。
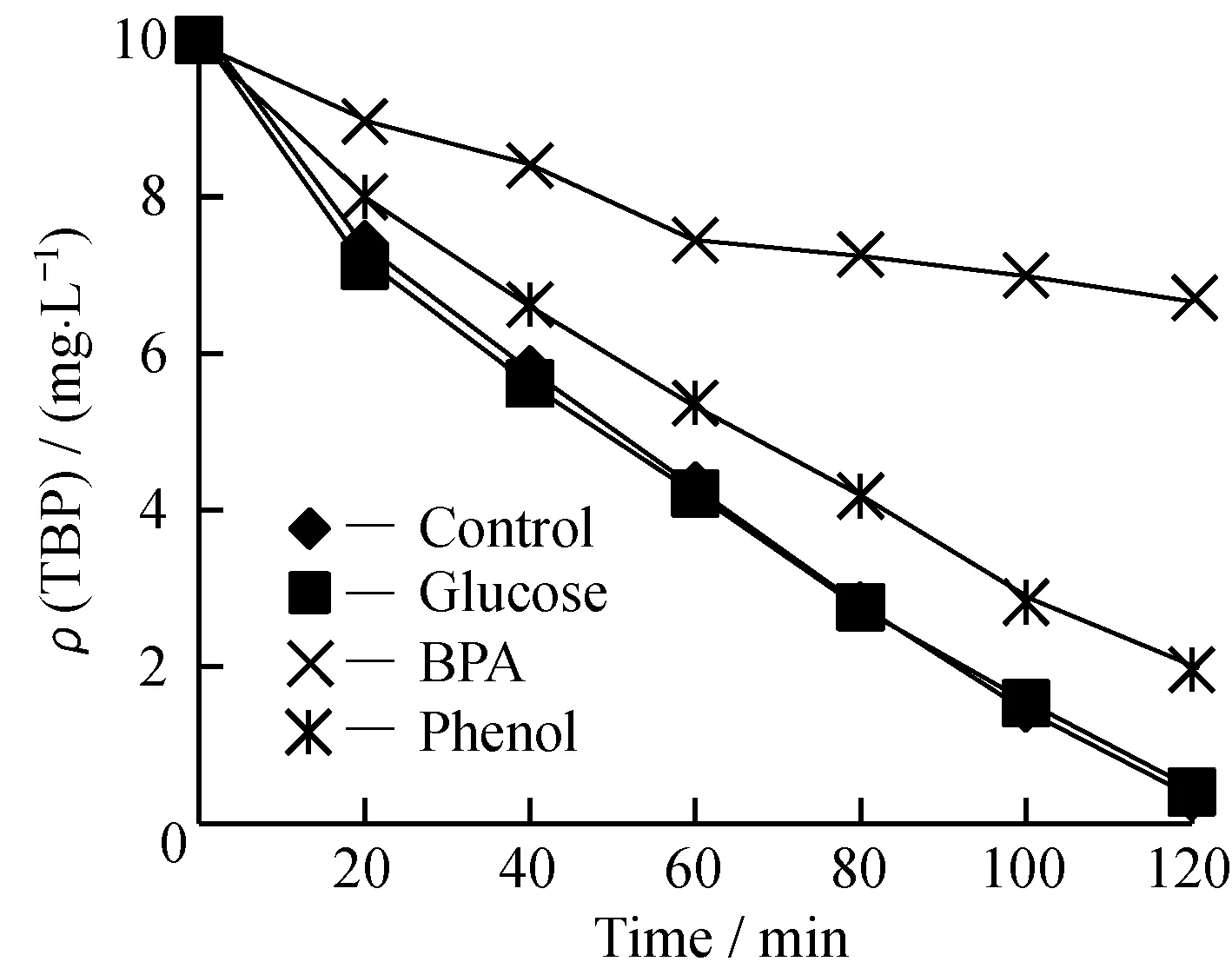
图6 第二碳源对活性污泥去除三溴苯酚的影响Fig.6 Influence of additional carbon source on removal of TBP in activated sludge system
初始反应条件为活性污泥质量浓度350 mg/L,三溴苯酚质量浓度10 mg/L,外加碳源质量浓度100 mg/L,pH=7.0,温度(25±1) ℃。由图6可知,三溴苯酚的降解量大小顺序在外加碳源存在下表现为:参照组=葡萄糖>苯酚>双酚A。由图7可知,降解过程的脱溴量大小顺序在外加碳源存在下表现为:葡萄糖>参照>苯酚>双酚A。结果表明,结构类似物苯酚和双酚A的存在对三溴苯酚的降解过程产生了抑制作用,并且双酚A的抑制作用大于苯酚的抑制作用,产生抑制的原因可能由于苯酚和双酚A同样作为酚类物质会与三溴苯酚竞争吸附到活性污泥的表面上,从而影响三溴苯酚的代谢过程。易降解碳源葡萄糖的存在增大了三溴苯酚降解过程中的脱溴量,表明葡萄糖的存在加速了三溴苯酚中间产物的降解,且在反应条件下葡萄糖作为主要基质提供微生物代谢所需能量而强化次要基质的降解,与文献[17]等的研究结果类似。

图7 第二碳源对活性污泥去除三溴苯酚过程中脱溴的影响Fig.7 Influence of additional carbon source on debromination of TBP in activated sludge system
2.6 重金属对活性污泥降解三溴苯酚的影响
选用Cu2+和Ni2+这两种水体中常见的重金属作为研究对象,考察它们对生物降解过程的影响。Cu2+和Ni2+存在时的比降解速率如图8所示,初始反应条件为pH=7.0,MLSS质量浓度350 mg/L,TBP质量浓度10 mg/L,温度(25±1) ℃。

图8 Cu2+和Ni2+对三溴苯酚的比降解速率的影响Fig.8 Influence of Cu2+ and Ni2+ on specific degradation rate of TBP in activated sludge system
由图8可知,在Cu2+和Ni2+存在的条件下,qbio随着金属质量浓度的升高而减小。其中Ni2+的抑制作用大于Cu2+的抑制作用,且当Cu2+和Ni2+的质量浓度为1 mg/L时产生了明显的抑制作用。金属离子会通过与生物酶(例如—SH)的相互作用抑制微生物对有机污染物的降解[18]。
2.7 重金属络合剂对活性污泥降解三溴苯酚的影响
水体中的络合剂会与重金属络合从而可能通过掩蔽作用减弱重金属对活性污泥的毒性作用,本文选取酒石酸和柠檬酸两种常见的且易生物降解的络合剂,考察在Cu2+存在下,络合剂对生物降解过程的影响,如图9和图10所示。反应初始条件为活性污泥中Cu2+、三溴苯酚质量浓度分别为300、10 mg/L,pH=7.0,温度(25±1) ℃。当Cu2+与酒石酸的物质的量之比分别为1∶2和1∶4时,qbio依次为0.03 d-1和0.04 d-1,与单独Cu2+相比,qbio几乎没有提高。当Cu2+与柠檬酸的物质的量之比分别为1∶2和1∶4时,qbio明显提高,依次为0.25 d-1和0.34 d-1;且当Cu2+与柠檬酸的物质的量之比为1∶4时,铜离子的抑制效应完全清除。结果表明添加柠檬酸作为络合剂可以在一定程度上减弱重金属对活性污泥的抑制作用,并且柠檬酸的效果优于酒石酸,主要原因在于柠檬酸金属离子的络合能力要优于酒石酸,从而减少了水相中游离金属离子的浓度,进而减小了抑制效应。

图9 酒石酸对活性污泥去除三溴苯酚过程的影响Fig.9 Influence of tartaric acid on removal of TBP in activated sludge system

图10 柠檬酸对活性污泥去除三溴苯酚过程的影响Fig.10 Influence of citric acid on removal of TBP in activated sludge system
3 结 论
(1) 贫营养环境下驯化所得的活性污泥,在三溴苯酚初始质量浓度为10~50 mg/L时,降解过程符合零级动力学。当三溴苯酚的质量浓度增加到80 mg/L时,qbio明显减小,高浓度的三溴苯酚对驯化过的活性污泥仍然会产生毒性作用。
(2) 当pH为6.0、7.0、8.0、9.0时,qbio分别为0.22、0.29、0.30、0.27 d-1,qbd分别为1.00、0.81、0.69、0.03 d-1。活性污泥对三溴苯酚的比吸附速率随pH增大而减小。
(3) 15~35 ℃内生物降解过程符合一般酶促反应的规律,升高温度有利于反应速率的加快,35 ℃时qbio为0.38 d-1,继续升高温度至45 ℃时,qbio减小为0.03 d-1。
(4) 苯酚和双酚A作为外加碳源时对三溴苯酚的降解产生抑制作用。葡萄糖作为外加碳源可以促进三溴苯酚降解过程中脱溴量的增加。
(5) Cu2+和Ni2+的存在均抑制了三溴苯酚的降解,且Ni2+的抑制效应要强于Cu2+。柠檬酸作为络合剂可以减弱Cu2+对活性污泥的抑制作用,当Cu2+与柠檬酸物质的量之比为1∶4时,Cu2+的抑制效应完全可以清除。
[1] SIM W J,LEE S H,LEE I S,etal.Distribution and formation of chlorophenols and bromophenols in marine and riverine environments[J].Chemosphere,2009,77(4):552-558.
[2] KNOB R,MARA J,STANOVA A,etal.Determination of brominated phenols in water samples by on line coupled isotachophoresis with capillary zone electrophoresis[J].Journal of Chromatography A,2010,1217(20):3446-3451.
[3] YAMAD T,TAKAHAMA Y,YAMADA Y.Biodegradation of 2,4,6-tribromophenol byOchrobactrumsp. strain TB01[J].Bioscience Biotechnology & Biochemistry,2008,72(5):1264-1271.
[4] THOMSON C,LUNDANES E,BECHER G.Brominated flame retardants in plasma samples from three different occupational groups in Norway[J].Journal of Environmental Monitoring,2001,3(4):366-70.
[5] RONEN Z,VISNOVSKY S,NEJIDAT A.Soil extracts and co-culture assist biodegradation of 2,4,6-tribromophenol in culture and soil by an auxotrophicAchromobacterpiechaudiistrain TBPZ[J].Soil Biology & Biochemistry,2005,37(9):1640-1647.
[6] BOYLE A W,PHELPS C D,YOUNG L Y.Isolation from estuarine sediments of a Desulfovibrio strain which can grow on lactate coupled to the reductive dehalogenation of 2,4,6-tribromophenol[J].Applied & Environmental Microbiology,1999,65(3):1133-1140.
[7] ZU Lei,LI Guiying,AN Taicheng,etal. Biodegradation kinetics and mechanism of 2,4,6-tribromophenol byBacillussp.GZT:A phenomenon of xenobiotic methylation during debromination[J].Bioresource Technology,2012,110(2):153-159.
[8] 王淮,程莎莎,姚日生.铜绿假单胞菌TBPY与黏质沙雷氏菌SMA协同降解三溴苯酚的特性[J].化工进展,2009,28(S2):192-195.
[9] 程莎莎,王淮,姚日生,等.混合菌株对三溴苯酚的降解特性[J].环境化学,2011,30(9):1576-1581.
[10] WILLIAMSON K J,MCCARTY P L.Rapid measurement of monod half-velocity coefficients for bacterial kinetics[J].Biotechnology & Bioengineering,1975,17(6):915-924.
[11] 李娟英.低浓度污染物生物处理特性研究[D].上海:华东理工大学,2005.
[12] 王占生,刘文君.微生物水源饮用水处理[M].北京:建筑工业出版社.1999:79-80.
[13] GU Yong,SUN Xianbo,LIU Yongdi.Biodegradation and biosorption of Bisphenol A in activated sludge system[J].Research on Chemical Intermediate,2016,42(5):4289-4301.
[14] DENG Jun,LIU Chunsheng,YU Liqin,etal.Chronic exposure to environmental levels of tribromophenol impairs zebrafish reproduction[J].Toxicology & Applied Pharmacology,2010,243(1):87-95.
[15] AZIZ C E,GEORGIOU G,SPEITE G E.Cometabolism of chlorinated solvents and binary chlorinated solvent mixtures usingM.trichosporiumOB3b PP358[J].Biotechnology & Bioengineering,1999,65(1):100-107.
[16] GIRBAL L,ROLS J L,LINDLEY N D.Growth rate influences reductive biodegradation of the organophosphorus pesticide demeton byCorynebacteriumglutamicum[J].Biodegradation,2000,11(6):371-376.
[17] LAPAT-POLASKO L,MCCARTY P L,ZEHNDER A.Secondary substrate utilization of methylene chloride by an isolated strain ofPseudomonassp.[J].Applied & Environmental Microbiology,1984,47(4):825-30.
[18] SANDRIN T R,MAIER R M.Impact of metals on the biodegradation of organic pollutants.[J].Environmental Health Perspectives,2003,111(8):1093-1101.
Biodegradation of Tribromophenol in Activated Sludge System
GU Yong, SUN Xian-bo, LIU Yong-di, WU Sha-na, CHEN Qiang, CHEN Ying
(School of Resources and Environmental Engineering,State Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process,East China University of Science and Technology,Shanghai 200237,China)
The acclimated sludge was used to investigate the influence of initial TBP concentration,pH,temperature,additional carbon sources,heavy metal and chelant on the degradation of tribromophenol (TBP) in activated sludge system.The experimental results showed that degradation of TBP followed the zero-order reaction in the concentration range of 10-50 mg/L.The specific biosorption rateqbddecreased with the increase of pH and pH 7.0-8.0 was in favor of biodegradation.Phenol and BPA as additional carbon sources inhibited the biodegradation of TBP.Both Cu2+and Ni2+also inhibited the biodegradation of TBP,while the inhibitory effect of Ni2+on biodegradation of TBP was stronger than that of Cu2+.Citric acid as chelant reduced the inhibitory effect of Cu2+by reducing free Cu2+in water phase.Whenn(Cu2+)∶n(Citric acid) was 1∶4,the inhibition of Cu2+was completely eliminated.
tribromopheol; additional carbon source; heavy metal; chelant
1006-3080(2016)05-0664-06
10.14135/j.cnki.1006-3080.2016.05.012
2016-03-08
顾 雍(1991-),男,江苏建湖人,博士生,研究方向为废水处理。E-mail:guyong2007@sina.com
孙贤波,E-mail:xbsun@ecust.edu.cn
X83
A
