聚乙烯醇与戊二醛的交联反应动力学
2016-11-21蒋文斌纪利俊吴艳阳朱家文
蒋文斌, 纪利俊, 陈 葵, 武 斌, 吴艳阳, 朱家文
(华东理工大学化工学院,上海 200237)
聚乙烯醇与戊二醛的交联反应动力学
蒋文斌, 纪利俊, 陈 葵, 武 斌, 吴艳阳, 朱家文
(华东理工大学化工学院,上海 200237)
聚乙烯醇与戊二醛的交联反应常用于微胶囊包覆和高分子材料的改性工艺中。采用分光光度法测定了反应体系中聚乙烯醇的浓度,研究了聚乙烯醇与戊二醛的交联反应特性,确定了聚乙烯醇与戊二醛的反应计量比。结果表明,交联反应可视为不可逆反应,聚乙烯醇与戊二醛的物质的量之比约为1∶525。建立了反应动力学方程,确定了交联反应对聚乙烯醇为零级反应,对戊二醛为0.7级反应,拟合得到了反应动力学参数。
缩醛反应; 戊二醛; 聚乙烯醇; 反应动力学
聚乙烯醇与戊二醛的交联产物作为一种良好的微胶囊壁材,常用于固体微粒和液滴的包覆,如制备醇醛树脂香精和柠檬香精微胶囊[1-2]、液体有机膦乳液微胶囊[3]等,粒子经过包覆后可以提高其机械强度和稳定性,使芯材屏蔽或使芯材缓释,扩大了被包覆材料的使用范围。聚乙烯醇与戊二醛交联产物还可作为高分子材料的改性剂,主要用于与高分子材料共混制膜,如制备戊二醛交联热塑性淀粉/聚乙烯醇混合膜[4]、戊二醛交联聚乙烯醇/碱木质素混合膜[5]等,提高了膜的机械强度和韧性。
聚乙烯醇与戊二醛的交联是羟基与醛基的醇醛缩合反应。在酸性条件下,醛基先与羟基反应生成半缩醛,半缩醛再与羟基脱水缩合生成醚,因此,一个醛基最多能够和两个羟基反应[6]。大部分小分子醇与单醛反应是可逆反应,转换率较低[7-8]。聚乙烯醇由于受到分子链结构与构型以及分子内外氢键的影响,使其反应活性与小分子醇存在较大差别[9-10]。NAKAMURA 等[11]研究了1,3-丁二醇、聚乙烯醇分别与甲醛、氯乙醛、丙醛和丁醛的反应,发现1,3-丁二醇与醛反应速率约是聚乙烯醇与醛反应速率的2倍,前者平衡常数却是后者平衡常数的1/10~1/20。与单醛相比,戊二醛分子的两个醛基能够与更多的羟基反应,使戊二醛与聚乙烯醇的反应更快,也更容易形成固化的交联产物。LOBOVA等[12]在制备聚乙烯醇缩戊二醛离子交换膜的过程中发现,常见的无机酸中以盐酸的催化效果最好,w为5%的戊二醛在60 ℃下与聚乙烯醇反应120 min,可以得到醛化率最大、强度最高的交联产物。ZHUANG等[13]通过测定溶液黏度的变化考察了聚乙烯醇与戊二醛凝胶化预聚过程的速率,发现反应体系中,凝胶化速率主要受pH的影响,而离子强度和温度对凝胶化速率的影响相对较小。HANSEN等[14]对比了黏度法和脉冲梯度场NMR法测定聚乙烯醇缩戊二醛凝胶浓度,认为脉冲梯度场NMR法比黏度法的测定精度更高,测量范围更广。
聚乙烯醇的羟基含量高,可作为膨胀型阻燃剂的碳源,与戊二醛交联包覆于阻燃剂表面,可形成具有成碳与阻燃二位一体的阻燃剂。研究聚乙烯醇与戊二醛的反应特性和反应动力学,对微胶囊包覆工艺至关重要。目前,对聚乙烯醇与戊二醛交联反应的研究多集中于微胶囊包覆过程和高分子材料改性过程的工艺条件,以及凝胶化预聚体浓度的测定方法、交联度等方面,对交联反应动力学方面的研究不够充分。在硼酸存在条件下,聚乙烯醇能够与碘反应生成绿色络合物,在波长为690 nm处有最大的吸收峰[15],采用分光光度法可以快速准确地测定溶液中聚乙烯醇的浓度。
本文测定了聚乙烯醇和戊二醛交联反应体系中聚乙烯醇的浓度随时间的变化,确定了反应物的反应计量比,得到了反应级数、活化能等动力学参数和反应动力学方程,研究结果可望为交联反应的实际应用和过程优化提供参考。
1 材料和方法
1.1 试剂原料
聚乙烯醇124(PVA),平均相对分子质量为105 000,国药集团化学试剂有限公司,化学纯;戊二醛(GA)溶液w为25%,国药集团化学试剂有限公司,生物试剂;盐酸,上海凌峰化学试剂有限公司,分析纯;碘化钾,国药集团化学试剂有限公司,分析纯;碘,上海凌峰化学试剂有限公司,分析纯;硼酸,国药集团化学试剂有限公司,分析纯。
1.2 实验仪器
紫外可见分光光度计,上海精科分析仪器厂,752N;超级恒温水浴槽,上海舜宇恒平科学仪器有限公司,CH1015,±0.1 ℃;电子天平,上海舜宇恒平科学仪器有限公司,FB224,±0.000 1 g;精密温度计,常州市凯悦热工仪表有限公司,0~100 ℃,±0.1 ℃。
1.3 装置及流程
实验装置如图1所示。用电子天平称取一定质量的PVA加热溶解于200 mL水中,冷却后倒入500 mL三口烧瓶中,加入一定量GA溶液后,加热至设定的反应温度。反应温度由水浴控制,通过精密温度计测量。搅拌下滴入一定量的盐酸后,开始反应,每隔一段时间取1 mL反应液置于100 mL容量瓶中,稀释至刻度,测定稀释液的吸光度,计算得到反应液中PVA浓度。

图1 戊二醛交联聚乙烯醇实验装置Fig.1 Experimental device of polyvinyl alcohol cross-linked with glutaraldehyde
1.4 PVA浓度的测定
分别量取10 mL不同浓度的PVA标准溶液置于50 mL容量瓶中,加入8 mL H3BO3(w=4%)溶液与2 mL碘液(2.5 g KI与0.65 g I2溶于100 mL水),稀释至刻度。摇匀后静置10 min,在1 mL石英比色皿中,以水为参比,测量溶液在690 nm波长处的吸光度。图2示出了PVA溶液的浓度与吸光度的关系曲线。
由图2可见,吸光度与浓度呈线性关系。拟合得到线性方程为
式中:A为吸光度;cPVA为PVA浓度,mol/L。
2 结果与讨论
2.1 反应计量比
在反应温度为60 ℃,催化剂盐酸浓度为0.020 mol/L,PVA的初始浓度为0.005 mol/L的条件下,分别加入不同量的GA进行反应,反应至PVA的浓度不变时,视为反应终止。不同的GA与PVA的质量比(mGA∶mPVA)下,反应终止时PVA浓度的结果见图3。由图3可见,随着mGA∶mPVA的增加,反应终止时PVA的浓度逐渐减小。当mGA∶mPVA=0.125∶1时,反应终止时PVA的浓度几乎为零,表明PVA完全反应,这与OGATA[16]认为PVA与醛的的交联可视为不可逆反应的研究结果一致。根据平均分子量,当mGA∶mPVA=0.125∶1时,PVA与GA反应计量比为1∶525。由PVA分子的结构通式结合上述反应计量比可知,参与反应的GA的醛基数与PVA的羟基数之比nCHO:nOH≈1∶10,明显低于小分子醇与醛缩合时醛基与羟基为1∶2的反应计量比。这是因为PVA分子量大,分子链上的羟基间易形成氢键,使其在与GA反应时存在较大的位阻效应,导致部分羟基不能参与反应。此外,在反应后期随着产物聚乙烯醇缩醛的沉淀析出,导致产物上未交联的羟基无法参与反应。
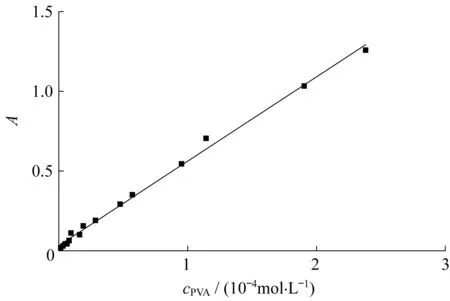
图2 聚乙烯醇溶液的浓度与吸光度的关系Fig.2 Correlation of PVA concentration and absorbance
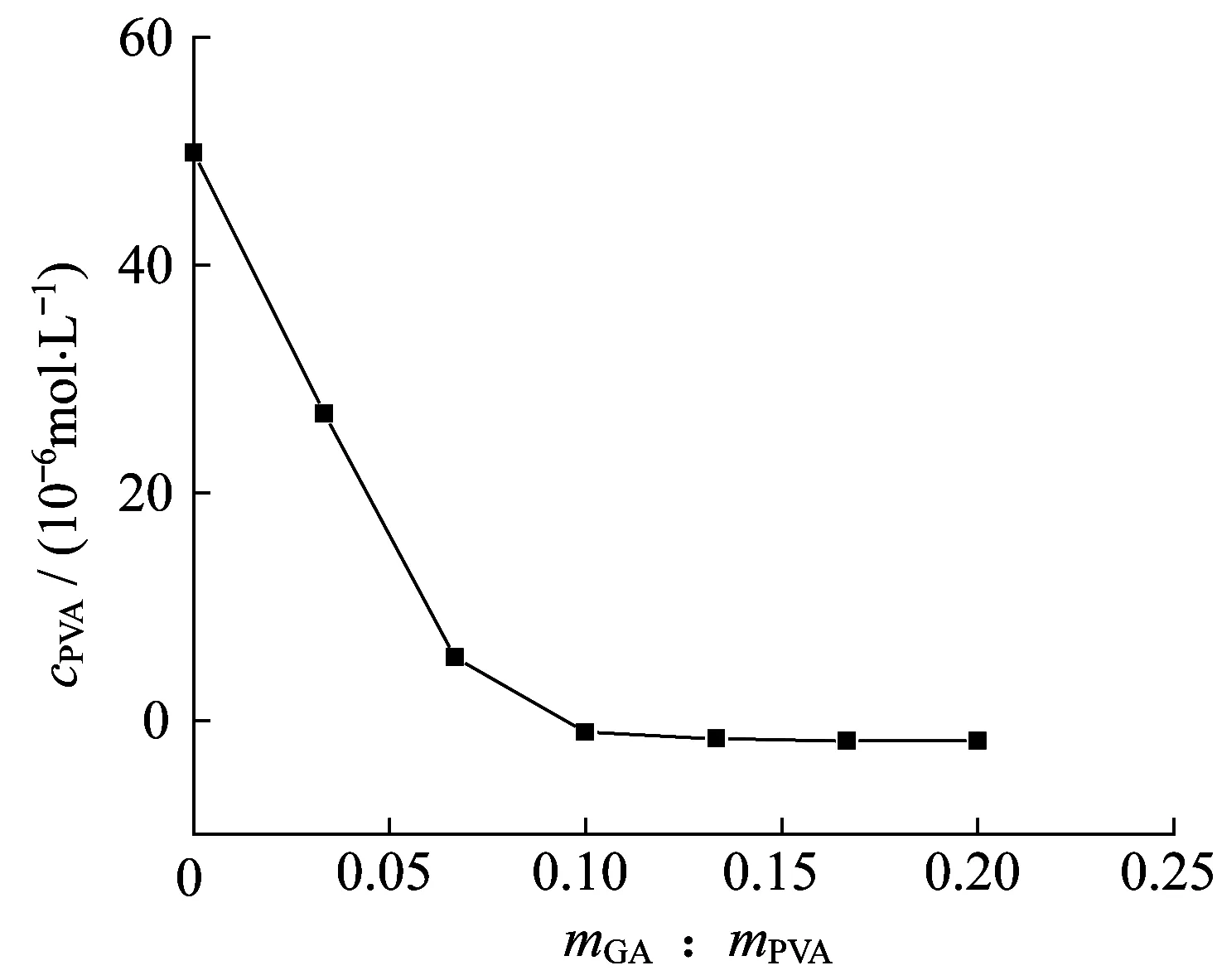
图3 mGA∶mPVA对反应终止时PVA浓度的影响Fig.3 Effect of mGA∶mPVA on PVA concentration at reaction end point
2.2 PVA与GA的交联反应动力学
2.2.1 概述 PVA与GA的交联反应是羟醛缩合反应。PVA与GA的交联反应可表示为
A+nB→C+H2O
速率方程可写成:
(1)
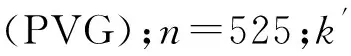
2.2.2 PVA反应级数 用孤立法求反应级数[17],在GA的浓度与PVA浓度之比为反应计量比的5倍条件下,反应中GA浓度可视为常数,式(1)可以改成:
(2)
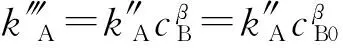
在不同温度、催化剂盐酸浓度为0.020 mol/L、GA过量的条件下,反应溶液中的PVA浓度随时间变化如图4所示。
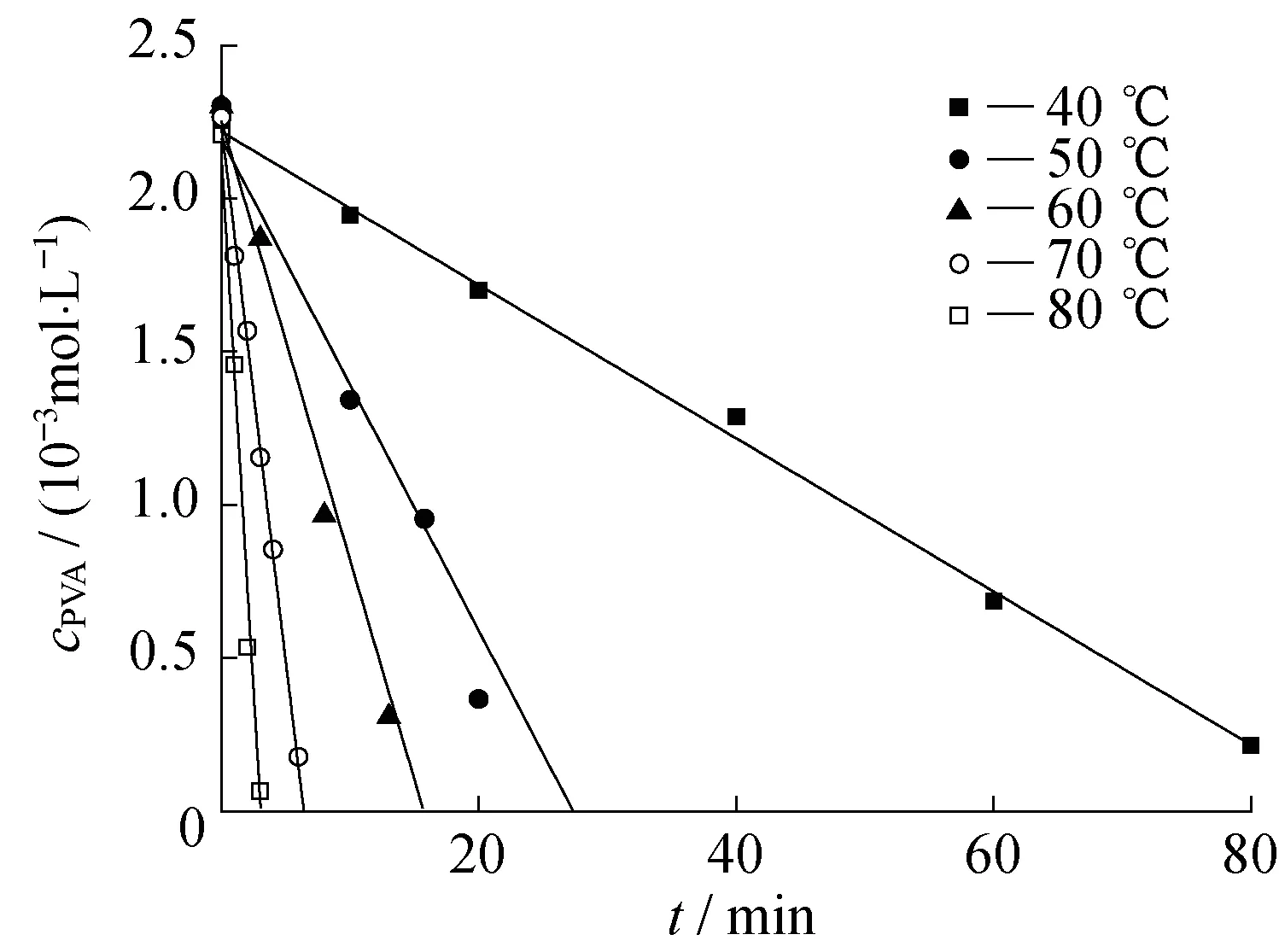
图4 GA过量条件下PVA浓度随时间变化Fig.4 Dependence of PVA concentration on reaction time under the excess of GA
由图4可以看出,PVA浓度随时间呈线性关系,采用线性拟合,相关系数R2的范围为0.96~0.99。这个结果符合零级反应特征,因此,PVA与GA的交联反应对PVA为零级,即α=0。
2.2.3 GA的反应级数 在不同温度下,催化剂盐酸的浓度为0.020 mol/L时,反应物的初始浓度比为反应计量比cPVA∶cGA=1∶525,由于交联反应对PVA为零级,因此,式(1)可以改为
(3)
式中,k″A=525βkA。图5示出了PVA和GA按化学计量比加入条件下PVA浓度随时间的变化规律。
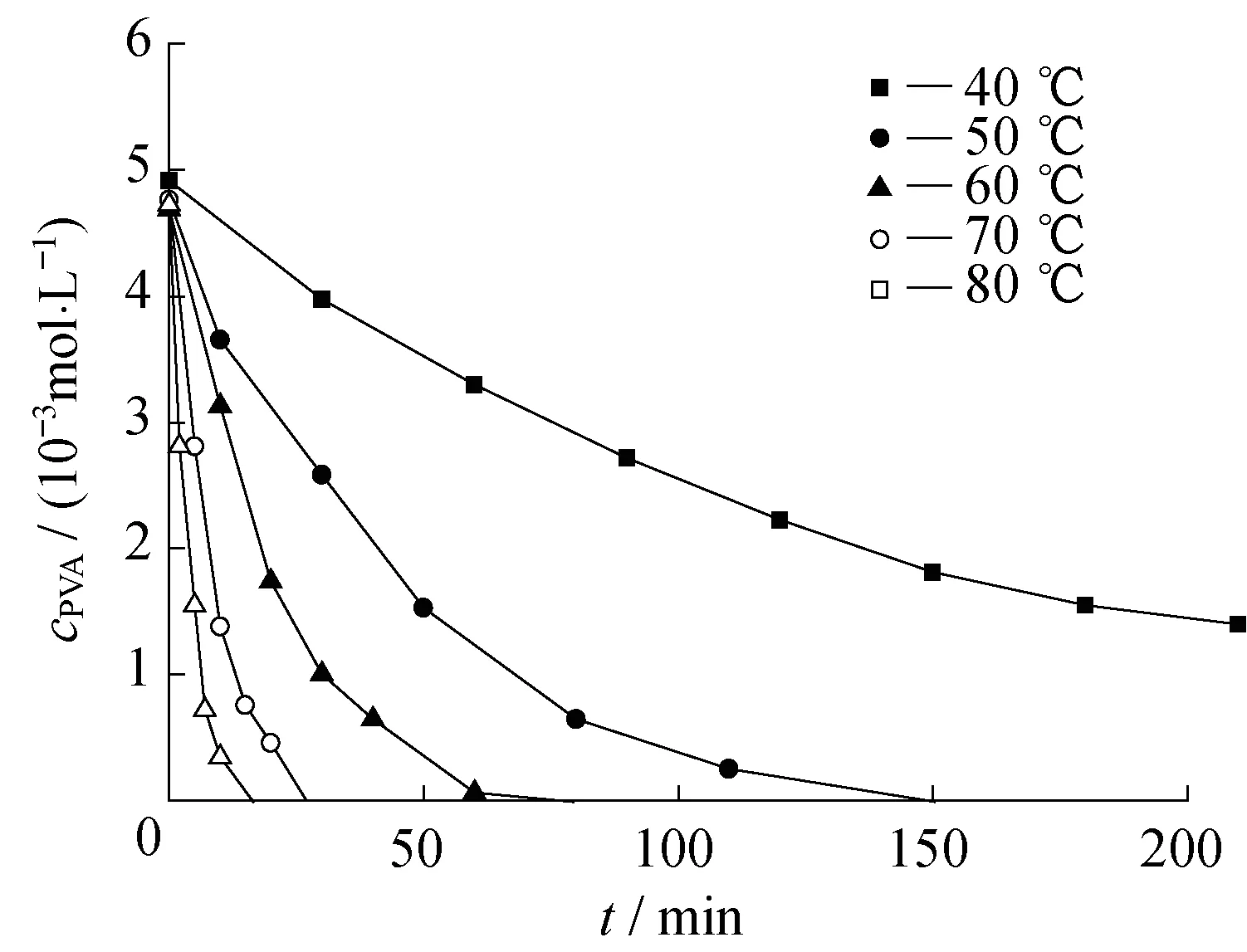
图5 在cPVA∶cGA=1∶525条件下PVA浓度随时间变化Fig.5 Dependence of PVA concentration on reaction time under cPVA∶cGA=1∶525
采用微分法求反应级数[17],对式(3)等号两边取对数,式(3)可变为
(4)
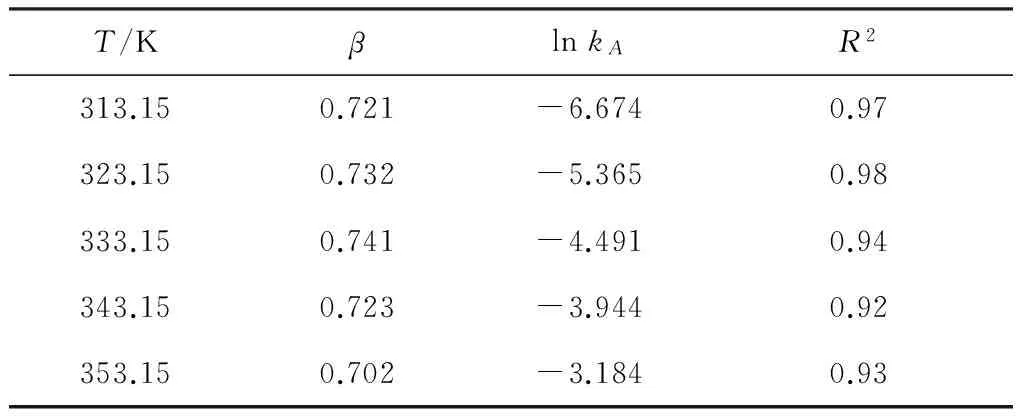
按式(4)对实验结果进行线性拟合,结果见图6和表1。
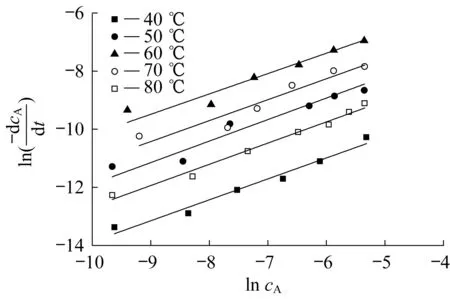
图6 不同温度下与ln cA关系曲线Fig.under different temperature表1 关系曲线的拟合参数Table 1 Fitting parameters of the correlation curve
T/KβlnkAR2313.150.721-6.6740.97323.150.732-5.3650.98333.150.741-4.4910.94343.150.723-3.9440.92353.150.702-3.1840.93
由于不同温度下,β的拟合结果相差不大,都接近于0.7,因此,PVA与GA的交联反应对GA为0.7级,即β=0.7。
2.2.4 反应动力学方程 将不同温度下求得的速率常数的对数lnkA对温度倒数T-1作图,并进行线性拟合,结果见图7。由拟合结果算出活化能Ea=77.50 kJ/mol,指前因子A=1.32×1010(mol/L)0.3/min2,又由于k″A=525βkA,因此PVA与GA的交联反应动力学方程为
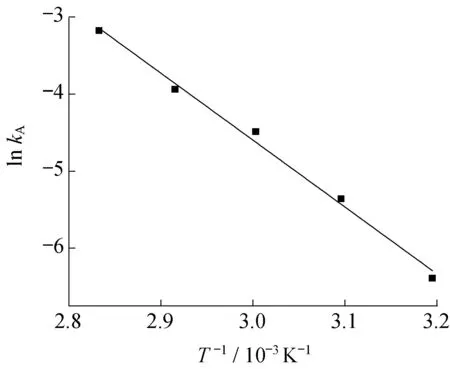
图7 ln kA与T-1的关系Fig.7 Correlation of ln kA and T-1
2.3 动力学模型检验
为验证动力学方程的准确性,选取PVA与GA的配比为反应计量比,分别在40、50、60、70、80 ℃下进行交联反应,将实验测得的PVA浓度与用反应动力学方程计算得到的PVA浓度随时间变化曲线比较,结果如图8所示。各温度条件下的实验值与计算值的最大相对误差为20.6%,平均相对误差为3.4%,说明本文的反应动力学方程是可靠的。

图8 PVA浓度实验值(图标)与计算值(曲线)随时间变化Fig.8 Dependence of experimental (points) and calculated (lines) PVA concentration on reaction time
3 结 论
本文采用分光光度法测定PVA的浓度,研究了PVA与GA交联反应的特性。在交联反应过程中,PVA与GA的反应的物质的量之比为1∶525,且交联反应可视为不可逆反应。研究了交联反应动力学,结果表明交联反应对PVA为零级,对GA为0.7级,得到的反应速率方程为

[1] 史富娟,杨俊玲.PVA缓释微香囊的研制及结构表征[J].纺织学报,2011,32(3):86-89.
[2] LEIMANN F V,GONÇALVES O H,MACHADO R A F,etal.Antimicrobial activity of microencapsulated lemongrass essential oil and the effect of experimental parameters on microcapsules size and morphology[J].Materials Science and Engineering C,2009,29(2):430-436.
[3] 奚平,林苗.W/O/W法制备甲基膦酸二甲酯微胶囊[J].东华大学学报(自然科学版),2004,30(4):56-59.
[4] LIU Ziqin,JIANG Man,XIA Bai,etal.Effect of postcrosslinking modification with glutaraldehyde on the properties of thermoplastic starch/poly(vinyl alcohol) blend films[J].Journal of Applied Polymer Science,2012,124(5):3774-3781.
[5] 苏玲,任世学,方桂珍.戊二醛交联碱木质素/聚乙烯醇膜的制备及其光学性能[J].生物质化学工程,2013,47(3):1-5.
[6] MAHAJANI S M,KOLAH A K,SHARMA M M.Extractive reactions with cationic exchange resins as catalysts(acetalization of aldehydes with alcohols)[J].Reactive & Functional Polymers,1995,28(7):29-38.
[7] ROSA C M.Synthesis of acetal(1,1-diethoxyethane)from ethanol and acetaldehyde over acidic catalysts[J].Applied Catalysis A:General,2000,198(12):1-4.
[8] CHOPADE S P,SHARMA M M.Acetalization of ethylene glycol with formaldehyde using cation-exchange resins as catalysts:Batch versus reactive distillation[J].Reactive and Functional Polymers,1997,34(1):37-45.
[9] RAGHAVENDRACHAR P,CHANDA M.Neighbouring group effect on the kinetics of acetalisation of poly(vinyl alcohol)[J].European Polymer Journal,1983,19(5):391-407.
[10] RUMYANTSEV M,ZELENTSOV S V,GUSHCHIN A V.Retardation effect in acetalization of poly(vinyl alcohol) with butyraldehyde[J].European Polymer Journal,2013,49(6):1698-1706.
[11] NAKAMURA N,SUZUKI K.Study on ketalization reaction of poly(vinyl alcohol) by ketones:IX.Kinetic study on acetalization and ketalization reaction of 1,3-butanediol as a model compound for poly(vinyl alcohol)[J].Journal of Polymer Science:Part A.Polymer Chemistry,1996,34(11):1719-1731.
[12] LOBOVA A B,GONCHAROVA N A,SHAMOLINA I I.Acetalization of polyvinyl alcohol fibers with glutaraldehyde[J].Khimicheskie Volokna,1984,6(4):39-40.
[13] ZHUANG Yinfeng,ZHU Zhongqi,CHEN Liuwei.Investigation of gelation behavior of polyvinyl alcohol-glutaraldehyde system[J].Journal of Applied Polymer Science,1997,63(2):267-272.
[14] HANSEN E W,BOUZGA A M,SOMMER B,etal.Crosslinking of PVA and glutaraldehyde in water monitored by viscosity and pulse field gradient NMR:A comparative study[J].Polymers for Advanced Technologies,2000,11(4):185-191.
[15] 束嘉秀,董亦斌,张惠芬.分光光度法直接测定水中聚乙烯醇(PVA)含量的研究[J].昆明理工大学学报(理工版),2003,28(5):127-130.
[16] OGATA Y,OKANO M,GANKE T.Kinetics of the formation of the formal of polyvinyl alcohol[J].Journal of the American Chemical Society,1956,78(13):2962-2964.
[17] 傅献彩.物理化学[M].第5版.南京:南京大学出版社,2011.
Cross-Linking Reaction Kinetics of Polyvinyl Alcohol with Glutaraldehyde
JIANG Wen-bin, JI Li-jun, CHEN Kui, WU Bin, WU Yan-yang, ZHU Jia-wen
(School of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
Cross-linking reaction between polyvinyl alcohol and glutaraldehyde has been widely applied to microencapsulation and polymer modification.In this study,the cross-linking between polyvinyl alcohol and glutaraldehyde was characterized.The polyvinyl alcohol concentration is measured in the reaction spectrophotometrically.The stoichiometric ratio is determined between polyvinyl alcohol and glutaral-dehyde.The experimental results have demonstrated that the cross-linking reaction is irreversible and the stoichiometry of polyvinyl alcohol and glutaraldehyde is about 1∶525.The kinetic equation has also been established for cross-linking reaction,with the polyvinyl alcohol and glutaraldehyde exhibiting a kinetic order of zero and 0.7 respectively,and the parameters have been evaluated by fitting.
acetalization; glutaraldehyde; polyvinyl alcohol; reaction kinetics
1006-3080(2016)05-0625-05
10.14135/j.cnki.1006-3080.2016.05.006
2015-12-19
蒋文斌(1989-),男,安徽安庆人,硕士生,主要从事阻燃剂聚磷酸铵的微胶囊改性的研究。E-mail:1249356470@qq.com
纪利俊,E-mail:jilijun@ecust.edu.cn.
TQ331
A
