经导管三尖瓣介入治疗进展
2016-11-21王建铭陈锦铷2韩秀敏综述
王建铭陈锦铷,2韩秀敏综述
(1.沈阳军区总医院先心病内科, 辽宁沈阳110016;2.大连医科大学,辽宁大连116044)
经导管三尖瓣介入治疗进展
王建铭1陈锦铷1,2韩秀敏1综述
(1.沈阳军区总医院先心病内科, 辽宁沈阳110016;2.大连医科大学,辽宁大连116044)


三尖瓣病变中最常见的是三尖瓣反流,发生率较高,仅次于左心瓣膜病变[1]。通常认为其他瓣膜手术后,三尖瓣反流即可明显缓解,因此三尖瓣的相关病变长期被忽视。现有大量证据显示中重度三尖瓣反流在三尖瓣修复或置换术后需再次治疗,促使三尖瓣干预治疗的指征增多[2-3];但多数情况下三尖瓣的二次手术风险和病死率均较高。随着经导管治疗主动脉瓣和二尖瓣疾病的快速发展应用,微创介入治疗三尖瓣疾病也是非常具有吸引力和前景的技术。因此,现对三尖瓣及相关病变的介入治疗现状和发展前景进行综述。
1 背景
三尖瓣病变可以是狭窄或者是关闭不全。三尖瓣狭窄极其少见,多由风湿热或类癌综合征引起。最常见的三尖瓣病变是三尖瓣反流,常是继发性而不是原发性病变,由瓣环扩张或三尖瓣瓣叶因右室压及容量负荷增加而受到牵拉引起[4]。
三尖瓣反流严重影响着患者的预后。在一项5 200例患者5年的随访研究中显示,中重度三尖瓣反流与病死率升高密切相关[5]。中度三尖瓣反流在左心瓣膜手术后的长期随访中发生恶化,并与生存率下降密切相关[6]。最近研究显示,二尖瓣术后的中重度三尖瓣反流可致远期病死率增加4倍[7]。既往接受过左心瓣膜手术,由于二次手术固有的高风险,只处理严重三尖瓣功能性病变相当棘手。一项临床研究显示,82例左心手术后再次接受三尖瓣手术的患者中其病死率达15%[8]。
为纠正严重功能性三尖瓣反流的三尖瓣成形术常是有效的,可改善右室形态和功能,对改善病死率有益[9-10],而三尖瓣置换术通常受限于解剖上修复不完美匹配。指南上推荐宜放宽行左心瓣膜手术时同时行三尖瓣手术的指征。然而仍有一些患者在三尖瓣修复或置换术后出现远期的瓣膜衰败失效。三尖瓣成形术后5年内再次出现三尖瓣中重度反流达60%[11],10年内需要再次三尖瓣手术的患者约占20%[12]。生物瓣置换术后或瓣膜成形术后衰败失效而再次手术,特别是存在并发症的患者中其病死率较高,术后30 d内病死率可达35%[13]。
鉴于外科处理严重的三尖瓣反流或三尖瓣生物瓣术后衰败而二次手术治疗的风险收益比,因此需要探索更加微创、风险更小的治疗方式。随着经导管主动脉瓣植入及瓣中瓣技术的发展,以及二尖瓣介入微创治疗的有效性验证,术后即刻及中期随访效果良好,这些微创介入技术获得肯定与推广应用。目前三尖瓣的瓣中瓣及瓣环内经导管植入瓣膜技术代表着新的治疗技术方向。
2 三尖瓣再次衰败后的经导管介入治疗技术
最近报道了经导管三尖瓣植入术治疗生物瓣置换术后或瓣环成形术后的三尖瓣衰败病例。瓣中瓣技术与主动脉瓣或二尖瓣术式相似,而由于三尖瓣的解剖位置,瓣环内瓣膜植入具有挑战性。
2.1 三尖瓣生物瓣衰败后经导管瓣中瓣植入术
2.1.1 介入瓣膜尺寸的选择
手术的主要难点在于选择合适尺寸的介入瓣膜。对于经导管三尖瓣生物瓣膜植入术,与主动脉瓣或二尖瓣的瓣中瓣技术类似,尺寸的选择贯穿于整个手术过程,可参考介入瓣膜的人工内径和CT测量的平均直径、三维经食管超声心动图(transesophageal echocardiography,TEE)以及造影。尽可能使用上述三种方式进行尺寸选择的系统评价。根据国外的经验报道造影结果通常会高估三尖瓣直径,而TEE会低估直径大小[14]。
2.1.2 经导管三尖瓣植入术
经导管三尖瓣瓣膜植入的入路选择通常为经心房或经颈静脉[15-16]。经股静脉路径也是安全有效的[17],可避免胸部切口以及其并发症,适用于外科高危患者。经股静脉路径手术在全麻和TEE引导下进行。过三尖瓣后J型导丝置于右心室尖部;Edwards SAPIEN XT瓣膜(最近为SAPIEN 3 瓣膜)(Edwards Lifesciences, Irvine, CA, USA)在输送系统前段承载。快速心室起搏 (140~180次/min),通过在左心室或冠状窦部临时起搏,或在术前安置永久起搏器。应该避免生物支架瓣膜预扩张,防止瓣叶撕裂或栓塞。在导管室通过监测血流动力学、TEE或造影监测植入效果,出院前再行CT三维重建确认。
2.1.3 介入瓣膜的选择
经导管三尖瓣植入术治疗既往三尖瓣置换术后衰败的病例,目前主要应用两种介入瓣膜:Edwards SPIEN[14]或Melody(Medtronic, Minneapolis, MN, USA)[18]介入瓣膜(图1)。

A.Edwards SPIEN介入瓣膜; B. Melody介入瓣膜
最近报道的2008~2014年间16例应用Melody(n=7)或Edwards SPIEN介入瓣膜(n=9)[19]。在所有年轻患者中手术成功率为100%(平均年龄为31岁),大多数为先天性心脏病(14例),仅有2例是初次获得性三尖瓣功能不全。Melody或Edwards SPIEN介入瓣膜行经导管三尖瓣植入术均可取得良好的临床效果。然而Melody介入瓣膜可用尺寸较小(最大直径为22 mm),无法满足获得性瓣膜病变的成人患者。而三尖瓣置换术后衰败的生物瓣尺寸在25~31 mm,不适宜应用Melody介入瓣膜。此外,研究显示Melody介入瓣膜植入后可能增加感染性心内膜炎风险[20],需要更多的临床研究来验证。
2.2 三尖瓣瓣环成形术后的经导管三尖瓣植入术
前述的瓣中瓣技术同样适用于在瓣环中植入,但三尖瓣瓣环成形术后行经导管三尖瓣植入术具有特殊性。
2.2.1 三尖瓣瓣环测量
针对瓣环选择适合的介入瓣膜尺寸仍是难点,特别是瓣环常为非理想的圆形。应综合三种技术(CT、TEE和造影技术)来决定介入瓣膜的合适尺寸,其原则是选择最接近瓣环平均内径大小,避免过度或不足。此外,在手术开始阶段用球囊小心扩张原瓣环可能对准确测量植入瓣膜的尺寸有帮助。
2.2.2 手术方法
应用Edwards SPIEN介入瓣膜,入路采用经心房[21]和经股静脉[22]途径。最近报道了3例经股静脉应用Edwards SPIEN XT瓣膜经导管行瓣环内植入术的结果[14]。衰败瓣膜的瓣环尺寸在30~32 mm,可植入26 mm Edwards SPIEN XT介入瓣膜。其中1例患者术后即刻出现中到重度的残余漏,分析原因是原瓣环材料的坚硬特性(Carpentier-Edwards Classic Ring; EdwardsLifesciences, Irvine, CA, USA),植入瓣膜开放后在瓣环水平出现瓣周漏。另外一个患者术后出现轻度的瓣周漏,两者的发生位置类似。最近研究显示,一例21岁女性,将22 mm Melody瓣膜植入在瓣膜衰败的26 mm人工瓣环内,出现严重瓣周漏,应用AGA plug 2封堵瓣周漏获得成功,最后仅有轻度反流[23]。
经典的Carpentier-Edwards人工三尖瓣瓣环材料坚硬,塑形困难,其优点是可提供经皮瓣膜植入时的造影标识点和着陆点,但其缺点是着陆区为非圆形,经皮介入瓣膜无法完全封闭瓣环,且介入瓣膜在瓣环的短径内无法充分展开。因此经皮三尖瓣植入术在坚硬的瓣环内需小心操作。如果既往植入瓣环的质地不太坚硬或弹性良好,介入瓣膜在释放中易于操作而更具优势,瓣周漏更少,但是这种瓣环在三尖瓣成形术中应用较少。
经导管瓣中瓣或人工瓣环中三尖瓣植入技术适用于经团队评估后外科手术极高危,或存在手术禁忌的患者。迄今为止,世界范围内仅有少数患者接受了该技术治疗,经验有限,术后应严密随访,包括至少每年一次的TEE和CT扫描。
3 原始三尖瓣反流的微创介入治疗
3.1 原始三尖瓣反流的经导管三尖瓣植入术
Kefer等[24]报道了首例经导管三尖瓣植入在原始瓣膜中的应用。患者为47岁女性,既往因先天性心脏病行二尖瓣及主动脉瓣置换术和三尖瓣成形术(无人工瓣环植入),现为三尖瓣狭窄伴关闭不全。由于无坚硬的目标区域承载经皮介入瓣膜,也无造影标记物帮助三尖瓣植入。因此应用2个覆膜CP支架(NuMED, Hopkinton, NY, USA)来提供坚硬的着陆区域。介入手术在全麻、造影和三维TEE引导下进行,选用26 mm Edwards SPIEN介入瓣膜经股静脉途径植入。为预防血流动力学不稳定而采用体外循环辅助支持。第一个介入瓣膜因位置太低而致反流无法接受,植入第二个26 mm介入瓣膜后,最终效果良好无狭窄,仅有轻度的中央反流。5个月后随访显示临床效果良好,血流动力学稳定。该技术需要更大样本的临床研究来确认其安全性、可行性及耐久性。
3.2 下腔静脉处植入瓣膜治疗重度三尖瓣反流
在下腔静脉处经皮异位植入主动脉瓣来治疗难治性腹水和低位重度水肿的技术已有报道[25]。目的是减少肝肾系统的静脉压力,以及减轻因重度三尖瓣反流导致的负荷增加。短期结果显示该技术可减轻水肿,降低肝淤血程度及外周水肿。尽管这项姑息技术的长期随访结果仍需评估,但短期效果令人鼓舞。目前应用Edwards SAPIEN XT介入瓣膜行腔静脉植入的注册研究已经开展。
3.3 二瓣化技术的兴起与初步探索
Mitralign系统(Mitralign Inc., Tewksbury, MA, USA)设计初衷为治疗功能性二尖瓣反流,现在适用于治疗功能性三尖瓣反流。该系统模拟外科手术经颈静脉途径,植入垫片缝合修复技术使三尖瓣二瓣叶化 (图2)。最终结果是通过缝合垫片、折叠三尖瓣隔瓣瓣环来实现。该技术在一例89岁因三尖瓣反流导致反复失代偿性心力衰竭的女性患者中成功应用[26]。
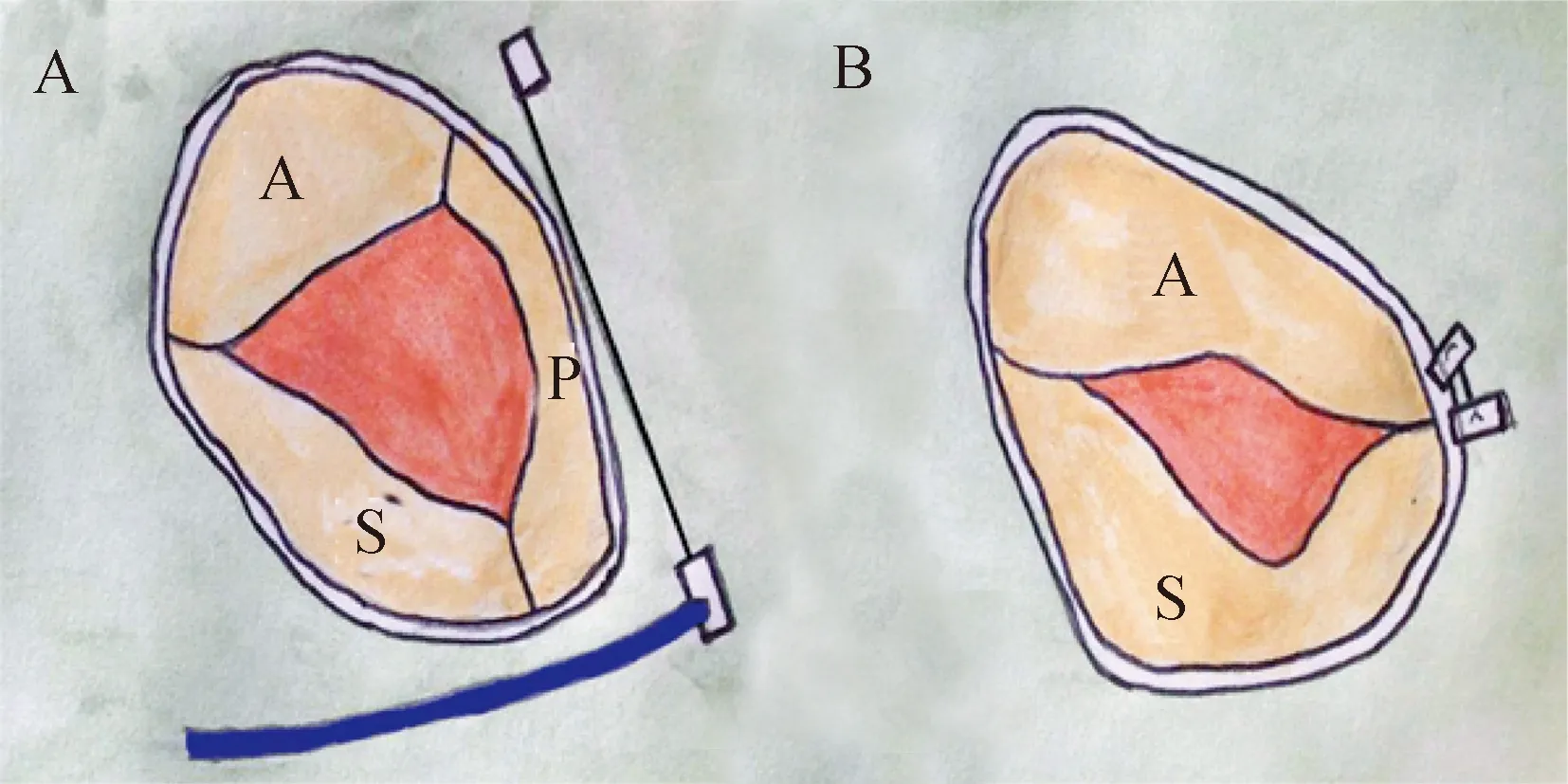
A.术前原位三尖瓣;B.纱布缝合修复后三尖瓣二瓣叶化
TriCinch系统 (4TECH CardioLtd, Galway, Ireland),也是使三尖瓣二瓣化的技术器械[27]。这种经皮器械装置的原理为在三尖瓣前后叶接合部安置不锈钢螺母重塑三尖瓣。螺母通过涤纶条带连接自扩张的镍钛合金支架,支架在下腔静脉内植入(图3)。将装置拉向下腔静脉,锚定后的螺母可缩小前后瓣环,张力由下腔静脉中的支架来维持。支架有多种尺寸可选(直径27~43 mm,长度66 mm),以确保大于下腔静脉肝段内径。

A.锚定部位至三尖瓣前后叶接合处;B.涤纶条带张力使三尖瓣二瓣化;C. 张力由下腔静脉中的支架来维持
图3 TriCinch系统应用示意图
经导管三尖瓣介入治疗严重功能性三尖瓣反流仍处于发展的初级阶段。至于有效性方面,虽然这些手术仅可使三尖瓣反流轻度减轻,但对于患者症状改善已足够。目前还有很多技术的问题尚未解决,需长期随访来评估这些装置的耐久性和长期有效性。广泛开展应用前需更多的病例来验证安全性和手术的可重复性。
4 展望
与二尖瓣治疗现状类似,三尖瓣的介入治疗技术是三尖瓣手术治疗的自然进步与延伸。目前鉴于三尖瓣二瓣化技术,更需要新技术来发展经皮介入治疗技术,如边对边修复或瓣环成形术(直接或间接),特别是致力于三尖瓣的解剖结构开展创新研究。
将MitraClip系统(AbbottVascular, Abbott Park, IL, USA)的三尖瓣病变治疗技术初次应用于矫正性大动脉转位[28]。该技术目前通过夹闭瓣叶进而降低右心三尖瓣功能性反流程度。然而在严重继发性三尖瓣反流患者中扩张的三尖瓣环可致瓣叶裂隙宽且接合错位,MitraClip系统能否解决问题值得商榷。最近,FORMA修复系统(Edwards Lifesciences, Irvine, CA, USA)的初次临床应用已报道,这项新技术旨在功能性三尖瓣反流患者保留瓣叶的接合。该装置是由垫片和输送轨道组成。垫片放置于反流孔道处,提供瓣叶接合表面,轨道将垫片输送至指定位置。至今该装置已在7例功能性三尖瓣反流患者中应用。应用该装置可使三尖瓣反流减少到轻到中度,尿量增加,水肿减轻,生活质量提高。尽管结果令人鼓舞但仍处于初级探索阶段。目前开展的注册临床研究Edwards经导管三尖瓣修复系统可行性研究,将决定这项技术的可行性、安全性及有效性。
其他三尖瓣介入治疗器械目前处于临床应用前试验阶段。Millipede系统(Millipede, LLC, Ann Arbor,Michigan, USA)通过接触装置经皮植入三尖瓣瓣环来保留自体三尖瓣瓣环的形状和直径。该装置在最终释放前可重新定位,输送系统也可以简化[29]。另一项新的经皮三尖瓣瓣环成形术应用经心房心包途径(TRAIPTA系统),前期动物实验显示三尖瓣瓣环直径明显减小[30]。
这些研究结果令人鼓舞,在人体应用前还要克服诸多挑战,如防止心包压塞以及冠状动脉压迫等。目前经导管三尖瓣介入治疗技术可以应用于既往有左心瓣膜手术史、再次外科手术风险高的患者。经皮介入治疗技术的终极目标是完全经皮三尖瓣置换,随着研究的不断深入与相关介入器材的创新发展,该技术必定会在未来占据举足轻重的治疗地位。
[1] Cohen SR, Sell JE, McIntosh CL, et al. Tricuspid regurgitation in patients with acquired, chronic, pure mitral regurgitation. II. Nonoperative management, tricuspid valve annuloplasty,and tricuspid valve replacement[J]. J Thorac Cardiovasc Surg, 1987,94(4):488-497.
[2] Vahanian A, Alfieri O, Andreotti F, et al. Guidelines on the management of valvular heart disease(version 2012):the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology(ESC) and the European Association for Cardio-Thoracic Surgery(EACTS)[J]. Eur J Cardiothorac Surg, 2012,42(4):S1-44.
[3] Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2014,129(23):e521-643.
[4] Ton-Nu TT, Levine RA, Handschumacher MD, et al. Geometric determinants of functional tricuspid regurgitation:insights from 3-dimensional echocardiography[J]. Circulation,2006,114(2):143-149.
[5] Topilsky Y, Nkomo VT, Vatury O, et al. Clinical outcome of isolated tricuspid regurgitation[J]. JACC Cardiovasc Imaging,2014,7(12):1185-1194.
[6] Song H, Kim MJ, Chung CH, et al. Factors associated with development of late significant tricuspid regurgitation after successful left-sided valve surgery[J]. Heart, 2009,95(11):931-936.
[7] Goldstone AB, Howard JL, Cohen JE, et al. Natural history of coexistent tricuspid regurgitation in patients with degenerative mitral valve disease:implications for future guidelines[J]. J Thorac Cardiovasc Surg,2014,148(6):2802-2809.
[8] Pfannmuller B, Moz M, Misfeld M, et al. Isolated tricuspid valve surgery in patients with previous cardiac surgery[J]. J Thorac Cardiovasc Surg, 2013,146(4):841-847.
[9] Tang GH, David TE, Singh SK,et al. Tricuspid valve repair with an annuloplasty ring results in improved long-term outcomes[J].Circulation,2006,114(1 Suppl):I577-581.
[10] van de Veire NR, Braun J, Delgado V, et al. Tricuspid annuloplasty prevents right ventricular dilatation and progression of tricuspid regurgitation in patients with tricuspid annular dilatation undergoing mitral valve repair[J]. J Thorac Cardiovasc Surg, 2011,141(6):1431-1439.
[11] Kim JB, Jung SH, Choo SJ, et al. Clinical and echocardiographic outcomes after surgery for severe isolated tricuspid regurgitation[J]. J Thorac Cardiovasc Surg, 2013,146(2):278-284.
[12] Guenther T, Noebauer C, Mazzitelli D, et al. Tricuspid valve surgery:a thirty-year assessment of early and late outcome[J]. Eur J Cardiothorac Surg, 2008,34(2):402-409.
[13] Bernal JM, Morales D, Revuelta C, et al. Reoperations after tricuspid valve repair[J]. J Thorac Cardiovasc Surg,2005,130(2):498-503.
[14] Bouleti C, Himbert D, Brochet E, et al. Transfemoral tricuspid valve-in-ring implantation using the Edwards Sapien XT valve:one-year follow-up[J]. Circ Cardiovasc Interv,2015,8(3). pii: e002225.
[15] Cheung A, Soon JL, Webb JG, et al. Transatrial transcatheter tricuspid valve-in-valve technique[J]. J Card Surg, 2012,27(2):196-198.
[16] Cullen MW, Cabalka AK, Alli OO, et al. Transvenous,antegrade Melody valve-in-valve implantation for bioprosthetic mitral and tricuspid valve dysfunction:a case series in children and adults[J]. JACC Cardiovasc Interv,2013,6(6):598-605.
[17] Calvert PA,Himbert D,Brochet E,et al. Transfemoral implantation of an Edwards SAPIEN valve in a tricuspid bioprosthesis without fluoroscopic landmarks[J]. EuroIntervention,2012,7(11):1336-1339.
[18] Roberts PA, Boudjemline Y, Cheatham JP, et al. Percutaneous tricuspid valve replacement in congenital and acquired heart disease[J]. J Am Coll Cardiol, 2011,58(2):117-122.
[19] Eicken A, Schubert S, Hager A, et al. Percutaneous tricuspid valve implantation:two-center experience with midterm results[J]. Circ Cardiovasc Interv, 2015,8(4). pii: e002155.
[20] Schneider H, Vogt M, Boekenkamp R, et al. Melody transcatheter valve:histopathology and clinical implications of nine explanted devices[J]. Int J Cardiol,2015,189:124-131.
[21] Mazzitelli D, Bleiziffer S, Noebauer C, et al. Transatrial antegrade approach for double mitral and tricuspid “valve-in-ring” implantation[J]. Ann Thorac Surg, 2013,95(1):e25-27.
[22] Fassa AA, Himbert D, Brochet E, et al. Transfemoral valve-in-ring implantation for a failing mitral homograft in the tricuspid position[J]. EuroIntervention,2014,10(2):269.
[23] Condado J, Leonardi R, Babaliaros V. Percutaneous tricuspid valve-In-ring replacement for the treatment of recurrent severe tricuspid regurgitation[J]. Catheter Cardiovasc Interv,2015,86(7):1294-1298.
[24] Kefer J,Sluysmans T,Vanoverschelde JL. Transcatheter Sapien valve implantation in a native tricuspid valve after failed surgical repair[J]. Catheter Cardiovasc Interv,2014,83(5):841-845.
[25] Lauten A, Ferrari M, Hekmat K, et al. Heterotopic transcatheter tricuspid valve implantation:first-in-man application of a novel approach to tricuspid regurgitation[J]. Eur Heart J,2011,32(10):1207-1213.
[26] Schofer J, Bijuklic K, Tiburtius C, et al. First-in-human transcatheter tricuspid valve repair in a patient with severely regurgitant tricuspid valve[J]. J Am Coll Cardiol,2015,65(12):1190-1195.
[27] Rogers JH. Functional tricuspid regurgitation:percutaneous therapies needed[J]. JACC Cardiovasc Interv,2015,8(3):492-494.
[28] Franzen O, von Samson P, Dodge-Khatami A, et al. Percutaneous edge-to-edge repair of tricuspid regurgitation in congenitally corrected transposition of the great arteries[J]. Congenit Heart Dis,2011,6(1):57-59.
[29] Ruiz CE, Kliger C, Perk G, et al. Transcatheter therapies for the treatment of valvular and paravalvular regurgitation in acquired and congenital valvular heart disease[J]. J Am Coll Cardiol,2015,66(2):169-183.
[30] Rogers T, Ratnayaka K, Sonmez M, et al. Transatrial intrapericardial tricuspid annuloplasty[J]. JACC Cardiovasc Interv,2015,8(3):483-491.
Development of Transcatheter Approach of Tricuspid Valve
WANG Jianming1,CHEN Jinru1,2,HAN Xiumin1
(1.DepartmentofCogenitalHeartDisease,GeneralHospitalofShenyangMilitaryRegion,Shenyang110016,Liaoning,China; 2.DalianMedicalUniversity,Dalian116044,Liaoning,China)


王建铭(1985—),主治医师,博士,主要从事结构性心脏病相关研究。Email:cyrusaaaa@163.com
韩秀敏(1966—),主任医师,博士,主要从事结构性心脏病及心力衰竭相关研究。Email:xiuminhan@126.com


2016-08-30
