雄性不育湿地松败育与SOD、POD活性及MDA含量的关系
2016-11-19唐国强杨章旗黄永利
唐国强 杨章旗 黄永利

摘要: 为研究湿地松(Pinus elliottii Engelm.)雄性败育与SOD、POD活性及MDA含量的关系,以南宁市林业科学研究所湿地松种子园中的雄性不育株和雄性可育株为试验材料,对其小孢子叶球和针叶的SOD、POD活性及MDA含量进行测定比较。结果表明,雄性不育株和可育株湿地松小孢子叶球SOD活性在整体上差异不明显。POD活性及MDA含量在同一时期不育株比可育株高,且差异明显。针叶SOD和POD活性雄性不育株比可育株低,POD活性差异很明显。针叶MDA含量雄性不育株和可育株差异不明显。在小孢子发育过程中,SOD、POD活性及MDA含量在多数采样时期雄性不育株小孢子叶球明显比针叶高,而可育株小孢子叶球均比针叶低。研究认为,小孢子叶球中较高的POD活性及MDA含量可能是引起湿地松雄性败育的重要生理原因。
关键词: 湿地松(Pinus elliottii Engelm.);雄性不育;小孢子叶球; 针叶
中图分类号:S791.246 文献标识码:A 文章编号:0439-8114(2016)04-0943-04
DOI:10.14088/j.cnki.issn0439-8114.2016.04.033
Relationships between SOD,POD Enzymes Activities,MDA Content
and the Abortion of Male Sterile Pinus elliottii
TANG Guo-qiang1,2,YANG Zhang-qi3,HUANG Yong-li2
(1.College of Forestry,Guangxi University,Nanning 530004,China;2.Nanning Forestry Science Institute,Wuming 530107,Guangxi,China;
3.Guangxi Zhuang Autonomous Region Forestry Research Institute,Nanning 530001,China)
Abstract: In order to clarify the relationships between SOD, POD activities, MDA content and male sterile Pinus elliottii Engelm., male sterile clones and male fertile clones in P. elliottii seed orchard of Nanning Forestry Science Institute were used as experimental material. SOD, POD activity and MDA content during male strobilus abortion were studied. The results were as follows, no significant difference was found in SOD activity of P. elliottii microstrobilus between male sterile clones and male fertile clones. The POD activity and MDA content of male sterile clones were higher than that of male fertile clones in the same periods; and the differences were significant. The SOD and POD activity in the needle of male sterile clones was lower than that of male fertile clones in the same periods. Moreover, the MDA content of P. elliottii needle did not differ statistically between male sterile clones and male fertile clones. In the process of microspore development, the SOD, POD activity and MDA content of male sterile clones was significantly higher than those in needle at most of periods; while SOD, POD of activity and MDA content in the microstrobilus of male fertile clones were lower than those in the needle. The research suggests that excessive POD activity and MDA content in microstrobilus might be the important physiological reasons for male sterility in P. elliottii.
Key words:Pinus elliottii Engelm.;male sterility;microstrobilus;needle
雄性不育在植物界中是一種常见现象,主要表现在有性繁殖过程中的花药、花粉粒或雄配子发育不正常而表现出的遗传现象[1]。早在1763年,Kolreuter就已经观察到植物雄性不育现象,据统计已经在43个科、162个属、320个种和297个种间杂种中发现了雄性不育现象[2];随着研究的不断深入,这个数目还在不断增加。湿地松(Pinus elliottii Engelm.)也存在雄性不育现象,其为雌雄同株异花植物,正常湿地松雌球花同枝下方着生雄球花。在松树杂交育种中,利用雄性不育材料可免除去雄等部分工作,同时雄性不育材料的应用可以避免自交,进一步提高种子品质,因此开展湿地松雄性不育的研究对今后湿地松雄性不育材料的应用及林木杂交育种有着极其重要的意义。
目前有关林木雄性不育机理的研究和应用相对较少,主要有杉木[3,4]、杨树[5,6]和一些小灌木如四合木[7]、大白刺[8]等,远落后于如水稻、玉米、小麦等农作物及一些草本植物雄性不育机理研究。现在农作物良种选育及制种方面,雄性不育材料已经广泛运用于杂交育种、轮回选择等过程中,并起着极其重要的作用。国内关于裸子植物雄性不育的报道主要有杉木[3,9],其他裸子植物未见有相关报道。近年在南宁市林业科学研究所湿地松种子园中发现一无性系,其小孢子叶球在其他小孢子叶球开始伸长生长时停止或减缓伸长生长,而且在其他正常无性系撒粉时小孢子叶开始干枯脱落,期间未有花粉撒出。经初步认定,其为雄性不育植株。为了解该雄性不育材料小孢子发育过程中小孢子败育的生理机制,选用该雄性不育株和可育株为试验材料,在小孢子发育的不同时期,测定小孢子叶球及针叶的超氧化物歧化酶(SOD)、过氧化物酶(POD)活性及丙二醛(MDA)含量变化,探讨湿地松雄性不育材料小孢子败育与SOD、POD活性及MDA含量的相关关系,现将结果报告如下。
1 材料与方法
1.1 材料
湿地松雄性不育株和可育株(对照)均为南宁市林业科学研究所湿地松种子园植株。树龄都为21年生。自小孢子叶球出现较为明显时(2013年12月12日)开始取材,到2014年2月6日结束。每株分东南西北4个方位每隔5~7 d混合取样一次,取小孢子叶球及其附近2~3层针叶,直到小孢子叶球干枯脱落。共取样11次。每次取下样品后立即放入冰壶带回室内,迅速分别处理后放入-80 ℃环境保存,备用。
1.2 方法
分别取湿地松雄性不育株及可育株每个取样时期的0.2 g左右的小孢子叶球和针叶材料于预冷的研钵中,加预冷的磷酸缓冲液在冰浴上研磨成匀浆,在4 ℃条件下10 000 r/min离心20 min,取上清液用于SOD及POD活性的测定。SOD活性测定采用NBT(氮蓝四唑)光化还原法,以抑制NBT光化还原的50%为一个酶活性单位,单位表述为U/g。POD活性测定采用愈创木酚法,以每分钟吸光度变化值表示酶活性的大小,单位表述为ΔA470/(g·min)。MDA含量测定采用TBA(硫代巴比妥酸)法[10]。各指标均以各时期混合均匀的小孢子叶球及其附近针叶为测定材料,每样品重复3次。所有试验数据均采用统计软件SPSS 21.0进行相应的分析处理。
2 结果与分析
2.1 小孢子叶球及其附近针叶SOD活性的动态变化
湿地松小孢子发育过程中小孢子叶球及附近针叶的SOD活性变化测定情况见图1。由图1可以看出,雄性不育株和可育株小孢子在發育过程中小孢子叶球的SOD活性波动较大,雄性不育株小孢子叶球SOD活性刚开始较高,最后较低,中间过程因波动有升有降,在2月4日小孢子叶球开始变干枯时SOD活性达到最低,干枯后回升。可育株小孢子叶球的SOD活性从刚开始起就下降,到12月31达到最低,之后回升,1月12日又开始下降,到雄球花开始撒粉时(2月初)SOD活性上升,花粉撒完后下降。11次采样有6个时期雄性不育株小孢子叶球SOD活性比可育株高。经分析表明,雄性不育株和可育株小孢子叶球SOD活性整体差异并不明显,但不同时期的差异很明显。在小孢子发育过程中,小孢子叶球附近针叶的SOD活性雄性不育株与可育株差异明显。除了1月12日外,雄性不育株小孢子附近针叶的SOD活性均比可育株的低,不过针叶的SOD活性在各个时期的变化并不明显。雄性不育株在11个采样时期有7个时期SOD活性小孢子叶球比针叶高,而可育株有9个时期小孢子叶球比针叶低。表明在小孢子发育过程中,SOD活性是雄性不育株小孢子叶球比针叶高,而可育株小孢子叶球比针叶低。
SOD是生物体内重要的保护酶之一,它的主要功能是催化超氧化物阴离子自由基·O2-发生歧化反应,生成H2O2和O2,从而清除·O2-,降低对细胞的损害。雄性不育株小孢子叶球中的SOD活性与可育株这些变化可能与其他酶及物质的相互调节有关。雄性不育株小孢子叶球SOD活性在小孢子叶即将干枯脱落时迅速降低,这可能与较高的POD活性及MDA含量有关。
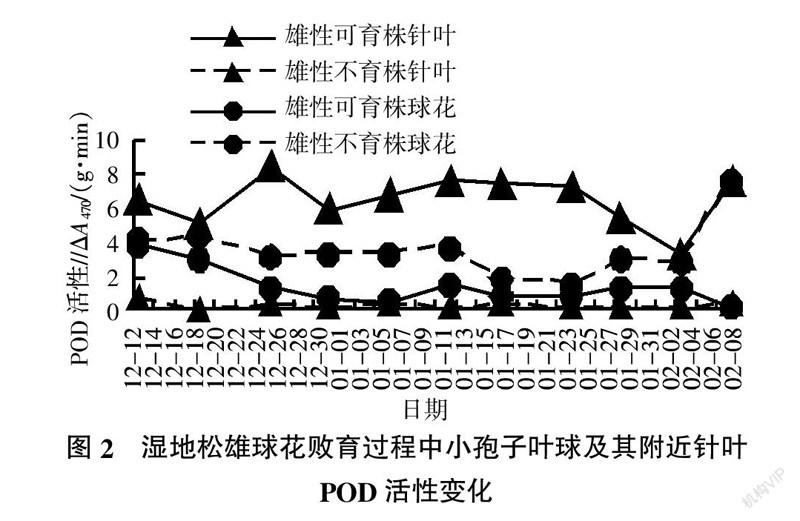
2.2 小孢子叶球及其附近针叶POD活性的动态变化
湿地松小孢子发育过程中小孢子叶球及附近针叶的POD活性变化测定情况见图2。由图2可见,雄性不育株和可育株在小孢子发育过程中小孢子叶球的POD活性差异很明显,雄性不育株小孢子叶球POD活性前期变动较小,后期下降后急速上升;可育株的POD活性前期急速下降,后期相对较为平稳,直到2月9日花粉撒完后急速下降;而不育株在小孢子叶球干枯后POD活性急剧上升;不育株与可育株小孢子叶球最初POD活性较为接近,随着可育株POD活性的下降,可育株和不育株的POD活性差异逐步拉大,如1月6日不育株小孢子叶球POD活性是可育株的7.80倍,到1月24日缩小为1.77倍。在可育株撒粉后,两者的POD活性差距达到最大,不育株为可育株的64.70倍。并且在同一时期内,不育株小孢子叶球的POD活性均比可育株高,这与前人的研究结果[11-14]基本是一致的,这说明湿地松雄性不育株小孢子叶球中活性氧维持在较高的水平,引起了膜脂过氧化,使其不能维持正常的生长发育,从而引起雄性败育。而小孢子叶球附近针叶的POD活性在小孢子发育的过程中雄性不育株远低于雄性可育株,这正好与小孢子叶球在各时期POD活性的含量变化相反。雄性不育株在小孢子发育的11个测定时期中,小孢子叶球附近针叶的POD活性均小于1ΔA470/(g·min),而雄性可育株小孢子附近针叶的POD活性最低为3.3ΔA470/(g·min),最高的达8.4ΔA470/(g·min),引起这一变化差异的原因还有待进一步研究。在取样的11个时期,雄性不育株小孢子叶球的POD活性均比针叶高,而雄性可育株小孢子叶球的POD活性均比针叶低。这个动态变化特点与SOD活性有类似的情况。
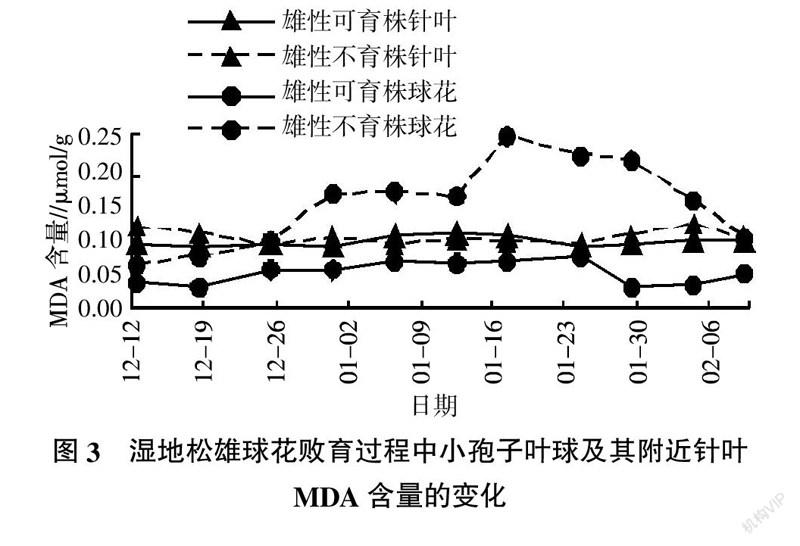
2.3 小孢子叶球及其附近针叶MDA含量的动态变化
湿地松小孢子发育过程中小孢子叶球及附近针叶MDA含量变化测定情况见图3。由图3可见,雄性不育株和可育株在小孢子发育过程中小孢子叶球的MDA含量两者差异很明显。其中不育株小孢子叶球的MDA含量变化较大,先降后升,到1月17日达到最大;可育株的小孢子叶球MDA含量变化较小,一直维持在较低水平,在1月29日小孢子叶球生长较快时MDA含量最小,开始撒粉时上升。雄性不育株小孢子叶球MDA含量在同一时期均比可育株的高,最高时可达可育株的7.10倍,最小也有1.65倍。小孢子叶球附近针叶MDA含量雄性不育株和可育株在各采样时期差异不明显。小孢子发育过程中的11次采样时期,雄性不育株MDA含量是小孢子叶球有9个时期比针叶的高,而雄性可育株MDA含量在各采样时期小孢子叶球均比针叶的低。MDA是自由基与细胞膜的不饱和脂肪酸发生过氧化或脱脂化降解的产物。其在植物体内积累是活性氧毒害的表现,因此其含量是判断植物脂质过氧化程度高低的重要指标。在氧化或脱脂降解过程中,膜通透性增加、离子外渗将影响细胞的正常生长和发育;已有研究证实植物中较高的MDA含量是植物雄性败育的重要生理原因之一[11,15-18]。
3 小结与讨论
目前,关于植物雄性不育机理的研究主要从细胞学、生理生化及育性基因等3个方面着手;雄性不育生理生化特性的研究目前主要是进行比较研究,而完全阐明雄性育性表达的生理生化过程的试验研究较少。SOD、POD是植物中活性氧清除系统重要的酶,在清除植物体内的自由基、维持自由基产生与清除系统的平衡起到重要的作用。关于植物雄性不育与保护酶活性变化及活性氧代谢的关系,前人分别在小麦[19]、葱[20]、不结球白菜[21]、辣椒[22]、油菜[18]等作物做过研究,表明活性氧代谢失调及保护酶活性异常是导致作物雄性不育的重要原因之一。但在涉及活性氧清除酶系统活性变化规律方面的试验结果并不一致,这说明不同植物、不同败育类型不育基因在败育过程中存在差异表达。MDA在植物体内积累一般认为是活性氧毒害的表现。试验里湿地松雄性不育株小孢子叶球在同一时期POD活性及MDA含量均比可育株高,差异非常明显。SOD活性虽然在7个时期不育株比可育株高,但总体差异不大;这可能因为较高的POD活性和MDA含量抑制了SOD活性的升高所致[23],SOD活性的变化可能与较高的POD活性及MDA含量相互作用有关。刘丽华等[12]对板栗雄性不育进行了比较,结果认为不育品种浮来无花在雄花序败育过程中POD活性高于可育品种大红袍。这与赵前程等[11]对花椰菜雄性不育系进行的研究结果类似,认为较高的POD活性引起雄性败育的原因一是POD活性增高将导致花药内源激素(IAA)的分解,影响营养物质的合成和运输;二是较高的POD活性可能促进了雄花序中乙烯的合成,进而导致雄花序的脱落。试验中湿地松雄性不育株小孢子叶球在同一时期POD活性及MDA含量均比可育株高,因此认为小孢子叶球中较高的POD活性及MDA含量是湿地松引起雄性败育的重要生理原因。
试验除了对湿地松小孢子叶球SOD、POD活性及MDA含量测定外,对小孢子附近的2~3层针叶也进行了类似的测定。结果表明,湿地松雄性不育株针叶SOD、POD活性均比可育株低,SOD活性总体差异明显,POD活性差异很明显,MDA含量差异不明显。湿地松雄性不育株针叶较低的SOD、POD活性可能与小孢子叶球活性氧代谢失衡有关。周仲华等[23]对棉花温敏雄性不育系败育不同部位的SOD、POD活性及MDA含量测定结果显示,棉花叶片在高温时期SOD活性及MDA含量雄性不育株均比可育株低,而POD活性则是雄性不育株比可育株高。目前关于雄性不育与雄性可育植株间雄性器官以外的组织生理生化的研究相对较少。本试验的结果表明,湿地松雄性不育株与可育株在小孢子发育过程中SOD、POD活性及MDA含量是不育株小孢子叶球比针叶高,可育株小孢子叶球比针叶低。这种活性氧清除系统的异常变化可能打破了叶与花的活性氧清除系统平衡,并进一步引起小孢子叶球脂膜过氧化,最终使小孢子败育。关于这些物质在败育过程中不同部位的变化及其相互作用关系还有待进一步系统的试验来证实。
参考文献:
[1] 李泽福,夏加发,唐光勇.植物雄性不育类型及其遗传机制的研究进展[J].安徽农业科学,2000,28(6):742-746.
[2] KAUL M L H. Male Sterility in Higher Plants[D]. New York: Springer-Verlag Press,1988.2-5.
[3] 李 平,余象煜,吕洪飞.杉木雄性不育株与可育株小孢子叶球的发育解剖和生理生化的比较研究[J].林業科学,1992(2):115-121.
[4] 何福基,钱领元,余象煜,等.杉木雄性不育植株的初步研究[J].浙江林学院学报,1989(1):105-106.
[5] 孟永红.毛白杨雄株花粉败育细胞学观察和双抗虫基因转化的研究[D].河北保定:河北农业大学,2004.
[6] 康向阳.毛白杨花粉败育机制的研究[J].林业科学,2001,37(3):35-39,145.
[7] 王迎春,征 荣,杨 持.四合木(Tetraena mongolica Maxim)雄性不育的细胞学研究[J].内蒙古大学学报(自然科学版),2000,31(1):88-92.
[8] 窦振东,燕 玲,赵淑文,等.大白刺雄性不育株超微结构和生理生化特性研究[J].干旱区资源与环境,2013,27(12):137-141.
[9] 吕洪飞,余象煜,李 平,等.杉木雄性不育株与可育株小孢子囊发育的电镜研究[J].武汉植物学研究,1997,15(2):97-102.
[10] 张治安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.
[11] 赵前程,耿 宵,陈雪平,等.花椰菜雄性不育系小孢子发育过程及其POD活性[J].华北农学报,2002,17(2):108-111.
[12] 刘丽华,李保国,齐国辉,等.雄性不育板栗雄花序败育与几种酶活性及MDA含量的关系[J].林业科学,2007,43(4):121-124.
[13] 胡美华,陈竹君,汪炳良.榨菜胞质雄性不育系及其保持系若干生化特性的比较[J].浙江农业大学学报,1998(1):59-60.
[14] 吕清璐,沈向群,汪 玉,等.美女樱雄性不育系与可育系花器官发育过程中生理生化指标的比较分析[J].江苏农业科学,2010(3):221-223.
[15] 陈贤丰,梁承邺.水稻不育花药中H2O2的积累与膜脂过氧化的加剧[J].植物生理学报,1991,17(1):44-48.
[16] 张明永,梁承邺,段 俊,等.CMS水稻不同器官的膜脂过氧化水平[J].作物学报,1997,23(5):603-606.
[17] 段 俊,梁承邺,张明永.玉米细胞质雄性不育性与膜脂过氧化的关系[J].植物生理学通讯,1996,32(5):331-334.
[18] 张明永,粱承邺,段 俊,等.油菜细胞质雄性不育系发育过程中活性氧的代谢[J].植物学报,1997,39(5):480-482.
[19] 赵会杰,劉华山,林学梧,等.小麦胞质不育系花粉败育与活性氧代谢关系的研究[J].作物学报,1996,22(3):365-367.
[20] 苗锦山,杨文才,李美芹,等.葱细胞质雄性不育与花蕾发育过程中活性氧代谢关系研究[J].华北农学报,2009,24(4):92-95.
[21] 袁建玉,侯喜林,李萍芳.不结球白菜胞质雄性不育新种质花蕾和叶片中活性氧代谢的变化[J].南京农业大学学报,2006, 29(1):18-22.
[22] 张子学,侯喜林.辣椒细胞质雄性不育与活性氧代谢的关系[J].西北植物学报,2005,25(4):799-802.
[23] 周仲华,朱四元,陈金湘.棉花温敏雄性不育与膜脂过氧化的关系研究[J].江西农业大学学报,2007,29(4):518-521.
