盐酸决奈达隆片仿制药与原研药的溶出度一致性评价
2016-11-19陈国华吴琼珠滕海堂郁婷婷中国药科大学药学院南京0009淮安市食品药品检验所江苏淮安300
赵 欣,陈国华,吴琼珠,滕海堂,郁婷婷(.中国药科大学药学院,南京 0009;.淮安市食品药品检验所,江苏淮安 300)
盐酸决奈达隆片仿制药与原研药的溶出度一致性评价
赵 欣1*,陈国华1#,吴琼珠1,滕海堂2,郁婷婷1(1.中国药科大学药学院,南京 210009;2.淮安市食品药品检验所,江苏淮安 223001)
目的:建立盐酸决奈达隆片的溶出度测定方法,并评价仿制药与原研药的质量一致性。方法:采用紫外-可见分光光度法,检测波长为288 nm。以磷酸盐缓冲液(pH4.5)、0.1 mol/L盐酸溶液[加入0.5%十二烷基硫酸钠(SDS)]、磷酸盐缓冲液(pH6.8,加入0.5%SDS)、水为溶出介质,溶出介质体积为1 000 ml,转速为75 r/min,分别考察盐酸决奈达隆片仿制药与原研药的溶出度,并通过计算相似因子(f2)来评价其溶出曲线的相似性。结果:盐酸决奈达隆检测质量浓度线性范围为2.147~25.764 μg/ml;精密度、稳定性、重复性试验的RSD<2.0%;4种溶出介质中的回收率分别为99.53%~101.05%(RSD=0.48%,n=9)、98.95%~100.05%(RSD=0.39%,n=9)、99.54%~100.20%(RSD=0.24%,n=9)、98.54%~100.06%(RSD=0.44%,n=9)。在4种溶出介质中,3批盐酸决奈达隆片仿制药与原研药溶出曲线的f2分别为56、60、63、68,68、52、59、67,65、68、76、62。结论:该方法适用于盐酸决奈达隆片的溶出度测定;盐酸决奈达隆片仿制药与原研药的体外溶出曲线具有相似性,故其质量一致性较好。
盐酸决奈达隆片;原研药;仿制药;溶出曲线;相似因子;多介质;一致性评价
盐酸决奈达隆(Dronedarone hydrochloride)是一种新型的抗心律失常药物,主要用于心房颤动、心房扑动、窦性心律、室性心律的治疗[1-2],由法国赛诺菲-安万特公司研制,并分别于2009年7月和12月获得美国食品与药品安全管理局(FDA)和欧洲药品评价局(EMEA)批准上市。其化学结构是苯并呋喃衍生物,与治疗房颤的胺碘酮药物相似,为钾离子通道阻滞药,但降低了其亲脂性还减小了碘源性的器官毒性[3-4]。
溶出度系指药物从片剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度[5],不仅是控制药物质量的体外指标,也是评价药物在体内释放和吸收的有效手段[6]。仿制药与原研药质量的差异主要体现在体外溶出度和体内生物等效性上,这两方面都直接关系药品的等效性[7]。目前国内发表的文献中,大多都是关于盐酸决奈达隆片在1种溶出介质中溶出曲线的测定及溶出方法的研究,美国药典(USP 39-NF 34)也只规定了其在磷酸盐缓冲液(pH4.5)中的溶出方法,而我国食品药品监督管理总局(CFDA)评价口服固体制剂内在质量需要考察多种pH溶出介质中的溶出曲线。因此,本文参照盐酸决奈达隆片USP标准,建立其溶出度测定方法,考察盐酸决奈达隆片在4种不同溶出介质中的溶出行为,并与原研药进行溶出曲线的对比,采用FDA推荐的相似因子(f2)对其进行相似性评价,为盐酸决奈达隆仿制药的质量一致性评价工作提供参考。
1 材料
1.1 仪器
UV-1800型紫外-可见分光光度计(日本Shimadzu公司);8453型紫外-可见分光光度计(美国Agilent公司);RC8MD型溶出试验仪(天津市天大天发科技有限公司);BT-1250D型电子天平(德国Sartorius公司)。
1.2 药品与试剂
盐酸决奈达隆片(中国药科大学药物制剂教研室自制,编号:S1、S2、S3,规格:400 mg/片);盐酸决奈达隆片原研药(法国Sanofi-Aventis公司,批号:GJ092,规格:400 mg/片);盐酸决奈达隆对照品(美国药典委员会,批号:F029Q0,纯度:99.4%);盐酸决奈达隆原料药(中国药科大学药物化学教研室自制,编号:150401,纯度:99.0%);其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取盐酸决奈达隆对照品约21.3 mg,置于50 ml量瓶中,加入1 ml甲醇使其溶解,分别用0.1 mol/L盐酸溶液(加入0.5%SDS)、磷酸盐缓冲液(pH4.5)、磷酸盐缓冲液(pH6.8,加入0.5%SDS)、水这4种溶出介质定容,摇匀,精密量取1 ml,置于20 ml量瓶中,用相应的溶出介质定容,摇匀,作为对照品溶液。
2.1.2 供试品溶液 取样品原研药(批号:GJ092)12片,取0.1 mol/L盐酸溶液(加入0.5%SDS)、磷酸盐缓冲液(pH4.5)、磷酸盐缓冲液(pH6.8,加入0.5%SDS)、水4种溶出介质各1 000 ml,按溶出度测定法[2015年版《中国药典》(四部)0931通则第二法(浆法)]进行溶出度试验,转速为75 r/min,温度为37.0℃,分别于10、15、20、30、45、60、90、120 min时取溶出液10 ml,并即时在溶出杯中补充37℃溶出介质10 ml,用0.45 μm微孔滤膜滤过,精密量取续滤液适量,用甲醇稀释20倍,摇匀,作为供试品溶液。
2.2 4种溶出介质的选择
目前,盐酸决奈达隆已被收入USP标准,其在USP标准中溶出度测定方法为浆法,75 r/min,标准溶出介质为1 000 ml的磷酸盐缓冲液(pH4.5)。本品规格为400 mg/片且为异形片,参考盐酸决奈达隆片USP标准和相关文献[6],故拟采用浆法和溶出体积1 000 ml进行溶出度试验。
由于盐酸决奈达隆为低溶解高渗透药物,属于BCSⅡ类,其解离常数(pKa)为9.8,为弱碱性药物,因此根据相关文献报道[6-8],推荐溶出介质为:0.1 mol/L盐酸溶液、磷酸盐缓冲液(pH6.8)、磷酸盐缓冲液(pH4.5)和水。在(37.0±0.5)℃下,用以上4种介质作为溶剂,制备盐酸决奈达隆饱和溶液,经适当稀释后,用紫外-可见分光光度法在288 nm波长处测定其吸光度,计算盐酸决奈达隆在4种介质中的溶解度,进而考察是否达到漏槽条件,结果见表1。取样品原研药(批号:GJ092)适量,分别采用上述4种溶出介质,依法测定,计算各时间点的累积溶出度并绘制溶出曲线,详见图1。
结合表1和图1可知,样品原研药在磷酸盐缓冲液(pH4.5)和水中具有较好的溶解度,均达到漏槽条件,可以直接作为与仿制药进行溶出比较的溶出介质,但在0.1 mol/L盐酸溶液和磷酸盐缓冲液(pH6.8)中溶出率很低,无法区分各制剂的质量,故需加入表面活性剂来提高溶出度。因此,首先筛选吐温80和十二烷基硫酸钠(SDS)来确定表面活性剂的种类,然后再进行表面活性剂用量的筛选。

表1 盐酸决奈达隆溶解度Tab 1 The solubility of Dronedarone hydrochloride

图1 样品原研药在不同溶出介质中的溶出曲线Fig 1 Dissolution curves of original preparation samples in different dissolution media
《普通口服固体制剂溶出曲线测定与比较指导原则》中规定表面活性剂浓度推荐在0.01%~1.0%(W/V)范围,故本试验选择中间浓度0.5%来筛选表面活性剂的种类。取样品原研药(批号:GJ092)适量,分别采用加入0.5%SDS和0.5%吐温80的0.1 mol/L盐酸溶液作为溶出介质,依法测定,计算各时间点的累积溶出度并绘制溶出曲线。另取加入0.5%SDS和0.5%吐温80的磷酸盐缓冲液(pH6.8)同法进行测定,详见图2。

图2 不同种类表面活性剂的溶出曲线A.0.1 mol/L盐酸溶液;B.磷酸盐缓冲液(pH6.8)Fig 2 Dissolution curves of different kinds of surfactantsA.0.1 mol/L Hydrochloric acid solution;B.Phosphate buffer solution(pH6.8)
由图2可知,样品原研药在加入表面活性剂SDS介质中的溶出速率明显高于加入吐温80的介质,而且吐温80为黏稠液体,不宜操作,加之易造成各样品间质量差异较大,故选择加入表面活性剂SDS。
表面活性剂SDS常规用量范围为0.01%~1.0%(W/V),故用量筛选从低浓度到高浓度依次递增。取样品(编号:S1)适量,分别采用0.01%、0.05%、0.1%、0.3%、0.5%、1.0%SDS的0.1 mol/L盐酸溶液和磷酸盐缓冲液(pH6.8)作为溶剂,进行溶解度测定,结果见表2。

表2 盐酸决奈达隆在不同浓度SDS介质中的溶解度(mg/ml)Tab 2 The solubility of dronedarone hydrochloride in the different concentration of SDS(mg/ml)
由表2可知,加入0.5%SDS和1.0%SDS的2种介质均达到了漏槽条件,但1.0%SDS比0.5%SDS溶液的黏度大,且由于表面活性剂用量越少越好,故最终选择加入0.5%SDS。
综上所述,样品的4种溶出介质为:0.1 mol/L盐酸溶液(加入0.5%SDS)、磷酸盐缓冲液(pH4.5)、磷酸盐缓冲液(pH6.8,加入0.5%SDS)和水。
2.3 线性关系考察
精密称取盐酸决奈达隆对照品(批号:F029Q0)适量,共4份,先用1 ml甲醇溶解,再分别用0.1 mol/L盐酸溶液(加入0.5%SDS)、磷酸盐缓冲液(pH4.5)、磷酸盐缓冲液(pH6.8,加入0.5%SDS)、水定容于50 ml量瓶中,制备质量浓度为0.426 mg/ml的对照品贮备液,然后精密移取上述贮备液0.1、0.2、0.4、0.6、0.8、1.0、1.2 ml,分别置于20 ml量瓶中,并用相应的溶出介质定容,摇匀,按紫外-可见分光光度法在288 nm波长处测定吸光度。以盐酸决奈达隆质量浓度(x,μg/ml)为横坐标、吸光度(y)为纵坐标进行线性回归,回归方程与线性范围见表3。

表3 回归方程与线性范围Tab 3 Regression equations and linear ranges
2.4 精密度试验
取“2.1.1”项下对照品溶液适量,按紫外-可见分光光度法在288 nm波长处重复测定6次。结果,盐酸决奈达隆吸光度的RSD分别为0.84%、0.36%、0.21%、0.62%(n=6),表明仪器精密度良好。
2.5 稳定性试验
取“2.1.2”项下4种介质中120 min时的供试品溶液适量,分别于室温下放置0、2、4、6、8 h时在288 nm波长处测定其吸光度。结果,盐酸决奈达隆吸光度的RSD分别为0.78%、0.82%、0.70%、0.91%(n=5),表明供试品溶液在4种介质中室温下8 h内稳定性良好。
2.6 重复性试验
取样品原研药(批号:GJ092)适量,按“2.1.2”项下方法制备供试品溶液,按紫外-可见分光光度法在288 nm波长处测定其吸光度。结果,盐酸决奈达隆吸光度的RSD分别为0.98%、0.59%、0.71%、0.81%(n=6),表明本方法重复性良好。
2.7 回收率试验
取样品原料药(编号:150401)约3.41、4.26、5.11 g(分别约为处方量的8、10、12倍),精密称定,分别置于3个研钵中,再分别加入空白辅料2.24 g(约为处方量的10倍),混匀;分别从3个研钵中精密称取细粉各3份,再分别置于50 ml量瓶中,按“2.1.2”项下方法制备供试品溶液,取上述供试品溶液适量,按紫外-可见分光光度法在288 nm波长处测定吸光度并计算回收率,结果见表4。

表4 回收率试验结果(n=9)Tab 4 Results of recovery tests(n=9)
2.8 溶出曲线的绘制
取3批样品(编号:S1、S2、S3)和1批原研药(批号:GJ092)各12片,取“2.2”项下4种溶出介质适量,分别按“2.1.2”项下方法制备供试品溶液[磷酸盐缓冲液(pH6.8,加入0.5%SDS)中,取样时间点延长至360 min];取上述供试品溶液和“2.1.1”项下对照品溶液各适量,按紫外-可见光分光光度法在288 nm波长下分别测定吸光度并计算各时间点的累积溶出度,绘制溶出曲线,详见图3。
2.9 溶出曲线相似性评价
以美国和日本规定采用的f2法来评价仿制药与原研药体外溶出曲线的相似性,以考察制剂其内在质量的差异。f2计算公式如下:

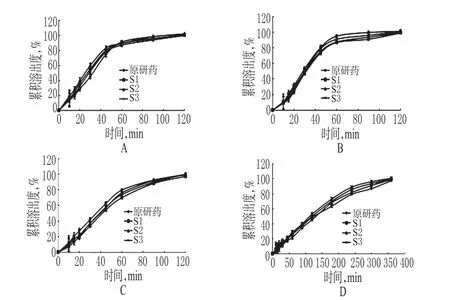
图3 盐酸决奈达隆仿制药与原研药在4种溶出介质中的溶出曲线A.磷酸盐缓冲液(pH4.5);B.水;C.0.1 mol/L盐酸溶液(加入0.5% SDS);D.磷酸盐缓冲液(pH6.8,加入0.5%SDS)Fig 3 Dissolution curves of generic and original preparations of Dronedarone hydrochloride tablet in 4 dissolution mediaA.Phosphate buffer solution(pH4.5);B.water;C.0.1 mol/L Hydrochloric acid solution(adding into 0.5%SDS);D.Phosphate buffer solution(pH6.8,adding into 0.5%SDS)
其中,n为取样时间点个数;Rt为原研药在t时刻的溶出度值;Tt为仿制药在t时刻的溶出度值;f2取值在1~100之间。f2值计算规定,原研药和仿制药在15 min内溶出达到85%时,不用再计算f2值,可直接认为两种制剂溶出行为相似。一般情况下,f2≥50时,可认为两条曲线具有相似性,仿制药与原研药具有等效性[9]。仿制药与原研药在不同溶出介质中的溶出曲线f2测定结果见表5。由表5可知,样品仿制药与原研药在4种溶出介质中的溶出行为相似。
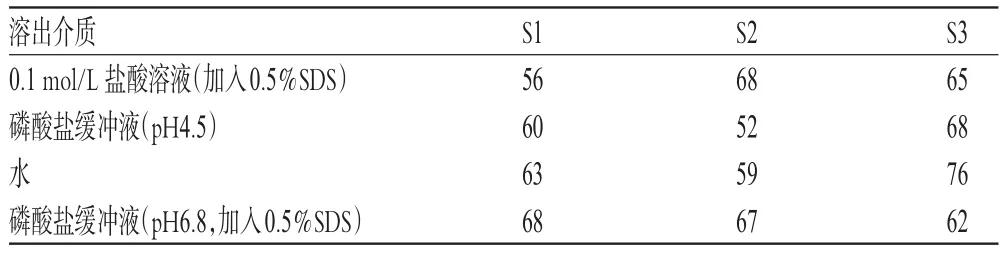
表5 4种溶出介质下的f2相似因子Tab 5 The f2factors in 4 dissolution media
3 讨论
3.1 波长的选择
盐酸决奈达隆在溶出介质中的最大紫外吸收分别为210 nm和288 nm波长,由于在288 nm波长处辅料无吸收,干扰小,因此本试验选择288 nm作为溶出度检测波长。
3.2 转速的选择
浆法常用的转速为50、75 r/min[10]。为了确定最佳转速,本试验需对比盐酸决奈达隆片在这两种转速条件下的溶出曲线。结果表明,在两种转速条件下盐酸决奈达隆片的溶出行为基本一致,而在75 r/min条件下,样品的溶出速率高于50 r/min条件下的溶出速率;且同时参考盐酸决奈达隆片USP标准中溶出度测定方法,故本试验溶出度试验的转速选择75 r/min。
3.3 仿制药与原研药的质量一致性
在多种pH溶出介质中溶出曲线的测定是先进国家药物审评机构评价口服固体制剂内在质量的一种重要手段[6],我国也于2012年开始实施“仿制药质量一致性评价”工程[11]。考察多种溶出介质条件下溶出行为,可以更全面、真实反映药物的体外释药情况和内在质量[12]。本试验以3个编号的盐酸决奈达隆片仿制药与1个批号的原研药分别在4种溶出介质中进行溶出度试验并绘制溶出曲线。结果发现,两种制剂在4种溶出介质中的溶出曲线均具有相似性,说明盐酸决奈达隆片仿制药与原研药质量一致性较好。
3.4 表面活性剂的筛选
通过溶解度试验和盐酸决奈达隆原研药在4种溶出介质中溶出曲线的测定,可知盐酸决奈达隆在0.1 mol/L盐酸溶液、磷酸盐缓冲液(pH6.8)的溶解性不好,需通过加入表面活性剂改善其溶解性。本试验先筛选表面活性剂的种类,确定使用SDS;再筛选SDS的用量,最终确定分别在0.1 mol/L盐酸溶液、磷酸盐缓冲液(pH6.8)中加入0.5%SDS,由此可提高盐酸决奈达隆在这两种介质中的溶解度,使之溶出曲线具有可比性。另外,在pH6.8的磷酸盐介质中,加入0.5%SDS后,2 h的溶出率仍低于50%,溶出曲线无区分度,结合现有文献报道[13],故本试验将取样时间点延长至360 min,使溶出曲线能更好的区分。因此,本试验选择0.5%SDS为表面活性剂。
综上所述,本方法适用于盐酸决奈达隆片的溶出度测定;盐酸决奈达隆片仿制药与原研药的体外溶出曲线具有相似性,故其质量一致性较好。
[1]李峰,田拴红,宋晓峰,等.盐酸决奈达隆合成新工艺[J].高等学校化学学报,2013,34(4):858.
[2]邓万俊.治疗心房颤动新药决奈达隆[J].中国新药与临床杂志,2010,29(1):5.
[3]贺鹏康,周菁.抗心律失常新药决奈达隆[J].临床药物治疗杂志,2010,8(2):58.
[4]孟祥业,金仲品.决奈达隆的药动学及临床研究概况[J].当代医学,2010,16(33):32.
[5]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:121.
[6]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946.
[7]夏锦辉,刘昌孝.固体药物制剂的体外溶出度的统计学评价分析[J].中国药学杂志,2000,35(2):130.
[8]谢沐风.如何科学、客观地制订溶出度试验质量标准[J].中国医药工业杂志,2012,43(3):243.
[9]张艳侠,袁转梅,陈育育.阿利苯多片溶出度方法的建立及溶出曲线的比较[J].西北药学杂志,2014(5):508.
[10]王亚敏.浅谈溶出度检查方法的研究[J].药物分析杂志,2007(10):1 667.
[11]孙婷,姜建国,宋更申,等.国内外不同厂家马来酸依那普利片在4种溶出介质中溶出曲线的比较[J].中国药房,2014,25(32):3 053.
[12]陈加飞,王平,赵昕,等.国产与原研洛索洛芬钠片的体外溶出曲线一致性的比较[J].国际检验医学杂志,2015,36(2):198.
[13]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308.
(编辑:刘 柳)
Consistency Evaluation of the Dissolution of Generic and Original Preparations of Dronedarone Hydrochloride Tablet
ZHAO Xin1,CHEN Guohua1,WU Qiongzhu1,TENG Haitang2,YU Tingting1(1.School of Pharmacy,China Pharmaceutical University,Nanjing 210009,China;2.Huaian Institute for Food and Drug Control,Jiangsu Huaian 223001,China)
OBJECTIVE:To establish a method for the dissolution determination of Dronedarone hydrochloride tablet,and evaluate the quality consistency of its generic and original preparations.METHODS:UV spectrometry was performed on the column of 288 nm,dissolution media of Phosphate buffer solution(pH4.5),0.1 mol/L Hydrochloric acid solution[adding into 0.5%sodium dodecyl sulfate(SDS)],Phosphate buffer solution[pH6.8,adding into 0.5%SDS]and water,volume of dissolution medium was 1 000 ml,rotation speed was 75 r/min,the dissolution of generic and original preparations of Dronedarone hydrochloride tablet was detected,and the similarity of dissolution curve was evaluated by calculating the similarity factor(f2).RESULTS:The linear range of dronedarone hydrochloride was 2.147-25.764 μg/ml;RSDs of precision,stability and reproducibility tests were lower than 2.0%;recoveries 4 dissolution media were 99.53%-101.05%(RSD=0.48%,n=9),98.95%-100.05%(RSD=0.39%,n=9),99.54%-100.20%(RSD=0.24%,n=9)and 98.54%-100.06%(RSD=0.44%,n=9).In the 4 dissolution media,f2of the dissolution curve of 3 batches of generic and original preparations of Dronedarone hydrochloride tablet was 56,60,63,68,68,52,59,67,65,68,76,62,respectively.CONCLUSIONS:The method is suitable for the dissolution determination of Dronedarone hydrochloride tablet;meanwhile,the in vitro dissolution curves of generic and original preparations of Dronedarone hydrochloride tablet show similarity,so the quality consistency is good.
Dronedarone hydrochloride tablet;Original preparation;Generic preparation;Dissolution curve;Similarity factor;Various media;Consistency evaluation
R927
A
1001-0408(2016)30-4278-04
2016-03-09
2016-07-16)
*硕士研究生。研究方向:工业药学。E-mail:814998462@qq. com
#通信作者:副研究员,博士,硕士生导师。研究方向:新药开发。E-mail:cgh63@163.com
DOI 10.6039/j.issn.1001-0408.2016.30.33
