纳米银与富里酸对AL细胞增殖及产生RNS/ROS的影响
2016-11-18王子茹徐升敏吴李君
王子茹,徐升敏,吴李君*
(1.中国科学技术大学 环境科学与光电技术学院,安徽 合肥 230026;2.中国科学院 合肥物质科学研究院 环境毒理与污染控制技术安徽省重点实验室,安徽 合肥 230031)
纳米银与富里酸对AL细胞增殖及产生RNS/ROS的影响
王子茹1,2,徐升敏2,吴李君1,2*
(1.中国科学技术大学 环境科学与光电技术学院,安徽 合肥 230026;2.中国科学院 合肥物质科学研究院 环境毒理与污染控制技术安徽省重点实验室,安徽 合肥 230031)
利用ALamar Blue法和RNS/ROS荧光特异性探针,探讨不同浓度纳米银(nAg,0.1~5 μg·mL-1)、银离子(Ag+,0.01~0.5 μg·mL-1)及纳米银与富里酸(FA,10 μg·mL-1)协同作用对人鼠杂交瘤(AL)细胞增殖及活性氮/活性氧自由基产生的影响及在这一过程中的作用.结果显示:在低浓度(小于等于1 μg·mL-1)情况下,nAg对AL细胞的毒性作用主要来自于nAg释放的银离子(Ag+),Ag+通过诱导胞内RNS的产生,进而产生增殖抑制作用;在高浓度(5 μg·mL-1)情况下,nAg对AL细胞的毒性主要来自于Ag+诱导的RNS和nAg本身诱导的ROS二者共同的作用.模拟水环境中存在的FA(10 μg·mL-1)能够显著降低nAg和Ag+对AL细胞增殖的抑制作用,并且能显著降低nAg和Ag+引起的AL细胞内RNS和ROS的升高作用.
纳米银;富里酸;自由基;增殖抑制
因为突出的抗菌作用,纳米银(silver nanoparticles,简称nAg)被广泛应用于医疗、水质处理、空气净化等生产及生活的各个方面.nAg的大量使用将不可避免地导致其进入水环境并扩散,对环境及人类健康产生潜在的危害,因此nAg的安全性评估也受到人们的广泛关注.细胞实验为评价nAg细胞毒性提供了有力手段,目前的研究发现nAg可以引起细胞毒性和基因毒性等在内的各种毒性效应[1-5].如nAg对MCF-7细胞可以产生细胞毒性[1].报道还显示小粒径的nAg与大粒径的nAg相比更容易改变细胞的新陈代谢等[4].同时,研究发现纳米银对不同的细胞毒性存在差异,如通过研究发现纳米银对HepG2比对L02细胞活性影响更大[5].此外,nAg进入水环境中会释放出银离子(Ag+)[4],由于Ag+也能产生生物学作用,nAg的生物毒性是来源于其本身还是其释放的Ag+引起的有待进一步研究.nAg对不同细胞产生的毒性效应是有差别的.中国仓鼠卵巢细胞(CHO)与人成纤维细胞构建的杂交瘤AL细胞已被用于辐射等多种环境因素的细胞和遗传毒性的检测,该检测系统相比于其他体系更加灵敏[6-7].因此,笔者利用杂交瘤AL细胞来探讨不同浓度的nAg的细胞毒性.
富里酸(fulvic acid,简称FA)普遍存在于水环境中,由于其具有多种功能性基团[8],这些基团可能与金属离子和纳米材料相互作用.这些相互作用可能会改变纳米材料的环境行为,也可能影响纳米材料的生物毒性.因此,FA可能会对水环境nAg产生作用,进而引起nAg生物毒性的改变.所以这种作用对nAg生物毒性影响的研究对实际评价nAg在环境中的毒性效应是十分必要的.
自由基主要有活性氧自由基(reactive oxygen species,简称ROS)及活性氮自由基(reactive nitrogen species,简称RNS)[9].研究发现,自由基可以显著影响细胞活力水平,因此被作为一个重要的指标来间接反映细胞受影响的程度[10].在外源物质的刺激下,能使细胞产生氧化应激反应,使细胞内高活性分子如ROS及RNS产生过多,从而改变线粒体功能,使脂质和DNA产生氧化损伤,进而引起细胞凋亡[11].
因此,笔者拟对nAg、FA与nAg的协同作用对AL细胞增殖和RNS/ROS产生的影响进行研究,并以nAg在培养基中释放约有浓度为10%的Ag+量到溶液中作为nAg的实验对照,探讨自由基在nAg诱导AL细胞毒性中的作用,为进一步研究nAg毒理学安全性评价提供参考依据.
1 实验材料与方法
1.1 实验材料
nAg(货号576832-5G,小于100 nm)、硝酸银、甘氨酸、ALamar Blue试剂等购自sigma公司.FA(货号 479-66-3)购自上海将来实业股份有限公司.F12培养基、胎牛血清购自Hyclone公司.庆大霉素购自江苏涟水制药有限公司.RNS的荧光探针由中国科学院合肥物质科学研究院王素华教授馈赠,使用方法参考文献[12].
1.2 实验仪器
酶标仪(SpectraMax M2)、荧光显微镜(OLYMPUS IX71)、高功率数控超声波清洗器(昆山市超声仪器有限公司)、细胞计数板(Bright-LineTMHemacytometer)、CK2倒置光学显微镜(Olympus 公司)、艾科浦超纯水系统(美国Aquapro公司)、低温高速离心机(MR1822,Jouan,France)、电感耦合等离子体-质谱仪(ICP-MS)(Agilent 7500CE).
1.3 实验方法
1.3.1 钠米银(nAg)、硝酸银溶液以及FA与nAg复合体系的制备
nAg溶于无菌超纯水中配制成1 mg·mL-1的储备液,低温超声 30 min 后,储备液于4 ℃保存备用,使用前储备液低温超声振荡10 min,用含 8% 胎牛血清的F12培养液稀释至实验所需浓度,混匀后使用.硝酸银(即Ag+)溶于无菌超纯水中配制成1 mg·mL-1的储备液,储备液于4 ℃保存备用,用含8%胎牛血清的F12培养液稀释至实验所需浓度,混匀后使用.FA溶于无菌超纯水中配制成1 mg·mL-1的储备液,储备液于4 ℃保存备用,使用前在实验所需的不同浓度的nAg溶液中加入终浓度为10 μg·mL-1FA即得FA与nAg复合体系,混匀后使用[13].
1.3.2 纳米银溶液中释放的银离子测定
将暴露在培养基24 h的nAg溶液从96孔板收集后加入超滤管中,50 000 r·min-1的超速离心机离心1 h分离出nAg溶液中的Ag+溶液,随后将过滤液用10%的硝酸酸化后用电感耦合等离子体-质谱仪(ICP-MS)测定溶液中的Ag+浓度.
1.3.3 细胞的培养
人鼠杂交瘤AL细胞(由哥伦比亚大学Tom K.Hei 教授馈赠)培养在含有8%胎牛血清、2×10-4M甘氨酸和25 μg·mL-1庆大霉素的F12完全培养液中.细胞培养温度为37 ℃,CO2浓度为5%常规传代培养.
1.3.4 ALamar Blue分析
取对数生长期的细胞,调整细胞密度为1× 105cell·mL-1,接种于96孔板,培养过夜后吸去原培养液,分别加入0(对照),0.1,0.5,1,5 μg·mL-1的nAg溶液和0(对照),0.01,0.05,0.1,0.5 μg·mL-1Ag+溶液以及0(对照),FA(对照),0.1,0.5,1,5 μg·mL-1的 FA与nAg的复合溶液,每组设定3个复孔,染毒24 h后,用PBS洗涤3次,加入含10% ALamar Blue溶液的细胞培养液,继续培养2 h后终止培养,采用酶标仪测定荧光强度(激发波长550 nm,发射波长590 nm),此Alamar Blue法测定的荧光强度与活性细胞数成正比[14],得到实验组和只有培养液的空白对照值,按以下公式计算细胞存活率

1.3.5 RNS的检测
取对数生长期的细胞,调整细胞密度为1× 105cells·mL-1,接种于96孔板,培养过夜后吸去原培养液,分别加入0(对照),0.1,0.5、1,5 μg·mL-1的nAg溶液和0(对照),0.01,0.05,0.1,0.5 μg·mL-1Ag+溶液以及0(对照),FA(对照),0.1,0.5,1,5 μg·mL-1包含10 μg·mL-1FA与nAg的复合溶液,每组设定3个复孔,染毒24 h后,用PBS洗涤3次,加入含6 μM probe-DOTAP(方法参考文献[11])溶液的细胞培养液,继续培养5 h后终止培养,PBS洗涤3次,采用荧光显微镜绿光激发,观察RNS成像,用Image J图片分析软件分析RNS荧光强度[15].
1.3.6 ROS的检测
取对数生长期的细胞,调整细胞密度为1× 105cells·mL-1,接种于96孔板,培养过夜后吸去原培养液,分别加入0(对照),0.1,0.5,1,5 μg·mL-1的nAg溶液和0(对照),0.01,0.05,0.1,0.5 μg·mL-1Ag+溶液以及0(对照),FA(对照),0.1,0.5,1,5 μg·mL-1包含10 μg·mL-1FA与nAg的复合溶液,每组设定3个复孔,染毒24 h后,用D-Hanks液洗3次,每孔加入含20 μM DCFH-DA的无胎牛血清F12培养液50 μL,继续培养2 h后,用D-Hanks液(含1% FBS)洗3次,采用酶标仪测定荧光强度(激发波长488 nm,发射波长525 nm).按以下公式计算细胞相对荧光强度

1.4 数据分析
所有样品均设置3个平行重复,RNS荧光图片应用Image J软件进行分析,数据采用Origin 8.0软件分析并进行绘图.数据以平均数±标准差来表示,用方差分析法对数据进行组间差异显著性比较,P<0.05表示差异具有显著性统计学意义,*代表与对照组比较的显著性差异(*P<0.05),#代表nAg与Ag+组比较的显著性差异(#P<0.05).
2 结果与分析
2.1 nAg溶液中释放出的Ag+浓度
培养基中分别加入0(对照),0.1,0.5,1,5 μg·mL-1的nAg溶液,暴露24 h,收集离心后,用电感耦合等离子体-质谱仪(ICP-MS)进行测定.0(对照),0.1,0.5,1,5 μg·mL-1的nAg溶液释放的Ag+的平均浓度为6×10-6,0.009 6,0.047,0.095,0.46 μg·mL-1.这表明实验中使用的nAg在培养液中暴露24 h约有浓度为9.4%的Ag+量的释放.因此,以nAg释放出约10% Ag+的相同浓度硝酸银溶液作为nAg的对照实验进行研究(表1).

表1 nAg在培养基中释放的Ag+浓度及释放的Ag+占原nAg百分比
2.2 nAg和Ag+对AL细胞毒性的影响
ALamar Blue分析结果表明,nAg处理AL细胞24 h,随着染毒浓度的升高,AL细胞的存活率呈下降趋势,即对AL毒性随nAg浓度的升高增强.与对照组相比,染毒浓度0.1 μg·mL-1nAg 处理对AL细胞增殖影响不大,0.5,1 μg·mL-1nAg处理AL细胞可以使细胞相对活力下降至89%,81%,而5 μg·mL-1nAg处理使细胞活力下降至36%,其抑制作用远大于0.5,1 μg·mL-1nAg的影响(图1).研究还发现,0.5,1 μg·mL-1的nAg对细胞增殖的抑制作用与0.05,0.1 μg·mL-1Ag+对细胞增殖的抑制作用相当,而5 μg·mL-1nAg的细胞增殖的抑制作用远大于0.5 μg·mL-1Ag+.0.05 μg·mL-1及以上剂量 Ag+处理AL细胞24 h后,细胞的存活率显著降低(图1).
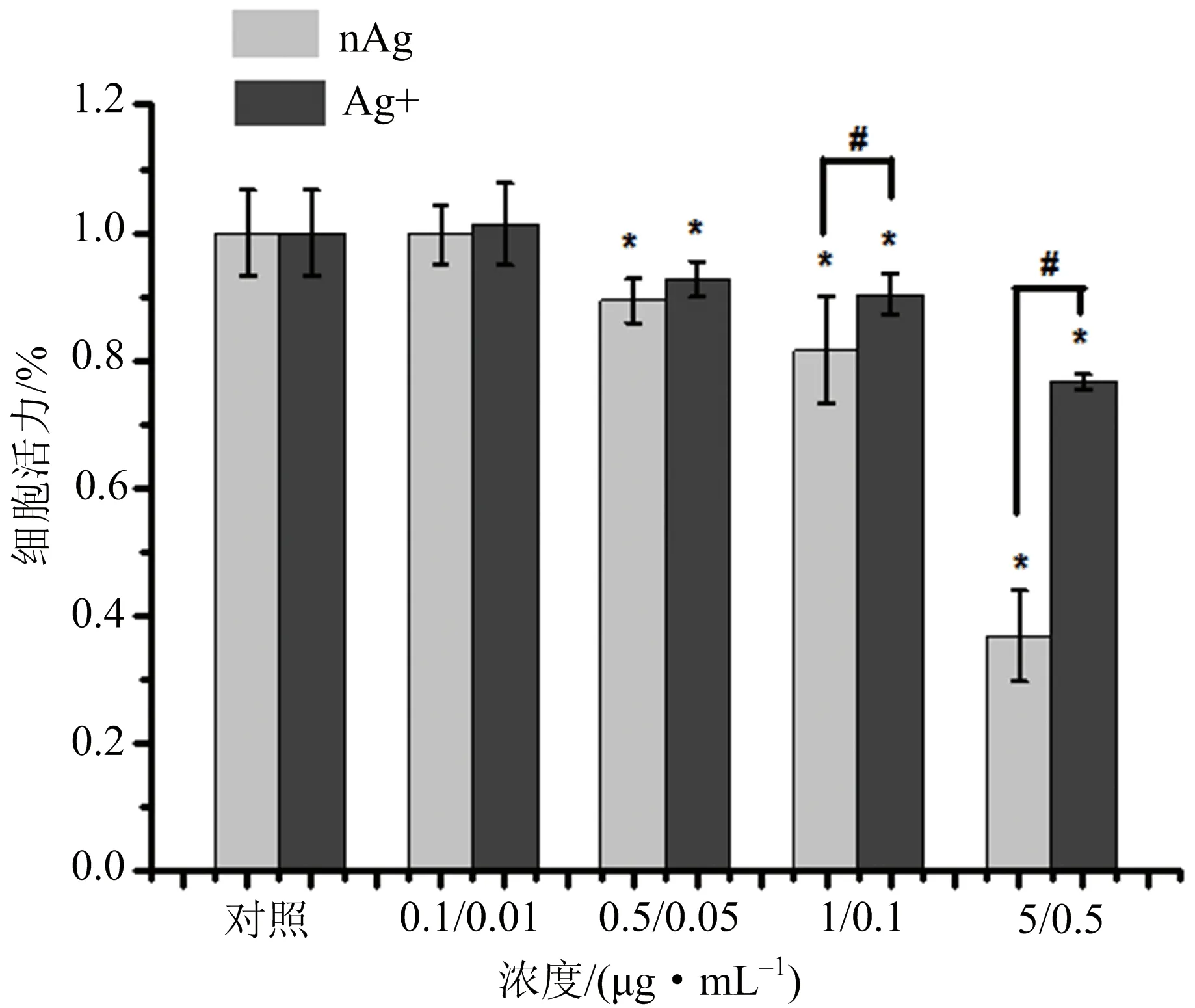
图1 nAg和Ag+对AL细胞活力的影响Fig.1 Effect of nAg and Ag+ on viability of AL cells
2.3 nAg和Ag+对AL细胞产生RNS/ROS的影响
根据nAg和Ag+对AL细胞毒性的影响,进一步检测其对AL细胞RNS的影响.荧光显微镜观察的结果经Image J分析显示,染毒浓度为0,0.1,0.5,1,5 μg·mL-1nAg处理AL细胞24 h后,各剂量nAg暴露组AL细胞的RNS相对荧光强度均较高.其中,与对照组相比,0.1,0.5,1,5 μg·mL-1nAg处理AL细胞24 h后,各剂量nAg暴露组AL细胞的RNS相对荧光强度增加了29%,30%,41%,72%(图2).0,0.01,0.05,0.1,0.5 μg·mL-1Ag+处理AL细胞24 h后,各剂量Ag+暴露组AL细胞的RNS相对荧光强度也均有显著性提升.并且nAg产生的胞内RNS与其10%浓度相对应的Ag+导致的细胞RNS荧光强度增加相当(图2A).
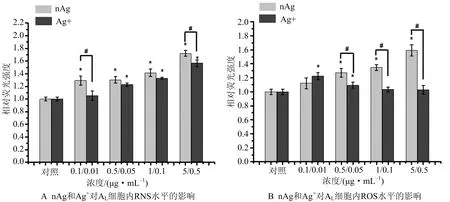
图2 nAg和Ag+对AL细胞内RNS/ROS水平的影响 Fig.2 Effect of nAg and Ag+ on RNS/ROS production in AL cells
此外,ROS荧光检测结果显示,染毒浓度为0,0.1,0.5,1,5 μg·mL-1nAg处理AL细胞24 h后,各剂量nAg暴露组AL细胞相对荧光强度均升高.与对照组相比,0.1,0.5,1,5 μg·mL-1nAg处理AL细胞24 h后,各剂量nAg暴露组AL细胞的RNS相对荧光强度分别增加了12%,27%,35%,59%(图2A).而Ag+处理AL细胞24 h后,与对照组相比,0.01,0.05 μg·mL-1Ag+能够显著诱导胞内ROS的增加,0.1,0.5 μg·mL-1Ag+对ROS水平没有影响.其中,0.01,0.05 μg·mL-1Ag+处理AL细胞24 h后,AL细胞的RNS相对荧光强度增加了22%,9%(图2B).
2.4 FA与nAg的协同作用对细胞毒性和RNS/ROS产生的影响及与nAg的比较
笔者研究发现,nAg与10 μg·mL-1FA的共处理,可以使nAg的毒性降低,显著恢复细胞的活力,表2显示,5 μg·mL-1nAg与10 μg·mL-1FA共处理AL细胞24 h,其细胞活力恢复得最多,可以恢复到61%.10 μg·mL-1FA 能够显著降低胞内RNS水平,有清除胞内自由基的作用.与对照组相比,1,5 μg·mL-1nAg与10 μg·mL-1FA处理AL细胞24 h后,各剂量nAg暴露组AL细胞的RNS相对荧光强度仅增加了18%,51%,比nAg诱导的胞内RNS水平相比明显降低(表2).当加入FA后,在FA的协同作用下,nAg对AL细胞的ROS影响显著降低.其中,与对照组相比,0.1,0.5,1,5 μg·mL-1nAg分别与10 μg·mL-1FA共处理AL细胞24 h后,各剂量nAg暴露组AL细胞的ROS相对荧光强度变化不大(表2).

表2 nAg和FA(10 μg·mL)与nAg的协同作用对AL细胞活力、胞内RNS水平、胞内ROS水平的影响
注:a指AL细胞暴露nAg时的对照为空白对照,暴露FA+nAg时的对照为10 μg·mL-1FA对照;b指相同浓度的nAg时,当加入10 μg·mL-1FA共处理后,FA+nAg和nAg对AL细胞活力、胞内RNS水平或胞内ROS水平的影响变化的百分比.
3 讨 论
文中的ALamar Blue实验显示,不同剂量的nAg对AL细胞产生增殖抑制作用且呈剂量依赖效应.nAg溶液中释放的相应的Ag+对AL细胞的增殖抑制作用在低浓度时(小于1 μg·mL-1)与nAg相当;而在高浓度时,nAg溶液中释放的Ag+对细胞的增殖抑制作用远小于nAg.因此,在低剂量(小于1 μg·mL-1)时,nAg对细胞的增殖抑制作用主要来自于nAg释放的Ag+;在高剂量(5 μg·mL-1)时,主要是nAg本身以及其释放的Ag+共同对AL细胞产生增殖抑制作用.有研究报道,PVP 包被nAg暴露于人单核细胞系THP-1中,并以硝酸银作对照,发现nAg和Ag+都能诱导细胞损伤[16],这与笔者实验的研究结果一致.
为了探讨其机制,笔者进一步研究了不同浓度nAg和Ag+对AL细胞活性自由基RNS/ROS产生的影响.通过分析发现,nAg导致的胞内RNS的升高主要来源于其释放的Ag+;而对ROS分析发现,低剂量情况下nAg诱导的胞内ROS的升高主要来源于其释放的Ag+,而高剂量情况下,nAg导致的胞内ROS的升高主要来源于nAg本身.因此,推测在低浓度情况下,nAg对AL细胞活力的抑制主要来自于nAg释放的Ag+,而Ag+诱导了胞内RNS的产生,这在抑制细胞活力时产生了一定作用;在高浓度情况下,nAg对AL细胞活力的抑制主要来自于Ag+诱导的RNS和nAg本身诱导的ROS二者共同的作用.5 μg·mL-1nAg的AL细胞较高增殖的抑制作用,可能是nAg在高暴露时主要是通过氧化应激反应,特别是ROS的升高的机制使AL细胞产生较大损伤,细胞活力降低;另一方面,高剂量nAg释放的Ag+以及低剂量的nAg的暴露下,ROS的产生和氧化应激反应比高剂量的nAg低,可能是由于Ag+及低剂量的nAg还可能通过其他机制如干扰细胞内生物分子的功能及其介导的信号转导,从而导致细胞功能障碍,参与更广泛的生物学过程从而使对细胞增殖抑制作用减弱.已有的研究也发现[17-18],纳米银和细胞接触后,通过多种途径进入细胞内,产生ROS,诱发氧化毒性,进而引起细胞凋亡,nAg与其释放的Ag+共同发挥毒性作用,但是存在的致毒机制可能不同,纳米银高剂量和低剂量暴露引起的生物毒性效应不同且相应的致毒机制也不完全相同.
笔者探讨了nAg和环境因子FA与nAg的协同作用下AL细胞活力的变化、RNS/ROS的变化及两者之间的关系.首先发现,FA与nAg协同作用时,可以在一定程度上降低nAg对细胞增殖的抑制作用.FA与nAg的协同作用对AL细胞活力的毒性影响小于nAg、Ag+对AL细胞活力的毒性影响.由于FA具有参与吸附、络合作用的官能团,金属离子可以和官能团发生多种反应[19-20].因此,推测FA能够吸附、络合nAg及Ag+,使nAg和Ag+的浓度降低,从而降低AL细胞胞内RNS和ROS的产生.因为富里酸(FA)是自然界有机物降解的基本产物,代表天然的一大部分有机物(NOM)并且是自然水中主要有机成分[21].另一方面,2015年,Gunsolus等[22]研究也发现,这些有机物与nAg具有高亲和性,当有机物富含硫/氮化合物时,会很大程度地增加nAg的稳定性,大量降低nAg释放Ag+的量并能很大程度地降低nAg的杀菌能力.因此,有关环境因子富里酸(FA)与nAg的协同作用的研究具有重要意义.
综上所述,nAg、Ag+对AL细胞有增殖抑制的毒性作用,而FA能够显著降低nAg对细胞的增殖抑制效应.这可能是由于FA吸附、络合nAg及Ag+,在一定程度上消除氮自由基和氧自由基的形成,引起氮自由基和氧自由基的降低,从而降低了nAg的细胞毒性.天然腐殖质在水体中普遍存在,nAg又是水体中的污染物,水环境中nAg和富里酸相互作用所引起的细胞毒性发生变化,此结论对于人工纳米材料环境安全性的评价理论和数据分析提供了一定的参考价值,对于深入理解人工纳米材料的环境过程、环境安全性评估具有一定的作用.
[2] AHAMED M,KARNS M,GOODSON M,et al.DNA damage response to different surface chemistry of silver nanoparticles in mammalian cells[J].Toxicology and Applied Pharmacology,2008,233:404-410.
[3] CHEN Y,WANG Z,XU M,et al.Nanosilver incurs an adaptive shunt of energy metabolism mode to glycolysis in tumor and nontumor cells[J].ACS Nano,2014,8 (6):5813-5825.
[4] WANG Z,LIU S,MA J,et al.Silver nanoparticles induced RNA polymerase-silver binding and RNA transcription inhibition in erythroid progenitor cells[J].ACS Nano,2013,7 (5):4171-4186.
[5] 张帮勇,巩凡,黄艳梅,等.纳米银对肝细胞体外增殖作用的实验研究[J].环境与健康杂志,2014,31 (10):897-900.
[6] WU L J,RANDERS-PEHRSON G,XU A,et al.Targeted cytoplasmic irradiation with alpha particles induces mutations in mammalian cells[J].Proc Natl Acad Sci USA,1999,96:4959-4964.
[7] HEI T K,HALL E J,WALDREN C A.Mutation induction and relative biological effectiveness of neutrons in mammalian cells.Experimental observations[J].Radiation Research,1988,115 (2):281-291.
[8] TANG W W,ZENG G M,GONG J L,et al.Impact of humic/fulvic acid on the removal of heavy metals from aqueous solutions using nanomaterials:a review[J].Science of the Total Environment,2014,468/469:1014-1027.
[9] 谢萍.自由基与细胞凋亡[J].生物学教学,2004,29 (1):3-4.
[10] WANG L,WANG X,ZHANG S,et al.A protective role of heme-regulated eIF2 alpha kinase in cadmium-induced toxicity in erythroid cells[J].Food and Chemical Toxicology,2013,62:880-891.
[11] MØLLER P,JACOBSEN N R,FOLKMANN J K,et al.Role of oxidative damage in toxicity of particulates[J].Free Radical Research,2009,44 (1):1-46.
[12] YAN Y,KRISHNAKUMAR S,YU H,et al.Nickel(II) dithiocarbamate complexes containing sulforhodamine B as fluorescent probes for selective detection of nitrogen dioxide[J].Journal of the American Chemical Society,2013,135 (14):5312-5315.
[13] 汤智,赵晓丽,吴丰昌,等.不同来源腐殖酸在纳米四氧化三铁上的吸附及对其沉降性的影响[J].环境化学,2015,34 (8):1520-1528.
[14] BONNIER F,KEATING M E,WRBEL T P,et al.Cell viability assessment using the Alamar blue assay:a comparison of 2D and 3D cell culture models[J].Toxicology in Vitro,2015,29 (1):124-131.
[15] MCCLOY R A,ROGERS S,CALDON C E,et al.Partial inhibition of Cdk1 in G 2 phase overrides the SAC and decouples mitotic events[J].Cell Cycle,2014,13 (9):1400-1412.
[16] FOLDBJERG R,PING O,HOUGAARD M,et al.PVP-coated silver nanoparticles and silver ions induce reactive oxygen species,apoptosis and necrosis in THP-1 monocytes[J].Toxicology Letters,2009,190 (2):156-162.
[17] BEER C,FOLDBJERG R,HAYASHI Y,et al.Toxicity of silver nanoparticles-nanoparticle or silver ion[J].Toxicology Letters,2011,208 (3):286-292.
[18] WANG Z,LIU S,MA J,et al.Silver nanoparticles induced RNA polymerase-silver binding and RNA transcription inhibition in erythroid progenitor cells[J].ACS Nano,2013,7 (5):4171-4186.
[19] YANG S B,HU J,CHEN C L,et al.Mutual effects of Pb(II) and humic acid adsorption on multiwalled carbon nanotubes/polyacrylamide composites from aqueous solutions[J].Environ Sci Technol,2011,45 (8):3621-3627.
[20] THURMAN E M,MALCOLM R L.Preparative isolation of aquatic humic substances[J].Environ Sci Technol,1981,15 (4):463-466.
[21] LI J,ZHANG S W,CHEN C L,et al.Removal of Cu(II) and fulvic acid by grapheme oxide nanosheets decorated with Fe3O4nanoparticles[J].Appl Mater Interfaces,2012,4 (9):4991-5000.
[22] GUNSOLUS I L,MOUSAVI M P S,HUSSEIN K,et al.Effects of humic and fulvic acids on silver nanoparticle stability,dissolution,and toxicity[J].Environ Sci Technol,2015,49 (13):8078-8086.
(责任编辑 于 敏)
Effect of silver nanoparticles and FA on the proliferation and RNS/ROS production of ALcells
WANG Ziru1,2,XU Shengmin2,WU Lijun1,2*
(1.School of Environmental Science and Optoelectronic Technology,University of Science and Technology of China,Hefei 230026,China;2.Key Laboratory of Environmental Toxicology and Pollution Control Technology of AnhuiProvince,Hefei Institutes of Physical Science,Chinese Academy of Sciences,Hefei 230031,China)
Using ALamar Blue assay and ROS/RNS fluorescent probe,we studied the cytotoxicity of silver nanoparticles (0.1-5 μg·mL-1nAg),silver ion (0.01-0.5 μg·mL-1Ag+) and nAg associated with fulvic acid (10 μg·mL-1FA) of Human-hamster hybrid ALcells in vitro.The results showed that silver ions released from nAg solution had much more effect on cell viability than nAg at low concentrations,and the inhibition was mainly through the induction of RNS by silver ions.However,at high concentrations nAg had much more effect on cell viability,and this inhibition was mainly due to the induction of RNS by silver ions and ROS by silver nanoparticles.The results also showed that FA could significantly recover the cellular viability decreased by silver nanoparticles and silver ion,as well as the induction of RNS/ROS.
silver nanoparticles;fulvic acid;RNS/ROS;proliferation inhibition
10.3969/j.issn.1000-2162.2016.06.014
2016-04-29
国家重大科学研究计划项目(2014CB932002)
王子茹(1988-),女,安徽宿州人,中国科学技术大学硕士研究生; *吴李君(通信作者),中国科学院合肥物质科学研究院研究员,博士生导师,E-mail:ljw@ipp.ac.cn.
R994.6
A
1000-2162(2016)06-0080-07
