胰腺导管内神经内分泌肿瘤的临床病理学分析
2016-11-18常晓燕贾丛伟孟云霄
常晓燕,贾丛伟,孟云霄,陈 杰
中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730
·论 著·
胰腺导管内神经内分泌肿瘤的临床病理学分析
常晓燕,贾丛伟,孟云霄,陈 杰
中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730
目的 总结胰腺导管内神经内分泌肿瘤的临床病理学特征。方法 回顾性分析4例胰腺导管内神经内分泌肿瘤患者的临床特点、病理形态学检查结果和免疫组织化学EnVision法检测结果。结果 4例患者中,男2例,女2例,年龄41~58岁;2例因腹部症状就诊,1例因呕吐就诊,1例就诊时皮肤巩膜黄染。影像学检查结果显示,1例有胰腺导管扩张及导管内结节,提示为胰腺导管内乳头状黏液性肿瘤(IPMN);3例腹部增强CT显示有胰头部占位,远端胰管不同程度扩张及远端胰腺萎缩,提示胰腺恶性肿瘤可能性大。大体检查结果显示肿物部分在胰腺大导管内膨胀性生长,阻塞导管并侵犯胰腺实质。镜下检查结果显示,4例肿瘤均以实性片状生长为主,2例可见梁状结构;实性肿瘤内混杂有腺体或小导管,尤以导管内更加明显。免疫组织化学检测结果显示,肿瘤细胞神经内分泌标记阳性;增生的小导管上皮细胞标记阳性,神经内分泌标记阴性。结论 胰腺导管内神经内分泌肿瘤罕见,临床症状和影像学资料类似IPMN或胰腺癌。肿瘤部分在胰腺导管内,部分位于胰腺实质内,病理形态显示内分泌肿瘤与导管上皮混杂形成ductulo-insular瘤,需与腺-神经内分泌肿瘤相鉴别。分级及预后类似经典胰腺神经内分泌肿瘤。
神经内分泌肿瘤;胰腺;导管内;诊断
ActaAcadMedSin,2016,38(5):568-573
神经内分泌肿瘤是胰腺最常见的实性肿瘤之一,过去被称为胰岛细胞瘤。历时数十年,命名几经变化,于2010年第4版消化系统肿瘤WHO分类中将消化系统神经内分泌细胞起源的肿瘤统一命名为神经内分泌肿瘤,包括神经内分泌瘤(neuroendocrine tumor,NET)和神经内分泌癌(neuroendocrine carcinoma,NEC)两大类[1]。根据临床特点,胰腺神经内分泌肿瘤分为无功能性和有功能性两种。随着影像学技术的发展,过去不易发现的无功能性神经内分泌肿瘤越来越多被发现并手术治疗,数量超过有功能的神经内分泌肿瘤。胰腺导管内肿瘤在第4版WHO消化系统肿瘤中分为导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)和导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm,ITPN)两类[2]。但不是所有发生在导管内的肿瘤都是导管上皮细胞来源;有文献报道,胰腺腺泡细胞癌[3]和神经内分泌肿瘤[4- 12]也可以发生在胰腺大导管内,临床特点及影像学检查类似IPMN。不同于胰腺外分泌来源的肿瘤,神经内分泌肿瘤发生在胰腺导管内极为少见。本研究总结了北京协和医院4例导管内NET的临床病理特点,提示临床和病理医生,神经内分泌肿瘤也可发生在导管内,并出现类似的临床表现。
资料和方法
资料来源 2006年1月至2015年12月在北京协和医院就诊的胰腺原发神经内分泌肿瘤患者,筛选出其中发生在胰腺大导管内的患者4例,收集患者的临床信息,包括:基本情况、主诉及症状、影像学资料、术式及手术记录等。
取材及病理学检查 手术切除标本经10%中性福尔马林充分固定,垂直胆总管平行打开胰腺,观察并描述肿瘤的位置、大小、颜色及质地;常规取材,石蜡包埋,4 μm切片,HE染色。复习4位患者的病理资料,收集以下信息:肿瘤大小、位置、核分裂数(10个高倍镜),细胞异型性、坏死、脉管内瘤栓;肿瘤浸润范围等。根据2010年第4版WHO消化系统肿瘤内分泌肿瘤[1]及《中国胃肠胰神经内分泌肿瘤病理诊断共识 2013版》[13]进行分级。核分裂象计数时应计数分裂象活跃的区域,至少计数50个高倍视野,并根据所使用的显微镜物镜视野直径进行换算。
免疫组织化学检测 采用EnVision法,4例患者均进行突触素(Syn)、嗜铬素(CgA)、CD56、pan-CK、CK19、Ki- 67、CD10、β-catinin等染色用以明确诊断并据此分类。
结 果
临床特点 4例患者中,男2例,女2例,年龄41~58岁;2例因腹部症状就诊,1例因呕吐就诊,1例就诊时皮肤巩膜黄染。3例均无功能改变,1例发现糖尿病1月余。实验室检查结果显示,2例患者的CA- 199超出正常范围,结合临床表现和影像学特点,考虑为胰腺癌可能性大;1例术前诊断导管内乳头状黏液性肿瘤; 1例术中2次手术切缘冰冻,均显示导管内可见肿瘤,故修改手术方式,行全胰腺切除。
影像学检查 4例患者均行腹部增强CT+胰腺薄扫+三维重建,2例行磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP),2例行内镜超声检查,结果显示:4例患者均有胰腺导管不同程度扩张,伴远端胰腺实质萎缩;1例临床考虑为IPMN,3例为胰腺实性占位。
大体检查 4例肿瘤主体位于胰腺大导管内,导管明显膨胀增粗。3例肿瘤完全阻塞大导管,膨大形成肿瘤结节,一侧导管壁增厚,类似肿瘤有厚的纤维性包膜,与周围胰腺导管相通(图1)。1例部分导管未完全被肿瘤充满,大体上显示小囊形成,位于导管内的肿瘤呈腊肠样。2例累及壶腹部,其中1例肿瘤甚至经胆总管及主胰管蔓延进入肠腔,形成小肠息肉样隆起(图2)。肿瘤切面灰黄色,实性,质中,与周围组织边界清楚。周围胰腺组织萎缩变薄,腺泡结构变小,质韧,可见到灰白色增粗的纤维条索。
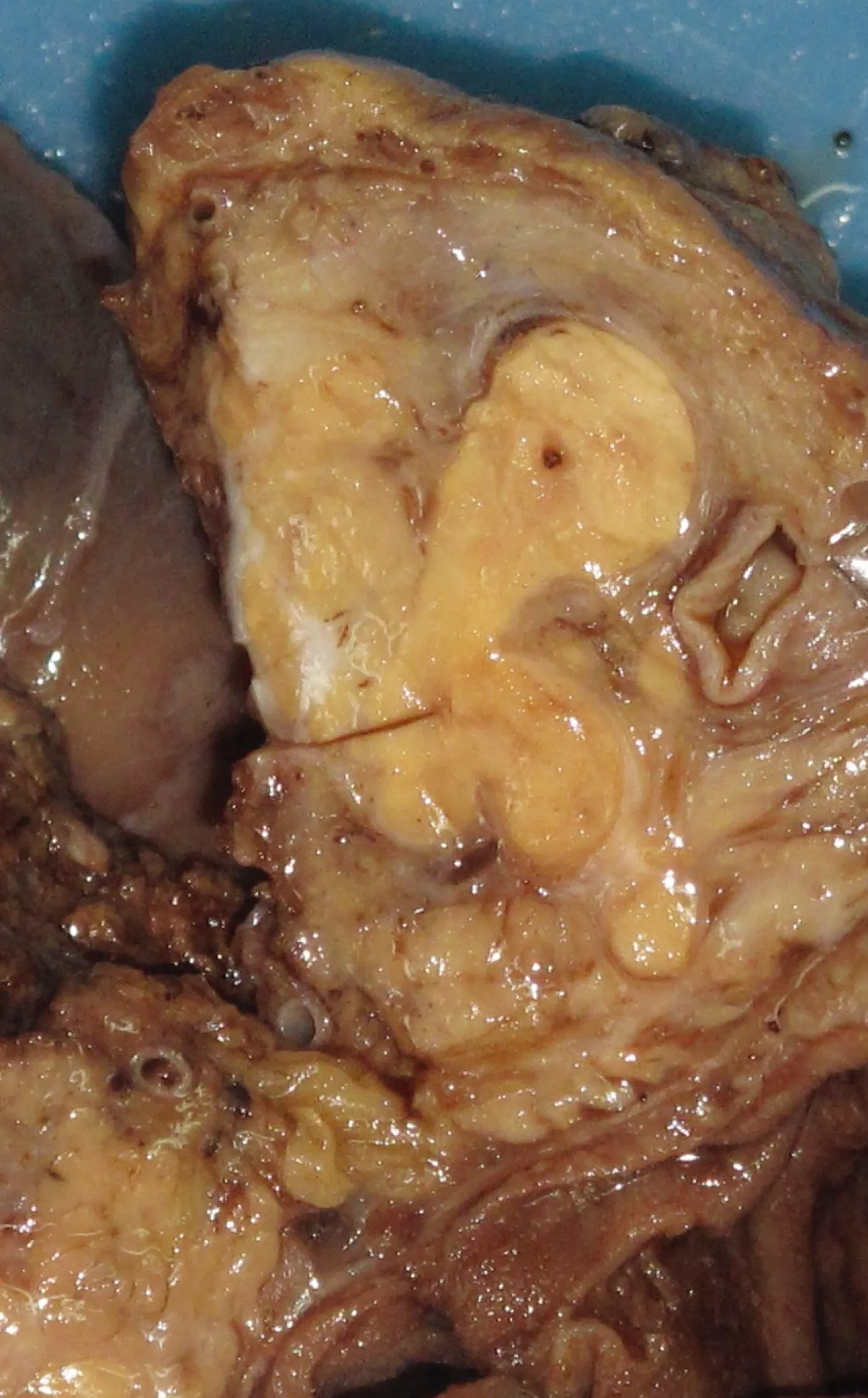
图 1 胰腺导管内神经内分泌肿瘤大体表现
Fig 1 Gross examination of intraductal neuroendocrine tumor showed a yellow mass surrounded by a capsule

图 2 胰腺导管内神经内分泌肿瘤累及壶腹部并进入小肠腔内形成息肉样
Fig 2 The tumor invaded into ampullary duct and formed a polypoid mass in the cavity of small intestine
镜下检查 低倍镜下示肿瘤边界不清,与胰腺实质呈锯齿状互相交错,在肿瘤实质内可见残存的胰腺小叶及腺泡。肿瘤大部分位于胰腺导管内(图3),但都侵犯胰腺实质,3例侵犯到周围脂肪组织。4例肿瘤都富于细胞,1例位于导管内的肿瘤内有大片坏死,3例仅有小灶坏死。4例均呈实性片状为主(图4),富于血管,间质很少。肿瘤细胞胞浆比较丰富,嗜酸性或透明,核浆比不高,3例核分裂数<2/10HPFs,1例核分裂数5~7/10HPFs。2例在实性排列的肿瘤细胞间可见少量梁状结构,梁状结构的细胞核浆比更高,染色更深(图5)。1例在肿瘤间可见均质红染的物质,经刚果红染色证实是淀粉样改变。肿瘤细胞染色质细颗粒状,呈点彩样,偶尔可见小核仁。
胰腺NET在导管内生长的部分,管壁可见单层立方上皮,细胞浆内有黏液,大导管囊壁局部和肿瘤密切连在一起成为一体,部分导管内可见息肉样突出物,与导管壁不相连。除肿瘤细胞外,还可看到很多小腺管夹杂其中,腺管形状规则,主要位于近导管的肿瘤内。腺管细胞单层排列,核位于基底部,核浆比不高,无明显异型性,无核分裂(图6)。
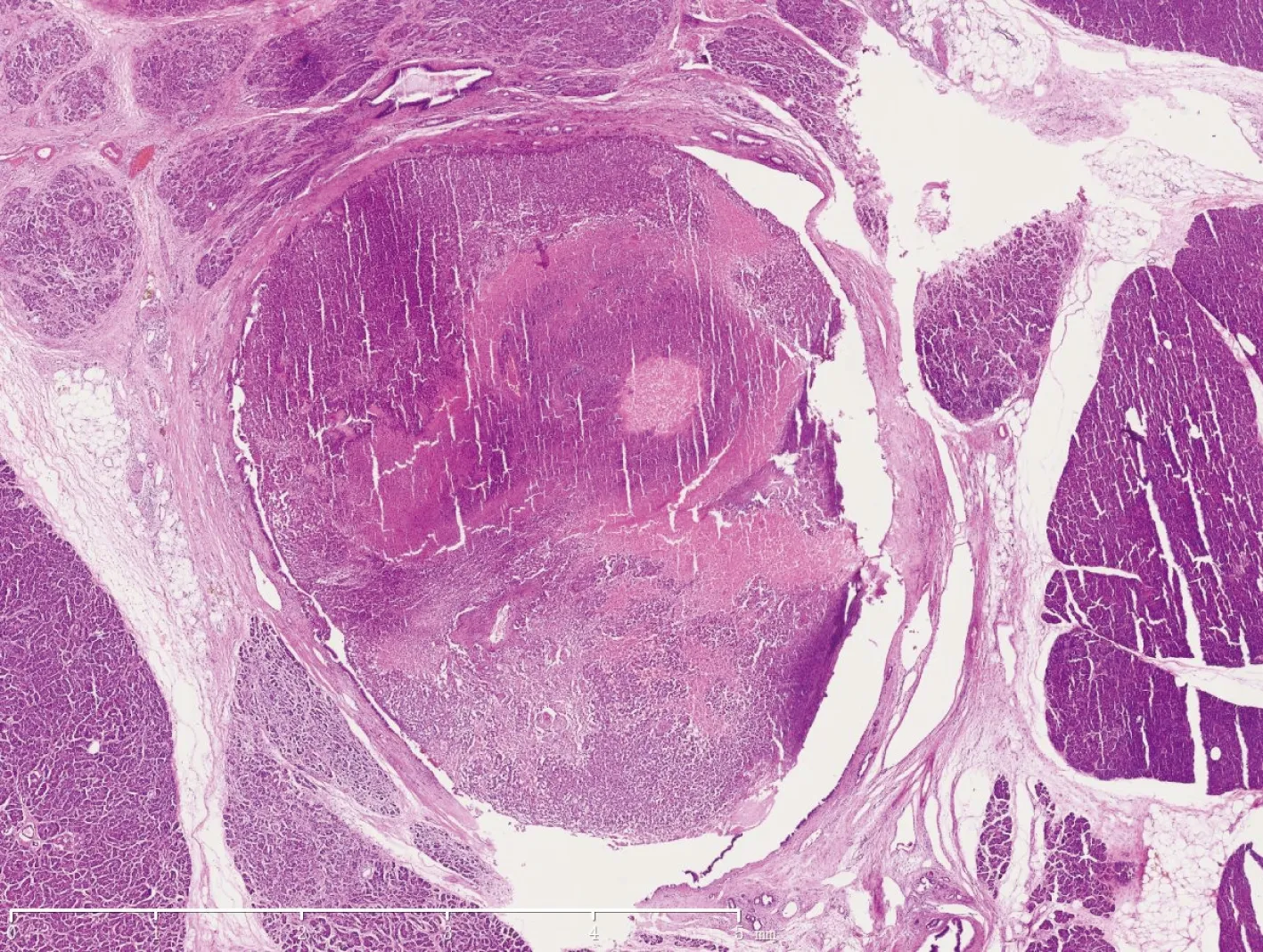
图 3 神经内分泌肿瘤发生在胰腺导管内(HE,×10)
Fig 3 Microscopically,the tumor located in the main duct of pancreas(HE,×10)
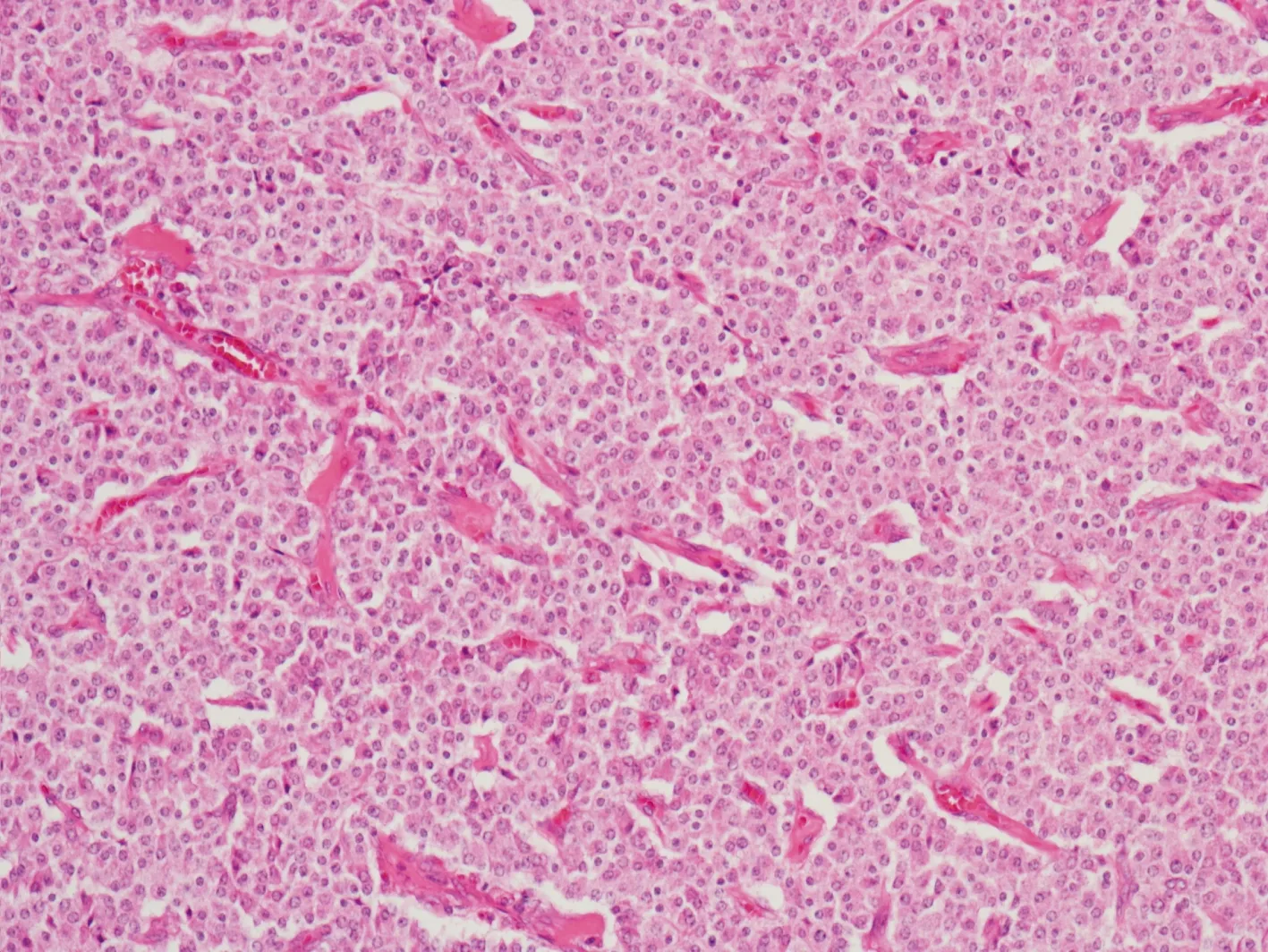
图 4 肿瘤细胞呈实性排列,富于血管,间质很少(HE,×100)
Fig 4 The tumor arranged in solid pattern with many vessels and few fibrotic stroma(HE,×100)
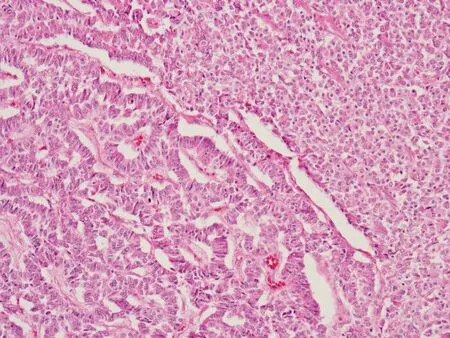
图 5 实性排列中可见梁状结构(HE,×100)
Fig 5 The tumor arranged in solid pattern and trabecular patterns(HE,×100)
1例有胰腺周围淋巴结转移(图7),转移瘤与胰腺原发的肿瘤形态相同,也为实性排列,没有明显的异型性,核浆比不高,核分裂<1/10HPFs;转移瘤内没有腺管结构伴随。周围胰腺组织有比较明显的慢性阻塞性胰腺炎改变,腺泡萎缩,纤维组织增生,小导管扩张。
免疫组织化学检查结果 4例患者均表现为Syn、CgA、CD56呈弥漫强阳性表达,其中夹杂的导管上皮细胞阴性;而肿瘤和夹杂的导管上皮均显示AE1/AE3和CK19阳性,但阳性程度不同,导管上皮强阳性,神经内分泌肿瘤弱阳性(图8)。CD10 阴性。Ki- 67指数不同区域有差别。选择阳性细胞最密集的区域,数500个细胞,计算Ki- 67的阳性率,结果显示2例阳性率小于2%,2例约4%~5%。

图 6 胰腺神经内分泌肿瘤细胞中可见小腺管散在分布(HE,×200)
Fig 6 Some small ducts and ductules distributed in the neuroendocrine tumor(HE,×200)
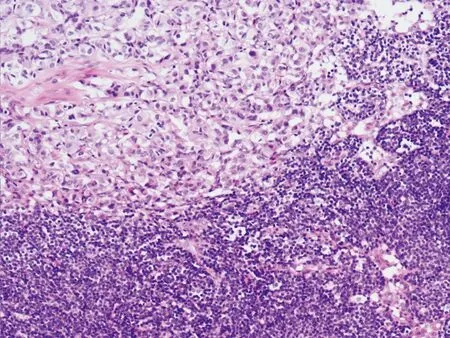
图 7 胰腺神经内分泌肿瘤淋巴结转移,转移瘤的形态特点与原发肿瘤相同,没有腺管状结构(HE,×100)
Fig 7 The metastatic tumor in lymph node was morphologically identical with the primary tumor in pancreas(HE,×100)
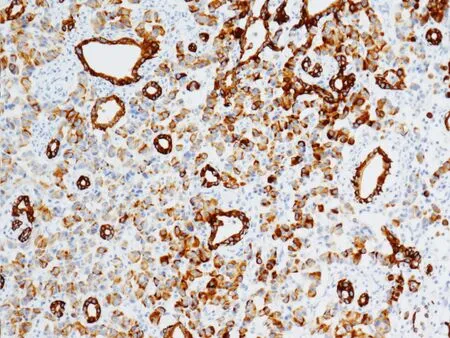
图 8 免疫组织化学CK19染色显示胰腺神经内分泌肿瘤细胞中可见小腺管(EnVision,×100)
Fig 8 Immunohistochemically CK19 was expressed strongly in the small ducts and weakly in neuroendocrine tumor cells(EnVision,×100)
讨 论
胰腺是消化系统神经内分泌肿瘤最常见的发生部位。功能性神经内分泌肿瘤因激素过度分泌导致明显的症状,最常见的是分泌胰岛素增多导致糖尿病的胰岛素瘤,其次是分泌胃泌素增多出现胃及小肠多发溃疡(Zollinger-Ellison综合征)的胃泌素瘤,分泌胰高血糖素增多会出现全身坏死性游走性红斑等。临床症状高度提示胰腺神经内分泌肿瘤的可能,故一般患者发现较早,肿瘤体积相对小,能早期治疗,预后比较好。无功能性胰腺神经内分泌肿瘤也可以分泌少许激素,如嗜铬素、胰多肽等,但通常不引起症状,所以通常发现较晚,肿瘤体积大,甚至发现时已经出现局部广泛浸润及远处转移,部分患者失去手术机会。文献报道中大部分导管内神经内分泌肿瘤都是无功能性,首发症状以腹痛为主[4,6,10]。本组中有3例为无功能性胰腺NET,因导管严重梗阻后的腹痛、胆汁淤积等症状,促使患者就诊。1例在手术前1个月内发生糖尿病,但免疫组织化学检查显示无胰岛素表达,我们推测不是肿瘤本身分泌胰岛素,而是因慢性萎缩性胰腺炎导致胰岛损伤,不足以代谢,而发生糖尿病。4例患者导管内胰腺NET手术前临床特点和影像学检查均首选考虑胰腺IPMN或胰腺癌,神经内分泌肿瘤的相关症状不典型。
大部分胰腺神经内分泌肿瘤是散发病例,但也有相当一部分是发生在一些有明确基因改变的综合征,最常见的是多发性内分泌肿瘤综合征- 1(multiple endocrine neoplasm- 1,MEN- 1)和Von Hippel-Lindau综合征(VHL)[14];神经纤维瘤病1型(neurofibromatosis,NF- 1)及结节性硬化等也可偶然发现胰腺NET。MEN- 1综合征的患者几乎100%都会发生胰腺NET,部分是功能性,多发结节常见,可以检测到11q13(包含MEN- 1基因)的杂合性缺失。VHL综合征有11%~17%的患者会发生胰腺NET,通常是小的无功能性,有时会发生混合性浆液性-神经内分泌肿瘤。文献报道有1例导管内神经内分泌肿瘤是发生在MEN- 1患者[5],本组4例均为散发病例,没有发生以上综合征。
胰腺神经内分泌肿瘤镜下形态多样,小梁状、条索状、巢状、菊形团等器官样结构,也可呈实性排列;间质可多可少,可有淀粉样物质沉积。本组病例神经内分泌肿瘤病理形态比较单一,主要是实性排列,2例夹杂有部分小梁状结构。胰腺NET偶尔可见到混杂有增生的腺管或小导管,1976年被Dahms等[15]称为ductulo-insular tumor。其后被多次描述并有不同命名,Deshpande等[16]详细总结了这一病变发生的各种情况,并期待其作为一种单独的病变类型。增生的小导管或腺体不仅混杂在胰腺NET中,还可以混杂在非肿瘤性病变内,如慢性胰腺炎时增生的纤维组织中见形态多样的小腺管或腺体。由于腺管周围缺少肌上皮,被纤维组织随意拉扯而形成扩张、扭曲等各种形状。Ductulo-insular tumor时腺管周围不一定有纤维组织增生,特点是在胰腺NET内,纤维组织较少。该情况需要与混合性腺-神经内分泌肿瘤鉴别,腺上皮的恶性程度不同,肿瘤预后差别很大。
免疫组织化学检查是诊断神经内分泌肿瘤必不可少的支持。现在应用最广泛也最特异的神经内分泌标记物有Syn、CgA。Syn敏感性高,CgA特异性强,二者搭配,可准确诊断几乎所有发生在胰腺的神经内分泌肿瘤。Syn和CgA阴性,仅有CD56阳性,不足以诊断胰腺NET,胰腺实性假乳头瘤和腺泡细胞癌有时也可以CD56阳性。Ki- 67指数是帮助胰腺NET分级的必要指标,中国神经内分泌肿瘤诊断指南(共识)中已经明确指出,要评估热点处500~2000个肿瘤细胞的Ki- 67阳性指数,作为诊断依据,而不是整张切片上所有细胞的阳性指数。
发生在导管内的神经内分泌肿瘤非常少见。Shimizu等[4]报道了世界上第1例导管内神经内分泌肿瘤,44岁女性,肿瘤主体位于胰头部,沿胰管蔓延到胰尾部,与本组1例类似。目前文献报道的胰腺导管内神经内分泌肿瘤纯粹导管内生长,无周围胰腺实质侵犯,仅有1例报道[5],其肿瘤来源被认为是大导管壁上皮细胞内的多潜能干细胞;除此之外,其他病例报告都有周围胰腺实质侵犯,通常的认知是胰腺NET发生在胰腺实质的胰岛内,侵入胰腺大导管并沿导管蔓延,形成导管内生长并引发相关症状。
神经内分泌肿瘤现在有许多治疗手段,如手术切除、放化疗和生物治疗等,但仍首选手术治疗。手术切除减瘤后,配合化疗,效果最佳。国外大样本资料证实,胰腺NET的G分级与预后和生存期有明显的统计学意义[1]。本组病例中,1例是G1级,但手术时就有淋巴结转移;3例虽然是G2,但没有发现大片坏死和淋巴结转移,临床分期低于G1级的1例,其中2例都出现脉管内瘤栓。4例均无神经侵犯,不同于胰腺导管腺癌噬神经的特点。除1例患者仅手术1个月外,其余3例患者随访17~26个月,患者均无瘤生存。
综上,本组资料提示胰腺神经内分泌肿瘤也可以发生在导管内,临床症状类似胰腺IPMN,甚至胰腺癌。肿瘤通常部分在导管内,部分在胰腺实质内,病理形态上内分泌肿瘤与导管上皮混杂形成ductulo-insular瘤,需与腺-神经内分泌肿瘤相鉴别;分级及预后类似经典胰腺神经内分泌肿瘤。
[1]Klimstra DS,Arnold R,Capella C,et al. Neuroendocrine neoplasms of the pancreas [M]//Bosman FT,Carneiro F,Hruban RH. WHO Classification of Tumors. Lyon:WHO Press,2010:322- 326.
[2]Adsay NV,KlöppelG,Fukushima N,et al. Intraductal neoplasms of the pancreas. [M]//B Bosman FT,Carneiro F,Hruban RH. WHO Classification of Tumors. Lyon:WHO Press,2010:304- 313.
[3]Basturk O,Zamboni G,Klimstra DS,et al. Intraductal and papillary variants of acinar cell carcinomas:a new addition to the challenging differential diagnosis of intraductal neoplasms [J]. Am J Surg Pathol,2007,31(3):363- 370.
[4]Shimizu K,Shiratori,K,Toki F,et al. Nonfunctioning islet cell tumor with a unique pattern of tumor growth [J]. Dig Dis Sci,1999,44(3):547- 551.
[5]Fassan M,Pizzi S,Pasquali C,et al. Pancreatic endocrine tumor in multiple endocrine neoplasia type 1 syndrome with intraductal growth into the main pancreatic duct [J]. Pancreas,2009,38(3):341- 342.
[6]Inagaki M,Watanabe K,Yoshikawa D,et al. A malignant nonfunctioning pancreatic endocrine tumor with unique pattern of intraductal growth [J]. J Hepatobiliary Pancreat Surg,2007,14(3):318- 323.
[7]Kawakami H,Kuwatani M,Hirano S,et al. Pancreatic endocrine tumors with intraductal growth into the main pancreatic duct and tumor thrombus within the protal vein:a case report and review of the literature [J]. Int Med,2007,46(6):273- 277.
[8]Kitami CE,Shimizu T,Sato O,et al. Malignant islet cell tumor projecting into the main pancreatic duct [J]. J Hepatobiliary Pancreat Surg,2000,7(5):529- 533.
[9]Terada T,Kawaguchi M,Furukawa K,et al. Minute mixed ductal endocrine carcinoma of the pancreas with predominant intraductal growth [J]. Pathol Int,2002,52(11):740- 746.
[10]Akatsu T,Wakabayashi G,Aiura K,et al. Intraductal growth of a nonfunctioning endocrine tumor of the pancreas [J]. J Gastroenterol,2004,39(6):584- 588.
[11]Runjan Chetty. Intraductal pancreatic neuroendocrine tumor [J]. Endocr Pathol,2009,20(4):262- 266.
[12]Jaclyn FH,Daniel ML,Christopher JD, et al. Intraductal polypoid lipid-rich neuroendocrine tumor of the pancreas with entrapped ductules:case report and review of the literature [J]. Endocr Pathol,2013,24(1):30- 35.
[13]2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志,2013,42(10):691- 694.
[14]Shi C,Klimstra DS. Pancreatic neuroendocrine tumors:pathologic and molecular characteristics [J]. Semin Diagn Pathol,2014,31(6):498- 511.
[15]Dahms BB,Lippe BM,Dakake C,et al. The occurrence in a neonate of a pancreatic adenoma with nesidio-blastosis in the tumor [J]. Am J Clin Pathol,1976,65(4):462- 466.
[16]Deshpande V,Selig MK,Nielsen GP,et al. Ductulo-insular pancreatic endocrine neoplasms:clinicopathologic analysis of a unique subtype of pancreatic endocrine neoplasms [J]. Am J Surg Pathol,2003,27(4):461- 468.
Clinicopathological Features of Intraductal Pancreatic Neuroendocrine Tumors
CHANG Xiao-yan,JIA Cong-wei,MENG Yun-xiao,CHEN Jie
Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
CHEN Jie Tel/Fax:010- 69159362,E-mail:xhblk@163.com
Objective To evaluate the clinical and pathologic characteristics of intraductal pancreatic neuroendocrine tumors (PanNETs). Methods Four cases of intraductal PanNETs were studied by light microscopy and immunohistochemistry with the analysis of morphologic features and review of relevant literatures. Results Two female patients and two male patients aged 41- 58 years were enrolled in this study. The chief complaint was abdominal pain in two patients,vomiting in one patient,and jaundice in the last patient. Imaging examination showed intraductal neoplasm with diagnosis as intraductal papillary mucinous neoplasm (IPMN) in case 1; space-occupying lesions were found in the head of pancreas in the other three cases with pancreatic ductal ectasia and distal pancreatic atrophy. Grossly the masses were located in pancreatic main duct and invaded into surrounding pancreatic parachyma. Microscopically the tumors arranged with solid pattern,with some trabecular structures in the last two cases. Small duct and ductules were seen in intraductal PanNETs. The immunohistochemical expression showed that SYN and CgA were positive in neoplastic cells and negative in small duct and ductules.Conclusions Intraductal PanNETs are rare conditions. The clinical symptoms and imaging findings are similar to IPMN or pancreatic carcinoma. The tumors are located within pancreatic duct partly and can invade the pancreatic parenchyma. Microscopically the neuroendocrine tumors mix with small duct and forms ductulo-insular structure,which should be differentiated with mixed ductal endocrine carcinoma. The grade and prognosis are similar to those of classical neuroendocrine tumors.
neuroendocrine tumor; pancreas; intraductal; diagnosis
陈 杰 电话/传真:010- 69159362,电子邮件:xhblk@163.com
R735.9
A
1000- 503X(2016)05- 0568- 06
10.3881/j.issn.1000- 503X.2016.05.014
2016- 09- 14)
