中药筋脉通对糖尿病大鼠背根神经节硝基酪氨酸和神经生长因子表达的影响
2016-11-18吴亚楠梁晓春高云周
吴亚楠,梁晓春,杨 丹,屈 岭,刘 伟,高云周
中国医学科学院 北京协和医学院 北京协和医院中医科,北京 100730
·论 著·
中药筋脉通对糖尿病大鼠背根神经节硝基酪氨酸和神经生长因子表达的影响
吴亚楠,梁晓春,杨 丹,屈 岭,刘 伟,高云周
中国医学科学院 北京协和医学院 北京协和医院中医科,北京 100730
目的 观察中药复方筋脉通(JMT)对糖尿病大鼠背根神经节(DRG)硝基酪氨酸(NT)和神经生长因子(NGF)表达的影响。方法 采用链脲佐菌素一次性腹腔内注射方法造模,随机数字表法将大鼠分为正常对照组(Con组)、糖尿病模型对照组(DM组)、JMT治疗组(JMT组)及牛磺酸治疗组(Tau组)4组,每组10只。成模后给予灌胃给药,JMT组[1.31 g/(kg·d),给药剂量为生药量]及Tau组[1.20 g/(kg·d)]均按成人剂量15倍给药,DM组和Con组灌服蒸溜水l ml/(100 g·d)。分别于治疗前及治疗后4、8、12、16周检测各组大鼠体重和血糖变化。所有大鼠均于灌胃16周后进行机械痛阈检测后处死,取大鼠DRG组织,采用免疫组织化学染色法和Western blot法检测大鼠DRG中NT 及NGF的表达。结果 免疫组织化学检测结果显示,与Con组相比,DM组的NT表达显著升高(P=0.000),NGF的表达显著降低(P=0.006);与DM组相比,JMT组及Tau组的NT表达显著降低(P=0.000,P=0.000),NGF表达显著升高(P=0.000,P=0.004),其中JMT治疗组NT较Tau组更为显著(P=0.004)。Western blot检测结果显示,与Con组相比,DM组的NT蛋白表达显著升高(P=0.000),NGF蛋白表达显著降低(P=0.000);与DM组比较,JMT组与Tau组的NT蛋白表达均显著降低(P=0.001,P=0.000),NGF蛋白表达均显著升高(P=0.000,P=0.001)。结论 中药JMT能够增加糖尿病大鼠DRG组织中NGF的表达,同时降低NT水平。
糖尿病周围神经病变;背根神经节;免疫组织化学;Western blot检测;硝基酪氨酸;神经生长因子;筋脉通
ActaAcadMedSin,2016,38(5):507-513
硝化应激是包括糖尿病及其并发症在内多种疾病重要的发病途径[1],硝基酪氨酸(nitrotyrosine,NT)是体内硝化应激存在的有力证据。神经的修复再生障碍是糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)发病中另一个重要的环节,神经生长因子(nerve growth factor,NGF)可以促进神经的修复与再生。研究表明,硝化应激可以导致NGF的表达异常[2]。既往研究中已发现中药筋脉通(Jingmaitong,JMT)能够抑制氧化应激[3],增加NGF表达[4],本研究观察了JMT对糖尿病大鼠DRG组织中NT及NGF表达的影响,以期为进一步了解JMT的作用机制提供理论依据。
材料和方法
实验动物及试剂 清洁级雄性SD大鼠40只,体重270~310 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK (京)2009- 0017。JMT胶囊(主要由女贞子、菟丝子、桂枝、细辛、元胡、水蛭等药物组成)为北京协和医院院内制剂,由北京九龙制药厂加工生产,每粒含生药0.35 g,批准文号(97)京卫药制加字[48]第F- 292号,生产批号061019。牛磺酸(taurine,Tau)购自美国Sigma-Aldrich公司,货号T4571,1000 g/瓶;精蛋白锌胰岛素注射液购自江苏万邦生化医药股份有限公司,400 U/10 ml,批准文号国药准字H32024565,生产批号080314;链脲佐菌素(streptozotocin,STZ)购自美国Sigma-Aldrich公司。即用型SABC免疫组织化学染色试剂盒及DAB显色试剂盒购自北京中杉金桥公司,兔抗大鼠NT多克隆抗体购自美国Bioss公司,兔抗大鼠NGF多克隆抗体购自美国Abcam公司。
模型建立及分组 雄性SD大鼠饲养于北京协和医院动物实验室清洁级环境,温度22℃(20~25℃),湿度45%(40%~70%),每日光照12 h(7∶00- 19∶00),噪音<60分贝。以大鼠维持饲料(碳水化合物60%、蛋白质22%、脂肪4.0%)饲养,自由饮水,分笼饲养,每笼4~5只。适应性饲养1周后,根据随机数字表法将大鼠随机分为正常对照组和造模组。对造模组大鼠按60 mg/kg体重的剂量,一次性左下腹腔内注射0.45%的STZ溶液。Con组按60 mg/kg体重的剂量,一次性左下腹腔内注射0.1 mol/L枸橼酸盐缓冲液。72 h后用血糖仪测尾尖血血糖,凡血糖≥16.7 mmol/L者为造模成功,作为DM大鼠。根据随机数字表法将造模成功的30只DM大鼠随机分为糖尿病模型对照组(DM组)、JMT治疗组(JMT组)及牛磺酸治疗组(Tau组)3组,每组10只。腹腔内注射枸橼酸盐缓冲液的大鼠,72 h后测尾尖静脉血血糖,凡血糖<7.0 mmol/L者,作为正常对照组(Con组),共10只,体重与鼠龄均相匹配。造模成功后开始灌胃给药:(1)JMT组:按成人剂量15倍给药,即1.31 g/(kg·d),给药剂量为生药量;(2)Tau组:按成人剂量15倍给药,即1.20 g/(kg·d);以上药物均用蒸馏水定期配制,4 ℃冰箱中保存,每日灌胃1次。DM组和Con组则灌服等体积蒸馏水,每日灌胃剂量1 ml/100 g体重。各组连续灌胃16周。为防止大鼠因血糖过高而无法存活至实验终点,实验进行至第4周后,根据实测大鼠血糖情况,给予精蛋白锌胰岛素注射液1~3 U每日1次皮下注射,维持血糖小于30.0 mmol/L。
一般情况、血糖及体重检测 观察大鼠的毛色、精神状态、摄食、体重及日常活动情况等。分别于治疗前,治疗后4、8、12、16周取尾尖血,用血糖仪测定血糖,每次测血糖前均称体重。
机械痛阈值的测定 采用Von Frey电子测痛仪(IITC公司,美国),在干预16周后处死大鼠前进行机械痛阈值的测定。将大鼠置于升高的金属网上,盖以透明的有机玻璃罩。先让大鼠适应环境10~15 min,然后用电子Von Frey仪的探头纤维垂直剌激大鼠后肢足底中部,使探头纤维稍成S形,观察是否出现缩足反应。大鼠在刺激后出现快速的缩足反应,记为阳性反应,并记录电子屏幕上的受力数值(g)。身体活动所引起的缩足反应则不记作阳性反应。每间隔3~5 min测量1次,每只大鼠每侧足底测量3次并记录。
标本处理 所有实验大鼠均连续灌胃16周后处死。用12%的乌拉坦以1 ml/100 g体重进行腹腔注射麻醉后俯卧位固定,于股骨干后外侧剪开皮肤,大鼠股外侧肌间隙进入,暴露坐骨神经,用玻璃分针钝性分离,沿坐骨神经向远心端方向将神经用力完整拉出,找到膨大的背根神经节,置于4%多聚甲醛溶液固定24 h,送至中国医学科学院基础医学研究所实验病理中心,常规脱水,石蜡包埋,连续切片,烤干后4 ℃保存,用于免疫组织化学检测;另取组织置于冻存管内,迅速投入液氮中冷冻转移至-80 ℃冰箱冻存,用于Western blot检测。
免疫组织化学染色法检测DRG组织中NT和NGF的表达 DRG组织石蜡包埋、切片,50~60 ℃烤干过夜,常规脱蜡,置枸橼酸溶液(pH 6.0)中,92~98 ℃加热10 min,置于室温15 min冷却,PBS冲洗2次,置3% H2O2中,室温10 min。PBS冲洗后,滴加5% BAS,室温孵育20 min,除去多余液体。滴加一抗即兔抗大鼠NT多克隆抗体稀释液150 μl(1∶400稀释),37 ℃孵育60 min。阴性对照滴加0.01 mol/L PBS代替一抗进行实验。PBS冲洗后滴加已生物素化的二抗即羊抗兔IgG 150 μl,37 ℃孵育20 min。经PBS冲洗后滴加SABC 150 μl,37 ℃孵育20 min。滴加150 μl新鲜配制的DAB溶液,镜下观察35 s后即出现特异性棕黄色颗粒,蒸馏水冲洗终止反应。苏木精复染40 s,蒸馏水冲洗。常规脱水透明,中性树脂封片。组织被染为棕黄色,细胞核被染为蓝色视为阳性。通过Leica显微镜及图像采集系统采集图像,采用Image-Pro Plus 6.0图像分析软件,对采集的免疫组织化学图像结果进行分析。测量积分光密度(integrated optical density,IOD)值,进一步计算出阳性区域平均光密度(average optical density,AOD)值,对免疫组织化学结果进行统计分析。
Western blot法测定DRG的NT和NGF蛋白表达
组织蛋白的提取:取新鲜DRG组织,剪碎后加入200 μl细胞裂解液转移至Eppendorf管中,放置于冰上。每隔5 min振荡1次,充分裂解后,收集悬液,离心收集的上清即为总蛋白,转移分装至另一Eppendorf管中,-80 ℃保存。
BCA法测定总蛋白浓度:用蒸馏水稀释各组待测蛋白样品(20倍稀释)。取BCA试剂盒A液和B液适量以50∶1的比例混匀形成浅绿色工作液。将20 μl不同浓度梯度的BSA标准品及稀释好的待测蛋白样品分别与400 μl工作液混合,37 ℃水浴反应30 min。将反应后的蛋白溶液分别取200 μl(每个标准品或样品设置3个重复孔)加入到96孔板中,振荡30 s。测定吸光度:酶标仪单波长562 nm测量A值,绘制标准曲线。20倍稀释后根据标准蛋白浓度及吸光值得到标准曲线,最终的待测蛋白实际浓度为测定结果乘以稀释倍数(20倍)。
Western blot检测:制备SDS-PAGE,将凝胶板固定于电泳装置内,加入电极缓冲液。将相同质量的待测样品(总蛋白80 μg),根据已测定的各样品的蛋白浓度,计算各个样品所需体积。与5倍体积的loading buffer混匀,沸水煮5 min后放入冰盒中速冷。顺序吸取蛋白样品至加样孔内,其中两侧为蛋白相对分子质量标准。接通电源,开始时电压为70 V,电泳10 min后转为100 V,待溴酚蓝电泳至胶底部时终止电泳。电泳结束后冰浴中进行电转,接通电源350 mA,根据相对分子质量大小转膜约45~90 min。将膜浸入用TBS-T配制5%脱脂奶粉室温封闭1 h。用封闭液将一抗按1∶1000稀释,β-Actin为1∶1000,将膜与一抗一起孵育,用TBS-T于摇床上4 ℃过夜。用封闭液稀释HRP标记的羊抗兔二抗(稀释比例1∶3000),将稀释后的二抗与膜室温孵育60 min。用TBS-T于摇床上清洗。然后用ECL进行显色反应,暗室内转印膜对X感光胶片曝光。用Image-Pro Plus 6.0图像分析软件,分析蛋白条带,以目的蛋白的灰度(目的蛋白的IOD值/相应内参蛋白β-actin的IOD值)作为目的蛋白表达的相对量进行统计分析。
统计学处理 采用SPSS 21.0统计软件包,完成数据录入后进行资料复查整理。分析前采用One Sample Kolmogorov-Smirnov Test检验数据是否符合正态分布,符合正态分布的数据采用均数±标准差描述,多组独立样本比较采用单因素方差分析,并进一步行均数的两两比较;非正态分布数据采用非参数检验方法(k个独立样本的检验)。P<0.05为差异有统计学意义。
结 果
一般情况观察、血糖和体重 Con组大鼠精神状态良好,毛色纯白有光泽,进食和饮水量以及尿量都正常,体重增长,动作自如。模型组大鼠出现多饮、多食、多尿,神态萎靡,毛色枯黄无光泽,尾巴有褐色花斑,下腹部鼓胀,竖毛弓背,活动少,体重增长缓慢。各治疗组大鼠有类似模型组的表现,但程度相对较轻。造模后4周,JMT组及Tau组各有1只大鼠死亡,尸体解剖未能明确死亡原因;造模后8周,DM组有2只大鼠死亡,发现时尸体已经僵硬,也未能明确死亡原因。
与Con组相比,造模各组大鼠的血糖在各时间点均显著升高(P均<0.05),各治疗组血糖在同一时间点与DM组相比差异无统计学意义(P均>0.05),两治疗组间血糖在各时间点差异均无统计学意义(P均>0.05)(图1)。
干预前后,同一时间点各治疗组大鼠之间的体重差异无统计学意义(P均>0.05)。给药4、8、12、16周,各造模组的体重与Con组相比明显下降(P均<0.05)(图2)。
JMT对糖尿病大鼠机械痛阈值的影响 Con组、DM组、JMT组和Tau组大鼠左侧机械痛阈值分别为(90.77±14.64)、(40.61±11.12)、(74.35±12.08)和(73.22±8.06)g,其中,DM组明显低于Con组(P=0.000),JMT组(P=0.001)和Tau组(P=0.001)明显高于DM组,JMT组和Tau组间差异无统计学意义(P=0.829);右侧机械痛阈值分别为(92.12±10.03)(42.45±8.77)、(78.56±14.76)和(79.43±12.37) g,其中,DM组明显低于Con组(P=0.000),JMT组(P=0.000)和Tau组(P=0.000)明显高于DM组,JMT组和Tau组间差异无统计学意义(P=0.961)。
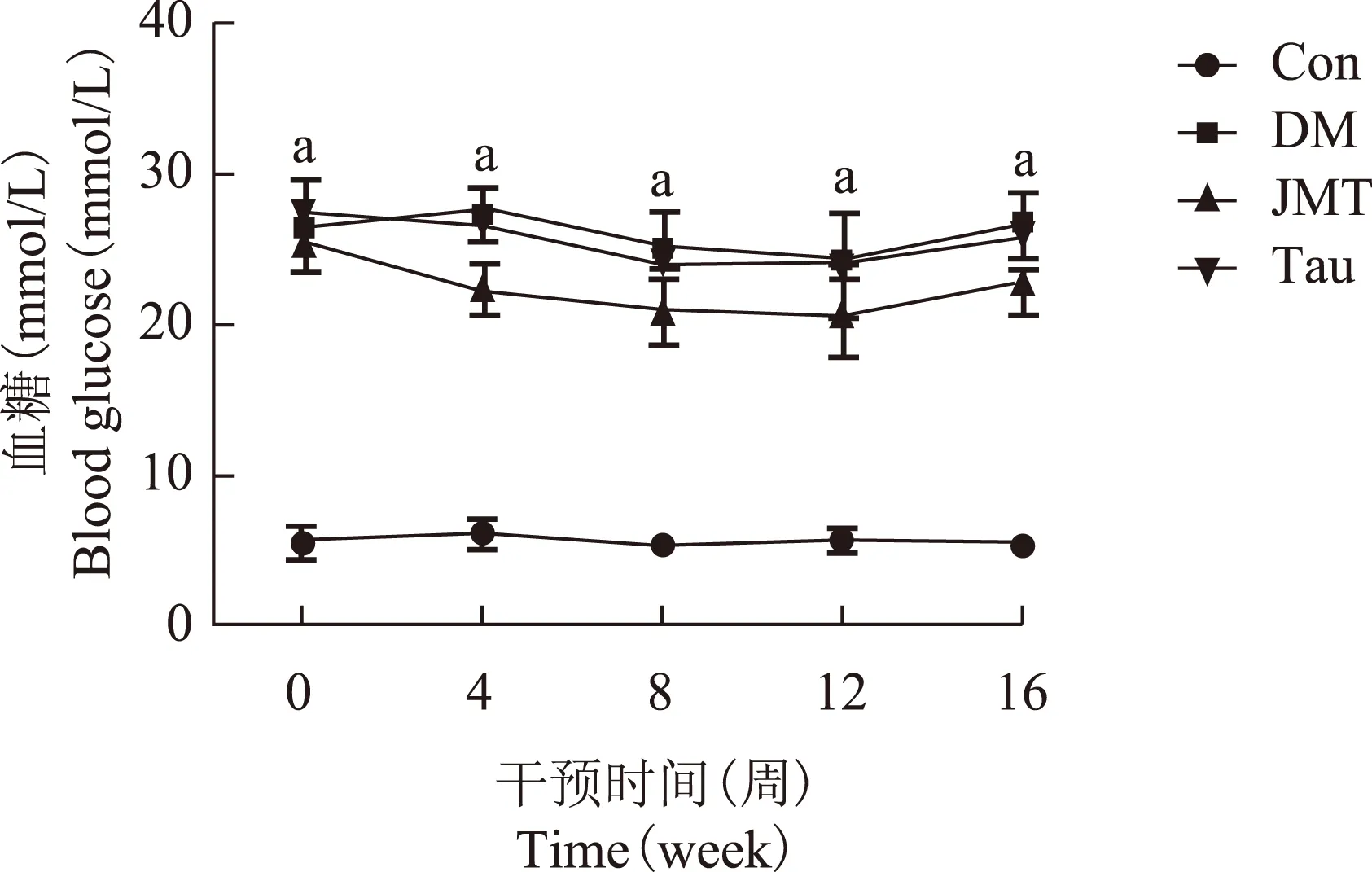
Con:正常对照组;DM:糖尿病模型对照组;JMT:筋脉通治疗组;Tau:牛磺酸治疗组
Con:normal control group;DM:diabetes mellitus group;JMT:Jinmaitong group;Tau:taurine group
与Con组比较,aP<0.05
aP<0.05 compared with Con group
图 1 各组大鼠治疗前后血糖变化
Fig 1 Changes of blood glucose level in each group before and after treatment
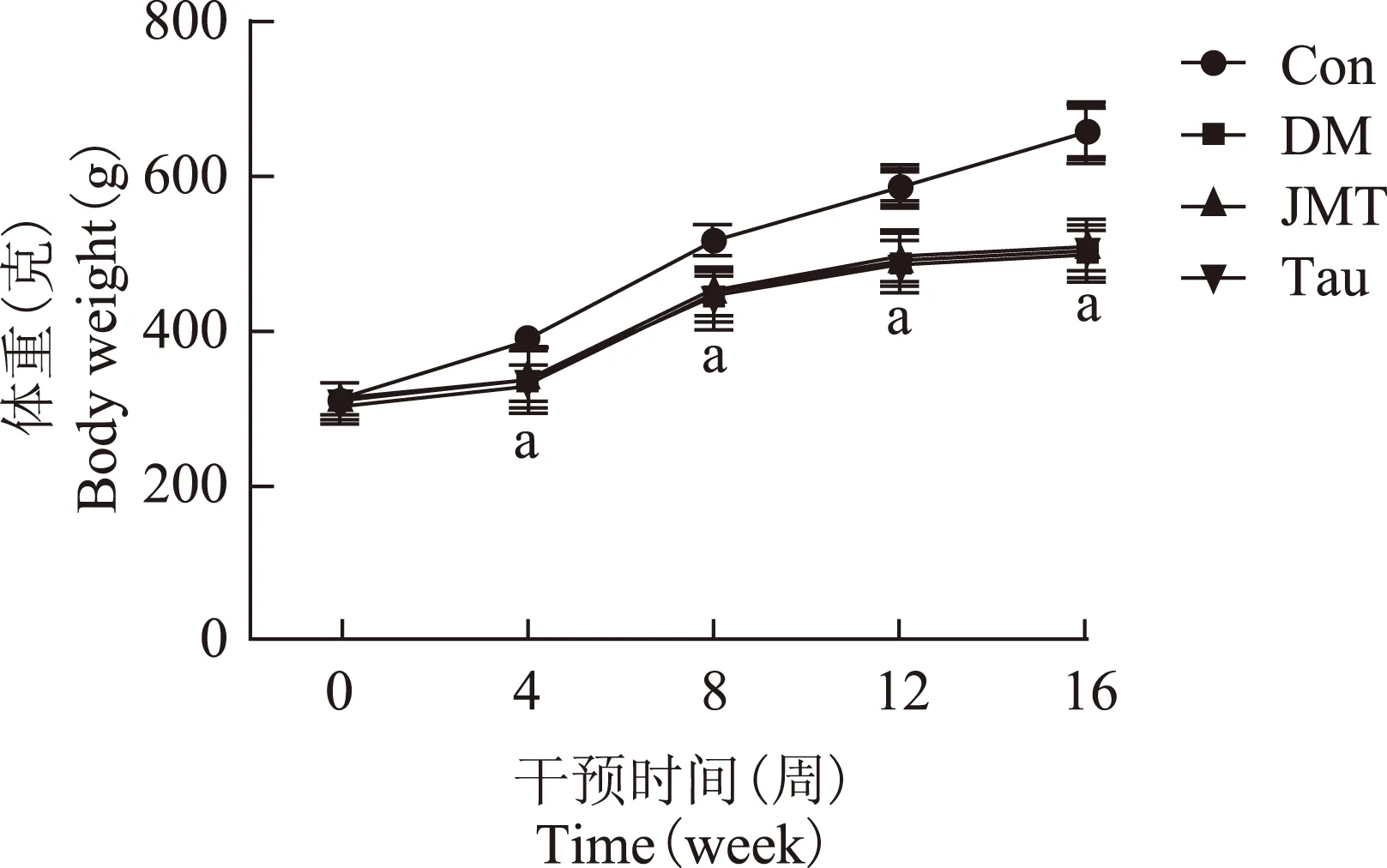
与Con组比较,aP<0.05
aP<0.05 compared with Con group
图 2 各组大鼠治疗前后体重变化
Fig 2 Changes of body weight in each group before and after treatment
免疫组织化学检测结果 Con组、DM组、JMT组和Tau组大鼠NT的AOD值分别为(6.58±0.48)×10-2、(15.72±0.73)×10-2、(7.28±0.88)×10-2和(9.67±0.79)×10-2,NGF的AOD值分别为(7.94±0.61)×10-2、(4.76±0.50)×10-2、(8.12±0.65)×10-2和(6.88±0.67)×10-2,其中,DM组的NT明显高于Con组(P=0.000),NGF明显低于Con组(P=0.006);JMT组及Tau组的NT明显低于DM组(P=0.000,P=0.000),NGF明显高于DM组(P=0.000,P=0.004);JMT组NT明显低于Tau组(P=0.004),NGF明显高于Tau组(P=0.037); JMT组的NT(P=0.273)及NGF(P=0.120)表达与Con组相比差异均无统计学意义(图3、4)。
Weston blot检测结果 Con组、DM组、JMT组和Tau组大鼠的NT蛋白表达分别为0.69±0.01、0.85±0.03、0.72±0.04和0.79±0.02,NGF蛋白表达分别为1.00±0.01、0.24±0.03、0.39±0.01和0.32±0.03,其中,DM组的NT明显高于Con组(P=0.000),NGF明显低于Con组(P=0.000);JMT组及Tau组的NT明显低于DM组(P=0.001,P=0.000),NGF明显高于DM组(P=0.000,P=0.001);JMT组的NGF明显高于Tau组(P=0.004); JMT组(P=0.026,P=0.000)和Tau组(P=0.000,P=0.000)的NT和NGF与Con组相比差异有统计学意义(图5)。
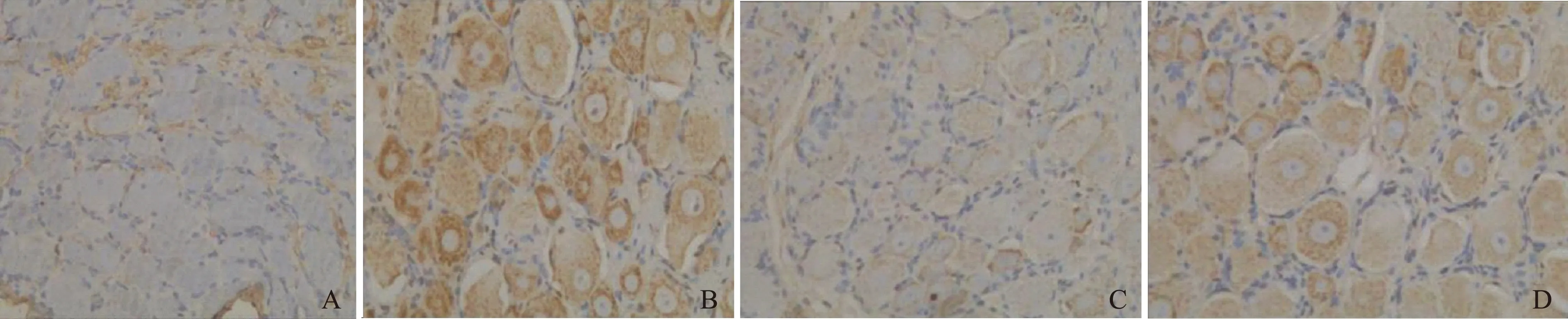
DRG:背根神经节;NT:硝基酪氨酸
DRG:dorsal root ganglion;NT:nitrotyrosine
A.Con;B.DM;C.JMT;D.Tau
图 3 大鼠DRG中NT的免疫组织化学染色(×200)
Fig 3 Immunohistochemical staining of NT in DRG of rats (×200)
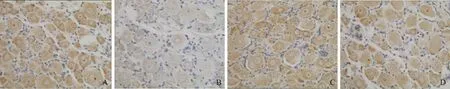
NGF:神经生长因子
NGF:nerve growth factor
A.Con;B.DM;C.JMT;D.Tau
图 4 大鼠背根神经节NGF的免疫组织化学染色(×200)
Fig 4 Immunohistochemical staining of NGF in DRG of rats(×200)
讨 论
DPN是糖尿病最常见的慢性并发症之一,远端多发对称性神经病变 (distal symmetric polyneuropathy,DSP)是其最常见的临床类型。大量研究已表明,一氧化氮(nitric oxide,NO)的产生及过氧亚硝基阴离子(peroxynitrite,ONOO-)的形成所导致的硝化应激是包括DSP在内的糖尿病并发症发生发展的重要原因[5]。NO是人体生理及病理过程中重要的介质。糖尿病时炎性介质致诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)广泛表达产生过量NO,同时糖尿病时氧化应激致O2-的产生增多[6]。由于NO 与O2-反应的速度是正常状态下超氧化物歧化酶与O2-反应速度的3倍,使得NO首先与O2-发生快速非酶促化反应生成ONOO-。ONOO-是一种强氧化剂,较NO及O2-具有更高的活性及细胞毒性,是糖尿病等疾病发生氧化及硝化应激反应时主要的氧化剂[7- 8],也是NO产生病理损伤的主要环节。ONOO-能直接导致脂质过氧化、DNA 链断裂、酶活性灭活,干扰信号传导通路[9],使线粒体功能障碍,并干扰转录调控及基因表达,使细胞发生坏死或凋亡[7- 8,10]。这些均是导致糖尿病周围感觉及运动神经及微血管功能障碍的原因[11]。此外,研究表明NO 还与轴索及髓鞘损伤及再生修复直接相关。局部过量产生的NO能损伤轴索,影响髓鞘的再生及修复,即便是低剂量慢性NO增加也能导致周围神经的损伤及糖尿病神经病变的发生[12- 13]。由于ONOO-极不稳定,生成后即与蛋白质酪氨酸残基或游离酪氨酸发生硝化反应,生成稳定的代谢产物NT,所以NT被公认是ONOO-生成的稳定的生物学标志[14],是硝化应激存在的有力证据。研究表明,DSP患者血液中NT浓度增加,且NT存在于糖尿病周围神经系统的各种细胞中[15]。
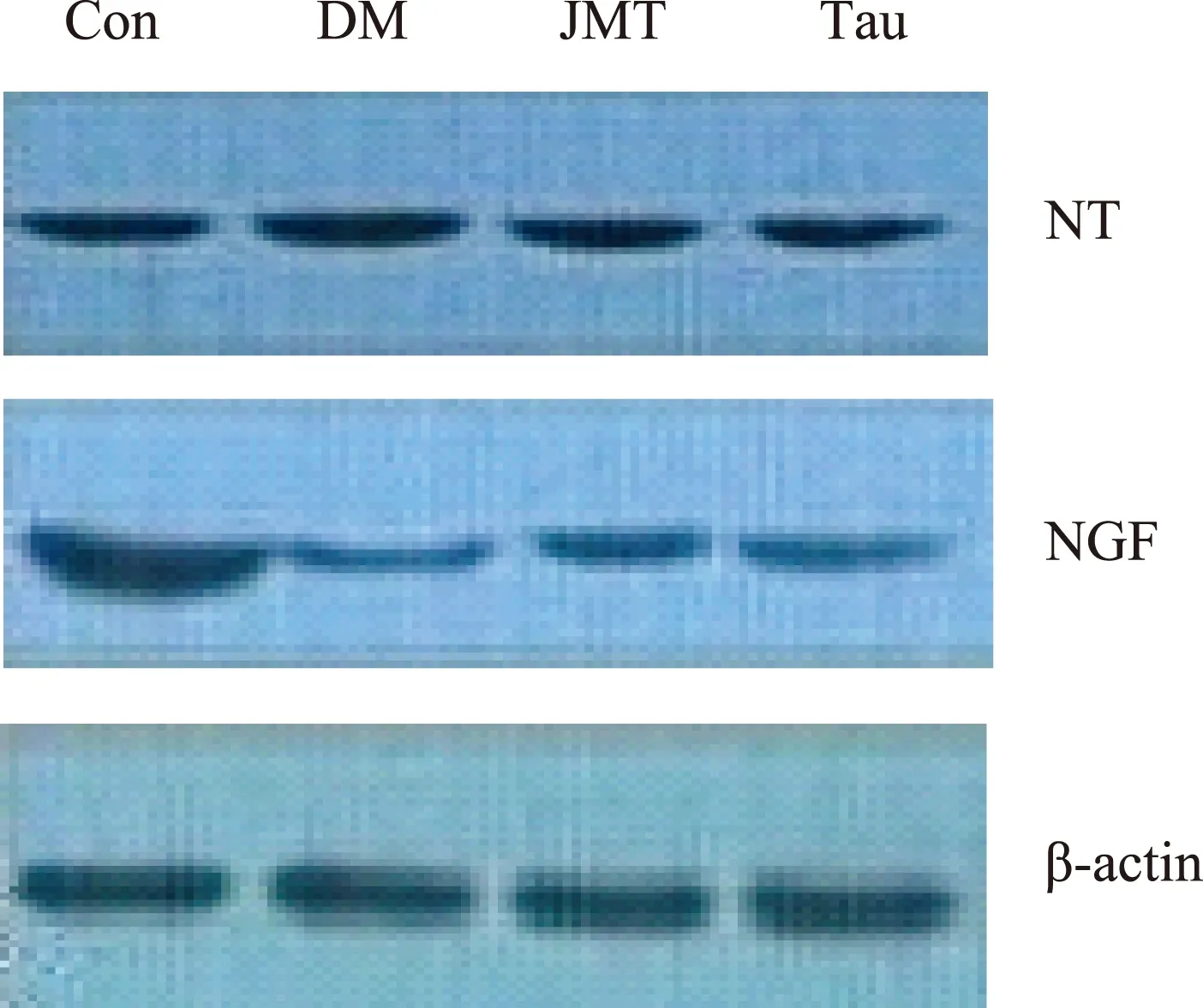
图 5 各组DRG组织中NT、NGF蛋白表达结果
Fig 5 The expressions of NT and NGF in DRG of each group
NGF是最早被发现的神经营养因子,不仅能够保护神经元,而且能够促进神经的再生和修复[16]。病理状态下NGF水平的降低可导致神经元功能障碍或死亡[17]。研究表明,糖尿病时NGF表达降低,影响了神经的修复再生[18]。硝化应激及NGF均可影响到神经的修复及再生,那么两者之间有什么关系呢?研究发现,硝化应激时产生的ONOO-可以损伤感觉神经元中NGF信号通路,使NGF信号通路中TrkA受体硝基化及p75NTR表达增加,使NGF发生异常[2],从而影响了神经的修复及再生。
本课题组多年研究发现,肾虚血瘀、筋脉不通是DPN的主要证型,并研制了复方中药JMT。JMT是由菟丝子、女贞子、水蛭、元胡、桂枝、细辛等组成,其中菟丝子和女贞子温阳育阴、阴阳俱补;元胡和水蛭活血化瘀;桂枝、细辛温经通脉。全方共奏补肾活血、温经通脉之功,临床取得良好的疗效。Tau是神经系统内含量最为丰富的游离氨基酸之一,中枢和外周神经系统的神经胶质细胞和神经末梢均含有丰富Tau。Tau作为抗氧化剂,对神经组织损伤具有各种保护作用,研究证明Tau通过抑制氧化应激作用而减轻包括DPN在内的糖尿病慢性并发症的发展[19],故本研究选用Tau作为阳性对照药物。
本研究从动物模型的建立,灌胃给药、取材等均依据课题组既往研究的经验及成果。既往研究曾经观察到成模后8周的STZ-DM大鼠坐骨神经传导速度减慢[20],成模16周DM大鼠甩尾潜伏期显著延长、痛阈值显著降低[4]。本研究结果也显示成模16周DM大鼠机械痛阈值显著降低,与既往研究结果一致,提示STZ-DM大鼠出现了痛觉过敏,说明动物模型存在感觉神经纤维受累。本研究观察到,JMT组血糖与DM组及Tau组比较,虽有偏低的趋势,但无统计学意义,说明JMT对糖尿病大鼠DRG中NT及NGF的影响可能不是通过降低血糖实现的。
DRG作为感觉传入的第1级神经元在痛觉的作用机制中占有重要地位。在糖尿病出现6个月后,DRG就可出现显著变化[21]。本研究选择DRG作为研究对象,并采用免疫组织化学法及Western blot法对DRG组织NT及NGF进行检测。因NT是酪氨酸硝基化产物,没有直接编码的mRNA,所以没有进行PCR检测。结果显示,DM组大鼠DRG组织中NT 的表达明显升高,NGF水平明显下降,证实了糖尿病状态下DRG组织中硝化应激反应明显增强,同时NGF水平显著下降。经JMT及Tau治疗16周后,两组NT的表达均显著下降,说明JMT及Tau均可抑制糖尿病大鼠DRG组织中NT的表达,减轻硝化应激反应,且JMT的作用优于抗氧化剂Tau。同时,JMT能够使NGF表达显著升高,这有可能是通过减少NT的产生,抑制硝化应激反应实现的,可能是JMT治疗DPN的机制之一。
[1]Ding R,Chen Y,Yang S,et al. Blood-brain barrier disruption induced by hemoglobininvivo:Involvement of up-regulation of nitric oxide synthase and peroxynitrite formation [J]. Brain Res,2014,1571:25- 38.
[2]Ali TK,Matragoon S,Pillai BA,et al.Peroxynitrite impairs nerve growth factor (NGF) survival signaling in sensory neurons[J].Diabetes,2008,57(4):889- 898.
[3]刘伟,梁晓春,孙青,等.筋脉通对糖尿病大鼠背根神经节氧化应激及细胞凋亡的影响[J].中国医学科学院学报,2013,35(6):649- 654.
[4]屈岭,梁晓春,吴群励,等.筋脉通对糖尿病大鼠周围神经组织神经生长因子表达的影响[J].中国中药杂志,2008,33(21):2539- 2544.
[5]Chen W,Jia Z,Zhu H,et al. Ethyl pyruvate inhibits peroxynitrite-induced DNA damage and hydroxyl radical generation:implications for neuroprotection[J]. Neurochem Res,2010,35(2):336- 342.
[6]Brownlee M. Biochemistry and molecular cell biology of diabetic complications [J]. Nature,2001,414(5):813- 820.
[7]Pacher P,Beckman JS,Liaudet L. Nitric oxide and peroxynitrite in health and disease[J]. Physiol Rev,2007,87(1):315- 424.
[8]Pacher P,Obrosova IG,Mabley JG,et al. Role of nitrosative stress and perxynitrite in the pathogenesis of diabetic complications. Emerging new therapeutical strategies[J]. Curr Med Chem,2005,12(3):267- 275.
[9]Esberg LB,Ren J.Role of nitric oxide,tetrahydrobiopterin and peroxynitrite in glucose toxicity-associated contractile dysfunction in ventricular myocytes[J].Diabetologia,2003,46(10):1419- 1427.
[10]Szabo C,Ischiropoulos H,Radi R. Peroxynitrite:biochemistry,pathophysiology and development of therapeutics[J].Nat Rev Drug Discov,2007,6(8):662- 680.
[11]Garcia-Soriano F,Virag L,Jaqtap P,et al. Diabetic endothelial dysfunction:the role of poly(ADP-ribose)polymerase activation[J]. Nat Med,2001,7(1):108- 113.
[12]Obrosova IG,Drel VR,Pacher P,et al.Oxidative-nitrosative stress and poly(ADP-ribose) polymerase (PARP) activation in experimental diabetic neuropathy:the relation is revisited[J]. Diabetes,2005,54(12):3435- 3441.
[13]Drel VR,Pacher P,Stevens MJ,et al. Aldose reductase inhibition counteracts nitrosative stress and poly(ADP-ribose) polymerase activation in diabetic kidney and high-glucose-exposed human mesangial cells[J]. Free Radic Biol Med,2006,40(8):1454- 1465.
[14]Augusto O,Gatti RM,Radi R. Spin-trapping studies of peroxynitrite decomposition and of 3-morpholinosydnonimine N-ethylcarbamide autooxidation:direct evidence for metal-independent formation of free radical intermediates[J]. Arch Biochem Biophys,1994,310(1):118- 125.
[15]Stojanovic I,Djordjevic G,Pavlovic R,et al.The importance of L-arginine metabolism modulation in diabetic patients with distal symmetric polyneuropathy[J].J Neurol Sci,2013,324(1- 2):40- 44.
[16]Yuanlin P,Xiaochun L. Chinese Medicine in diabetic peripheral neuropathy:experimental research on nerve repair and regeneration[J]. Evid Based Complement Alternat Med,2012,2012:191632.
[17]Freeman RS,Burch RL,Crowder RJ,et al. NGF deprivation-induced gene expression:after ten years,where do we stand [J].Prog Brain Res,2004,146:111- 126.
[18]Nori SL,Rocco ML,Florenzano F,et al.Increased nerve growth factor signaling in sensory neurons of early diabetic rats is corrected by electroacupuncture[J]. Evid Based Complement Alternat Med,2013,2013:652735.
[19]Drel VR,Lupachyk S,Shevalye H,et al. New therapeutic and biomarker discovery for peripheral diabetic neuropathy:PARP inhibitor,nitrotyrosine,and tumor necrosis factor-α[J].Endocrinology,2010,151(6):2547- 2555.
[20]Roman S,Hanna S,Lupachyk S,et al. Peroxynitrite and protein nitration in the pathogenesis of diabetic peripheral neuropathy[J].Diabetes Metab Res Rev,2014,30(8):669- 678.
[21]梁晓春,张宏,郭赛珊,等.筋脉通对糖尿病大鼠坐骨神经传导速度、醛糖还原酶及山梨醇浓度的影响[J].中国糖尿病杂志,2000,8(1):37- 39.
Effects of Chinese Medicinal Compound Jinmaitong on the Expression of Nitrotyrosine and Nerve Growth Factor in the Dorsal Root Ganglia of Diabetic Rats
WU Ya-nan,LIANG Xiao-chun,YANG Dan,QU Ling,LIU Wei,GAO Yun-zhou
Department of TCM,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
LIANG Xiao-chun Tel:010- 69155331,E-mail:xcliang@vip.sina.com
Objective To study the effects of Chinese medicinal compound Jinmaitong(JMT) on the expressions of nitrotyrosine (NT) and nerve growth factor (NGF) in dorsal root ganglia of diabetic rats. Methods Experimental rat diabetic models were established by the intraperitoneal injection of streptozotocin. Rat models were then randomly divided into four groups including normal control group (Con group),diabetes mellitus group (DM group),Jinmaitong group(JMT group)(treated with JMT similar to the fifteen-fold dose of adult recommended dosage),and taurine group(Tau group)(treated with Taurine similar to the fifteen-fold dose of adult recommended dosage),with 10 rats in each group. The Con and DM groups were treated with distilled water at a daily dose of 1 ml/100 g. All rats were given intragastric administration for 16 weeks and then killed. Body weight and blood glucose were detected before and at the 4th,8th,12th,and 16th week after treatment. The pain threshold to mechanical stimulation with von Frey filament were carried out before death. The expressions of NT and NGF in dorsal root ganglion were detected by immunohistochemistry and Western blot analysis,respectively. Results Immunohistochemistry showed that the average optical density (AOD) of NT expression in DM group were significantly higher than those in control group (P=0.000),and the AOD of NGF was significantly lower than the control group (P=0.006).The AOD of NT(P=0.000,P=0.000) in both treatment groups decreased significantly and the AOD of NGF(P=0.000,P=0.004)significantly increased compared with DM group. The AOD of NT in JMT group was significantly lower than Tau group (P=0.004). Western blot analysis showed that the protein level of NT in DM group was significantly higher than that in control group (P=0.000),and the protein level of NGF was significantly lower than that in control group (P=0.000). Compared with the DM group,the protein level of NT in both treatment groups significantly decreased (P=0.001,P=0.000),and the protein level of NGF increased significantly (P=0.000,P=0.001). Conclusion Traditional Chinese medicine JMT can obviously up-regulate the expressions of NGF and reduce the NT levels in dorsal root ganglia of diabetic rats.
diabetic peripheral neuropathy; dorsal root ganglion; immunohistochemistry; Western blot analysis; nitrotyrosine; nerve growth factor;Jingmaitong capsule
北京市自然科学基金(7122147)Supported by the Beijing Natural Science Foundation(7122147)
梁晓春 电话:010- 69155331,电子邮件:xcliang@vip.sina.com
R445.2
A
1000- 503X(2016)05- 0507- 07
10.3881/j.issn.1000- 503X.2016.05.003
2015- 09- 21)
