骨髓间充质干细胞与内皮细胞平面共培养促进微血管网形成的初步研究
2016-11-18张磊付炜张文白洁冯蓓唐梓清张海波
张磊 付炜 张文 白洁 冯蓓 唐梓清 张海波
骨髓间充质干细胞与内皮细胞平面共培养促进微血管网形成的初步研究
张磊付炜张文白洁冯蓓唐梓清张海波
目的研究大鼠骨髓间充质干细胞(BMSCs)与内皮细胞(ECs)在不使用Matrigel等基质,以及在含或不含血清的条件下,于普通平面培养皿上共培养的成网能力,为日后两类细胞相互作用的研究提供一种外界干扰最少的共培养条件。方法以全骨髓贴壁培养法分离培养大鼠BMSCs,并从培养形态、细胞表面标记物和三系分化能力等方面予以鉴定。以添加或不添加10%FBS的低糖DMEM为培养液,将大鼠BMSCs与ECs共培养于普通平面培养皿上,连续观察微血管网的形成过程,并通过CM-Dil标记特定细胞的方法了解血管网中细胞构成。平滑肌细胞标记物SM22α,Calponin及内皮细胞标记物CD31被用于检测上述条件下微血管网中细胞标记物变化。结果通过全骨髓贴壁培养可分离并获得大鼠BMSCs。在含10%FBS条件下,细胞于普通平面培养皿上共培养8 d可形成明显的微血管网,微血管网由大鼠BMSCs和ECs共同构成;在无血清共培养条件下,大鼠BMSCs和ECs可于24 h内共同参与形成微血管网。免疫荧光染色显示CD31+细胞和SM22α+/Calponin+细胞共同构成网状结构。结论在普通平面培养皿上,以含血清或不含血清的培养液共培养大鼠BMSCs和ECs均可形成微血管网。
骨髓间充质干细胞内皮细胞共培养微血管网
组织器官中的微小血管是保障组织正常生理代谢和养料供给的重要结构。然而,体外新构建的组织工程组织或器官,一般尚缺乏微小血管,因此体内移植后早期的营养供给主要依靠周围组织液渗透。但溶解的氧气向组织中渗透的深度不到200μm[1],因此对于大部分组织工程组织或器官,是否具有或能否快速形成微小血管,是其移植成功的关键,也一直是组织工程研究的重要课题[2]。
为了实现组织工程组织的血管化,提出了支架材料改造、添加促血管生成相关因子[3]、体内预血管化[4]等方法。这些方法基于新生血管形成的基本环节,其特征是材料或组织植入后,自体滋养血管缓慢长入,但效率较低。近年来,于体外直接构建组织微血管,尤其是基于血管内皮细胞共培养的血管新生方法开始受到越来越多重视。作为参与新生血管形成的主要细胞,内皮细胞可与血管平滑肌相互作用:共培养体系中,前者可促进平滑肌细胞增殖,并提高平滑肌中α-SMA及Calponin等标记物的含量[5]。当内皮细胞与血管周细胞、脂肪基质细胞等具有干细胞性的间质细胞共培养时,体外可自发形成微血管网[6]。由于这种微血管网的形成被认为是血管新生的重要过程,因此在体外实验中,是否观察到这种自发形成的微血管网,是评价内皮细胞与另一种细胞共培养后能否可以促进新生血管形成的标志[7]。
尽管自发形成的微血管网已被证明是共培养的内皮细胞与其中的间充质干细胞直接接触后相互作用的结果,并与该过程中细胞分泌的白细胞介素1β(IL-1β)、IL6等细胞因子有关[8],但随着研究的深入,共培养条件对微血管网形成的影响受到关注。Li等[9]认为,传统的基质胶(Matrigel)作为研究共培养体系中微血管形成的支持基质是不合适的,因此他们有意识地选择普通培养皿作为共培养载体,以排除基质胶对其他细胞的非特异性促微血管网形成作用[10]。另外,作为培养液常用的添加物,胎牛血清(FBS)对微血管网形成的影响也开始受到重视[11]。但事实上,多数研究依然添加FBS,并使用含内皮细胞支持成分的培养液,这都可能对研究间充质干细胞与内皮细胞共培养的相互作用造成潜在影响。
本研究中,我们以大鼠骨髓间充质干细胞(BMSCs)和内皮细胞(ECs)为实验对象,在普通平面培养皿中直接共培养,并以添加或不添加FBS的低糖DMEM为培养液,探索上述细胞在较单一的外界条件下自发形成微血管网的能力,为今后研究上述细胞的相互作用,提供外界作用最少的共培养条件。
1 材料与方法
1.1材料
体质量(150±10)g雄性清洁级SD大鼠(上海斯莱克实验动物有限公司)。大鼠主动脉内皮细胞(Cell Application公司,cat.#R304K-05a)。
低糖DMEM培养液(Hyclone,美国),胎牛血清(Novogen,澳大利亚),OriCellTMSD Rat Mesenchymal Stem Cell Condrogenic Differentiation Medium、Osteogenic Differentiation Medium、Adipogenic Differentiation Medium(OriCell,美国),抗大鼠CD11b、CD29、CD31、CD44、CD45单抗(eBioscience,美国),CellTrackerTMCM-Dil(Invitrogen,美国),Anti-SM22 alpha antibody、Anti-CD31[HEC7]antibody、Calponin、Donkey Anti-Mouse IgG H&L、Donkey Anti-Rabbit IgG H&L(Abcam,美国)。
1.2方法
1.2.1大鼠BMSCs的分离和培养
采用全骨髓贴壁法分离培养大鼠BMSCs[12]:将大鼠颈椎脱臼处死后,完全浸泡于75%乙醇,10 min后取出。在无菌条件下完整分离大鼠股骨或胫骨。取出的股骨或胫骨用低糖DMEM培养液清洗后,转入10 m L含10%FBS和1%青霉素/链霉素的低糖DMEM培养液中。用止血钳夹碎骨骼一端,再用10m L无菌注射器抽取培养液,从骨骼断端插入,反复冲洗出骨髓。将所得的含骨髓的培养液转移到10 cm培养皿中,置于37℃、含5%CO2的培养箱静置恒温培养。原代细胞静置培养24 h后换液,换液时用PBS洗去培养皿底部不贴壁的细胞。以后每2天换液,细胞达到60%~70%融合时传代。传代后的细胞每2~3天换液,当其达到70%融合后再传代。第3代大鼠BMSCs用于后续实验。
1.2.2大鼠BMSCs的鉴定
由于大鼠BMSCs在不同的培养阶段具有特定的细胞形态,因此原代和传代后的大鼠BMSCs可通过倒置相差显微镜观察,予以形态学方面的鉴别。为了解分离培养细胞的表面标记物,第3代大鼠BMSCs用胰酶消化后重悬于200μL PBS,根据试剂操作说明,分别加入抗大鼠CD11b、CD29、CD31、CD44和CD45单抗[13],于4℃条件下避光孵育30min。标记细胞用PBS洗涤后,通过流式细胞仪对其表面标记物予以鉴定[14-15]。未标记的细胞作为阴性对照。为了验证上述获得的大鼠BMSCs具有三系分化能力,我们按照OriCellTMSD Rat Mesenchymal Stem Cell Condrogenic Differentiation Medium、Osteogenic Differentiation Medium和Adipogenic Differentiation Medium说明书的指导方案,分别诱导其成骨、成脂肪和成软骨,并完成特殊染色。
1.2.3大鼠BMSCs和ECs的共培养
根据我们预实验的结果和类似文献的报道,我们将大鼠BMSCs和ECs按照4.0×104cells/cm2和1.3×104cells/cm2的密度种植于6孔板,以含10% FBS和1%青霉素/链霉素的低糖DMEM为培养液,分别于共培养24 h、48 h、4 d和8 d动态观察微血管网的形成情况。为了进一步观察两种细胞在无血清培养条件时的成网能力,以相同的实验方法,将细胞培养于仅添加有1%青霉素/链霉素的低糖DMEM培养液中培养观察。
1.2.4微血管网的细胞来源构成
为了解何种细胞参与构成了微血管网,实验中将其中一种细胞标记红色荧光,再按照上述有血清条件下共培养的方法培养8 d,最后通过荧光显微镜观察,标记有红色荧光的细胞在微血管网结构中的定位。具体方法是,以PBS重悬待染色的细胞至1.0×106cells/mL,每毫升细胞液加入5μL CM-Dil染液。将标记的细胞置于37℃培养箱孵育5 min后,再转移至4℃冰箱孵育15 min,完成细胞荧光标记。处理后的细胞用PBS洗涤2次。实验时,将标记有CM-Dil的大鼠BMSCs与未标记的ECs,或标记有CM-Dil的ECs和未标记的大鼠BMSCs按上述已确定的比例混合,并以含10%FBS培养液共培养,8 d后用荧光显微镜观察标记细胞的分布。将标记有CM-Dil的ECs和未标记的大鼠BMSCs共培养于无血清低糖DMEM培养液,24 h后用荧光显微镜观察带荧光细胞与未带荧光细胞间的定位关系。1.2.5共培养体系中的细胞分化
为了解共培养体系中大鼠BMSCs的表型变化,我们以相同的种植密度,将大鼠BMSCs和ECs共培养于24孔板中,以含10%FBS的培养液共培养8 d后固定,完成免疫荧光染色。在无血清培养条件下,共培养24 h后,完成免疫荧光染色。实验中内皮细胞标记物CD31被标记为红色,平滑肌细胞标记物calponin或SM22α标记为绿色;最后用DAPI套染细胞核。
2 结果
2.1大鼠BMSCs的培养
原代细胞在培养皿中培养3 d后,倒置相差显微镜下可见贴壁细胞呈棒状或纺锤状,细胞聚集呈克隆样生长(图1A)。培养至第7天时,细胞克隆变大,细胞增多(图1B)。细胞传代后,细胞分散生长,呈长梭形(图1C)。
2.2大鼠BMSCs的细胞表面标记物检测和三系分化能力鉴定
以流式细胞技术对第3代大鼠BMSCs的几种表面标记物予以鉴定。结果表明,分离培养的细胞CD11b、CD31、CD45呈阴性,CD29、CD44为阳性(图2A)。我们还进一步检测了该大鼠BMSCs的三系分化能力。细胞成脂诱导4周后,可见细胞中出现大小不一具有强折光性、且能被油红O染为红色的脂滴。细胞成骨诱导3周,可见由茜素红S染为红色的钙盐沉积。细胞软骨诱导4周可形成坚实的软骨球,通过免疫组化染色,可见棕色染色的Ⅱ型胶原,证明有软骨细胞生成(图2B-D)。通过上述细胞形态、表面标记物、三系分化能力等方面的鉴定,我们认为,通过大鼠全骨髓贴壁法可获得较纯的大鼠BMSCs。2.3大鼠BMSCs和ECs普通平面培养皿上共培养
将两种细胞按既定的比例混合,以含10%FBS的低糖DMEM培养液,在普通平面培养皿上培养,第4天可见共培养体系中部分细胞开始聚集成条索网状,到共培养第8天,条索中聚集的细胞增多,相互间开始连接成网,表明微血管网形成,且明显高出周围的细胞(图3A-D)。相同条件下,单独培养的ECs或大鼠BMSCs在整个过程中仅表现为细胞数量增多,长满培养皿,未见条索样微血管网形成(图3E-F)。
2.4大鼠BMSCs和ECs平面共培养后的细胞表型变化
为了解共培养微血管网形成后的细胞表型变化,我们通过免疫荧光染色对内皮细胞标记物CD31、平滑肌细胞标记物SM22α和Calponin进行染色。单独培养于含血清培养液中的内皮细胞,其CD31+,SM22α-和Calponin-;而单独培养的第3代大鼠BMSCs基本不表达SM22α及Calponin。上述两种细胞在含血清培养液中共培养8 d后,可见微血管网形成。免疫荧光染色显示,血管网条索中存在CD31+细胞(图4A);同时出现大量SM22α+及Calponin+细胞。这些具有平滑肌细胞标记物的细胞,大部分位于微血管网状结构上(图4B-C),表明微血管出现的同时,其构成细胞向平滑肌发生分化,分化的细胞聚集构成微血管网。
2.5微血管网的细胞来源构成
为了解共培养体系中微血管网的细胞构成来源,我们首先用CM-Dil活细胞染料将大鼠BMSCs标记红色荧光,再与未标记的ECs共培养。共培养第8天,微血管网形成,荧光显微镜观察见微血管网结构中红色荧光标记的大鼠BMSCs(图5A-C)。我们将ECs单独用CM-Dil标记红色荧光,并与未标记的大鼠BMSCs共培养。在第8天可见明显的微血管网形成,且有ECs标记的红色荧光(图5D-F)。上述现象说明,有血清平面共培养条件下,微血管网主要由大鼠BMSCs和ECs共同构成。
2.6无血清及平面共培养下微血管网的自发形成
无血清条件下共培养可以排除动物血清成分对实验结果的影响。因此,我们进一步将上述两种细胞在无血清低糖DMEM培养液中培养。结果显示,共培养17 h后细胞即可相互连接,构成明显的网状结构(图6A)。对照组中,单独培养的ECs或大鼠BMSCs在无血清培养液中无法形成类似的网状结构(图6B-C)。用CM-Dil标记ECs,与未标记的大鼠BMSCs共培养后,还可以观察到带红色荧光的ECs及不带荧光的大鼠BMSCs共同参与形成微血管网(图6 D-F)。与有血清条件共培养不同的是,无血清条件下形成的微血管网于3 d内迅速消失,不能长期维持。免疫荧光染色结果显示,网状结构中内皮细胞标记物CD31+细胞与平滑肌标记物SM22α+或Calponin+细胞共同构成微血管网(图6G-H)。上述实验现象说明,两种细胞在无血清条件下于平面培养皿中共培养依然可以自发形成微血管网。

图1 不同培养时期大鼠BMSCs的形态(标尺:100μm)Fig.1 Them orphology of the culturing rat bonem ar row stem cells(BM SCs).(Scale bar:100μm)
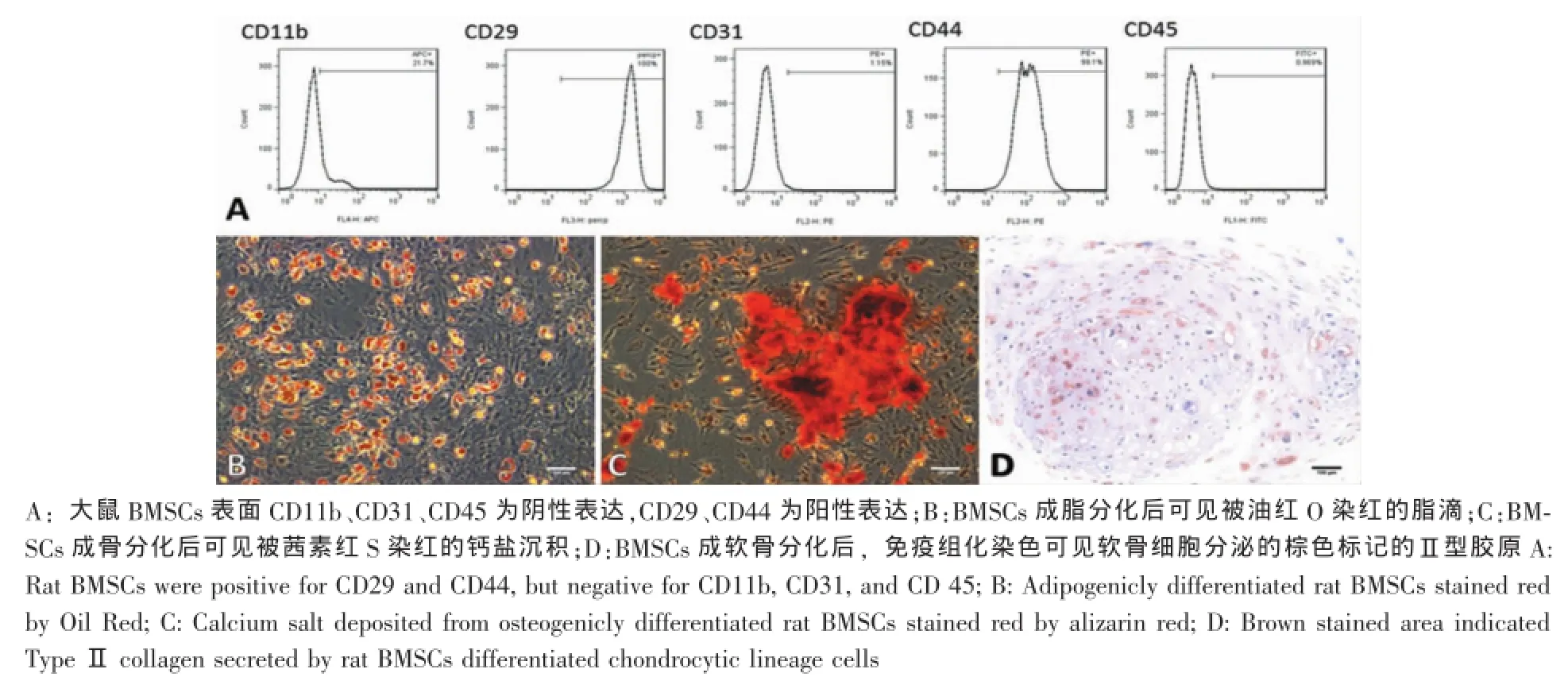
图2 大鼠BMSCs细胞表面标记物和三系分化鉴定(标尺:100μm)Fig.2 Cell surface phenotypes and trilineage differentiation of rat bonem arrow stem cells(BMSCs)(Scale bar:100μm)

图3 大鼠BMSCs和ECs在普通平面培养皿中共培养(标尺:A-C 100μm;D-F 200μm)Fig.3 Rat bonem arrow stem cells(BMSCs)and endothelial cells(ECs)co-cultured on two-dim ensional p lastic tissue cu lture p late (Scale bars:A-C 100μm;D-F 200μm)
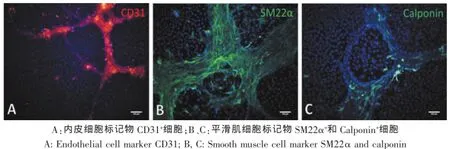
图4 在含10%FBS低糖DMEM培养条件下,平面培养皿中共培养8 d后,共培养细胞的细胞表型鉴定(标尺:100μm)Fig.4 Imm unofluorescent stain ing of cellm arker of the vascular network form ed 8 days after co-cultured in m ed ium containing 10%FBS.(Scale bar:100μm)
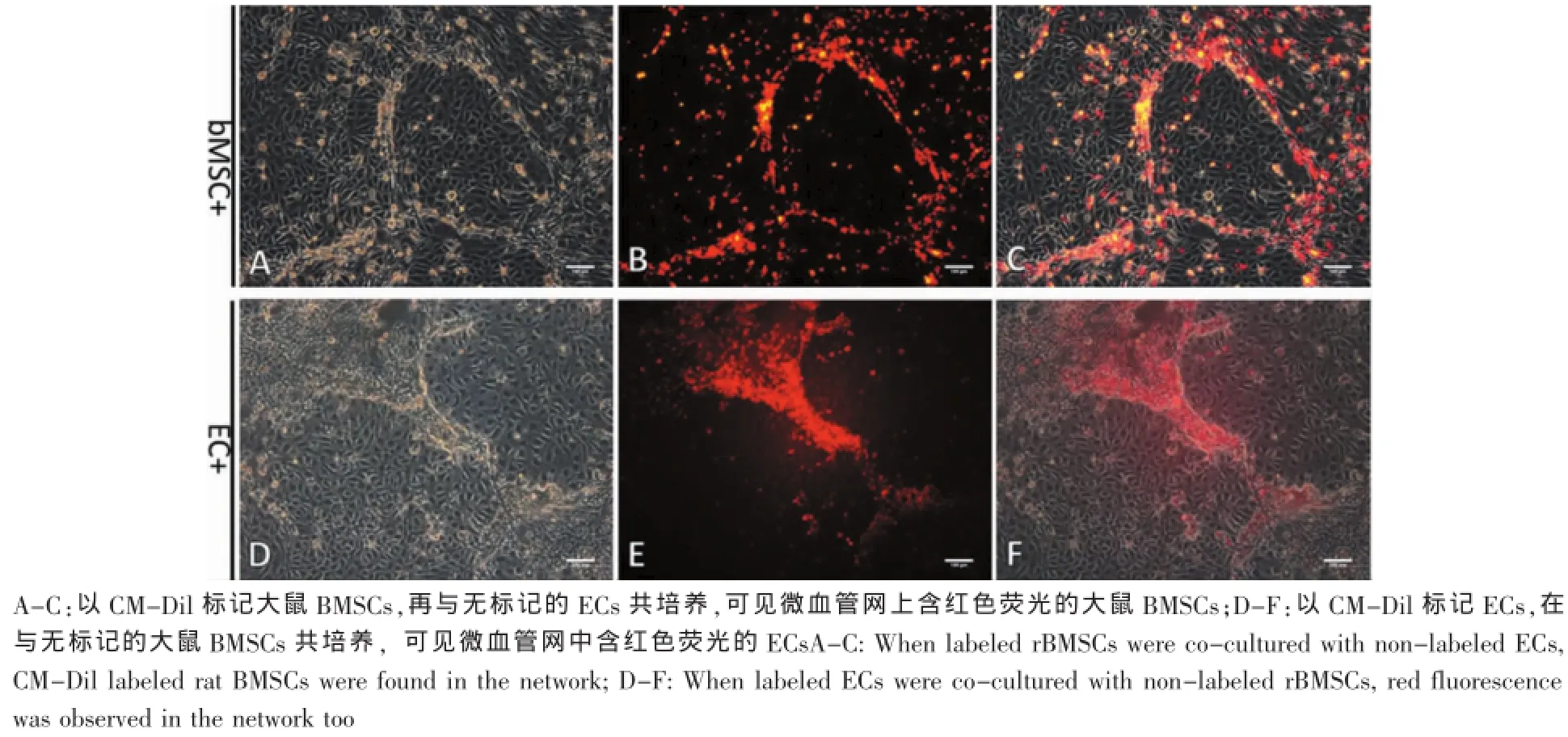
图5 有血清平面共培养条件下微血管网的细胞构成(标尺:100μm)Fig.5 Cell constitu tion of the vascular network from rat bonemarrow stem cells(rBMSCs)and endothelial cells(ECs)co-cultured on p lastic tissue culture p late.(Scale bars:100μm)
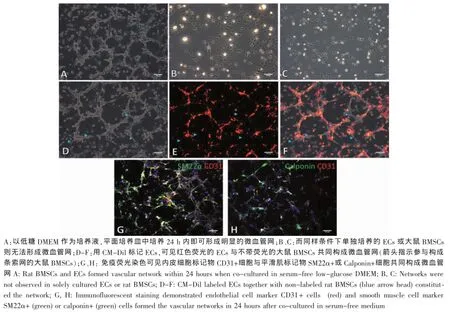
图6 无血清平面共培养条件下的微血管网的形成和细胞构成(标尺:100μm)Fig.6 Vascular network form ation and cell constitution in serum-free co-culture condition on p lastic two-dim ensional tissue culture p late(Scale bars:100μm)
3 讨论
BMSCs是一类来源于骨髓,具有自我更新能力和多向分化潜能的细胞。由于其容易获取与培养扩增,因此广泛应用于再生医学研究。本实验中,我们首先通过形态观察,确认抽取培养的骨髓细胞具有BMSCs的一般特征。根据Li等[12]的描述,原代培养24 h的BMSCs呈棒状或纺锤状,并逐渐于原代培养第1~5天形成大小不一的细胞克隆。这与我们分离培养的原代骨髓细胞的生长形态一致。传代后的骨髓细胞在融合后呈螺旋状排列,也符合典型的BMSCs形态描述[12]。针对BMSCs表面标记物,我们获取的骨髓细胞CD11b、CD31、CD45呈阴性,CD29、CD44为阳性,符合文献中BMSCs的一般特征[13]。而三系分化实验还证明了该骨髓细胞具有成骨、成软骨和成脂肪潜能。因此可以认为,我们通过全骨髓贴壁分离培养的骨髓细胞是BMSCs。
尽管MSC与ECs相互作用可促进微血管网形成,但培养条件及外源物质干扰对共培养体系的潜在影响尚未获得普遍重视。已知内皮细胞培养于基质胶中可自发形成网状结构。因此,基质胶成管实验被广泛用于鉴定内皮细胞或评价干细胞向内皮细胞分化[16]。由于所用的基质胶(Matrigel)来源于Engelbreth-Holm-Swarm小鼠肉瘤细胞分泌的细胞外基质,其来源情况复杂,因此基于基质胶的实验依然存在诸多影响结果的不确定因素:一方面,在基质胶中成网并不是内皮细胞才具有的特征[10],将含MSC细胞团的基质胶移植到裸鼠皮下后,MSC可向内皮细胞分化[17];另一方面,不同生产来源的基质胶对内皮细胞的作用也不尽相同,甚至产生截然不同的结果[18]。因此,在本实验中,我们采用了以普通培养皿平面条件下共培养的方法。这是研究细胞间相互作用最直接的方法,同时也避免了基质胶引起的不确定的实验结果。实验表明,平面培养皿中的BMSCs和ECs,在含10%FBS低糖DMEM培养液中共培养8 d,即可明显聚集成由BMSCs与ECs共同组成的微血管网。这与Merfeld-Clauss等[11,19]的实验结果一致。他们将ECs与脂肪间充质细胞在二维条件下共培养6 d后可见明显的微血管网。
无血清培养从培养液层面杜绝了血清中复杂成分对实验结果可能造成的影响。研究发现,BMSCs可于无血清MEM培养液中培养2~4周,且不影响其增殖和分化能力[20]。在此基础上,我们设想将BMSCs和ECs在平面共培养于单纯DMEM培养液中,以探索无血清DMEM作为培养液时是否仍能形成微血管网。结果显示,共培养的细胞依然可以相互连接形成网状结构,然而与含血清培养液共培养条件下形成的细胞网不同,无血清条件下微血管网形成的时间更短(24 h以内)、参与形成微血管网的细胞更少、稳定维持的时间变短(<3 d)。但可以确定的是,微血管网依然由BMSCs与ECs共同形成。
在不同的共培养条件及时间下,共培养体系中自发形成的微血管网的特征不同。总结文献报道中的网络形态,在培养皿中二维共培养的细胞,在共培养24 h内形成者,微血管网条索细,由单细胞相互连接形成[9]。而长时间(如1周左右)共培养下形成的微血管网条索中则聚集有大量细胞,因而粗大,且可以观察到中间包围的未被募集的平滑肌细胞标记物阴性的细胞[11]。这与我们实验中出现的两类微血管网形态一致。
共培养细胞的直接接触是间充质干细胞-内皮细胞网形成的必要条件[19]。在其形成过程中,还会发生细胞表型变化。我们的实验中,随微血管网出现的还有参与其构成的SM22α+和Calponin+细胞,且该细胞的出现与培养液条件无关。既往的研究将脐血间充质干细胞与内皮细胞在Matrigel中培养,可观察到共培养体系细胞中SM22、SMA这类平滑肌细胞相关基因表达增高[21]。有研究指出,间充质干细胞与内皮细胞接触共培养后,间充质干细胞内TGF-β表达上调。Hirschi等将具有多能性10T1/2细胞与内皮细胞共培养,发现前者可新表达SM22α与Calponin等平滑肌标记物。这与TGFβ诱导10T1/2细胞表达平滑肌细胞标记物结果类似;而中和共培养体系中的TGFβ则可阻断平滑肌细胞标记物的表达[22],并阻断这两种细胞在Matrigel共培养体系中微血管网的形成[23]。Lin等[24]通过在脂肪间充质干细胞与内皮细胞共培养体系中加入TGFβ1受体阻断剂后,不仅微血管网形成明显受到抑制,还可下调内皮细胞VEGF、VE-cadherin等因子的表达。另外,间充质干细胞还可被VEGF诱导分化为内皮细胞[25]。
综合上述实验结果,我们认为,大鼠BMSCs与ECs在普通平面培养皿中,以添加或不添加10% FBS的低糖DMEM为培养液共培养,可以观察到明显的自发微血管网形成。这说明上述条件可以作为研究这两种细胞相互作用的“最低条件”,以获得最直接和准确的实验结果。但我们的实验也还存在不足,比如尚未观察到共培养体系中细胞趋化迁移的过程,也不能明确证明共培养后CD31+,SM22α+或Calponin+细胞来源于何种细胞,以及共培养前后的定量关系。这些问题还将在今后的研究中逐步完善。
[1]Carmeliet P,Jain RK.Angiogenesis in cancer and other diseases [J].Nature,2000,407(6801):249-257.
[2]Rouwkema J,Rivron NC,van Blitterswijk CA.Vascularization in tissue engineering[J].Trends Biotechnol,2008,26(8):434-441.
[3]Gorin C,Rochefort GY,Bascetin R,et al.Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion[J]. Stem Cells Transl Med,2016,5(3):392-404.
[4]Schumann P,LindhorstD,von See C,etal.Accelerating the early angiogenesis of tissue engineering constructs in vivo by the use of stem cells cultured in matrigel[J].JBiomed Mater Res A,2014, 102(6):1652-1662.
[5]Chaterji S,Park K,Panitch A.Scaffold-free in vitro arterial mimetics:the importance of smooth muscle-endothelium contact [J].Tissue Eng Part A,2010,16(6):1901-1912.
[6]Sarkanen JR,Vuorenpaa H,Huttala O,et al.Adipose stromal cell tubule network model provides a versatile tool for vascular research and tissue engineering[J].Cells Tissues Organs,2012, 196(5):385-397.
[7]Blocki A,Wang Y,Koch M,etal.NotallMSCs can actas pericytes: functional in vitro assays to distinguish pericytes from other mesenchymal stem cells in angiogenesis[J].Stem Cells Dev, 2013,22(17):2347-2355.
[8]Li J,Ma Y,Teng R,etal.Transcriptional profiling reveals crosstalk between mesenchymal stem cells and endothelial cells promoting prevascularization by reciprocalmechanisms[J].Stem Cells Dev, 2015,24(5):610-623.
[9]LiH,Daculsi R,Grellier M,et al.The role of vascular actors in two dimensional dialogue of human bonemarrow stromal cell and endothelial cell for inducing self-assembled network[J].PLoS One,2011,6(2):e16767.
[10]Donovan D,Brown NJ,Bishop ET,et al.Comparison of three in vitro human"angiogenesis"assays with capillaries formed in vivo [J].Angiogenesis,2001,4(2):113-121.
[11]Merfeld-Clauss S,Lupov IP,Lu H,et al.Adipose stromal cells differentiate along a smooth muscle lineage pathway upon endothelial cell contact via induction of activin A[J].Circ Res, 2014,115(9):800-809.
[12]Li X,Zhang Y,Qi G.Evaluation of isolation methods and culture conditions for rat bone marrow mesenchymal stem cells[J]. Cytotechnology,2013,65(3):323-334.
[13]Liu J,Wang Y,Wu Y,et al.Sodium butyrate promotes the differentiation of rat bone marrow mesenchymal stem cells to smooth muscle cells through histone acetylation[J].PLoSOne, 2014,9(12):e116183.
[14]Huang WH,Chen HL,Huang PH,et al.Hypoxic mesenchymal stem cells engraft and ameliorate limb ischaemia in allogeneic recipients[J].Cardiovasc Res,2014,101(2):266-276.
[15]Liu Y,Deng B,Zhao Y,et al.Differentiated markers in undifferentiated cells:expression of smooth muscle contractile proteins in multipotent bonemarrow mesenchymal stem cells[J]. Dev Growth Differ,2013,55(5):591-605.
[16]Zhang R,Wang N,Zhang LN,et al.Knockdown of DNMT1 and DNMT3a promotes the angiogenesis of humanmesenchymal stem cells leading to arterial specific differentiation[J].Stem Cells, 2016,34(5):1273-1283.
[17]Qiu X,Zhang Y,Zhao X,et al.Enhancement of endothelial differentiation of adipose derived mesenchymal stem cells by a three-dimensional culture system of microwell[J].Biomaterials, 2015,53:600-608.
[18]Patel R,Alahmad AJ.Growth-factor reduced Matrigel source influences stem cell derived brain microvascular endothelial cell barrier properties[J].Fluids Barriers CNS,2016,13:6.
[19]Merfeld-Clauss S,Gollahalli N,March KL,et al.Adipose tissue progenitor cells directly interactwith endothelial cells to induce vascular network formation[J].Tissue Eng Part A,2010,16(9): 2953-2966.
[20]Pochampally RR,Smith JR,Ylostalo J,et al.Serum deprivation ofhumanmarrow stromal cells(hMSCs)selects for a subpopulation of early progenitor cells with enhanced expression of OCT-4 and other embryonic genes[J].Blood,2004,103(5):1647-1652.
[21]LeeWY,WeiHJ,Wang JJ,etal.Vascularization and restoration of heart function in ratmyocardial infarction using transplantation of human cBMSC/HUVEC core-shell bodies[J].Biomaterials, 2012,33(7):2127-2136.
[22]Hirschi KK,Rohovsky SA,D'Amore PA.PDGF,TGF-beta,and heterotypic cell-cell interactionsmediate endothelial cell-induced recruitment of 10T1/2 cells and their differentiation to a smooth muscle fate[J].JCell Biol,1998,141(3):805-814.
[23]Darland DC,D'Amore PA.TGF beta is required for the formation of capillary-like structures in three-dimensional cocultures of 10T1/2 and endothelial cells[J].Angiogenesis,2001,4(1):11-20.
[24]Lin S,Xie J,Gong T,et al.TGFbeta signalling pathway regulates angiogenesis by endothelial cells,in an adipose-derived stromal cell/endothelial cell co-culture 3D gel model[J].Cell Prolif, 2015,48(6):729-737.
[25]Shen Y,Zuo S,Wang Y,et al.Thromboxane governs the differentiation of adipose-derived stromal cells toward endothelial cells in vitro and in vivo[J].Circ Res,2016,118(8):1194-1207.
Two-D imensional Co-Culture of Bone M arrow Mesenchymal Stem Cells and Endothelial Cells for Inducing the Self-Assemb led Vascular Network
ZHANG Lei1,FU Wei1,2,ZHANG Wen1,BAI Jie1,2,FENG Bei1,2,TANG Ziqing1, ZHANG Haibo1.1 Department of Pediatric Cardiothoracic Surgery;2 Institute of Pediatric Translational Medicine,Shanghai Children's Medical Center,School of Medicine,Shanghai Jiaotong University,Shanghai200127,China.Corresponding author: ZHANGHaibo(E-mail:haibo.z@yahoo.com).
Objective To observe the vascular network formation by co-culturing rat bone marrow mesenchymal stem cells(BMSCs)and endothelial cells(ECs)under conditions of two-dimensional co-culturing with/without serum,which would provide a minimum basal co-culture condition for the further study of the interactions between the cells.M ethods Rat BMSCs were isolated by direct adherence of the whole bonemarrow,and were identified by cellmorphology,cell surface antigens and three-lineage differentiation.Low-glucose DMEM with/without 10%FBSwas used during the co-culture of rat BMSCs and ECs,followed by a consecutive observation of the vascular network formation.CM-Dil solely labeled rat BMSCs or ECs were then co-cultured to verify the cell type within the network.Finally,immunofluorescent staining of EC marker CD31 and smoothmuscle cellmarker SM22αand Calponin was used to identify the cell differentiation during the co-culture. Resu lts Whole marrow direct adherence was used to isolate rat BMSCs successfully.With medium containing 10%FBS, co-cultured cells assembled vascular network in 8 days,which was formed together by rat BMSCs and ECs.In serum-free medium,however,self-assembled vascular network was formed together by co-cultured cells within 24 hours.In both settings,CD31+cells and SM22αor Calponin weremostly seen in the network structure.Conclusion Rat BMSCs and ECscan be co-cultured on two-dimensional plateswith/without serum-containingmedium for the induction of the self-assembled vascular network.
Bonemarrow mesenchymal stem cell;Endothelial cell;Co-culture;Vascular network
Q813.1+2
A
1673-0364(2016)05-0269-08
10.3969/j.issn.1673-0364.2016.05.001
国家自然科学基金(31200735);上海市科委基金(134119a0400,15411966800);上海卫生和计划生育委员会项目(20144Y0166);东南大学生物电子学国家重点实验室开放研究基金。
200127上海市上海交通大学医学院附属上海儿童医学中心心胸外科(张磊,付炜,张文,白洁,冯蓓,唐梓清,张海波);儿科转化医学研究所(付炜,白洁,冯蓓)。
张海波(E-mail:haibo.z@yahoo.com)。
(2016年8月14日;
2016年9月27日)
