新疆杏果实发育过程中可溶性糖和有机酸的变化
2016-11-17郑惠文张秋云李文慧章世奎席万鹏
郑惠文,张秋云,李文慧,章世奎,席万鹏,3
(1西南大学园艺园林学院,重庆400716;2新疆农科院轮台国家果树资源圃,新疆轮台 841600;3南方山地园艺学教育部重点实验室,重庆 400715)
新疆杏果实发育过程中可溶性糖和有机酸的变化
郑惠文1,张秋云1,李文慧2,章世奎2,席万鹏1,3
(1西南大学园艺园林学院,重庆400716;2新疆农科院轮台国家果树资源圃,新疆轮台 841600;3南方山地园艺学教育部重点实验室,重庆 400715)
【目的】明确新疆杏果实可溶性糖和有机酸的组成与含量特征,揭示果实发育过程中糖、酸动态变化规律。【方法】以5个新疆杏品种不同发育阶段的果皮和果肉为试验材料,使用高效液相色谱法(high performance liquid chromatograph,HPLC)检测各样品中可溶性糖和有机酸,对比分析果实发育过程中其组成与含量的变化情况。【结果】从新疆杏果实中共检测到3种可溶性糖(蔗糖、葡萄糖和果糖)。其中,蔗糖和葡萄糖为主要糖。果实成熟时,果皮中两种主要糖分别占总糖含量的60.7%—79.1%和13.5%—34.7%,果肉中占总糖含量的65.5%—82.4%和8.2%—25.9%,果皮、果肉中果糖的含量相对较低,仅占总糖含量的4.6%—10.6%和6.5%—10.7%。整个果实发育过程中,3种可溶性糖和总糖的含量均明显增加,各种糖的比例也发生明显变化。葡萄糖占总糖的比例不断减少,果皮中葡萄糖占总糖比例从79.4%降至13.5%,果肉中从74.1%降至8.2%;而蔗糖的比例不断增加,果皮中从11.0%增加到79.1%,果肉中从11.0%增加到82.4%,成为成熟果实中最主要的糖。从新疆杏果实中共检测到6种有机酸,包括苹果酸、奎宁酸、柠檬酸、酒石酸、草酸和富马酸。成熟果实中苹果酸、奎宁酸和柠檬酸是最主要的有机酸,占总酸含量的94.6%—98.3%。果实发育过程中,苹果酸和草酸呈下降趋势,柠檬酸、奎宁酸和富马酸呈上升趋势,酒石酸无明显变化规律。果实发育前期(幼果期至膨大期),总酸的含量明显增加,而在果实成熟过程中(转色期至完熟期)迅速下降。整个果实发育过程中,尽管苹果酸占主导地位,但各品种在有机酸的积累模式上有明显差异,依据其变化特点可分为2种模式:由苹果酸和奎宁酸或苹果酸向苹果酸、奎宁酸和柠檬酸3种主要有机酸共积累。果实成熟时,3种共积累酸的比例在品种间差异较大:‘库尔勒托拥’(KE)、‘阿克牙勒克’(AK)和‘克孜佳娜丽’(KZ)中,柠檬酸>苹果酸>奎宁酸;‘索格佳娜丽’(SG)中,奎宁酸>苹果酸>柠檬酸;‘苏联2号’(SL)中苹果酸、奎宁酸和柠檬酸的比例相当。果皮和果肉在可溶性糖、有机酸的组成、含量和积累模式上均无明显差异。【结论】新疆杏果实发育过程中,可溶性糖和有机酸积累呈现明显的变化规律,糖的积累模式由葡萄糖积累型向蔗糖积累型转变,有机酸由苹果酸和奎宁酸积累型或苹果酸积累型向苹果酸、奎宁酸和柠檬酸3种酸共积累的模式转变,糖、酸积累模式的转变在新疆杏果实甜度和酸度以及风味品质决定中都具有十分重要的作用。
杏;糖;有机酸;高效液相色谱;果实发育;果实成熟
0 引言
【研究意义】杏是重要的核果类果树[1],由于其独特的风味和较高的营养价值而深受消费者喜爱[2-6]。新疆是世界杏的重要起源和栽培中心,拥有丰富的品种资源,已经成为中国杏资源保存中心和优质特色杏的主要产区[7-9]。截至2014年底,新疆杏的种植面积已经达到13.6×104hm2,总产量1.40×106t[10]。新疆杏以其独特的风味品质著称,在消费市场上颇受欢迎。而可溶性糖和有机酸是构成果实风味的重要因子,在果实风味决定中具有基础性作用,多年来一直是果实品质研究领域的重要主题[11-14]。【前人研究进展】近年来,前人已经开展了有关杏果实糖、酸的相关工作。陈美霞等[15]比较了华北生态型和欧洲生态型杏果实的可溶性糖,结果表明各品种在糖组分及总糖含量间都存在较大差异,但蔗糖含量均最高,果实发育过程中果糖和葡萄糖变化不大,成熟期蔗糖含量急剧增加。而对华北杏有机酸的研究认为,杏品种可分为苹果酸型和柠檬酸型,苹果酸型的苹果酸和总酸含量均在硬核前逐渐上升,硬核后开始降解,而柠檬酸的含量始终很低,柠檬酸型的柠檬酸呈现“S”型变化曲线,在果实发育前期含量很低,硬核期结束时急剧上升,而苹果酸的变化规律正好与柠檬酸相反[16]。孙家正[17]检测了30个杏品种成熟期的糖和有机酸,同样得出蔗糖含量最高的结论,同时发现,南疆杏有机酸和华北杏总酸含量相近,但组分差异很大,南疆杏苹果酸含量高于柠檬酸近2倍,而华北杏柠檬酸含量高于苹果酸4倍。另据报道[18],南疆杏总糖含量是华北杏的2.23倍,果糖含量是华北杏品种的7.85倍,新疆杏的酸度低,对果实风味差异有显著贡献。【本研究切入点】截至目前,大部分研究主要比较了成熟期杏果实糖、酸组成差异,对新疆杏的糖、酸动态变化仍然缺乏系统认识,果皮和果肉在糖酸积累上是否有差异也未见报道。【拟解决的关键问题】本研究以5个主栽的新疆杏品种不同发育阶段的果皮和果肉为试验材料,使用HPLC技术鉴定分析各个样品中可溶性糖和有机酸,对比分析各品种及果实发育过程中果皮和果肉中糖、酸组分与含量变化情况,初步明确新疆杏果皮和果肉中糖和酸的组成与含量特征,揭示果实发育过程中糖、酸的动态变化规律,研究结果不仅可以加深对新疆杏果实风味品质形成的认识,还将为杏风味品质调控和育种提供理论及实践依据。
1 材料与方法
试验于2015年在西南大学南方山地园艺学教育部重点实验室进行。
1.1 试验材料
以新疆农业科学院轮台果树资源圃种植的5个主栽新疆杏品种为材料(表1)。于2015年2月选择树龄相同,树体结构相同(均为三主枝自然开心型),生长情况一致的树进行标记,每个品种标记6棵。施肥、修剪和病虫害防治统一按照资源圃栽培管理技术流程进行。
于2015年4月24日至7月27日期间,选取大小均匀、果形正常、无病虫害的果实,分别在幼果期(S1)、膨大期(S2)、转色期(S3)、青熟期(S4)、完熟期(S5)5个发育阶段采摘果实,每个品种采摘180个,采摘当天空运至西南大学南方山地园艺学教育部重点实验室。
表1 植物样品材料及其采样时间Table1 The plant materials used in the present study and the sampling time
各发育阶段的具体采样时间见表1。果实运抵实验室后,去除有机械损伤的果实,每50个果实作为一个重复,每个样品重复3次。其中,每个重复20个果实用于测定单果重、果实大小、可溶性固形物(TSS)和可滴定酸(TA),其余30个果实去核后用刀片将果皮和果肉快速分开,并切成3 mm小块后加入液氮速冻混匀,保存在-80℃冰箱下备用。由于幼果期和膨大期果实太小果皮和果肉不易分开,因此这两个时期以整个去核后的果实进行试验,转色期、青熟期和完熟期3个时期果皮和果肉分别进行(图1)。
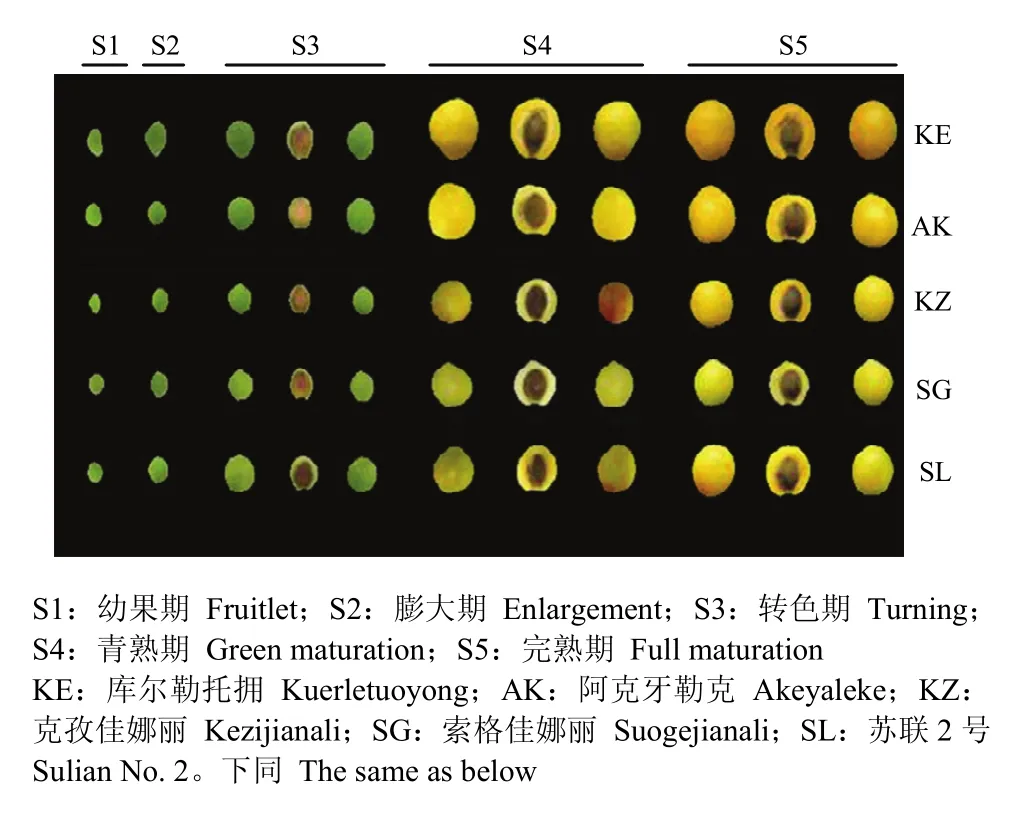
图1 5个新疆杏品种不同发育阶段的果实Fig. 1 Fruit at diffreent development stages of 5 Xinjiang apricot cultivars
1.2 试剂来源
果糖、葡萄糖、蔗糖、奎宁酸、苹果酸、柠檬酸和富马酸标准品均购自美国Sigma公司,草酸和酒石酸购自生工生物工程(上海)股份有限公司。其他试剂均为分析纯,购自中国上海国药化学试剂有限公司。
1.3 可溶性固形物(TSS)、可滴定酸测定(TA)
TSS使用日本爱宕数字手持式折射仪AYAGO PAL-1测定。TA测定使用滴定法进行。将果肉匀浆后,用纱布过滤。10 mL果汁用蒸馏水稀释10倍后转移到250 mL烧杯中,用磁力棒持续搅动。pH计浸入到果汁中,用0.1 mol·L-1NaOH滴定,加入酚酞指示剂,滴定至pH达到8.1时计算可滴定酸含量,结果用mmol·L-1H+来表示。
1.4 可溶性糖和有机酸的高效液相色谱检测
1.4.1 糖、酸的提取 提取方法参照Xi等[19]的方法进行。称取3 g果皮或果肉冻样,加液氮使用冷冻磨样机研磨成均匀的粉末,加入5 mL 80%乙醇,涡旋混匀。35℃水浴提取20 min,在4℃下10 000 r/min离心15 min,吸取上清液,重复提取3次,合并上清液,用80%乙醇定容至20 mL。取4 mL提取液,在4℃下,10 000 r/min离心5 min,取3 mL上清液,并在氮吹仪上吹干,用1.5 mL双蒸水溶解壁上的果渣,经过0.22 μm的水膜过滤纯化移入进样品,待高效液相色谱进行检测。
1.4.2 色谱条件 可溶性糖和有机酸色谱条件参考ZHANG等[20]的方法进行。糖检测使用的色谱柱为岛津(4.6 mm×250 mm),0.5 μm的NH2柱,以乙腈∶水=7∶3为流动相,流速为1.2 mL·min-1,等度洗脱,柱温为40℃,载气流速为40 P,漂移管温度为65℃。
有机酸检测使用的色谱柱为ODS(4.6 mm×250 mm),0.5 μm的C18柱子,50 mmol·L-1(NH2)2HPO4,以H2PO3为缓冲液调节至pH=2.7为流动相,流速为0.5 mL·min-1,等度洗脱,柱温为25℃,检测波长210 nm。
果糖、葡萄糖、蔗糖均能在10 min内被完全分离,6种待检测的有机酸包括草酸、酒石酸、奎宁酸、苹果酸、柠檬酸和富马酸,均能在25 min内被完全分离,分离效果良好。根据样品与标准品的保留时间进行定性分析,运用外标法制作标准曲线法进行定量,标准曲线的线性范围均能覆盖样品中可溶性糖和有机酸的含量,回归方程的R2均在0.99以上,最终含量以mg·g-1FW表示。
1.5 数据分析
采用OriginPro 8.0(Microcal Software,Inc.,Northampton,MA,USA)软件作图。所有样品均设3个重复,测定结果以平均值(means)±标准差(standard deviation)表示。样品间的差异显著性采用单因素方差分析(One Way ANOVA)邓肯氏检验法测验。
2 结果
2.1 果实基本品质指标分析
从图2-A、2-B可以看出,果实纵径和重量在各品种果实发育过程中变化趋势一致,在幼果期至转色期缓慢增加,转色期至青熟期迅速增加,完熟期略有增加或保持不变,形成了明显的“S”型增长曲线。从果实大小和单果重来看,‘库尔勒托拥’是大果型品种,‘阿克牙勒克’是中果型品种,‘克孜佳娜丽’‘索格佳娜丽’和‘苏联2号’是小果型品种。从果实形状来看,‘索格佳娜丽’果实属于圆形,‘库尔勒托拥’‘阿克牙勒克’‘克孜佳娜丽’和‘苏联2号’属于椭圆形果实的品种。
由图2-C可以看出,果实TSS在果实发育前期即幼果期、膨大期和转色期基本趋于稳定,在6.1%—10.9%,而后迅速上升,在完熟期达到峰值。果实发育过程中,‘克孜佳娜丽’和‘苏联2号’的TSS含量变化最大,分别在8.2%—16.4%和8.9%—18.1%。成熟期‘苏联2号’的TSS含量最高为18.1%,‘索格佳娜丽’TSS含量最低为10.6%。与TSS的变化趋势相反,供试品种的TA在果实膨大期较高,在2.0 mmol·L-1H+以上,转色期后迅速下降,果实成熟时达到最低(图2-D)。果实成熟中,全部供试品种的TA在0.4—3.2 mmol·L-1H+,‘索格佳娜丽’的TA最低,‘克孜佳娜丽’的TA最高。
2.2 新疆杏果实发育过程中可溶性糖的变化
从图3-A可以看出,果实发育过程中,供试品种可溶性糖的组分和含量呈现明显的变化规律。共检测到果糖、葡萄糖和蔗糖3种可溶性糖,未检测到山梨醇糖。果实发育期间,总糖、果糖、葡萄糖和蔗糖的含量总体上都呈上升趋势。果实发育前期,主要是幼果期至膨大期,总糖、果糖、葡萄糖和蔗糖的含量尽管都有增加,但仍然保持在较低水平,果实发育后期,即转色期至完熟期迅速增加,在青熟期或者完熟期达到峰值。‘阿克牙勒克’幼果期果实,‘苏联2号’膨大期和转色期果肉、青果期果肉,‘苏联2号’完熟期果肉总糖含量为对应时期的最高值。‘克孜佳娜丽’幼果期果实、‘索格佳娜丽’膨大期果皮、‘阿克牙勒克’转色期果肉、‘索格佳娜丽’青熟期果肉和‘阿克牙勒克’完熟期果肉总糖含量为对应时期的最低值。果实发育前期,‘苏联2号’果皮蔗糖含量明显高于其他品种,‘库尔勒托拥’的蔗糖和葡萄糖的含量明显高于其他品种,果实发育后期,‘库尔勒托拥’和‘苏联2号’的总糖、蔗糖和葡萄糖的含量均明显高于其他品种。果实发育前期各品种果皮和果肉中果糖含量无明显差异,果实发育后期即果实成熟过程中,‘库尔勒托拥’‘阿克牙勒克’和‘苏联2号’果肉中果糖含量均高于‘索格佳娜丽’。整体上,各品种果皮中果糖含量差异不明显。

图2 新疆杏果实发育过程中基本指标的变化Fig. 2 Changes of basic indexes in Xinjiang apricot fruit during development and ripening


图3 新疆杏果实发育过程中可溶性糖含量与比例的变化Fig. 3 Changes of soluble sugars contents and ratio in Xinjiang apricot fruit during development and ripening
从图3-B、C可以看出,整个发育过程中,供试品种中各种糖的比例发生明显变化。供试品种发育过程中,葡萄糖的比例明显降低,果皮中葡萄糖占总糖比例从79.4%降至13.5%,果肉从83.4%降至8.2%。幼果期至转色期,果皮中葡萄糖占总糖的比例在48.5%—79.4%,果肉在37.7%—83.4%,葡萄糖是前3个发育时期果实中主要的可溶性糖。果糖的变化与葡萄糖相似,在果实发育的整个过程中,其比例总体上是降低的,果皮中果糖占总糖比例从22.8%降至4.6%,果肉从27.4%降至6.5%。果实发育前期,果皮中果糖所占总糖的比例在10.3%—22.8%,果肉在12.4%—27.4%,是果实发育前期第二大糖。与葡萄糖和果糖不同,果实发育过程中,蔗糖占总糖的比例不断增加,在果皮中从10.2%增加到79.1%,果肉中从10.9%增加到82.4%,果实发育后期,特别是青熟期至完熟期,果皮中蔗糖占总糖的比例在52.5%—79.1%,果肉中在62.4%—82.4%,成为果实发育后期的第一大可溶性糖。与果实发育前期相比,果实发育后两个时期,葡萄糖占总糖比例有所降低,果皮中在13.5%—42.1%,果肉在8.2%—29.1%,葡萄糖由第一主要可溶性糖成为第二大可溶性糖。果实发育后期,果糖占总糖的比例最低,果皮中果糖占总糖比例在4.6%—11.5%,果肉中在5.8%—11.6%。
2.3 新疆杏果实发育过程中有机酸的变化
从图4-A可以看出,供试品种果实发育过程中有机酸组分和含量均呈现明显的变化规律。草酸、酒石酸、奎宁酸、苹果酸、柠檬酸和富马酸是新疆杏果实中检测到的有机酸。整个果实发育期间,草酸、酒石酸和苹果酸呈下降趋势,柠檬酸和富马酸呈上升趋势,奎宁酸没有固定的变化规律。在果实发育前3个时期,总酸的含量明显增加,后两个发育时期迅速下降。整个果实发育过程中,草酸、酒石酸、奎宁酸、苹果酸、柠檬酸和富马酸的变化范围依次为:果皮中在0—1.9、0—5.8、0—20.1、8.9—23.8、0—12.9和0.01—0.03 mg·g-1FW;果肉中分别在0.1—2.3、0—2.4、0—18.3、8.37—22.7、0—9.45和0—0.04 mg·g-1FW。果实发育过程中,奎宁酸、苹果酸和柠檬酸是新疆杏果实的主要有机酸,富马酸含量最低,草酸和酒石酸介于它们之间。同一个发育时期,奎宁酸在‘索格佳娜丽’果肉幼果期、‘阿克牙勒克’果肉膨大期、‘索格佳娜丽’果肉转色期、‘阿克牙勒克’果皮青熟期和‘索格佳娜丽’果皮完熟期的积累量最高,而在‘库尔勒托拥’‘索格佳娜丽’及‘苏联2号’幼果期,‘库尔勒托拥’和‘苏联2号’膨大期、转色期,‘库尔勒托拥’果皮青熟期和‘库尔勒托拥’果肉完熟期的积累量最低。整个果实发育过程中,除‘阿克牙勒克’果肉外,奎宁酸的含量在其他样品中均呈增加趋势。各供试品种的果皮和果肉中,苹果酸在整个果实发育过程中均呈下降趋势。同一个发育时期,苹果酸在‘索格佳娜丽’果皮幼果期,‘克孜佳娜丽’果肉膨大期、转色期、青熟期和‘阿克牙勒克’果皮完熟期的积累量最高,‘苏联2号’果肉幼果期、‘库尔勒托拥’果肉膨大期、‘索格佳娜丽’果肉转色期、‘库尔勒托拥’果肉青熟期和‘库尔勒托拥’果肉完熟期的积累量最低。对大多数品种而言,柠檬酸多在转色期才能检测到,只有‘克孜佳娜丽’在膨大期就能检测到柠檬酸。整个果实发育过程中,柠檬酸的含量呈明显的上升趋势。同一发育时期,柠檬酸在‘克孜佳娜丽’果肉膨大期、‘苏联2号’果皮转色期、‘索格佳娜丽’果皮青熟期和‘阿克牙勒克’果皮完熟期积累量最高,而在‘库尔勒托拥’果肉青熟期和完熟期积累量最低。整个发育过程中,草酸含量整体趋于下降。草酸在所有参试品种的果肉中含量均高于果皮。富马酸的含量在整个果实发育过程中趋于上升,而酒石酸无明显变化趋势。总酸含量在果实发育前期趋于增加,而在过程成熟过程中下降。供试品种中,‘库尔勒托拥’的总酸含量最低。
从图4-B、C可以看出,整个发育过程中,果实中有机酸的比例发生明显变化。整个发育过程中,奎宁酸、苹果酸和柠檬酸在果皮和果肉中分别占总酸比例的72.7%—98.7%和79.6%—97.6%,是新疆杏果实的主要有机酸。苹果酸是新疆杏果实中第一大有机酸,果实发育过程中,果皮、果肉中占总酸的比例分别为98.4%—26.7%和94.6%—29.2%,柠檬酸占总酸比例分别在0—50.0%和0—37.0%,奎宁酸分别为0—56.9%和0—50.3%,草酸分别为0—9.0%和0.2%—9.0%,酒石酸分别为0.1%—26.3%和0—11.4%,果皮和果肉中富马酸占总酸的比例最低,为0.1%—0.2%。
果实发育过程中,不同品种中,3种主要有机酸苹果酸、奎宁酸和柠檬酸占总酸比例呈现不同的变化模式。‘阿克牙勒克’‘克孜佳娜丽’‘索格佳娜丽’在果实发育前期,主要以积累苹果酸和奎宁酸为主,两种酸占总酸的比例在果皮中为84.3%—98.5%,果肉中为78.6%—97.6%。果实发育前期,苹果酸和酒石酸的含量比例在‘库尔勒托拥’中占据主导地位,两种酸在果皮和果肉中也有明显差异:幼果期至转色期,果皮中酒石酸比例迅速从11.4%增加到26.3%,苹果酸和酒石酸占总酸含量的90.3%—99.0%;果肉中酒石酸的含量明显降低,从11.4%降低到2.3%,而奎宁酸从0增加到15.2%,苹果酸和酒石酸的含量占总酸含量的65.8%—91.0%。果实发育前期,‘苏联2号’为苹果酸主导型,苹果酸在果皮和果肉中占总有机酸的比例分别为94.0%—98.4%和94.0%—94.6%。果实成熟期,随着苹果酸含量的迅速下降和柠檬酸含量的不断增加,苹果酸、奎宁酸和柠檬酸成为果实中积累的主要有机酸,但3种酸在不同品种的比例明显不同。‘库尔勒托拥’‘阿克牙勒克’和‘克孜佳娜丽’中3种有机酸占总有机酸的比例大小依次为:柠檬酸>苹果酸>奎宁酸。‘索格佳娜丽’中为:奎宁酸>苹果酸>柠檬酸,‘苏联2号’中苹果酸、奎宁酸和柠檬酸的比例相当。
3 讨论
果实糖、酸组成与含量不仅受基因型的控制[21],也受果实发育的调控,其积累和变化模式各异。苹果果实在发育前期蔗糖和果糖含量极低,但葡萄糖含量较高,随着果实发育果糖含量明显上升,葡萄糖含量下降,后期果糖成为主要的可溶性糖[22]。桃果实发育前期果糖和葡萄糖为主要的可溶性糖,后期蔗糖含量明显上升并成为主要的可溶性糖[23-24]。华北杏在果实发育过程中总糖变化趋势与蔗糖变化趋势一致,果实发育前期果糖和葡萄糖含量较高,后期蔗糖含量明显上升,成熟期蔗糖含量最高[15]。本研究结果发现,果实发育过程中葡萄糖和蔗糖是杏果实主要的可溶性糖,发育后期含量迅速上升,这与前人研究结果一致。葡萄糖、蔗糖、果糖和总糖在整个发育过程中都明显增加,其中蔗糖的增加最为迅速。果实发育前期,葡萄糖在总糖中所占比例最高,是果实发育前期最主要的可溶性糖,随着蔗糖含量明显升高,蔗糖是果实发育后期的主要可溶性糖。本研究还发现,果实发育早期果皮中果糖∶葡萄糖∶蔗糖为1.7∶7∶1.6,转色期为1.2∶4.9∶3.9,成熟期为0.7∶2.8∶6.5,在果实发育早期果肉中果糖∶葡萄糖∶蔗糖为1.7∶6.9∶1.4,转色期为1.4∶4.2∶4.4,成熟期为0.9∶1.9∶7.2。果实发育过程中,果皮、果肉中糖的组成、含量以及各种糖的比例相对一致,成熟期果皮、果肉中糖的含量依次为:蔗糖>葡萄糖>果糖。
前人研究结果显示,桃、杏、葡萄果实发育过程中有机酸含量逐渐升高,果实成熟期迅速下降。桃果实发育初期有机酸含量最高,后迅速下降至最低,成熟时有机酸含量最低[25-27]。与杏果实相似,苹果酸和柠檬酸是苹果果实的主要有机酸,果实发育过程中,两种酸都逐渐降低,但柠檬酸降低的幅度远远大于苹果酸,导致成熟时苹果果实以积累苹果酸为主[28]。葡萄果实坐果后,琥珀酸含量最高,果实成熟时含量急剧下降,其中酒石酸、柠檬酸在生长发育过程中含量不断下降,但苹果酸随果实发育含量逐渐上升[29],葡萄果实生长发育过程中总有机酸含量先上升到最高值,成熟期含量下降[30-31]。柠檬酸和奎宁酸是柑橘果实发育前期的主要有机酸,果实成熟后在酸性品种中柠檬酸占主导地位,而低酸品种中苹果酸占主导地位,其含量明显高于柠檬酸[32]。陈美霞等[16]对华北杏的研究发现,不同杏品种的果实中苹果酸和柠檬酸含量的变化存在较大的差异,‘新世纪’杏在果实发育过程中总酸和苹果酸含量变化趋势完全一致,为苹果酸型,发育过程中柠檬酸含量始终很低;‘凯特’杏在果实发育过程中柠檬酸含量呈现“S”型变化曲线,苹果酸变化呈反“S”型,总酸含量变化呈单峰型。认为杏品种分为苹果酸型和柠檬酸型两大类。本研究结果表明,苹果酸、奎宁酸和柠檬酸是新疆杏的主要有机酸,整个果实发育期间,苹果酸和草酸呈下降趋势,柠檬酸、奎宁酸和富马酸呈上升趋势,酒石酸无明显变化规律。在果实发育前3个时期,总酸含量明显增加,果实成熟过程中迅速下降。
本研究还发现,果实发育过程中有机酸的比例有明显变化。果实发育早期,果皮和果肉中奎宁酸和苹果酸是主要的有机酸,在果皮和果肉中分别占72.7%—98.5%和74.9%—97.6%,果实发育后期由于柠檬酸含量上升,苹果酸,柠檬酸和奎宁酸成为主要的有机酸,在果皮和果肉中分别占占95.9%—98.4%和93.3%—97.4%,果实中有机酸积累模式由两种酸或者一种酸积累转变为苹果酸、柠檬酸和奎宁酸3种酸共积累的模式。同一品种中,果皮和果肉在有机酸积累上有一定差异。成熟期果皮中草酸含量低于果肉,在果实发育过程中,果皮中酒石酸含量高于果肉,成熟期果皮和果肉中各组分有机酸含量依次为:苹果酸>奎宁酸>柠檬酸>酒石酸>草酸>富马酸。
4 结论
蔗糖和葡萄糖为新疆杏的主要糖,整个果实发育过程中,葡萄糖、果糖、蔗糖和总糖的含量均明显增加,果实成熟时,糖的积累模式由葡萄糖积累型向蔗糖积累型转变。苹果酸、奎宁酸和柠檬酸是新疆杏果实最主要的有机酸,果实发育过程中,苹果酸和草酸呈下降趋势,柠檬酸、奎宁酸和富马酸呈上升趋势,酒石酸无明显变化规律,在果实发育前期,总酸含量明显增加,果实成熟过程中迅速下降。果实发育过程中,各品种在有机酸的积累模式上有明显差异,依据其模式特点可分为2种类型:由苹果酸和奎宁酸积累型或苹果酸积累型向苹果酸、奎宁酸和柠檬酸3种酸共积累的模式转变。果实成熟过程中,苹果酸、奎宁酸和柠檬酸3种共积累酸的比例在品种间差异较大。因此,杏果实成熟过程中可溶性糖和有机酸积累模式的转变在其风味决定中有重要作用。整体上,果实发育过程中,果皮、果肉在可溶性糖和有机酸的含量、组成及积累模式上均无明显差异。
[1] 张加延, 张钊. 中国果树志: 杏卷. 北京: 中国林业出版社, 2003.
ZHANG J Y, ZHANG Z. China Fruit Records: Apricot Volume. Beijing: China Forestry Press, 2003. (in Chinese)
[2] ERDOGAN-ORHAN I, KARTAL M. Insights into research on phytochemistry and biological activities of Prunus armeniaca L.(apricot). Food Research International, 2011, 44(5): 1238-1243.
[3] ENGEL R, ABRANKÓ L, BALOGH E, BLÁZOVICS A, HERMÁN R, HALÁSZ J, ERCISLI S, PEDRYC A, STEFANOVITS-BÁNYAI É. Antioxidant and antiradical capacities in apricot (Prunus armeniaca L.)fruits: variations from genotypes, years, and analytical methods. Journal of Food Science, 2010, 75(9): C722-C730.
[4] RUIZ D, EGEA J, TOMÁS-BARBERÁN FA, GIL MI. Carotenoids from new apricot (Prunus armeniaca L.) varieties and their relationship with flesh and skin color. Journal of Agricultural and Food Chemistry, 2005, 53(16): 6368-6374.
[5] BUREAU S, RENARD C M, REICH M, GINIES C, AUDERGON J M. Change in anthocyanin concentrations in red apricot fruits during ripening. LWT-Food Science and Technology, 2009, 42(1): 372-377.
[6] TURAN S, TOPCU A, KARABULUT I, VURAL H, HAYALOGLU A A. Fatty acid, triacylglycerol, phytosterol, and tocopherol variations in kernel oil of Malatya apricots from Turkey. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10787-10794.
[7] 陈学森, 李宪利, 张艳敏, 吴树敬, 沈洪波, 束怀瑞. 杏种质资源评价及遗传育种研究进展. 果树学报, 2001, 18(3): 178-181.
CHEN X S, LI X L, ZHANG Y M, WU S J, SHEN H B, SHU HU R. Advances in apricot germplasm resources evaluation and genetic breeding. Journal of Fruit Science, 2001, 18(3): 178-181. (in Chinese)
[8] 林培钧, 崔乃然. 天山野果林资源-伊犁野果林综合研究. 北京:中国林业出版社, 2000.
LIN P J, CUI N R. Wild Fruit Tree in Tianshan-A Comprehensive Study on Wild Fruit Tree in Yili. Beijing: China Forestry Press, 2007.(in Chinese)
[9] RAI I, BACHHETI R, SAINI C, JOSHI A, SATYAN R. A review on phytochemical, biological screening and importance of wild apricot(Prunus armeniaca L.). Oriental Pharmacy and Experimental Medicine, 2016, 16(1): 1-15.
[10] 新疆维吾尔自治区统计局. 新疆统计年鉴. 北京: 中国统计出版社,2014: 249-260.
Statistics Bureau of the Xinjiang Autonomous Region. Xinjiang Statistical Yearbook. Beijing: China Statistics Press, 2014: 249-260.(in Chinese)
[11] 张上隆, 陈昆松. 果实品质形成与调控的分子生理. 北京: 中国农业出版社, 2007.
ZHANG S L, CHEN K S. Molecular Physiology of Fruit Quality Development and Regulation. Beijing: China Agriculture Press, 2007.(in Chinese)
[12] KADER A A. Flavor quality of fruits and vegetables. Journal of the Science of Food and Agriculture, 2008, 88(11): 1863-1868.
[13] 张永平, 乔永旭, 喻景权, 赵智中. 园艺植物果实糖代谢的研究进展. 中国农业科学, 2008, 41(4): 1151-1157.
ZHANG Y P, QIAO Y X, YU J Q, ZHAO Z Z. Progress of researches of sugar accumulation mechanism of horticultural plant fruits. Scientia Agricultura Sinica, 2008, 41(4): 1151-1157. (in Chinese)
[14] 李金龙. 果实内糖的积累与糖代谢相关酶. 中国林副特产, 2015(3): 92-93.
LI J L. Sugar accumulation in fruit and enzymes related sugar metabolism. Forest By-Product and Speciality in China, 2015(3): 92-93. (in Chinese)
[15] 陈美霞, 赵从凯, 陈学森, 房师梅, 张宪省. 杏果实发育过程中糖积累与蔗糖代谢相关酶的关系. 果树学报, 2009, 26(3): 320-324.
CHEN M X, ZHAO C K, CHEN X S, FANG S M, ZHANG X S. Sugar accumulation and changes in activities of sugar-metabolizing enzymes of apricot. Journal of Fruit Science, 2009, 26(3): 320-324.(in Chinese)
[16] 陈美霞, 赵从凯, 陈学森,郝会军, 张宪省. 杏果实发育过程中有机酸积累与相关代谢酶的关系. 果树学报, 2009, 26(4): 471-474.
CHEN M X, ZHAO C K, CHEN X S, HAO H J, ZHANG X S. Sugar accumulation and changes in activities of organic acid-metabolizing enzymes of apricot. Journal of Fruit Science, 2009, 26(4): 471-474.(in Chinese)
[17] 孙家正. 南疆栽培杏部分表现型性状遗传多样性研究[D]. 山东农业大学, 2010.
SUN J Z. 2010. Study on genetic diversity of phenotypic traits in apricot (Prunus Armeniaca L.) cultivars in Southern Xinjiang, China.[D]. Tai’an: Shandong Agricltural University, 2010. (in Chinese)
[18] 张君萍, 高疆生, 李疆, 何天明, 张卫芳, 徐林, 樊国权. 新疆杏与华北杏果实主要营养成分比较分析. 新疆农业科学, 2006, 43(2): 140-144.
ZHANG J P, GAO J S, LI J, HE T M, ZHANG W F, XU L, FAN G Q. Comparison analysis on main nutritive component of Xinjiang apricot and North China apricot. Xinjiang Agricultural Sciences, 2006, 43(2): 140-144. (in Chinese)
[19] XI W P, ZHANG Q Y, LU X Y, WEI C Q, YU S L, ZHOU Z Q. Improvement of flavor quality and consumer acceptance during postharvest ripening in greenhouse peaches by carbon dioxide enrichment. Food Chemistry, 2014, 164: 219-227.
[20] ZHANG W S, CHEN K S, ZHANG B, SUN C D, CAI C, ZHOU C H,XU W P, ZHANG W Q, FERGUSON I B. Postharvest responses of Chinese bayberry fruit. Postharvest Biology and Technology, 2005,37(3): 241-251.
[21] BUREAU S, RUIZ D, REICH M, GOUBLE B, BERTRAND D,AUDERGON J M, RENARD CMGC. Application of ATR-FTIR for a rapid and simultaneous determination of sugars and organic acids in apricot fruit. Food Chemistry 2009, 115(3): 1133-1140.
[22] 王海波, 陈学森, 辛培刚, 张小燕, 慈志娟, 石俊, 张红. 几个早熟苹果品种果实糖酸组分及风味品质的评价. 果树学报, 2007, 24(4): 513-516.
WANG H B, CHEN X S, XIN P G, ZHANG X Y, CI Z J, SHI J,ZHANG H. Study on sugar and acid constituents in several early apple cultivars and evaluation of their flavor quality, Journal of Fruit Science, 2007, 24(4): 513-516. (in Chinese)
[23] 邓月娥, 张传来, 牛立元, 苏成军, 韩红萍. 桃果实发育过程中主要营养成分的动态变化及系统分析方法研究. 果树科学, 1998,15(1): 48-52.
DENG Y E, ZHANG C L, NIU L Y, SU C J, HAN H P. Studies on the changes of some main nutritional components in peach fruits during maturation and the method of systematic analysis. Journal of Fruit Science, 1998, 15(1): 48-52. (in Chinese)
[24] 金锡凤. 桃果实发育期间几种成分的变化. 落叶果树, 1993(2): 27-29.
JIN X F. Several components change during development. Deciduous Fruits, 1993(2): 27-29. (in Chinese)
[25] ETIENNE C, MOING A, DIRLEWANGER E. Isolation and characterization of six peach cDNAs encoding key proteins in organic acid metabolism and soolute accumulation: involvement in regulating peach fruit acidity. Physiology Plantarum, 2002, 114: 259-270.
[26] MOING A, SVANELLA L, ROLIN D, GAUDILLÈRE M,GAUDILLÈRE J P, MONET R. Compositional changes during the fruit development of two peach cultivars differing in juice acidity. Journal of the American Society for Horticultural Science, 1998,123(5): 770-775.
[27] WU B, QUILOT B, GÉNARD M, KERVELLA J, LI S. Changes in sugar and organic acid concentrations during fruit maturation in peaches, P. davidiana and hybrids as analyzed by principal component analysis. Scientia Horticulturae, 2005, 103(4): 429-439.
[28] ACKERMANN J, FISCHER M, AMADO R. Changes in sugars, acids,and amino acids during ripening and storage of apples (cv. Glockenapfel). Journal of Agricultural and Food Chemistry, 1992,40(7): 1131-1134.
[29] ZHANG Y, LI P, CHENG L. Developmental changes of carbohydrates,organic acids, amino acids, and phenolic compounds in ‘Honeycrisp’apple flesh. Food Chemistry, 2010, 123(4): 1013-1018.
[30] ALI K, MALTESE F, FORTES A M, PAIS M S, CHOI Y H,VERPOORTE R. Monitoring biochemical changes during grape berry development in Portuguese cultivars by NMR spectroscopy. Food Chemistry, 2011, 124(4): 1760-1769.
[31] DOKOOZLIAN N, KLIEWER W. Influence of light on grape berry growth and composition varies during fruit development. Journal of the American Society for Horticultural Science, 1996, 121(5): 869-874.
[32] ALBERTINI M V, CARCOUET E, PAILLY O, GAMBOTTI C,LURO F, BERTI L. Changes in organic acids and sugars during early stages of development of acidic and acidless citrus fruit. Journal of Agricultural and Food Chemistry, 2006, 54(21): 8335-8339.
(责任编辑 赵伶俐)
Changes in Soluble Sugars and Organic Acids of Xinjiang Apricot During Fruit Development and Ripening
ZHENG Hui-wen1, ZHANG Qiu-yun1, LI Wen-hui2, ZHANG Shi-kui2, XI Wan-peng1,3
(1College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400716;2Luntai National Germplasm Garden of Fruit Trees, Xinjiang Academy of Agricultural Sciences, Luntai 841600, Xinjiang;3Key Laboratory of Horticulture Science for Southern Mountainous Regions, Ministry of Education, Chongqing 400715)
【Objective】The aim of this study was to characterize the content and composition of soluble sugars and organicacids in Xinjiang apricot fruit and to reveal the change rule.【Method】In this study, the soluble sugars and organic acids in peels and pulps of five Xinjiang apricot cultivars were determined by high performance liquid chromatography (HPLC) during fruit development and ripening. 【Results】 Three sugars were identified from Xinjiang apricot fruit, including sucrose, glucose and fructose. Sucrose and glucose are the predominant soluble sugars in Xinjiang apricot fruit. At the full-ripe stage, the ratio of sucrose to total sugar was 60.7%-79.1% in peels and 65.5%-82.4% in pulps, whereas glucose occupied 13.5%-34.7% of total sugar in peels and 8.2%-25.9% in pulps, respectively. Fructose only made up 4.6%-10.6% and 6.5%-10.7% of total sugar in peels and pulps respectively. Three individual sugars identified and total sugar increased significantly throughout the whole development period. The ratio of glucose to total sugar decreased from 79.4% to 13.5% in peels and 74.1% to 8.2% in pulps, respectively. Conversely, the ratio of sucrose to total sugar increased from 11.0% to 79.1% in peels and 11.0% to 82.4% in pulps. A total of six organic acids, including malic acid, quinic acid, citric acid, tartaric acid, oxalic acid and fumaric acid, were identified from Xinjiang apricot. Malic acid,quinic acid and citric acid were the dominant organic acids in ripe fruit, occupying 94.6%-98.3% of total organic acid. During fruit development and ripening, the contents of malic acid and oxalic acid decreased dramatically, while the contents of citric acid, quinic acid and fumaric acid increased significantly, no clearly consistent trend was observed for tartaric acid. The content of total acid in fruit increased during early development (from fruitlet to enlargement stage), but decreased rapidly during fruit ripening (from turning to full-ripe stage). Though malic acid predominated in fruit throughout the whole development period, different accumulation patterns for organic acids were observed in all cultivars studied. The patterns were divided into two types: malic acid and quinic acid dominated, malic acid and citric acid dominated, or only malic acid dominated during early development period, yet all types changed to malic acid, quinic acid and citric acid dominated during ripening. However, the ratio of malic acid, quinic acid or citric acid to total organic acid differed significantly in cultivars tested during fruit ripening. The ratio order in ‘Kuerletuoyong’ (KE),‘Akeyaleke’ (AK) and ‘Kezijianali’ (KZ) was citric acid > malic acid > quinic acid, the ratio in ‘Suogejianali’ (SG) was quinic acid >malic acid > citric acid, the ratio in ‘Sulian No. 2’ (SL) was that all three organic acids appeared to be largely equal. No significant differences were found in soluble sugars and organic acid content, composition or accumulation pattern between peels and pulps.【Conclusion】Xinjiang apricot presented an obvious chemical changing trend of soluble sugars and organic acids accumulation during fruit development and ripening. The sugar accumulation pattern changed from glucose dominated to sucrose dominated, while the organic acids accumulation pattern changed from two or one of malic acid, quinic acid and citric acid to the accumulation of the three organic acids all together. Thus, this pattern may play an important role in sweetness, acidity and flavor determination for Xinjiang apricot fruit.
apricot; sugars; organic acids; HPLC; fruit development; fruit ripening
2016-04-06;接受日期:2016-08-12
国家自然科学基金(31471855)
联系方式:郑惠文,E-mail:zhenghuiwen553@foxmail.com。通信作者席万鹏,E-mail:xwp1999@zju.edu.cn
