犬细小病毒病的诊断与治疗
2016-11-16张明星
张明星
(甘肃农业大学动物医学院动物科学专业,甘肃定西 743026)
犬细小病毒病的诊断与治疗
张明星
(甘肃农业大学动物医学院动物科学专业,甘肃定西 743026)
犬细小病毒病是由犬细小病毒引起的犬的一种急性、高度接触性的传染病,本病在临床上以剧烈呕吐,血样粪便,出血型肠炎,脱水,非化脓性心肌炎为特征,剖检可见小肠广泛性出血、肠黏膜脱落、坏死。其感染率高达100%,致死率高达10%~50%等为特征。本病一年四季均可发生,寒冷季节多发,多见于犬类比较聚集的单位或地区。不同年龄、性别和品种的犬均能感染本病,但以未成年的幼犬最为易感,给养犬业造成很大损失。本论文选取其中一个典型病例,对该病的症状、诊断和治疗等进行分析和总结。
1 典型病例
2015年1月25日,定西市康乐动物医院一只患病边牧犬前来就诊,基本信息如下:雌性,体重3.5kg,年龄两个半月,体温38.8℃。临床表现:腹泻两天,呕吐,口色泛白,狂躁,无食欲,无饮欲,脉搏116次/min,搏动差,心律不齐,肠音差。经了解,该犬只采食单纯犬粮,未免疫,未驱虫,基本在家饲养很少遛狗,来之前发病4~5d。
2 诊疗试剂
犬细小病毒抗原诊断试剂盒(韩国产)、犬细小病毒抗体诊断试剂盒(韩国产)、犬细小单克隆抗体、参麦注射液(10ml)、西咪替丁注射液(0.2g/2ml)、酚磺乙胺注射液(0.25g/2ml)、维生素C注射液(0.5g/2ml)、维生素B6注射液(0.1g/1ml)、辅酶A(100单位)、ATP注射液(20mg/2ml)、0.9%氯化钠、(100ml,250ml)、5%葡萄糖注射液(100ml,250ml)、肌苷注射液(100mg/2ml)、羊胎素转移因子注射液(15mg/10ml)、犬细小抑制蛋白(冻干型)(400万单位)、复方氯化钠(500ml)、硫酸阿米卡星注射液(0.2g/2ml)(20万单位)。
3 诊疗设备
体温计、听诊器、注射器、输液器、消毒棉、镊子、针头、橡胶管、试管、留置针、输液泵、胶布、移液枪、迈瑞BC-2800Vet全自动血球计数仪、犬冠状病毒抗原快速检测试纸、犬细小病毒抗原快速检测试板。
4 临床症状
临床表现为腹泻,呕吐,口色泛白,狂躁,无食欲,无饮欲,搏动差,心律不齐,肠音差。
5 诊断
5.1血常规检查
在病犬前肢静脉采血,用移液枪取20微升,加入稀释液中,用迈瑞BC-2800Vet全自动血球计数仪检测。
5.2犬细小病毒抗原检查
用犬细小病毒抗原快速检测试板检测:用采样棒蘸取口水,放入收集管中使之浸泡于缓冲液中,充分摇匀,然后再于肛门采取粪样,放入收集管中使之浸泡于缓冲液中,充分摇匀,用滴管吸取缓冲液上层,向检测板样品孔中滴加3~4滴,等待检测液在吸收衬垫上扩散完毕,加样5~10 min后,即可判读结果。通过检测线与对照线是否出现色带,来判读结果。阴性结果:检测线T没有出现色带,而对照线C出现色带;阳性结果:T与C都出现色带;无效结果:T与C都没有出现色带,或只出现T色带。
5.3犬冠状病毒抗原检查
用犬冠状病毒抗原快速检测试纸检测,用采样棒蘸取患犬肛门粪样,放入装有稀释液的样品管中充分搅拌混合,然后再取口水,放入收集管中使之浸泡于缓冲液中,充分摇匀,静置2 min,用吸管吸取上清液,在试剂盒样品孔中滴加2~4滴提取液,等待5 min观察结果,10 min后的结果无效。判断结果:根据检测线与对照线的结果判断阴性和阳性。阴性:只有对照线C呈红色或者紫色线时,此情况表示没有感染病毒;阳性:只有检测线T与对照线C均呈红色或紫色时,此情况表示已经感染病毒;无效结果:T 与C都没有出现色带,或只出现T色带。
5.4诊断结果
5.4.1血常规检查结果
使用兽用血液细胞分析仪检测血常规,结果详见表1。
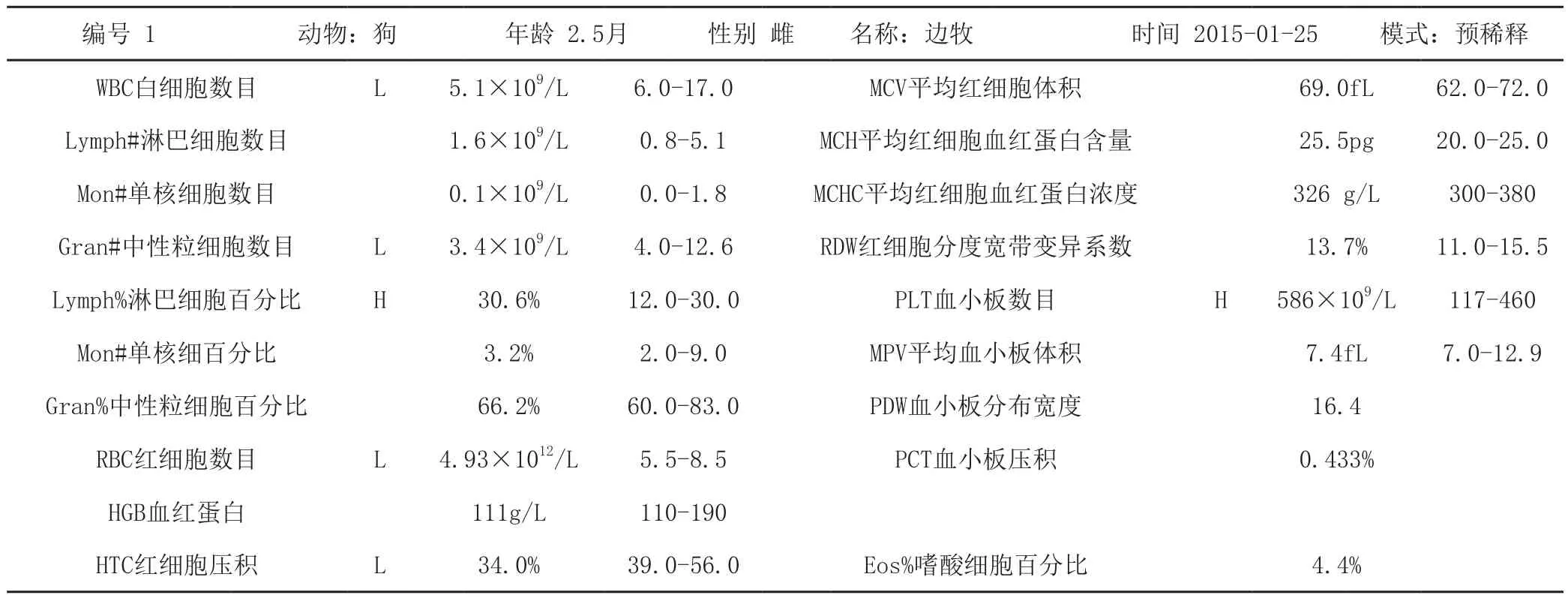
表1 兽用血液细胞分析仪细胞计数
由检测结果显示该犬白细胞数目、中性粒细胞数目低于正常水平,这是犬病毒感染的标志。血小板数目高于正常水平,说明该犬有出血。
5.4.2犬细小病毒抗原检查结果
使用检测反应板检测抗原,结果详见下图。

由检测结果显示为阳性(T与C都出现色带),说明该犬为犬细小病毒感染者。
5.4.3犬冠状病毒抗原检查结果
使用检测反应板检测抗原,结果详见下图。

由检测结果显示结果为阴性(只有对照线C呈红色或者紫色线时),说明该犬没有感染犬冠状病毒。
综合各项诊断结果,确诊该犬感染细小病毒。
6 治疗
6.1抑制病原体
治疗原则:抑制疾病的发展,控制继发感染,提高动物机体抵抗力。
肌肉注射药物:CPV抑制蛋白240万单位,参麦注射液2.0 ml,羊胎素转移因子注射液2.0 ml,硫酸阿米卡星注射液0.5 ml,以上药物肌肉注射,每天1次,连用3~5d。
静脉注射:第一组,0.5%葡萄糖60.0 ml,CPV单抗4 ml。第二组,0.5%葡萄糖50.0 ml,Vitamin C0.5g,Vitamin B61.0 ml,西咪替丁注射液1.0ml,酚磺乙胺注射液1.0 ml。第三组,0.5%葡萄糖50.0 ml,肌苷注射液2 ml,辅酶A 50单位,ATP注射液2 ml。第四组,复方氯化钠10.0 ml。静脉注射,每天1次,连用3~5d。
6.2对症疗法
对症治疗原则:止血、止吐、止泻、抗休克、抗菌消炎及灌肠处理。止血时,临床常用酚磺乙胺,维生素K,在治疗过程中给予一定量维生素C,能够提高止血的功效,有利于消化道黏膜损伤的快速愈合,提高止血作用。止吐一般用维生素B6、甲氧氯普胺、阿托品等药物,胃肠道出血时不能使用甲氧氯普胺。止泻主要使用斯密达,因病犬呕吐,口服给药不好,最好用深部灌肠。抗生素类药物可以选择氨苄西林钠,庆大霉素静脉注射,每天1次或2次。心功能不全(心肌炎)者可静脉滴注参麦注射液1~10ml,VB120.25~0.5mg,肌苷50~100mg,混合肌注。
6.3护理措施
犬细小病毒病在治疗过程中,护理非常重要,病犬的整个消化系统基本不能接受食物,但在治疗过程中给予少量清淡饮食如稀饭、面糊等有利于治疗本病,愈后开始饲喂时,可饲喂易于消化的流体样食物,不能饲喂肉、蛋、牛奶制品及高蛋白饲料,否则会导致胃肠二次损伤。体温偏低时,应注意保暖。
6.4治疗结果
药物治疗4d后,该犬精神好转,食欲饮欲良好,没有出现呕吐,腹泻等现象,预计该犬已经康复,现做血常规检查和犬细小病毒抗原检查。结果如下:
6.4.1血常规检查
使用兽用血液细胞分析仪检测血常规,结果详见表2。

表2 兽用血液细胞分析仪细胞计数
综合犬细小病毒抗原检查和血常规检查,该犬细小病毒已经治愈。
6.4.2犬细小病毒抗原检查
由检测结果显示为阴性(检测线T没有出现色带,而对照线C出现色带)。表明该犬细小病毒已经治愈,达到了理想的治疗效果。

7 讨论与分析
7.1流行病学特点
本病分为间接传染和直接接触传染。病犬、康复犬和带毒犬都是传染源,病犬主要从尿液粪便和呕吐物中排毒,而康复犬可能从尿液和粪便中长期排毒,污染饮水、饲料、食具和周围环境,使接触受到感染。
7.2诊断
在犬的常见病症中,犬细小病毒病应注意与犬冠状病毒肠炎、犬瘟热、犬细菌性胃肠炎等疾病的鉴别。
7.3预防
(1)接种疫苗:预防本病的根本措施是免疫接种,进口苗和国产苗的品种很多,一定要到正规医院按要求连续注射质量较好的疫苗。
(2)作好消毒工作:犬细小病毒对多种理化因素和常用消毒剂具有较强的抵抗力,存活时间长,故其传染性极强,但对福尔马林,84 消毒液等敏感。一旦发病,应迅速隔离病犬,对病犬污染的犬舍饲具、用具、运输工具进行严格的消毒,
(3)加强日常工作:时常做好保温工作,需要长途运输的情况应做到尽量减少其应激反应,可在运输之前通过饮水加入电解多维,以缓解其反应。定时定量饲喂饲料,定期驱虫。健康犬不要接触病犬,动物医院对患病犬做好隔离工作。
[1]侯加法.小动物疾病学[M].中国农业出版社,2002:82-84.
[2]陈溥言.兽医传染病学(第五版)[M].北京:中国农业出版社,2005.
[3]祝兴林,何剑斌,赵玉军,等.犬细小病毒感染的研究现状[J].辽宁畜牧兽医,2004,(10):40-42 .
