高效阴离子交换色谱法同时测定菊粉酶解产物中的单糖、双糖和低聚果糖
2016-11-15徐艳冰郑兆娟孙秀程许茜茜欧阳嘉
徐艳冰,郑兆娟,徐 颖,孙秀程,许茜茜,欧阳嘉,*
(1.南京林业大学林学院,江苏 南京 210037;2.南京林业大学化学工程学院,江苏 南京 210037;3.江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
高效阴离子交换色谱法同时测定菊粉酶解产物中的单糖、双糖和低聚果糖
徐艳冰1,郑兆娟2,3,徐 颖1,孙秀程1,许茜茜2,欧阳嘉2,3,*
(1.南京林业大学林学院,江苏 南京 210037;2.南京林业大学化学工程学院,江苏 南京 210037;3.江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
建立了低聚果糖样品中的葡萄糖、果糖、蔗糖、蔗果三糖、蔗果四糖和蔗果五糖的高效阴离子交换色谱-脉冲安培法的定量分析方法。采用阴离子交换柱CarboaPacTMPA10(250 mm×2 mm)脉冲安培法进行检测,以氢氧化钠和醋酸钠为淋洗液进行梯度洗脱,柱温30 ℃,流速0.3 mL/min。结果表明,葡萄糖、果糖、蔗糖、蔗果三糖、蔗果四糖和蔗果五糖在质量浓度0.1~10 mg/L范围内的线性关系良好,相关系数r2大于0.996 1,各组分的相对标准偏差均在2.69%~7.21%之间。将此方法应用于菊粉酶解后反应产物的检测,结果表明该方法快速简便且灵敏度高,能满足反应样品中低聚果糖的检测要求。
高效阴离子交换色谱;菊粉;低聚果糖
低聚果糖(fructooligosaccharides,FOS),是由2~10 个单糖通过β-2,1-糖苷键连接形成的直链低度聚合糖[1],也是一种纯天然、高效能、无公害的绿色食品和饲料添加剂,还是双歧杆菌的增殖因子,有多种生理功能[2-3]。菊粉是由β-呋喃果糖以β-2,1-糖苷键相连,并在其还原端接一个α-吡喃葡萄糖基的果聚糖,呈直链结构[4-5]。菊粉主要存在于菊芋、菊苣、蒲公英、牛蒡和朝鲜蓟等植物体的根部或茎部,是一种来源丰富的可再生资源。菊粉酶按其作用于糖苷键的方式不同分为内切型和外切型两类[6]。外切菊粉酶作用于菊粉链果糖末端的糖苷键,逐一水解释放出果糖,直至最后的葡萄糖,主要产物为果糖;内切菊粉酶作用于菊粉内部,随机从菊粉链内部切断糖苷键,降解产物主要为低聚果糖[7]。
目前糖类的分析和检测主要采用高效液相色谱(high performance liquid chromatography,HPLC)法[8-12]。由于低聚果糖样品是由不同聚合度的低聚糖组成的混合物,采用普通的HPLC法不能有效分离分析这些组分[13-15],从而使得低聚果糖难以进行定量分析,限制了产品质量的鉴定[16]。新型的有机高聚物阴离子交换固定相在pH 0~14范围内稳定;糖类化合物具有弱酸性及亲水性,在比较强的碱性溶液中以阴离子形态存在;因此可用强碱性溶液做流动相进行阴离子交换分离。与HPLC法相比[17-19],高效阴离子交换色谱(high performance anion exchange chromat ography,HPAEC)可利用不同相对分子质量的低聚糖之间羟基解离度的细微差异实现它们的精确分离,具有操作方便、针对性强、灵敏高和应用范围广等优点[20-21],适用于低聚糖的定性分析和定量检测。本实验采用CarboaPacTMPA10阴离子交换柱,利用HPAEC-脉冲安培检测(pulsed amperometric detector,HPAEC-PAD)建立了低聚果糖样品的定量分析方法,从而达到高效、快速分离葡萄糖、果糖、蔗糖、蔗果三糖(1-kestose,GF2)、蔗果四糖(nystose,GF3)和蔗果五糖(fructofuranosyl nystose,GF4)的目的。
1 材料与方法
1.1 材料与试剂
菊粉 青海威德生物技术有限公司;葡萄糖、蔗糖、GF2、GF3、无水醋酸钠 美国Sigma公司;果糖上海国药集团;GF4 日本和光纯药工业株式会社;500 g/L氢氧化钠溶液 美国Fluka公司。实验用水均采用电阻率不低于18.2 MΩ•cm的超纯水。
1.2 仪器与设备
ICS-3000离子交换色谱系统、CarboaPacTMPA10分析柱(250 mm×2 mm)、CarboaPacTMPA10保护柱(50 mm×2 mm) 美国Dionex公司;AS40自动进样器、柱温箱、PAD(Au工作电极,pH-Ag/AgCl复合参比电极)、色谱工作站 美国Chromeleon公司;超纯水设备 法国ELGA LabWater公司;离心机 美国Thermo Fisher公司。
1.3 方法
1.3.1 标准溶液的制备
用超纯水将葡萄糖、果糖、蔗糖、GF2、GF3和GF4分别配成一定质量浓度的母液,取适量母液配制成不同质量浓度的标准溶液,分装后标注配制时间并于-20 ℃条件下冷冻保存。使用前取出解冻至室温,取等量同浓度级别的标准溶液混合后作为工作标准溶液。
1.3.2 淋洗液的配制
200 mmol/L NaOH溶液:取500 g/L NaOH溶液10.5 mL,用超纯水稀释至1 L并定容,混匀后立即通氮气(41.3~55.1 kPa(6~8 psi))保护。500 mmol/L NaAc溶液:称取20.5 g无水NaAc固体,用超纯水溶解后转至500 mL容量瓶中,加入500 g/L NaOH溶液2.6 mL后定容,混匀后经0.22 μm醋酸纤维膜过滤,立即通氮气(41.3~55.1 kPa(6~8 psi))保护。
1.3.3 样品的制备
在200 g/L菊粉中加入60 U/g菊粉酶(由本实验室生产,来自于Aspergillus niger DSM 2466),在60 ℃、pH 4.6条件下反应8 h,反应结束后,取酶解产物于100 ℃灭活5 min,10 000 r/min条件下离心5 min。离心后取上清液,用超纯水稀释至检测浓度范围后经0.22 μm滤膜过滤,进行检测和分析。
1.3.4 色谱条件
以200 mmol/L NaOH、500 mmol/L NaAc为淋洗液进行二元梯度洗脱;淋洗程序:0~10 min,NaOH溶液浓度为40 mmol/L;10~25 min,NaOH溶液浓度从180 mmol/L线性升至200 mmol/L,同时NaAc溶液浓度从50 mmol/L降至0 mmol/L;25~55 min,以40 mmol/L NaOH溶液冲洗系统;流速0.3 mL/min;柱温30 ℃;进样体积10 μL;检测器:四电位PAD。
2 结果与分析
2.1 色谱条件优化
鉴于糖类化合物分子具有电化学活泼性及在强碱溶液中呈离子化状态,Rocklin等[22]于1983年首先报道了用阴离子交换色谱柱分离,PAD测定糖的方法。大多糖类化合物呈弱酸性,在强碱溶液中会部分或全部以阴离子形式存在,因此可以在阴离子交换柱上被保留并得到分离。表1列出了常用的分离糖的阴离子交换分离柱和主要应用。

表1 分析糖的色谱柱及其应用Table 1 Chromatographic columns for analysis of carbohydrates
由表1可知,CarboPac MA1能很好地分离 糖醇化合物[23],但是葡萄糖的保留时间长达24 min,其他糖的保留时间也长到不可接受的程度。CarboPac PA100和PA200主要用于分离低聚糖,而CarboPac PA1、PA10和PA20则是用于分离单糖和小分子低聚糖的阴离子交换柱。已有文献[24-25]报道,CarboPac PA1存在明显的溶解氧负峰,会干扰待测糖类的分离效果,而溶解氧在CarboPac PA10色谱柱的固定相上的保留较强,从而避免了其对单糖的干扰,并且低聚糖在CarboPac PA10色谱柱上也可以得到较好的分离。CarboPac PA20柱容量较小,常用于快速分离单糖或双糖,但单糖与双糖的分离度较差,低聚糖的分离效果也略差于CarboPac PA10柱。考虑到本实验需要分析的6 种糖的分析效果,选择CarboPac PA10色谱柱进行相关测定。
2.1.1 流速的选择
淋洗液的流速对色谱的分离有影响,在一定条件下增加流速会使分离度减小、峰面积减小、峰宽变窄。通过不同流速条件下对混合标准溶液的分离效果来判断流速对分离效果的影响。考察了流速在0.2~0.4 mL/min范围内的影响,其他条件同1.3.4节。从图1可以看出,随着流速的降低各组分的保留时间都有所延长,且分离度也增加,但分离效果不明显。综合考虑分离度和分离时间等因素,本实验最终选择的流速为0.3 mL/min。

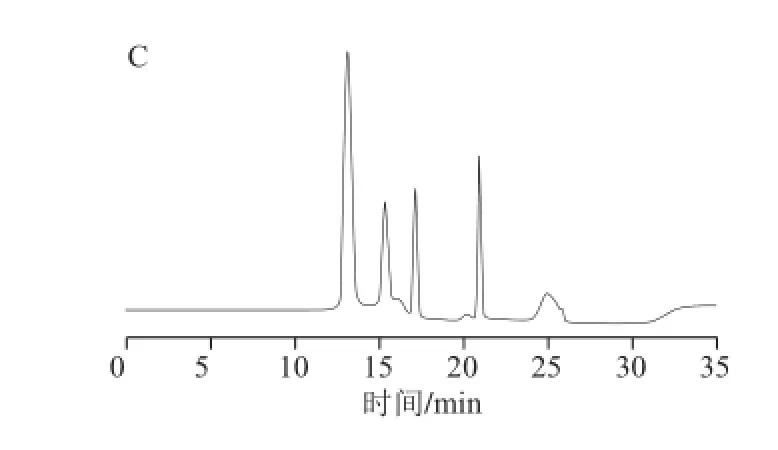
图1 流动相流速对分离效果的影响Fig.1 Effects of mobile pha se flow rate on the separation
2.1.2 醋酸钠添加时间
为提高洗脱效果,用水、氢氧化钠和醋酸钠进行三元梯度洗脱。当被洗脱成分与固定相亲和力强(如寡糖、多糖等)时,需要在淋洗液中加入比较强的淋洗离子,无电化学活性的Ac-常被加入。由于低聚果糖成分复杂,分离时常采用梯度淋洗的方式。本实验探究了5~15 min范围内添加醋酸钠梯度淋洗对洗脱效果的影响。如图2所示,可以看出在5 min时添加醋酸钠,各组分分离效果不佳,不利于定量分析。而在15 min时添加醋酸钠,会导致分离时间过长。因此选择在10 min时添加醋酸钠流动相。

图2 醋酸钠添加时间对分离效果的影响Fig.2 Effects of addition time of sodium acetate on the separation
2.1.3 标准物的确定
在1.3.4节的色谱条件下测定各标准溶液,确定各组分的保留时间;再测定混合标准液,得到混合标准液的色谱图(图3)。由图3可以看出,各物质的出峰顺序及时间为葡萄糖(8.817 min)、果糖(10.400 min)、蔗糖(13.017 min)、GF2(16.900 min)、GF3(20.450 min)、GF4(23.017 min)。

图3 混合标准液色谱图Fig.3 Chromatogram of mixed standard solution
2.2 标准曲线方程、线性关系、相对标准偏差和回收率

表2 6种标准糖的线性方程、线性范围和线性相关系数Table 2 Regression equations with linear ranges and correlationcoefficients (r2) for six sugars
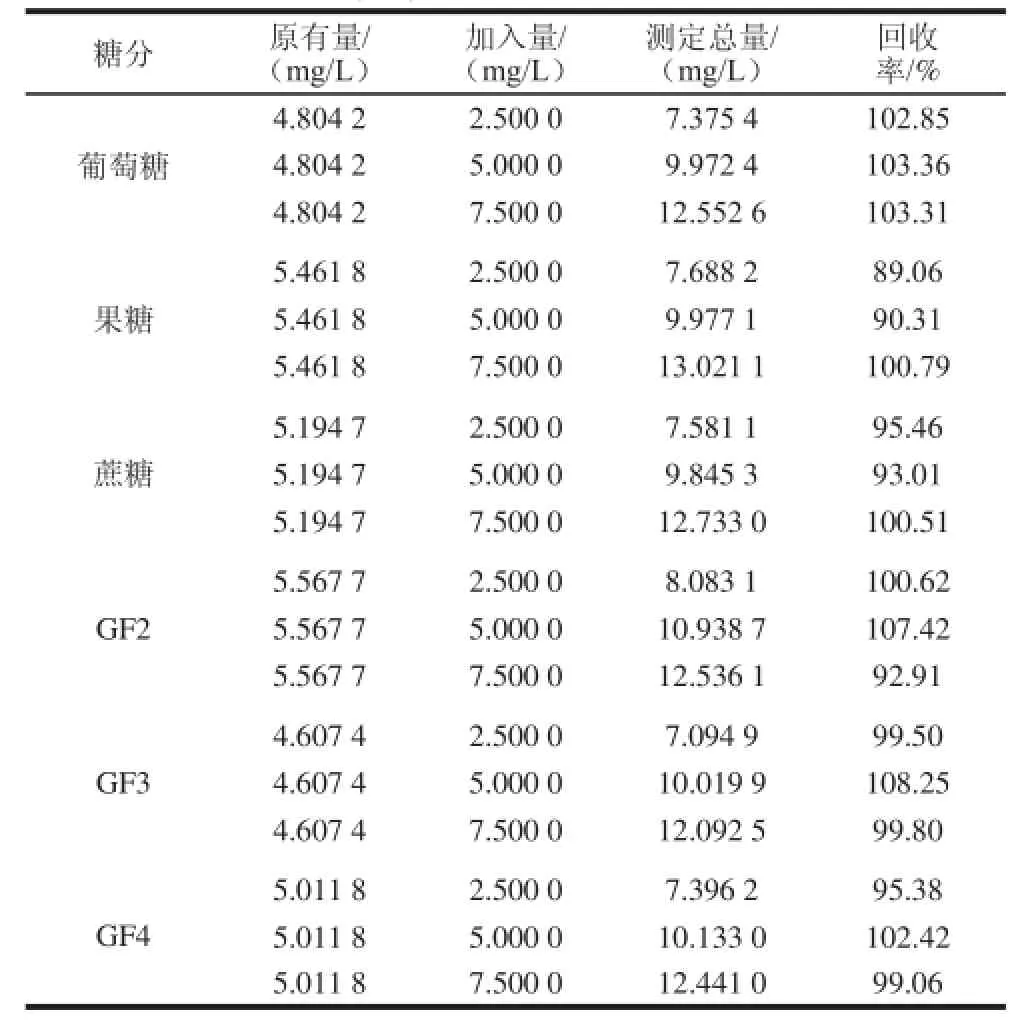
表3 样品中葡萄糖、果糖、蔗糖、GF2、GF3和GFF44的加标回收率(n=33)Table 3 Recoveries of glucose, fructose, sucrose, 1-kestose, nystose,and fructofuranosyl nystose spiked into real sample (n= 3)
将10 g/L 6 种糖标准溶液依次稀释配制成质量浓度为0.1、0.25、0.5、1.0、2.5、5.0、7.5 mg/L和10 mg/L的混合标准溶液,在优化的色谱条件下检测,根据各峰面积(y)对质量浓度(x)进行线性回归,得到6 种标准糖的标准曲线方程、线性范围和相关系数,结果见表2。向标准样品中添加低、中、高3 个水平的标准糖溶液,每个水平重复测定3 次,计算方法的回收率。从表3可以看出,回收率在89.06%~108.25%之间。将混合标准溶液在1.3节色谱条件下进样6 次,测得各组分的峰面积的相对标准偏差均在2.69%~7.21%之间。
2.3 实际样品分析
将菊粉酶酶解菊粉的产物10 000 r/min离心后,取上清液,稀释2 000 倍,经0.22 μm滤膜过滤,在1.3.4节中色谱条件下进行分析,测得各组分的质量浓度,见表4,其中GF2、GF3和GF4的总得率达到了49.07%。
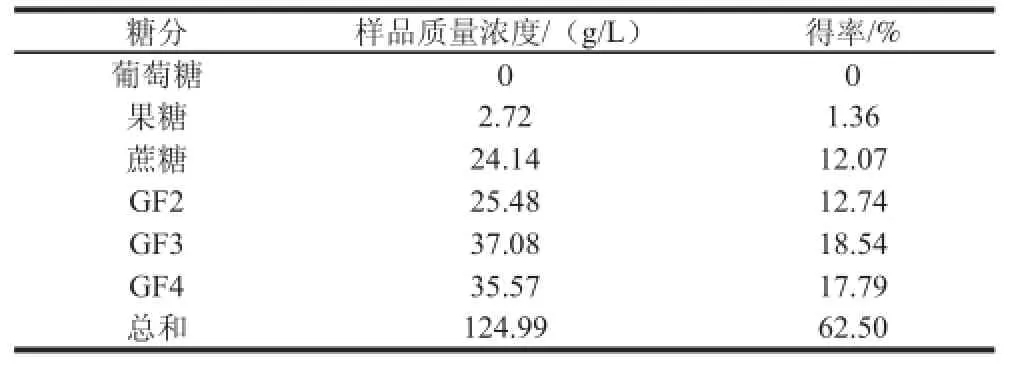
表4 样品中低聚果糖的检测结果(n=3)Table 4 Determination of FOS in samples (n=3))
3 结 论
本实验建立了一种简单快速地分析菊粉经内切菊粉酶酶解后所得产物的方法,由HPAEC柱分离后通过PAD进行检测,得到样品中葡萄糖、果糖、蔗糖、GF2、GF3和GF4的含量。本方法相对于其他的常规方法,灵敏度高、处理步骤简单、无需衍生,稀释后可直接进行检测,是一种测定菊粉酶解样品中单糖、双糖和低聚果糖的有效方法。
[1] CHI Z M, ZHANG T, CAO T S, et al. Biotechnological potential of inulin for bioprocesses[J]. Bioresource Technology, 2011, 102(6): 4295-4303. DOI:10.1016/j.biortech.2010.12.086.
[2] BOSSCHER D, van LOO J, FRANCK A. Inulin and oligofructose as functional ingredients to improve bone Mineralization[J]. International Dairy Jou rnal, 2006, 6(9): 1092-1097. DOI:10.1016/ j.idairyj.2005.10.028.
[3] ROBERFROID M B. Inulin-type fructans: functional food ingredients[J]. The Journal of nutrition, 2007, 137(Suppl 1): 2493-2502.
[4] MATÍAS J, GONZÁLEZ J, ROYANO L, et al. Analysis of sugars by liquid chromatography-mass spectrometry in Jerusalem artichoke tubers for bioethanol production optimization[J]. Biomass and Bioenergy, 2011, 35(5): 2006-2012. DOI:10.1016/ j.biombioe.2011.01.056.
[5] MUTANDA T, MOKOENA M P, OLANIRAN A O, et al. Microbial enzymatic production and applications of short-chain fructooligosaccharides and inulooligosaccharides: recent advances and current perspectives[J]. Journal of Industrial Microbiology and Biotechnology, 2014, 41(6): 893-906. DOI:10.1007/s10295-014-1452-1.
[6] ROCHA J R, CATANA R, FERREIRA B S, et al. Design and characterisation of an enzyme system for inulin hydrolysis[J]. Food Chemistry, 2006, 95(1): 77-82. DOI:10.1016/j.foodchem.2004.12.020.
[7] 陈晓明, 陈静, 陈寒青, 等. Aspergillus fi cuum内切菊粉酶基因在大肠杆菌中表达[J]. 食品与生物技术学报, 2011, 30(3): 388-393.
[8] 丁洪流, 李灿, 金萍, 等. 高效液相色谱-蒸发光散射法测定食品中的单糖、双糖、低聚果糖和糖醇[J]. 色谱, 2013, 31(8): 804-808. DOI:10.3724/SP.J.1123.2013.01013.
[9] 范丽, 徐勇, 连之娜, 等. 高效阴离子交换色谱-脉冲安培检测法定量测定低聚木糖样品中的低聚木糖[J]. 色谱, 2 011, 29(1): 75-78. DOI:10.3724/SP.J.1123.2011.00075.
[10] 李静, 李仁勇, 梁立娜. 毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成[J]. 分析化学, 2012, 40(9): 1415-1420. DOI:10.3724/ SP.J.1096.2012.20061.
[11] 朱松, 戴军, 陈尚卫, 等. 高效阴离子交换色谱法检测酱油中的单糖及双糖[J]. 分析测试学报, 2013, 31(11): 1411-1415. DOI:10.3969/ j.issn.1004-4957.2012.11.012.
[12] 张志国, 生庆海. HPLC法检测低聚果糖的研究[J]. 食品科学, 2002, 23(8): 221-223.
[13] 甘宾宾. 高效液相色谱法测定低聚果糖的组分[J]. 色谱, 1999, 17(1): 87-89.
[14] 程涛, 刘晓铭. 高效液相色谱法测定乳制品中的低聚果糖的含量[J].中国乳品工业, 1999, 27(5): 26-27.
[15] 王浩, 刘艳琴, 杨红梅, 等. 液相色谱-质谱联用技术测定无糖食品中果糖, 葡萄糖, 蔗糖, 麦芽糖和乳糖[J]. 分析化学, 2010, 38(6): 873-876. DOI:10.3724/SP.J.1096.2010.00873.
[16] 马瑞, 欧阳嘉, 李鑫, 等. 高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J]. 色谱, 2012, 30(1): 62-66. DOI:10.3724/SP.J.1123.2011.09033.
[17] 李媚, 李廿, 曾平, 等. 高效液相色谱法同时测定右旋糖酐发酵液中的多种糖分[J]. 食品科技, 2014, 39(12): 308-312. DOI:10.13684/ j.cnki.spkj.2014.12.065.
[18] 张媛媛, 聂少平, 万成, 等. 高效液相色谱-蒸发光散射检测法同时测定单糖, 双糖及低聚果糖[J]. 食品科学, 2009, 30(18): 237-239.
[19] 刘玉峰, 李黎, 李东, 等. 高效液相色谱法测定食品中的单糖, 双糖[J].食品科学, 2007, 28(3): 293-296.
[20] 徐颖, 臧颖, 姜婷, 等. 高效阴离子交换色谱-脉冲安培检测法同时测定生物转化样品中的海藻糖、葡萄糖和麦芽糖[J]. 色谱, 2014, 32(12): 1400-1403. DOI:10.3724/SP.J.1123.2014.07037.
[21] 张磊, 周光明, 熊建飞. 离子色谱法检测水果, 饮品中的蔗糖, 葡萄糖和果糖[J]. 食品科学, 2012, 33(8): 159-162.
[22] ROCKLIN R D, POHL C A. Determination of carbohydrates by anion exchange chromatography with pulsed amperometric detection[J]. Journal of Liquid Chromatography, 1983, 6(9): 1577-1590. DOI:10.1080/01483918308064876.
[23] 唐坤甜, 梁立娜, 蔡亚岐, 等. 高效阴离子交换色谱分离-脉冲安培检测法测定烟草料液中的糖, 糖醇和醇类化合物[J]. 分析化学, 2007, 35(9): 1274-1278. DOI:10.3321/j.issn:0253-3820.2007.09.007.
[24] 牟世芬, 于泓, 蔡亚岐. 糖的高效阴离子交换色谱-脉冲安培检测法分析[J]. 色谱, 2009, 27(5): 667-674. DOI:10.3321/ j.issn:1000-8713.2009.05.019.
[25] 潘城. 高效液相色谱-示差折光法测定饲料中低聚果糖含量[J]. 中国饲料, 2015(3): 26-27. DOI:10.15906/j.cnki.cn11-2975/s.20150308.
Simultaneous Determination of Monosaccharides, Disaccharides, and Fructooligosaccharides in Inulin Hydrolysates by High Performance Anion Exchange Chromatography
XU Yanbing1, ZHENG Zhaojuan2,3, XU Ying1, SUN Xiucheng1, XU Qianqian2, OUYANG Jia2,3,*
(1. College of Forestry, Nanjing Forestry University, Nanjing 210037, China; 2. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China; 3. Jiangsu Key Lab of Biomass-based Green Fuels and Chemicals, Nanjing 210037, China)
An analytical method for the simultaneous determination of glucose, fructose, sucrose, kestose, nystose, and fructofuranosylnystose in fructooligosaccharide products was developed by using high performance anion exchange chromatography coupled with pulsed ampere detection (HPAEC-PAD). The analysis was performed on a CarboPacTMPA10 column(250 mm × 2 mm)by gradient elution using NaOH-NaAc as the mobile phase. The column temperature was set at 30 ℃, and the fl ow rate was 0.3 mL/min. The results showed that the calibration curves developed for glucose, fructose, sucrose, kestose, nystose and fructofuranosylnystose had a good linear relationship within the concentration range of 0.1–10 mg/L (r2> 0.996 1). The relative standard deviation for six repetitive determinations of each sugar was between 2.69% and 7.21%. Thi s method is convenient, simple, and sensitive for the detection of fructooligosaccharide products from the enzymatic hydrolysis of inulin.
high performance anion exchange chromatography; inulin; fructooligosaccharides
10.7506/spkx1002-6630-201602013
TS245.9
A
1002-6630(2016)02-0077-05
徐艳冰, 郑兆娟, 徐颖, 等. 高效阴离子交换色谱法同时测定菊粉酶解产物中的单糖、双糖和低聚果糖[J]. 食品科学, 2016, 37(2): 77-81. DOI:10.7506/spkx1002-6630-201602013. http://www.spkx.net.cn
XU Yanbing, ZHEN Zhaojuan, XU Ying, et al. Simultaneous determination of monosaccharides, disaccharides, and fructooligosaccharides in inulin hydrolysates by high performance anion exchange chromatography[J]. Food Science, 2016, 37(2): 77-81. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602013. http://www.spkx.net.cn
2015-05-18
国家自然科学基金青年科学基金项目(31200443;31300487);江苏省杰出青年基金项目(BK2012038);国家高技术研究发展计划(863计划)项目(2012AA022301);江苏省自然科学基金项目(BK20130970);江苏省重点研发计划项目(BF2015007)
徐艳冰(1991—),女,硕士研究生,研究方向为工业微生物。E-mail:xuyanbing90@126.com
*通信作者:欧阳嘉(1972—),女,教授,博士,研究方向为植物纤维资源利用、基因工程和酶工程。E-mail:hgouyj@njfu.edu.cn
