层层自组装法制备百里香精油微胶囊条件优化
2016-11-15申莉莉白友菊马治灿陈加平
黄 晶,申莉莉,白友菊,马治灿,陈加平,冯 武
(华中农业大学食品科学技术学院,湖北 武汉 430070)
层层自组装法制备百里香精油微胶囊条件优化
黄 晶,申莉莉,白友菊,马治灿,陈加平,冯 武*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
采用层层自组装的方法,以百里香精油乳化液纳米微粒作为核心,利用壳聚糖和海藻酸钠对百里香精油进行包埋;以司盘80和吐温60复配乳化剂亲水亲油平衡(hydrophilic lipophilic balance,HLB)值、用量及油乳比例3 个因素进行实验,确定乳化液最适制备条件;以壁材溶液质量浓度、组装层数、每层组装时间、搅拌速率、组装温度、壁材溶液pH值和固化剂用量进行单因素试验,以主要因素设计正交试验,确定最佳包埋条件。结果表明,乳化液制备条件为HLB值10、乳化剂用量6%、精油与乳化剂体积比1∶6,此条件下所制备的乳化微粒为模板,组装层数4 层、搅拌速率1 040 r/min、每层组装时间15 min、壁材溶液pH 5.0、组装温度30 ℃,此条件下包埋率最高为80.23%。
层层自组装;微胶囊;百里香精油;正交试验;包埋率
百里香精油具有强抗氧化性、抗菌效果好的特点,是高效的天然防腐剂、抗氧化剂及食品稳定剂[1]。然而,精油中的香气成分容易挥发,与食品成分直接接触会降低其作用,解决这一问题的措施之一就是微胶囊化技术。经过微胶囊化后,由于囊壁对囊芯的保护作用,使得囊芯呈现出特殊的稳定性,可以减少挥发,防止氧化,所以它可以贮存并在工业应用中保持较长的时间[2]。
壳聚糖(chitosan,CS)和海藻酸钠(sodium alginate,ALG)是两种具有生物活性、可生物降解、生物相容性好的材料,并且分别带有聚阳离子和聚阴离子[3-4]。目前国内外关于精油微胶囊化的研究很多,其中应用层层自组装法对精油进行包埋的研究比较少[5]。本研究采用乳化交联技术,以乳化液微粒作为核心模板,并利用层层自组装技术在其表面交替组装CS/ALG[6-13]。层层自组装技术相比于其他方法具有许多优点,其对成膜的基质无限制,能够在纳米尺度上对胶囊的大小、组成、结构、形态和囊壁厚度进行精确的控制,制备的微胶囊具备良好的机械和化学稳定性[14-15]。
利用高速搅拌技术、高压均质技术及超声分散技术制备的百里香精油乳化液纳米微粒为核心,进行层层自组装,获得百里香精油微胶囊,通过将冷冻干燥的微胶囊粉末制备成粉包的形式与果蔬一起贮藏,实现精油缓慢释放并对果蔬以熏蒸的形式加以保护。为百里香精油运用于果蔬防腐保鲜及货架期的延长提供参考。
1 材料与方法
1.1 材料与试剂
百里香精油 美国国际香精香料公司。
CS(脱乙酰度85%~95%)、ALG(500 cps)、95%乙醇、司盘80、吐温80、司盘60、吐温20、吐温60(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
UV1700紫分光光度计 日本岛津公司;PHS-25数显pH计 上海理达仪器厂;KQ2200DE超声仪 昆山市超声仪器有限公司;ATS均质机 宁波新芝生物科技股份有限公司;WV GP470光学显微镜 上海徕卡显微系统有限公司;Malvern Zetasizer Nano ZS粒径仪英国马尔文公司;Beta2-8LD冷冻干燥器 德国Christ公司;752型可见分光光度计 上海光博仪器有限公司。
1.3 方法
1.3.1 乳化液制备
1.3.1.1 乳化剂相容性
[16]方法,将司盘与吐温按质量比为5∶5混合后再与水混合,使混合表面活性剂体积分数为5%,40 ℃、1 560 r/min条件下将混合物搅拌乳化20 min,观察司盘60与吐温20、吐温60、吐温80 以及司盘80 与吐温20、吐温60、吐温80 的相容性。
1.3.1.2 乳化剂亲水亲油平衡(hydrophilic lipophilic balance,HLB)值的确定
司盘80与吐温60 复配成HLB值8、9、10、11、12、13、14,用量6%(体积分数,下同),精油与乳化剂体积比1∶6,搅拌(50 ℃、20 min、1 560 r/min),然后超声(40 ℃、99 W、30 min),再高压均质(20 ℃,1 000 bar,10 min)后测定Zeta电位。
1.3.1.3 精油与乳化剂体积比的确定
精油与乳化剂体积比为1∶7、1∶6、1∶5、1∶4、1∶3,乳化剂用量6%、HLB值10条件下测定乳化液Zeta电位。
1.3.1.4 乳化剂用量的确定
在乳化剂用量为2%、4%、6%、8%、10%,精油与乳化剂体积比1∶6、HLB值10时,测定乳化液Zeta电位。
1.3.2 百里香精油微胶囊的制备
参考文献[17]的方法稍作修改。向一定量乳化液中加入质量浓度分别为0.05、0.1、0.15、0.2、0.25 g/100 mL CS溶液(氯化钠0.5 mol/L,pH 4.5,溶于2%醋酸溶液),40 ℃、1 040 r/min速率搅拌组装20 min后,在40 W、40 ℃条件下超声分散10 min,得到乳液微粒表面组装有一层CS的微球,测定电导率。
向组装了一层的微球中分别加入质量浓度分别为0.05、0.1、0.15、0.2、0.25 g/100 mL的ALG溶液(氯化钠0.5 mol/L,pH 4.5),40 ℃、1 040 r/min速率搅拌20 min进行组装,再在40 W、20 ℃超声分散10 min,得到组装了两层的微球,测定电导率。
在组装了两层的微球中,分别加入20 mL质量浓度分别为0.05、0.1、0.15、0.2、0.25 g/100 mL的CS(pH4.5,氯化钠0.5 mol/L)溶液,40 ℃、1 040 r/min转速搅拌20 min进行组装,之后在40 W、40 ℃条件下超声分散10 min,测定电导率。
重复2、3 层组装的两步,层层自组装。待组装到适宜层数后,用质量分数10% NaOH溶液调节pH 6.0,加入一定量固化剂氯化钙,于4 ℃固化1 h,经冷冻干燥,得到固态微胶囊产品。
1.3.3 百里香精油标准曲线制作
移取10 μL百里香精油,用95%乙醇溶液定容至10 mL,摇匀;再从这10 mL中分别移取0.2、0.4、0.6、0.8、1.0 mL并用95%乙醇溶液定容至10 mL,摇匀,在274 nm波长处测定其吸光度。以百里香精油体积为横坐标,以吸光度为纵坐标绘制标准曲线。
1.3.4 Zeta电位的测定
取100 μL微胶囊悬浮液,用蒸馏水稀释100 倍,对稀释液进行Zeta电位测定。
1.3.5 百里香精油微胶囊制备单因素试验
1.3.5.1 组装层数的确定
微胶囊制备的搅拌速率1 040 r/min、每层组装时间15 min、壁材溶液pH 4.5、固化剂(1.5%氯化钙溶液)用量10%(体积分数,下同)、组装温度40 ℃时,分别制备层数分别为2、4、6、8层的微胶囊,测定其包埋率。
1.3.5.2 搅拌速率的确定
微胶囊制备的组装层数4 层、每层组装时间15 min、壁材溶液pH 4.5、固化剂用量10%、组装温度40 ℃时,分别在搅拌转速为520、780、1 040、1 300、1 560 r/min的条件下制备微胶囊,测定其包埋率。
1.3.5.3 每层组装时间的确定
微胶囊制备的组装层数4 层、搅拌速率1 040 r/min、壁材溶液pH 4.5、固化剂用量10%、组装温度40 ℃时,分别在组装时间15、20、25、30 min的条件下制备微胶囊,测定其包埋率。
1.3.5.4 壁材溶液pH值的确定
微胶囊制备的组装层数4层、搅拌速率1 040 r/min、每层组装时间15 min、固化剂用量10%、组装温度40 ℃时,分别在壁材溶液pH 3.5、4.0、4.5、5.0的条件下制备微胶囊,测定其包埋率。
1.3.5.5 固化剂用量的确定
微胶囊制备的组装层数4层、搅拌速率1 040 r/min、每层组装时间15 min、壁材溶液pH 4.5、组装温度40 ℃时,分别在固化剂用量2%、4%、6%、8%、10%的条件下制备微胶囊,测定其包埋率。
1.3.5.6 组装温度的确定
微胶囊制备的组装层数4层、搅拌速率1 040 r/min、每层组装时间15 min、壁材溶液pH 4.5、固化剂用量10%时,分别在组装温度20、30、40、50 ℃的条件下制备微胶囊,测定其包埋率。
1.3.6 百里香精油微胶囊制备正交试验

表1 L9(34)正交试验设计因素水平Table 1 Factors and their coded level used in L9(34) orthogonal array desiggnn
按照文献[18],进行正交试验优化(表1)。根据单因素试验方差分析结果确定每层组装时间、壁材溶液pH值及组装温度3 个因素影响极显著。对此3 个因素加上搅拌速率4 个单因素设计正交试验,确定四因素三水平表,对结果进行极差分析。
1.3.7 微胶囊包埋率的测定
微胶囊表面油含量的测定:根据文献[19-20]方法,稍作修改,精确称取一定质量的百里香精油固态微胶囊,用5 mL 95%乙醇溶液迅速过滤,定容至10 mL,测定274 nm波长处紫外吸光度,根据标准曲线计算百里香精油表面油的含量。
微胶囊总油含量的测定:精确称取0.01 g的百里香精油固态微胶囊,用5 mL 95%乙醇溶液室温浸泡30 min,再在20 ℃、99 W进行超声破碎15 min,再在室温浸泡30 min,迅速过滤,将滤液定容至10 mL,测定274 nm波长处吸光度,根据标准曲线计算百里香精油表面油的含量。然后参见式(1)计算包埋率。

1.3.8 微胶囊产率的测定
参考文献[21]的方法,得到冷冻干燥后的微胶囊粉末质量、制备微胶囊所用壁材的质量及所用百里香精油的质量、固化交联所用固化剂的质量。产率公式见式(2)。

1.3.9 验证实验
由正交试验结果分析得到微胶囊制备的最佳水平,利用该最佳水平的条件制备微胶囊,对其包埋率进行测定,以验证该最优水平。
2 结果与分析
2.1 百里香精油标准曲线制作
由百里香精油对吸光度的标准曲线可得方程为y=8.00x-0.013 0,其相关性系数R2=0.999 1,表明百里香精油在0~0.1 μL内与吸光度线性相关性较高。标准曲线方程中,x为百里香精油含量/(μL/mL),y为274 nm波长处吸光度。
2.2 乳化液制备条件优化
2.2.1 乳化剂种类选择
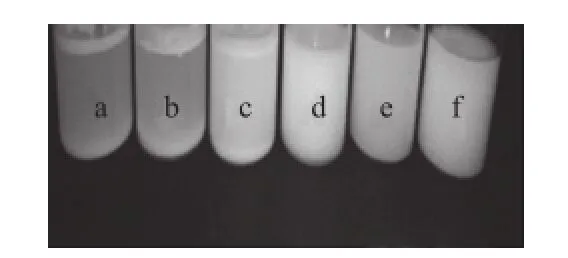
图1 乳化剂复配稳定性Fig.1 Emulsifier stability
由图1可知,不同乳化剂之间的相容性存在差异,其中司盘80和吐温20、司盘80和吐温60、司盘80与吐温80复配可以得到稳定的乳化剂水溶液,这和乳化剂分子结构有关。司盘系列分子较小,而吐温系列分子较大,当它们二者进行复配时,司盘插入吐温间隙中。司盘80与吐温80的两者的相容性较好。而当司盘80与吐温60复配时,两者也具有良好的相容性。结合黏度分析,可知司盘80与吐温60复配时所制得的乳化液黏度最大为26.4 mPa·s,而司盘80与吐温80的黏度为20.1 mPa·s,而黏度越大,则乳化液越不容易沉降,故其稳定性是最好的,综上分析,选择司盘80与吐温60进行复配。与吴成兰[16]结果存在一定的差异,但最终结论最佳复配乳化剂组合为司盘80与吐温60与他的结果一致。
2.2.2 乳化剂HLB值选择
如图2所示,HLB值为10时,Zeta电位绝对值最大,乳化颗粒之间分散性最大,所得乳化液最稳定。因为HLB值为10时最接近百里香精油乳化时的最适HLB值,而其他值则由于和10逐渐远离而使得乳化效果变差。与已有研究[22]结论相符。
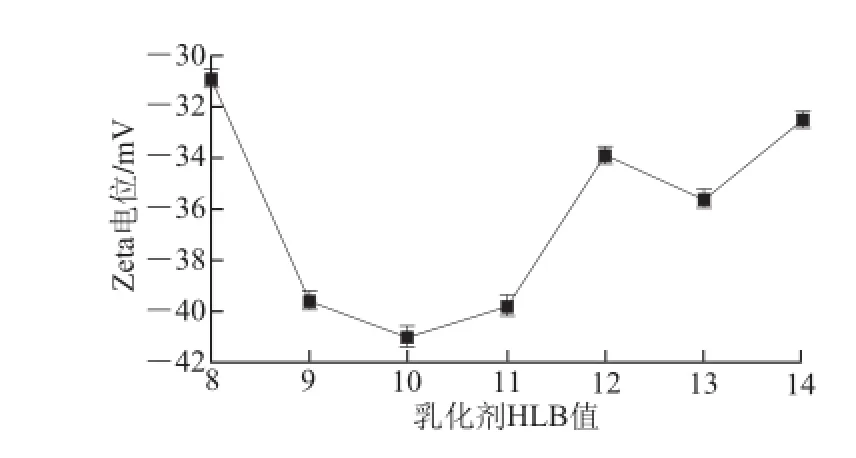
图2 不同HLB值乳化剂制备乳化液Zetaa电位Fig.2 Zeta potential of emulsions with emulsifiers of different HLB values
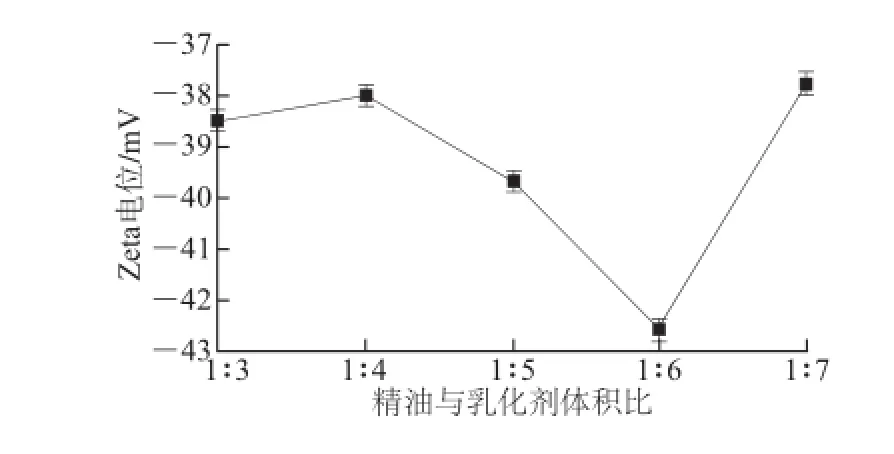
图3 不同精油与乳化剂体积比条件下乳化液Zetaa电位Fig.3 Zeta potential of emulsions with different ratios of oil to emulsifier
2.2.3 精油与乳化剂体积比选择
如图3所示,精油与乳化剂体积比为1∶6时,Zeta电位绝对值最大,乳化颗粒之间分散性最大,所得乳化液最稳定。因为精油与乳化剂比值较小时,乳化剂用量不能将精油进行充分的乳化,而当乳化剂用量过多时,乳化液含量过大,乳化微粒间分散性降低。
2.2.4 乳化剂用量选择
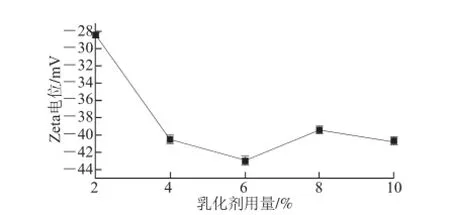
图4 不同乳化剂用量条件下乳化液Zetaa电位Fig.4 Zeta potential of emulsions with different concentrations of emulsifier

图5 最佳乳化液光镜图(×40)Fig.5 Light micrograph of optimal emulsion (× 40)
如图4所示,乳化剂用量为6%时,Zeta电位绝对值最大,乳化颗粒之间分散性最大,所得乳化液最稳定。因为精油与乳化剂比值较小时,乳化剂用量不能将精油进行充分的乳化,而当乳化剂用量过多时,乳化液质量浓度过大,乳化微粒间分散性降低。所得最佳乳化液见图5。
2.3 百里香精油微胶囊制备工艺优化
2.3.1 壁材溶液质量浓度选择
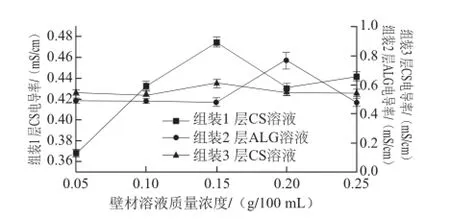
图6 不同壁材溶液质量浓度条件下微球电导率变化Fig.6 Changes in conductivity of microspheres with different wall materials as a function of wall material concentration
如图6所示,在进行微胶囊的第1层组装时,随着CS溶液质量浓度增加,电导率呈现先增加后减小的趋势。由于随着质量浓度的增加,CS分子组装到微球表面量逐渐增加,使得微球导电性逐渐增加,而随着CS质量浓度的继续增加,分子间流动性变差,使得导电性又出现降低的趋势。因此,选择CS质量浓度为0.15 g/100 mL。在进行微胶囊的第2层组装时,随着ALG溶液质量浓度增加,电导率呈现先增加后减小的趋势。由于随着质量浓度的增加,ALG分子组装到微球表面量逐渐增加,使得微球导电性逐渐增加,当ALG质量浓度继续增加时导致分子间流动性变差,使得导电性又出现降低的趋势。因此,选择ALG质量浓度为0.20 g/100 mL。在进行微胶囊的第3层组装时,随着CS溶液质量浓度增加,电导率呈现先增加后减小的趋势,在CS质量浓度为0.15 g/100 mL时电导率最大。因此,选择CS质量浓度为0.15 g/100 mL来作为后面层层自组装时的质量浓度。

图7 不同组装层数条件下微胶囊Zeta电位变化Fig.7 Changes in Zeta potential of microcapsules with different assembly layers
由图7可知,随着组装层数的增加,微球表面Zeta电位出现正负交替变化,则说明,CS和ALG两种壁材溶液在微球表面实现了有效的层层自组装过程。符合研究表明的CS和ALG能够成功进行层层自组装的相关结论[23]。
2.3.2 组装层数对包埋率的影响

表2 罗丹明B标记CS微球溶液吸光度Table 2 Absorbance values of rhodamine B labeled chitosanmicrosphere solutions

图8 不同组装层数条件下微胶囊包埋率Fig.8 Microencapsulation efficiencies with different assembled layers
由表2可知,采用罗丹明B标记的CS替代未标记的CS组装到微球表面,随着组装层数的增加,在560 nm波长处可见光处吸光度增大,而当组装到第3层之后,吸光度增加比较小,基本趋于稳定,则第4层之后CS组装到微胶囊上的比较少,而且组装过程中精油会损失,故组装4 层最佳。并且结合包埋率测定结果(图8)可知,在组装层数为4 层时包埋率最大,由于在组装层数太小时,精油装载时间太短,还没有充分地进入微球内部,而组装层数过多时,精油出现了较大的损失。因此,选择组装层数为4层。
2.3.3 搅拌速率对微胶囊包埋率的影响

图9 不同搅拌速率条件下微胶囊包埋率Fig.9 Microencapsulation efficiencies at different stirring speeds
由图9可知,在搅拌速率为780 r/min时包埋率最大,由于在搅拌速率太小时,精油分子运动较缓慢,还没有充分地进入微球内部就已挥发;而搅拌速率过快时,精油分子容易出现飞溅,产生较大的损失。因此,选择搅拌速率为780 r/min。对此单因素进行方差分析得到其F值为2 352.63,而F0.05=5.96,F0.01=14.55,F>F0.01,故该因素对包埋率影响极显著。方差分析参考工具书[24]的方法进行计算与分析。
2.3.4 每层组装时间对微胶囊包埋率的影响
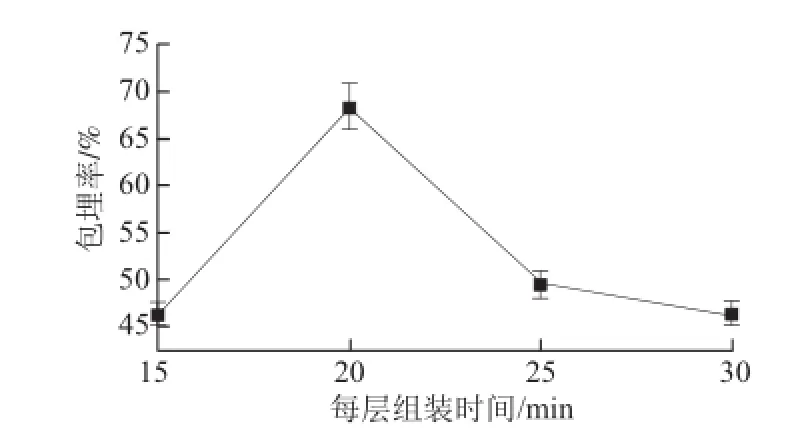
图10 不同每层组装时间条件下微胶囊包埋率Fig.10 Microencapsulation efficiencies with different assembly times for each layer
由图10可知,在每层组装时间为20 min时包埋率最大,由于在组装时间太短时,还没有充分地进入微球内部就已挥发;而组装时间过长时,精油分子容易挥发,产生较大的损失。因此,选择组装时间为20 min。对此单因素进行方差分析得到其F值为2.48,而F0.05=5.96,F0.01=14.55,F<F0.05,故该因素对包埋率影响不显著。
2.3.5 壁材溶液pH值对微胶囊包埋率的影响

图11 不同壁材溶液pH值条件下微胶囊包埋率Fig.11 Microencapsulation efficiencies at different pH values of wall material solution
如图11所示,对不同体系pH值形成的微胶囊的油脂包埋率进行测定,发现pH值为3.5~4.5时,包埋率逐渐增加,而当pH值由4.5增大到5.0,包埋率反而减少,这是由于此时CS和ALG产生的凝聚现象受到了抑制,形成的微胶囊较不稳定[25-26]。因此,选择合适的pH值为4.5。对此单因素进行方差分析得到其F值为15.38,而F0.05=5.96,F0.01=14.55,F>F0.01,故该因素对包埋率影响极显著。
2.3.6 固化剂用量对微胶囊包埋率的影响

图12 不同固化剂用量条件下微胶囊包埋率Fig.12 Microencapsulation efficiencies with different amounts of curing agent
由图12可知,在固化剂用量为8%时包埋率最大,由于在固化剂用量太少时,形成的微胶囊结构不稳定;而固化剂用量过多时,形成的微胶囊结构致密,精油渗透进入微球内部的量减小或者在总油提取的过程中未能实现充分的提取。因此,选择固化剂用量为8%。对此单因素进行方差分析得到其F值为4.34,而F0.05=5.96,F0.01=14.55,F<F0.05,故该因素对包埋率影响不显著。
2.3.7 组装温度对微胶囊包埋率的影响
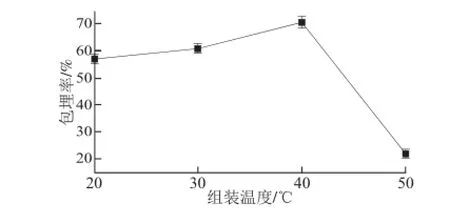
图13 不同组装温度条件下微胶囊包埋率Fig.13 Microencapsulation efficiencies at different assembly temperatures
由图13可知,在组装温度为40℃时包埋率最大,由于在组装温度太低时,精油分子热运动较弱,不能充分扩散进入微胶囊内部;而组装温度太高时,精油分子容易挥发,产生较大的损失。因此,选择组装温度为40 ℃。对此单因素进行方差分析得到其F值为42.62,而F0.05=5.96,F0.01=14.55,F>F0.01,故该因素对包埋率影响极显著。
2.4 百里香精油微胶囊制备正交试验
从单因素试验结果可知,影响微胶囊油脂包埋率的各因素主要为壁材溶液pH值、组装温度、每层组装时间和搅拌速率。由此4 个因素设计正交试验,试验设计及结果见表3。
(1)属性anaType表示指代类型,即哪种要素的指代,或是事件的指代.若是对象要素的指代,属性值为Object;若是时间要素的指代,属性值为Time;若是环境要素的指代,属性值为Location;若是事件的指代,属性值为Event.
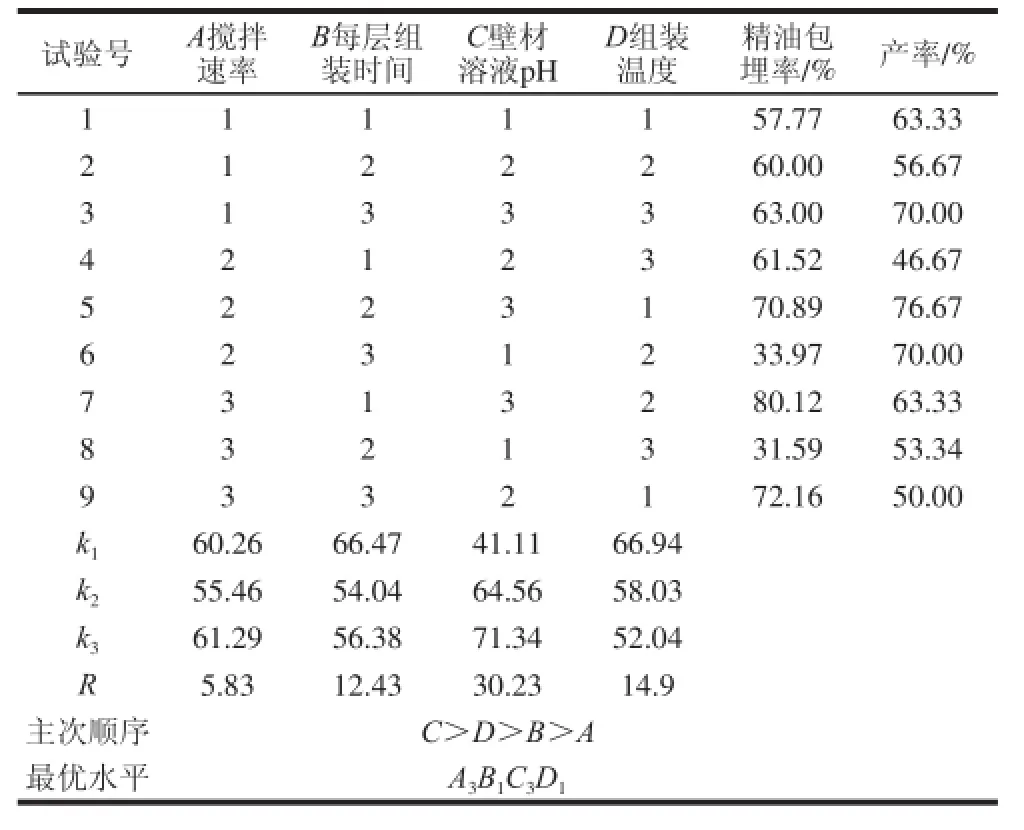
表3 百里香精油微胶囊正交试验优化结果与分析Table 3 Orthogonal array design with analysis of experimental resultsfor thyme oil microcapsulation
从精油的利用率及来看,选择包埋率最高的条件为最优制备条件,由表3可知,最佳组合为A3B1C3D1,即壁材溶液pH 5.0、组装温度30 ℃、每层组装时间15 min、搅拌速率1 040 r/min。为了验证试验设计所得结果的可靠性,采用上述工艺进行百里香精油微胶囊的包埋实验,得到包埋率为80.23%,与最优水平得到的结果相差很小,说明该最佳水平是可靠的。
3 结 论
通过正交试验优化方法对百里香精油微胶囊包埋条件探索,结果表明最佳制备组合水平为A3B1C3D2,即搅拌速率1 040 r/min、每层组装时间15 min、壁材溶液pH 5.0、组装温度30 ℃,此条件下包埋率为80.23%。
参考文献:
[1] 王娣. 百里香精油的微胶囊制备及其缓释性能[J]. 食品科学, 2013, 34(6): 60-63. DOI:10.7506/spkx1002-6630-201306013.
[2] 王芳, 淡小艳. 橘皮精油微胶囊的制备及其稳定性研究[J]. 中国粮油学报, 2012, 27(12): 78-82. DOI:10.3969/j.issn.1003-0174.2012.12.014.
[3] 郎轶咏, 李峥. 壳聚糖-海藻酸钠微球载体的制备[J]. 解放军药学学报, 2012, 28(5): 432-435. DOI:10.3969/j.issn.1008-9926.2012.05.17.
[4] 位晓娟, 张长青. 壳聚糖的性能、产品及应用[J]. 中国修复重建外科杂志, 2010, 24(10): 1265-1270.
[6] PUETK J, ZIELIN K, SACZKO J. New approach to hydrophobic cyanine-type photosensitizer delivery using polymeric oil-cored nanocarriers: hemolytic activity, in vitro cytotoxicity and localization in cancer cells[J]. European Journal of Pharmaceutical Sciences, 2010, 39(5): 322-335. DOI:10.1016/j.j.ejps.2009.12.012.
[7] OGAWA S, DECKER E A, MCCLEMENTS D J. Production and characterization of O/W emulsions containing droplets stabilized by lecithin-chitosan-pectin mutilayered membranes[J]. Agricultural and Food Chemistry, 2004, 52(11): 3595-3600. DOI:10.1021/jf020590f.
[8] 梁振鹏, 王朝阳, 孙启龙, 等. LbL层层纳米自组装法制备新型微胶囊[J]. 化学进展, 2004, 16(4): 485-491. DOI:10.3321/j.issn:1005-281X.2004.04.002.
[9] GUDIPATI V, SANDRA S, MCCLEMENTS D J, et al. Oxidative stability and in vitro digestibility of fish oil-in-water emulsions containing multilayered membranes[J]. Agricultural and Food Chemistry, 2010, 58(13): 8093-8099. DOI:10.1021/jf101348c.
[10] SZCZIPANOWICZ K, HOEL H J, WARSZYNSKA L S, et al. Formation of biocompatible nanocapsules with emulsion core and pegylated shell by polyelectrolyte multilayer adsorption[J]. Langmuir, 2010, 26(15): 12592-12597. DOI:10.1021/la102061s.
[11] LERTSUTTHIWONG P, NIMMANNIT U, ROJSITTHISAK P. Preparation of turmeric oil-loaded chitosan-alginate biopolymeric nanocapsules[J]. Materials Science and Engineering C Biomimetic and Supramolecular Systems, 2009, 29: 856-860. DOI:10.1016j. Msec.2008.08.004.
[12] ADAMCZAK M, KUPIEC A, JAREK E. Preparation of the squalene-based capsules bymembrane-emulsification method and polyelectrolyte multilayer adsorption[J]. Colloids and Surfaces A:Physicochem. Engineering, 2014, 462(20): 147-152. DOI:10.1016/ j.colsurfa.2014.09.004.
[13] SAK U B, SKI P W, KAZIMIERA A. Influence of pH upon in vitro sustained dye-release from oil-core nanocapsules with multilayer shells[J]. Colloids and Surfaces A: Physicochemical Engineering, 2012, 423(5): 266-272. DOI:10.1016/j.colsurfa.2011.12.006.
[14] DECHER G. Fuzzy nanoasemblies: toward layered polymeric multi-composites[J]. Science, 1997, 277: 1232-1237. DOI:10.1126/ science.277.5330.1232.
[15] ZHANG Y J, YANG G, XU J Z, et al. Fabrication of hollow capsules based on hydrogen bonding[J]. Advanced Materials, 2003, 15(10): 832-835. DOI:10.1002/adma.200304315.
[16] 吴成兰. 表面活性剂及乳化方式对蓖麻油乳化效果的影响[D]. 西安: 陕西科技大学, 2012. DOI:10.7666/d.Y2093995.
[17] SHABBAR A, ERIC K, MOHANAD B. Fabrication of polymeric nanocapsules from curcumin-loaded nanoemulsion templates by self-assembly[J]. Ultrasonics Sonochemistry, 2015, 23(1): 81-92. DOI:10.1016/j.Ultsonch.2014.10.006.
[18] 李志西, 杜双奎. 试验优化设计与统计分析[M]. 北京: 科学出版社, 2010: 132-251.
[19] 时慧, 敬思群. 茴香精油微胶囊制备工艺优化[J]. 中国酿造, 2012, 31(8): 112-116. DOI:10.3969/j.issn.0254-5071.2012.08.031.
[20] 王赛赛, 陶宁萍. 大蒜精油微胶囊包埋工艺研究[J]. 食品工业科技, 2011, 32(4): 228-231.
[22] 刘勋, 宋正富, 胡敏, 等. 多孔淀粉制备微胶囊化粉末花椒精油的研究[J]. 现代食品科技, 2009, 25(4): 408-410. DOI:10.3969/ j.issn.1673-9078.2009.04.019.
[23] 廖正福. HLB值及其在乳液聚合研究中的应用[J]. 广西师范学院学报(自然科学版), 2003, 20(2): 12-16. DOI:10.3969/ j.Issn.1002-8743.2003.02.003.
[24] 李华, 史国齐, 万昌秀. 壳聚糖/海藻酸钠自组装微球的制备及释药性能[J]. 华西药学杂志, 2008, 23(3): 249-252. DOI:10.3969/ j.issn.1006-0103.2008.03.002.
[25] 张卫明, 石雪萍, 孙晓明. 生姜精油微胶囊化工艺研究[J].林产化学与工业, 2008, 28(5): 65-69. DOI:10.3321/ j.issn:0258-2417.2008.05.014.
[26] GAO G B, QIAN C X, GAO M J. Preparation and characterization of hexadecane microcapsule with polyurea-melamine formaldehyde resin shell materials[J]. Chinese Chemical Letters, 2010, 21(5): 533-537. DOI:10.1016/j.cclet.2009.11.021.
Condition Optimization for Thyme Oil Microcapsules Prepared by Layer-by-Layer Self-Assembly Method
HUANG Jing, SHEN Lili, BAI Youju, MA Zhican, CHEN Jiaping, FENG Wu*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In this work, using thyme oil emulsion nanoparticles as the core, chitosan (CS) and sodium alginate (ALG) were employed for embedding thyme essential oil by a layer-by-layer self-assembly method. Three emulsification conditions including HLB (hydrophilic lipophilic balance) value of 1:1 mixture of Span 80 and Tween 60, emulsifier concentration and ratio of oil to emulsifier were optimized to be 10, 6% and 1:6, respectively. The maximum microencapsulation efficiency of 80.23% was obtained when self-assembly of the emulsion particles in four layers by alternate use of CS and ALG was conducted for 15 min at 30 ℃ with stirring at a speed of 1 040 r/min, as determined by orthogonal array design.
self-assembly; microcapsule; thyme oil; orthogonal array design; embedding rate
10.7506/spkx1002-6630-201602009
TS202.3
A
1002-6630(2016)02-0051-07
黄晶, 申莉莉, 白友菊, 等. 层层自组装法制备百里香精油微胶囊条件优化[J]. 食品科学, 2016, 37(2): 51-57. DOI:10.7506/spkx1002-6630-201602009. http://www.spkx.net.cn
HUANG Jing, SHEN Lili, BAI Youju, et al. Condition optimization for thyme oil microcapsules prepared by layer-by-layer self-assembly method[J]. Food Science, 2016, 37(2): 51-57. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602009. http://www.spkx.net.cn
2015-05-25
华中农业大学预研项目(52209-814010)
黄晶(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:13163266519@163.com
*通信作者:冯武(1973—),女,副教授,博士,研究方向为食品生物技术。E-mail:fengwuwen@163.com
