分离格栅视觉诱发电位在开角型青光眼诊断中的应用
2016-11-15周龙芳严晓琴
周龙芳, 张 宪, 严晓琴, 李 木, 张 虹
(华中科技大学同济医学院附属同济医院 眼科, 湖北 武汉, 430030)
分离格栅视觉诱发电位在开角型青光眼诊断中的应用
周龙芳, 张宪, 严晓琴, 李木, 张虹
(华中科技大学同济医学院附属同济医院 眼科, 湖北 武汉, 430030)
目的评价分离格栅视觉诱发电位(ic-VEP)在原发开角型青光眼(POAG)诊断和分级中的应用价值。方法选取原发性开角型青光眼患者85例(85眼),其中早期青光眼39例(39眼),中晚期青光眼46例(46眼),正常人56例(56眼)。所有受试者均进行Humphery 30-Ⅱ 中央30°视野(MS)及柯谛亚电生理仪分离格栅模式检查(定量检查,刺激对比度分别为8%、14%、22%、32%)、神经节细胞复合体厚度(GCC)检查。结果早期青光眼平均8%SNR值小于1,中晚期青光眼平均8%及14%SNR值均小于1,早期及中晚期青光眼组梯度对比度刺激SNR值均显著小于正常(P<0.05)。ic-VEP SNR与黄斑区神经节细胞复合体厚度(GCC)及视野检查的平均光度敏值(MS)呈正相关。在早期青光眼中, 14% SNR与GCC及MS相关;在中晚期青光眼中, 32% SNR与GCA及MS相关。早期POAG中, 8%-SNR或14%-SNR曲线下面积最大为0.902;中晚期POAG中, 8%-SNR或14%-SNR曲线下面积最大为0.887。在早期青光眼中, ic-VEP及视野分级的加权Kappa值为0.416;中晚期青光眼中,加权Kappa值为0.689。 结论ic-VEP在POAG诊断中具有较高诊断效能及灵敏度。不同时期青光眼中, GCC及MS和不同对比度刺激的ic-VEP SNR相关。
视觉诱发电位; 分离格栅模式; 原发性开角型青光眼; 分级
原发性开角型青光眼是不可逆性致盲眼病,是一组以视网膜神经节细胞(RGCs)及其轴突的进行性丢失[1-2]和神经纤维层不可逆性损害为特征视神经病变[3-4]。研究[5]报道,RGCs分为胞体较大的M细胞及胞体较小的P细胞,黄斑区RGCs分布密度是最高的[6-8],在青光眼神经节细胞损害过程中,RGCs细胞会出现早期至晚期的损害,其中大细胞M细胞在青光眼选择性易损[9-10]。分离格栅视觉诱发电位(ic-VEP)采用分离格栅刺激方式,通过检测M细胞信号传导通路的开与关的功能,判断 M细胞的有无损害,从而诊断开角型青光眼。
1 资料与方法
1.1一般资料
选取2015年3—10月武汉同济医院就诊的原发性开角型青光眼患者85例(85眼),其中早期青光眼39例(39眼),中晚期青光眼46例(46眼),正常人56例(56眼)。开角型青光眼入组标准: ① 最佳矫正视力≥0.5; ② 裂隙灯检查眼前节正常,房角开放; ③ 经本院青光眼专科医生诊断明确的青光眼; ④ 2次及以上可信视野检查提示青光眼的特征性视野损害; ⑤ 眼底检查提示青光眼特征性眼底改变, C/D≥0.6, 双眼C/D差异>0.2;盘沿切迹;局部或弥漫视网膜神经纤维层变薄缺失等。正常眼入组标准: ① 最佳矫正视力≥0.8; ② 无高眼压病史; ③ 眼底检查正常者; ④ 2次以上可信视野检查结果未见异常者。排除标准: ① 存在除青光眼以外的眼底病史,如老年性黄斑变性等;糖尿病视网膜病变,神经系统疾病可能影响眼部者。② 患有其他影响视野的眼科疾病,如遗传性视神经病变,视神经炎、视网膜色素变性等。③ 长期全身或局部应用激素者。④ 近6个月有眼部感染或眼部手术史。
1.2方法
所有研究对象均进行了如下眼科检查:验光、眼压、眼底视盘立体照、角膜厚度、黄斑区神经节细胞复合体(GCC), Humphery自动视野计检查、柯谛亚电生理仪ic-VEP检查。1.2.1视野检查:视野检查采用中心30°范围标准自动视野计检查(Humphery 30-Ⅱ, Carl Zeiss Meditec, Inc. USA )。假阳性和假阴性率均小于30%,固视丢失小于20%,可信度差的经学习后将进行重复检查,直至符合标准。记录平均光敏度值(MS)用以进行统计学分析。视野缺损至少符合以下3项标准之一: ① 青光眼半野检测至少2次检查异常; ② 连续2次及以上检查在青光眼的典型部位出现聚集性的缺损点至少3个; ③ 模式偏差图上缺损点P<5%,至少1个缺损点P<1%。
1.2.2ic-VEP检查:采用湖州美科沃华公司生产的柯谛亚电生理仪,选用分离格栅(isolated-check)刺激模式,瞳孔自然大小,双眼分别进行检查。受检眼与刺激图形中心平齐,检查距离70 cm。记录电极沿头皮中线放置:活动电极Oz放置在枕骨粗隆上2~3 cm; 参考电极Pz放置在鼻根和枕骨粗隆中间;接地电极放置于眉心处。采用定量模式逐级给予2%、4%、8%、14%、22%、32%对比度,频率为10.71 Hz的刺激,其中的2%、4%对比度刺激作为适应刺激。检查同时进行患者状态视频监控,整个检查时长为96 s, 分8个循环,若某一循环中出现显著噪音或其他干扰,则系统自动剔除此循环并重新记录。每个受试者检测2次,中间间隔休息30 min以上,取可信度高的检查结果纳入最后统计分析,即相位波动范围在180 deg之内者。
1.3青光眼分级标准
按视野分级参照Hodapp-Anderson-Parrish (HAP)分级标准[11]: ① 轻度: MD<-6 dB;P<5%的点数少于25%(18个点),并且模式偏差图上P<1%的点少于10个;中央5度范围内所有点光敏感度需>15 dB。② 中度: MD<-12 dB;P<5%的点数少于50%(37个点),并且模式偏差图上P<1%的点少于20个;中央5度范围内不出现光敏感度为0 dB的点;中央5度范围内仅在一个半视野中可能有光敏感度<15 dB的点。③ 重度(符合以下任意1条标准): MD>-12 dB;P<5%的点数大于50%(37个点),并且模式偏差图上P<1%的点多于20个;中央5度范围内至少有1个点光敏感度为0 dB; 中央5度范围内仅在上下半视野中均有光敏感度<15 dB的点;按照ic-VEP青光眼分级如下:早期:8%或14% SNR<1, 而其他对比度刺激SNR均>1; 中期: 8%、14% SNR<1, 而22%、32% SNR均>1; 晚期: 8%、14%、22% SNR<1, 而32% SNR>1或所有对比度刺激SNR均<1。
2 结 果
2.1受试者一般情况
85例(85眼)中早期青光眼39例(39眼),中晚期青光眼46例(46眼),正常人56例(56眼)。收集本院眼科确诊的POAG患者85例(85眼),早期POAG 39例,其中男22例,女17例,平均年龄40.6±10.6岁;中晚期46例,其中男21例,女25例,平均年龄43.5±12.2岁。对照组为同时选取的排除青光眼的正常体检人员56例,其中男30例,女26例,平均年龄48.2±10.2岁。3组性别、年龄、屈光度的差异均无统计学意义(P>0.05)。见表1。
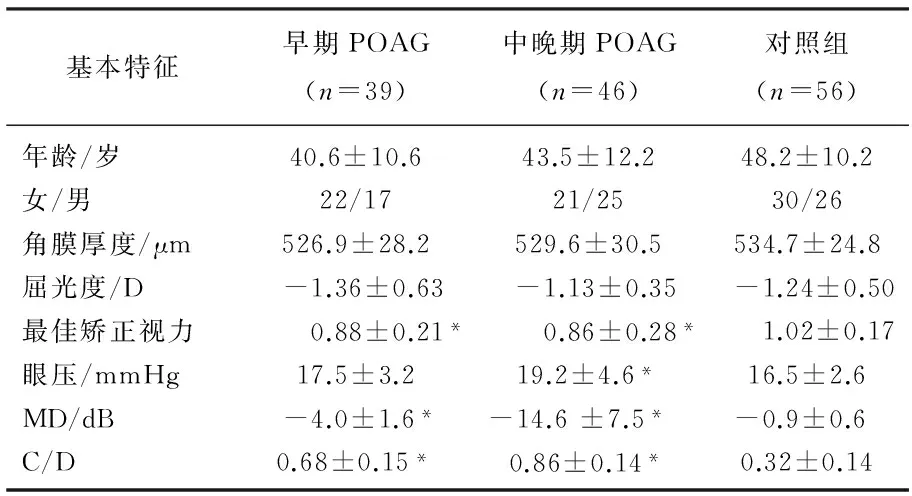
表1 3组研究对象者基本特征比较
与对照组比较, *P<0.05。
2.2ic-VEP SNR结果
对照组和早期及中晚期POAG组不同对比度(8%、14%、22%、32%)刺激下SNR值比较表明,随着对比度刺激的增强, 3组SNR值也逐渐增大,差异具有统计学意义(P<0.05)。见表2。
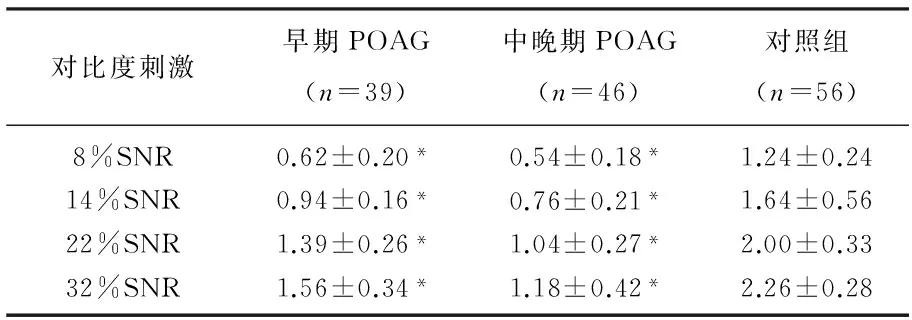
表2 正常组和青光眼组SNR比较
与对照组比较, *P<0.05。
2.3ic-VEP SNR与GCC厚度及MS相关性
ic-VEP SNR与黄斑区神经节细胞复合体厚度(GCC)及中心10°视野检查的平均光度敏值(MS)呈正相关;在早期POAG中, 14% SNR与GCC及MS相关;在中晚期POAG中,32% SNR与GCA及MS相关,差异有统计学意义(P<0.05)。见表3、4、5。
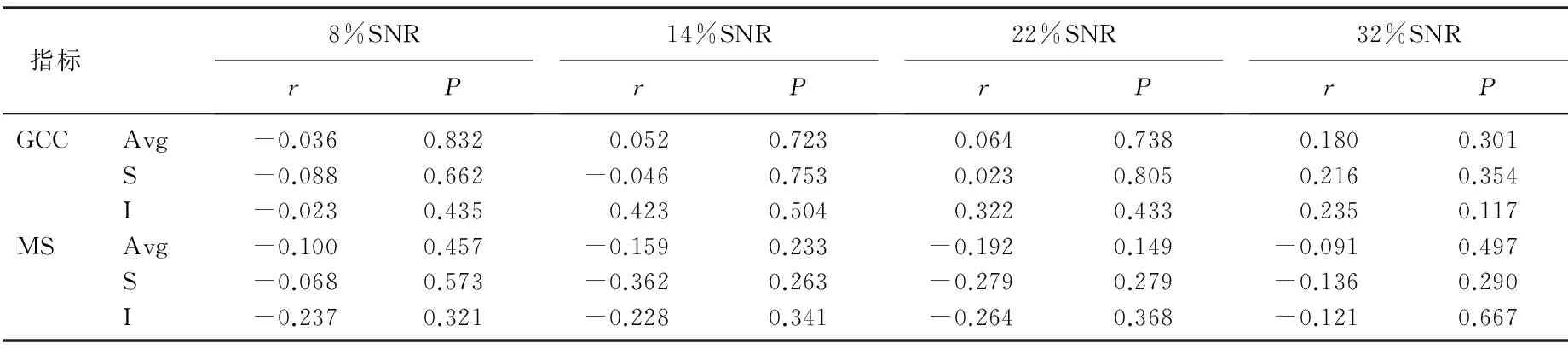
表3 ic-VEP SNR与对照组神经节细胞复合体厚度及中心10°视野灵敏度的相关性
r: 相关系数; Avg: 平均值; S: 上方; I: 下方。
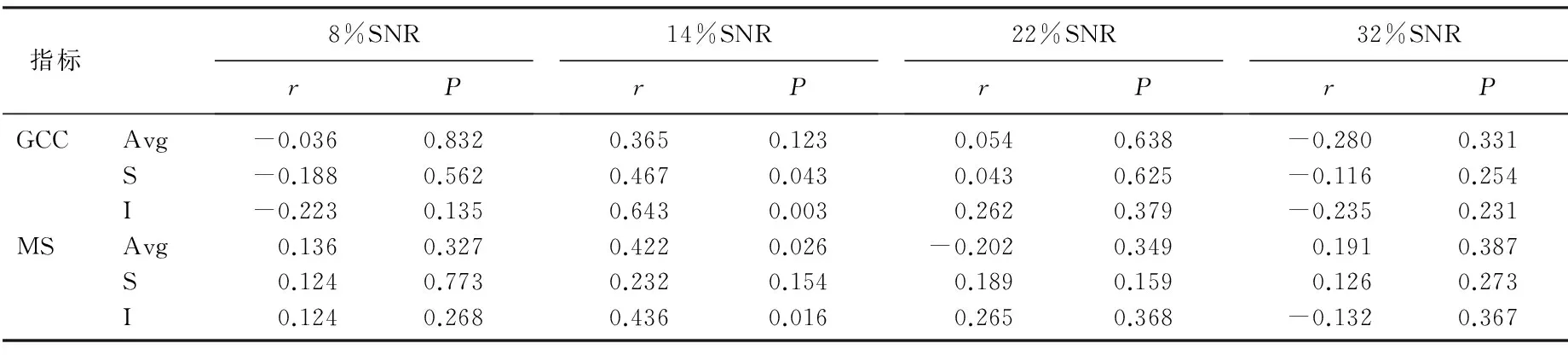
表4 ic-VEP SNR与早期POAG组神经节细胞复合体厚度及中心10°视野灵敏度的相关性
r: 相关系数; Avg: 平均值; S: 上方; I: 下方。
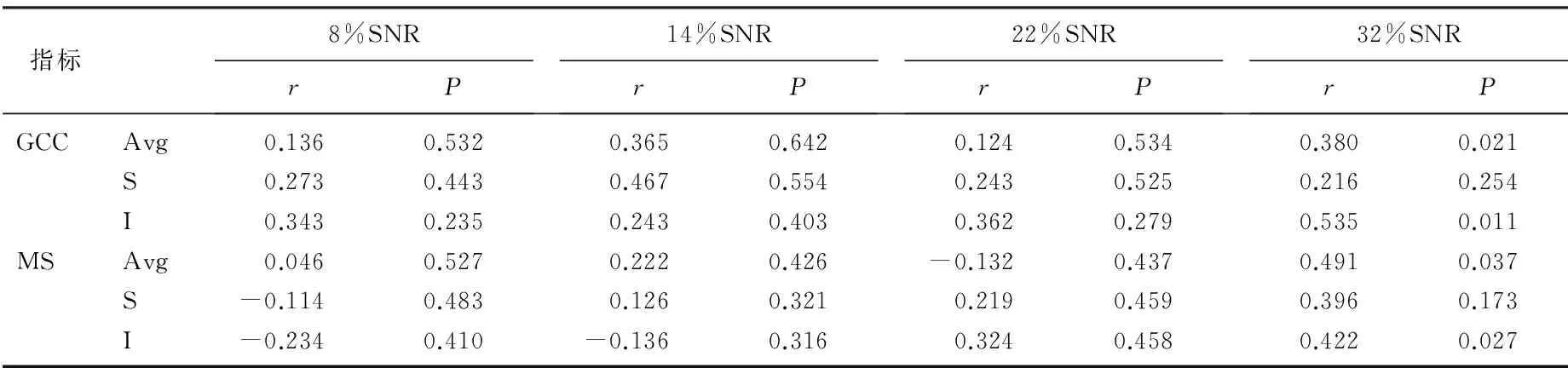
表5 ic-VEP SNR与中晚期POAG组神经节细胞复合体厚度及中心10°视野灵敏度的相关性
r: 相关系数; Avg: 平均值; S; 上方; I: 下方。
2.4ic-VEP SNR值诊断效能
采用ROC曲线下面积(AUCs)分析icVEP SNR值的诊断能力。早期POAG中, 8%-SNR或14%-SNR曲线下面积最大为0.902;中晚期POAG中, 8%-SNR或14%-SNR曲线下面积最大为0.887, 诊断效能较高。见表6。
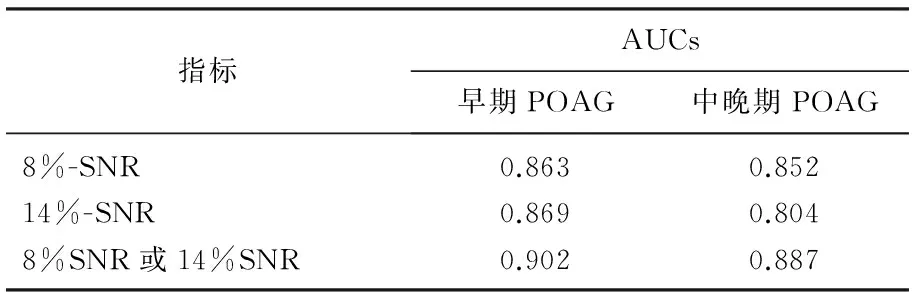
表6 ic-VEP在早期POAG及中晚期POAG中的ROC曲线下面积
2.5icVEP与视野检查一致性评估
在早期POAG中, ic-VEP及视野分级的加权Kappa值为0.416, 中晚期POAG中,加权Kappa值为0.698。
3 讨 论
开角型青光眼发生的理论根源在于神经节细胞的损害,这发生于视野缺损前4~6年。视网膜神经节细胞分为M细胞(10%)、P细胞(80%)及其他细胞(10%),它在黄斑区呈多层分布,且密度最高,研究[12]表明早期青光眼易累及M细胞。常规的图形视网膜电图和图形视觉诱发电位都可以发现视功能异常,但是传统的图形视网膜电图主要用于检査黄斑区视功能,传统图形视觉诱发电位的是用闪光或图形刺激整个视网膜测得的总和反应,对微小病灶不敏感。ic-VEP采用特定明暗对比度分离刺激视网膜M型神经节细胞,使其产生电活动,通过大脑皮层监测其经中间神经元传导到视觉中枢后引起的电位变化。它反映了从视神经节细胞经视路到视皮层的神经传导过程。目前研究[13]发现ic-VEP在个体间不同对比度的SNR存在一定变异性,给予逐级递增的对比度刺激(2%、4%、8%、14%、22%、32%)使受试者有适应刺激的过程并监测其电位变化,然后选取适应后的8%、14%、22%、32%对比度刺激参数进行分析,降低个体变异性对结果的影响。
开角型青光眼中由于视网膜神经节细胞的受损使得视网膜受刺激后向视觉中枢传递的减少,因而导致ic-VEP检查中 SNR值变小。本研究发现在青光眼患者中,不管是早期POAG或晚期POAG患者SNR值小于正常,且随着对比度增强, SNR值会逐渐升高。青光眼患者SNR值较正常组显著降低,这与既往研究结果一致[14-15]。ic-VEP 8%及14%对比度刺激SNR在青光眼诊断中具有较高诊断效能,这与既往研究M型细胞对15%对比度最敏感的理论基础相符[16],当ic-VEP给予8%对比度累加8%对比补偿即16%总对比度刺激时, M细胞达到饱和状态,故能最大反映M细胞电活动传导,如检查出现异常,则能充分体现M细胞受损,因M细胞受损主要在青光眼发生的早期,因而8%SNR显示早期青光眼损害。14%对比度刺激时,主要显示轻度的P细胞受损,亦是早期青光眼损害的病理改变[12]。22%及32%对比度的异常,则为中晚期青光眼的改变,在此对比度下出现异常改变,则定义为ic-VEP的中晚期青光眼。本研究中对于早期POAG中,在14%对比度刺激下的SNR值与神经节细胞复合体厚度及视野的MS具有一致相关性;在中晚期POAG中,32%对比度刺激下的SNR值与神经节细胞复合体厚度及视野的MS具有一致相关性,差异均具有统计学意义。
在POAG的分级诊断中,以ic-VEP SNR为标准和以视野HAP为标准的一致性比较中发现,在早期POAG中, ic-VEP及视野分级的加权Kappa值为0.416,中晚期POAG中,加权Kappa值为0.698。早期POAG中, ic-VEP与视野分级的一致性较中晚期POAG差。作者发现在视野检查判断的早期POAG中, ic-VEP SNR判定结果较视野检查重,即视野检查判定的轻度患者, ic-VEP SNR患者判定为中晚期患者。与视野在POAG诊断分级中的一致性差异可能有以下影响因素有关: ① ic-VEP监测黄斑中心10°视网膜神经节细胞的传导电活动变化,对于10°范围内的视野改变敏感,检出率更高。② 因眼底神经节细胞损伤出现在视野出现之前,在早期POAG中,视野损害不重,但是视网膜神经节细胞包括M、P细胞均已出现损害, icVEP SNR检测显示中晚期改变。此外POAG早期的损害易发生视盘颞侧神经纤维层,此处的视网膜神经节细胞轴索位于神经纤维层的深层,如果这个部位轴索丢失,尽管总体神经纤维层厚度已经发生改变,但浅层正常的轴索仍可覆盖深层缺损区域,仅仅出现轻微的改变,不易被眼底照片及视野检查发现。在这一阶段ic-VEP检查可显示视网膜节细胞电活动传导的异常,显示出较视野更好的敏感性。
[1]Weinreb R N, Khaw P T. Primary open angle glaucoma[J]. Lancet, 2004, 363: 1711-1720.
[2]Heijl A, Leske M C, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression: results from the Early Manifest Glaucoma Trial[J]. Arch Ophthalmol, 2002, 120: 1268-1279.
[3]Masaaki, Sasaoka, Katsuki, et al. Changes in visual fields and lateral geniculate nucleus in monkey laser-induced high intraocular pressure model[J]. Experimental Eye Research, 2008, 86: 770-782.
[4]Ly T, Gupta N, Weinreb R N, et al. Dendrite plasticity in the lateral geniculate nucleus in primate glaucoma[J]. Vision Res, 2011, 51: 243-250.
[5]Harwerth R S, Carter-Dawson L, Shen F, et al. Ganglion cell losses underlying visual field defects from experimental glaucoma Invest [J]. Ophthalmol Vis Sci, 1999, 40: 2242-2250.
[6]Ojima T, Tanabe T, Hangai M, et al. Measurement of retinal nerve fiber layer thickness and macular volume for glaucoma detection using optcal coherence tomography[J]. Jpn J Ophthalmol, 2007, 51: 197-203.
[7]Leung C K, Chan W M, Yung W H, et al. Comparison of macular and eripapillary measurements for the detection of glaucoma: an optical coherence tomography study[J]. Ophthalmology, 2005, 112(3): 391-400.
[8]Tan O, Li G, Lu AT, et al. Mapping of macular substructures with optical coherence tomography for glaucoma diagnosis[J]. Ophthalmology, 2008, 115(6): 949-956.
[9]Yoseph Glovinsky, Harry A Q, Gregory R, et al. Retinal Ganglion Cell Loss Is Size Dependent in Experimental Glaucoma Invest[J]. Ophthalmol Vis Sci, 1991(32): 484-491.
[10]Kaplan E. The M, P, and K pathways in the primate visual system. In: Chalupa LM, Werner JS, eds. The Visual Neurosciences[M]. Cambridge: MIT Press, 2003: 481-493.
[11]Budenz D L, Rhee P, Feuer W J, et al. Comparison of glaucomatous visual field defects using standard full threshold and Swedish interactive threshold algorithms[J]. Arch Ophthalmol, 2002, 120(9): 1136-1141.
[12]Ehud Kaplan. The M, P and K pathways of the Primate Visual System revisited[J]. The New Visual Neuroscience, 2012, 16(10): 1102-1109.
[13]Vance Zemon, James C, Tsai. Novel electrophysiological instrument for rapid and objective assessment of magnocellular deficits associated with glaucoma[J]. Documenta Ophthalmologica, 2008, 117(11): 233-244.
[14]Klistomer A l, Graham S L. Early magnocellular loss in glaucoma demonstrated using the pseudorandomly stimulated flash visual evoked potential [J]. J Glaucoma, 1999, 8(2): 140-148.
[15]Klistomer A I, Graham S L, Martins A. Multifocal pattern electroretinogram does not demonstrate localised field defects in glaucoma[J]. Doc Ophthalmol, 2000, 100(2/3): 155-165.
[16]James C, Tsai M D. VEP Technology for the Detection of Glaucomatous Visual Field Loss[J]. GLAUCOMA TODAY, 2009, 17(3): 52-57.
Application of isolated-check VEP in the diagnosis of patients with open-angle glaucoma
ZHOU Longfang, ZHANG Xian, YAN Xiaoqin, LI Mu, ZHANG Hong
(DepartmentofOphthalmology,TongjiHospitalAffiliatedtoTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan,Hubei, 430030)
ObjectiveTo explore the application value of ic-VEP in the diagnosis and grading of POAG. MethodsA total of 85 patients with POAG (85 eyes) were selected, including 39 patients with early glaucoma (39 eyes), 46 patients with middle and late stages of glaucoma (46 eyes) and 56 healthy people (56 eyes). All subjects received Humphery 30-Ⅱ central 30°visual field (MS) test, electrophysiological instrument isolated-check mode test (quantitative tests, stimulus contrasts were respectively 8%, 14%, 22%, 32%) and ganglion cell complex (GCC) thickness test. ResultsMean 8% SNR value of early glaucoma was less than 1, mean 8% and mean 14% SNR values of middle and late stages of glaucoma were both less than 1, gradient contrast stimulated SNR values of all stages of glaucoma were less than normal, and there were significant differences (P<0.05). The ic-VEP SNR was positive correlated with ganglion cell complex (GCC) thickness and mean luminosity sensitivity (MS) of visual field test. In early glaucoma, 14% SNR was correlated with GCC and MS, while in middle and late stages of glaucoma, 32% SNR was correlated with GCC and MS (P<0.05). AUC of 8% SNR or 14% SNR in early POAG was largest as 0.902, and AUC of 8% SNR or 14% SNR in middle and late stages of POAG was largest as 0.902. The weighted Kappa value of ic-VEP and visual field grading was 0.416 in early glaucoma, and was 0.659 in middle and late stages of glaucoma. ConclusionThe ic-VEP has a high diagnostic efficacy and sensitivity for POAG. GCC and MS are correlated with ic-VEP SNR stimulated by different contrast in various stages of glaucoma.
VEP; Isolated-check mode; POAG; grading
2016-05-23
张虹, E-mail: dr_zhanghong@vip.163.com
R 775.2
A
1672-2353(2016)19-071-05DOI: 10.7619/jcmp.201619021
