NOD鼠体内CD4+NKG2D+T细胞与CD8+T细胞间关系
2016-11-15王宇航马旻轩徐娅雯潘兴元龚卫娟季明春
王宇航, 马旻轩, 徐娅雯, 李 凯, 潘兴元, 钱 莉, 龚卫娟, 季明春
(扬州大学医学院 病原生物学和免疫学教研室, 江苏 扬州, 225001)
NOD鼠体内CD4+NKG2D+T细胞与CD8+T细胞间关系
王宇航, 马旻轩, 徐娅雯, 李凯, 潘兴元, 钱莉, 龚卫娟, 季明春
(扬州大学医学院 病原生物学和免疫学教研室, 江苏 扬州, 225001)
目的探讨NOD鼠体内CD4+NKG2D+T细胞与CD8+T细胞间关系。方法动态监测NOD鼠外周血中CD4+NKG2D+T及CD8+NKG2D+T细胞在不同周龄频率。利用IGRP206-214特异性CTL清除的NOD鼠,对其外周血中CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞频率进行分析。将磁珠分选所得CD4+NKG2D+T细胞分别与经CFSE标记的纯CD4+NKG2D-T细胞、CD8+T细胞共培养4 d, 检测体系中CD4+NKG2D-T细胞、CD8+T细胞CFSE的荧光强度变化。结果NOD鼠外周血CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞频率均随其1型糖尿病疾病进程发展逐渐升高,且二者之间呈正相关。IGRP206-214特异性CTL清除的NOD鼠,外周血中CD4+NKG2D+/CD4+T细胞频率随CD8+NKG2D+/CD8+T细胞频率降低显著下降。与单独培养的CD4+NKG2D-T细胞相比,加入CD4+NKG2D+T细胞的培养体系中, CD4+NKG2D-T细胞增殖加快。但CD4+NKG2D+T细胞对CD8+T增殖作用不明显。结论NOD鼠体内存在着一群与1型糖尿病疾病进程正相关的CD4+NKG2D+T细胞,且该群细胞极有可能是通过直接作用于CD4+NKG2D-T细胞而间接对CD8+T细胞产生作用。
CD4+NKG2D+T细胞; CD8+T细胞; 1型糖尿病; NOD鼠
Relationship between CD4+NKG2D+T and CD8+T cells in NOD rats
1型糖尿病(T1D)是一种自身反应性T细胞攻击自身胰岛β细胞使其受损的自身免疫性疾病[1-2]。该过程,主要是由效应性的CD4+T细胞和CD8+T细胞实施,其他多种免疫细胞共同参与而形成的。NKG2D为NK细胞活化性受体,近来研究发现亦可表达于人NKT、γδT、激活的巨噬细胞、CD4+T细胞亚群、CD8+T细胞及鼠的NKT、γδT细胞亚群、激活的CD8+T细胞、CD4+T细胞亚群。有研究[3-6]表明,1型糖尿病的动物模型NOD鼠的胰岛β细胞表达NKG2D的配体Rae-1,因此产生了表达NKG2D受体的自身反应性CD8+T细胞,大量浸润在胰岛中,并且NOD鼠体内的CD4+NKG2D+T细胞是一群与正常小鼠体内CD4+NKG2D+T不同的细胞亚群,它随着NOD鼠T1D疾病病程的发展而变化[7]。在人类中,Rodacki等[8]报道同NOD小鼠类似,在炎症等因素刺激下,NKG2D 配体可能诱导表达于胰岛细胞,这将激活表达NKG2D 受体的CD4+T细胞及自身反应性CD8+T细胞等单个核细胞。
1 材料与方法
1.1实验小鼠
NOD鼠,引种于南京大学模式动物研究所,饲养于扬州大学医学院微生物与免疫学实验室SPF级鼠房。所有饲料、饮水以及垫料均经过灭菌处理。所有实验操作均在无菌超净工作台内进行,操作都符合实验动物福利。
1.2主要试剂
Anti-Mouse CD8a APC、Anti-Mouse CD4FITC、Anti-Mouse CD314(NKG2D) PE均购自美国eBioscience公司。BD FACSTMLysing Solution购自美国BD公司。
1.3NOD鼠动态血糖监测
从10周龄至30周龄进行血糖监测,1次/周。血糖检测前更换新的垫料,并进行禁食6 h。当连续2周的空腹血糖值高于13.9 mmol/dL时,则认定该只NOD鼠发生糖尿病。
1.4流式检测CD4+NKG2D+T、CD8+NKG2D+T细胞频率
小鼠眼眶静脉丛采血后,标记相应抗体,裂解红细胞。PBS洗涤后,调整体系至200 μL用流式细胞仪进行检测。
1.5CFSE标记淋巴细胞增殖
利用磁珠分选试剂盒(购自德国美天妮公司)所得细胞数调整至0.5×106至10×107/mL。用1 mL 5%HIFCS充分混匀细胞,加入适量CFSE保证其终浓度应在5 mmol/L。室温避光孵育5 min后PBS洗涤细胞,重复2次。
1.6统计学分析
采用GraphPad Prism5进行统计,采用t检验或ANOV方差检验进行分析,当P<0.05为差异具有统计学意义。
2 结 果
2.1NOD鼠外周血CD4+NKG2D+/CD4+T细胞及CD8+NKG2D+/CD8+T细胞频率随T1D疾病进程显著上升
NOD鼠的血糖值随着1型糖尿病的疾病发展逐渐升高,且在30周左右的发病率高达80%, 故分别在6、8~10、12~16、20、25、30周以及发病期,取NOD鼠外周血进行监测。结果显示,随NOD鼠1型糖尿病疾病发展其外周血中CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞的频率显著上升。见图1和表1。
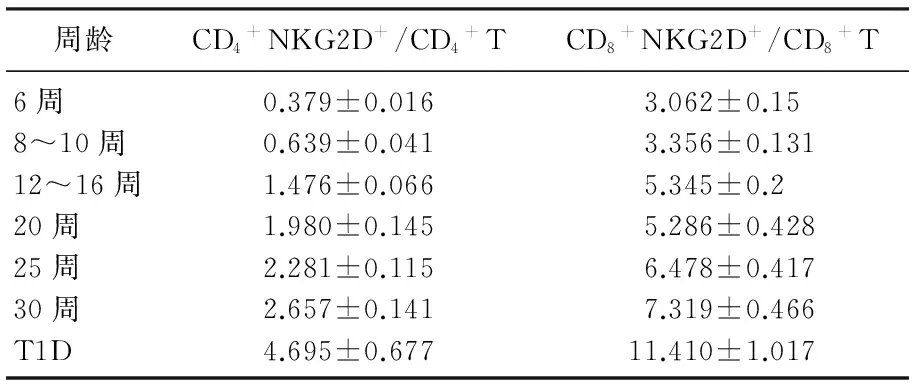
表1 各周龄NOD鼠外周血CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞频率 %
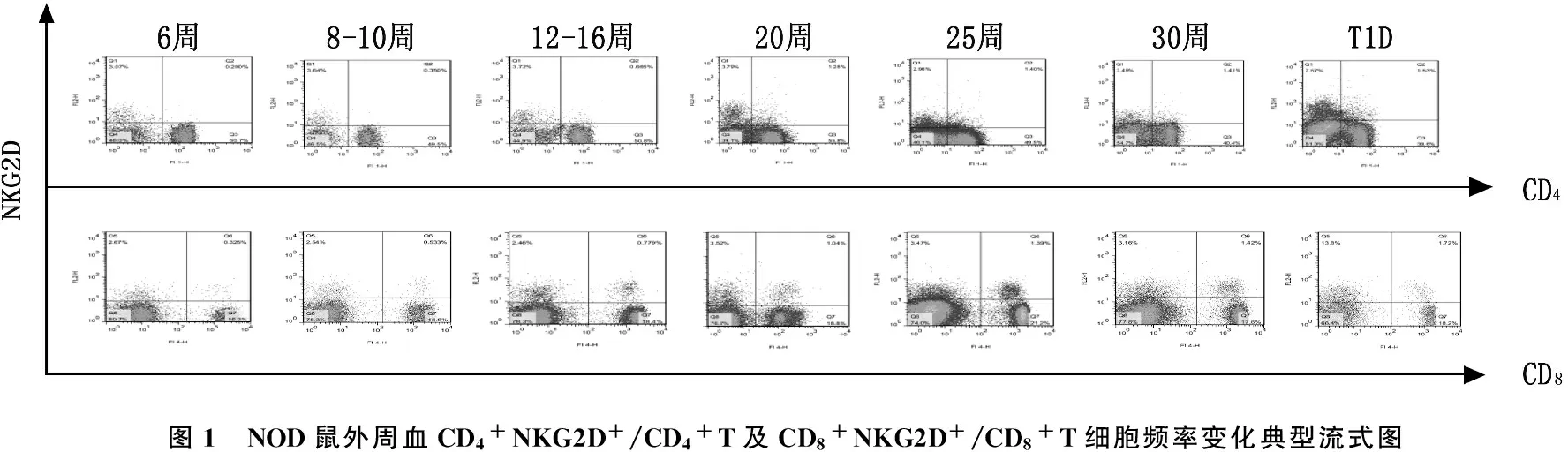
图1 NOD鼠外周血CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞频率变化典型流式图
2.2IGRP206-214特异性CTL清除的NOD鼠外周血中CD8+NKG2D+/CD8+T与CD4+NKG2D+/CD4+T细胞频率均降低
本课题组前期已成功制备IGRP206-214特异性CTL清除的NOD鼠模型,且实验结果表明实验组较对照组在降低NOD鼠血糖及发病率方面均有明显效果。利用该小鼠模型,取同为35周龄的处理组及同周龄PBS对照组小鼠(已发病)的外周血,对其CD4+NKG2D+/CD4+T及CD8+NKG2D+/CD8+T细胞频率进行分析。结果显示与CD8+NKG2D+/CD8+T细胞频率变化趋势相同,外周血CD4+NKG2D+/CD4+T细胞频率也降低。见表2和图2。

表2 IGRP206-214特异性CTL清除的NOD鼠外周血CD8+NKG2D+/CD8+T及CD4+NKG2D+/CD4+T细胞频率 %
与PBS比较, *P<0.05。


图2IGRP206-214特异性CTL清除的NOD鼠外周血CD8+NKG2D+/CD8+T及CD4+NKG2D+/CD4+T细胞频率典型流式图
2.3NOD鼠外周血中CD4+NKG2D+/CD4+T与CD8+NKG2D+/CD8+T细胞频率呈正相关
将上述所得的NOD鼠外周血CD4+NKG2D+/CD4+T细胞频率与相应个体相同周龄的外周血CD8+NKG2D+/CD8+T细胞频率做线性回归分析发现,NOD鼠外周血CD4+NKG2D+/CD4+T细胞频率与CD8+NKG2D+/CD8+T细胞频率成正向线性相关(P<0.0001,n=24)。见图3。
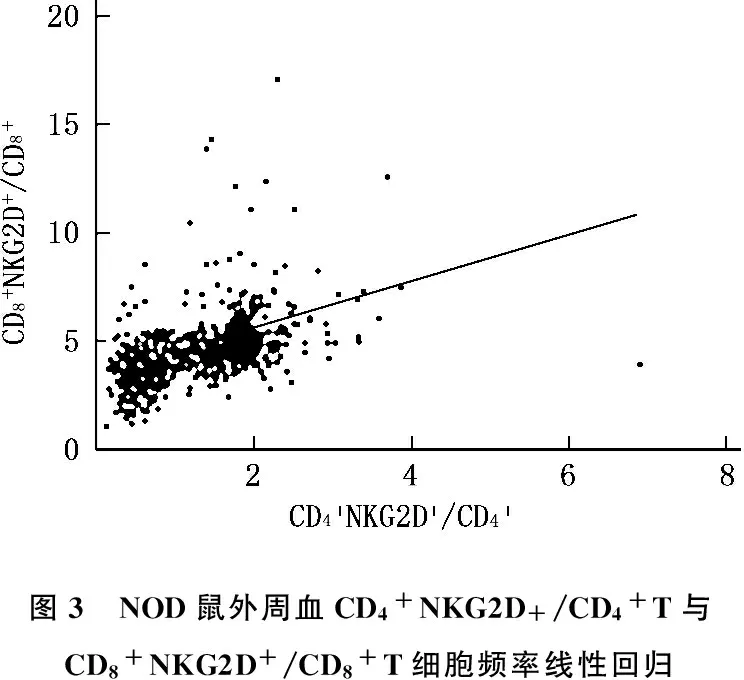
图3 NOD鼠外周血CD4+NKG2D+/CD4+T与CD8+NKG2D+/CD8+T细胞频率线性回归
2.4NOD鼠中CD4+NKG2D+T细胞直接促进CD4+NKG2D-T细胞增殖但对CD8+T细胞增殖影响不大
为观察NOD鼠体内CD4+NKG2D+T细胞对CD4+NKG2D-T细胞及CD8+T细胞的作用方式,作者取20周龄尚未发病的NOD雌鼠脾脏,采用磁珠分选方式分别获取CD4+NKG2D+T细胞、CD4+NKG2D-T细胞以及CD8+T细胞。将所得的CD4+NKG2D+T细胞分别与经CFSE标记的CD4+NKG2D-T细胞、CD8+T细胞共培养。4 d后检测体系中的CD4+NKG2D-T细胞、CD8+T细胞CFSE的荧光强度变化情况。结果发现,与单独的CD4+NKG2D-T细胞相比,加入CD4+NKG2D+T细胞的培养体系中,其CD4+NKG2D-T细胞的增殖加快。而CD8+T的增殖则几乎无变化。见图4。
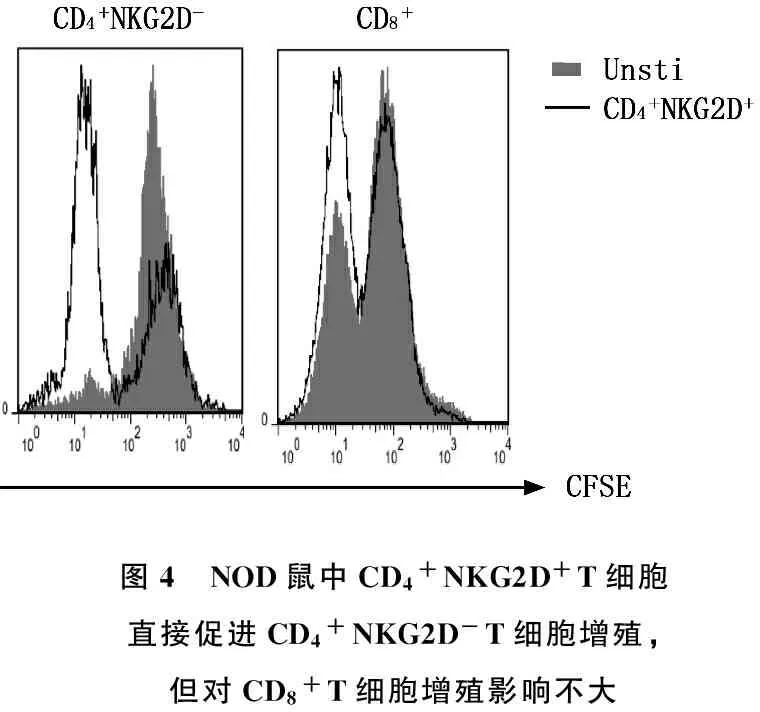
图4 NOD鼠中CD4+NKG2D+T细胞直接促进CD4+NKG2D-T细胞增殖,但对CD8+T细胞增殖影响不大
3 讨 论
NKG2D为NK细胞活化性受体,近来研究[9]发现亦可表达于其他多种免疫细胞。有研究[10]显示,NOD鼠的胰岛β细胞表达NKG2D的配体Rae-1, 并且其胰岛中有大量CD8+NKG2D+T细胞浸润。那么NOD鼠体内的CD4+NKG2D+T、CD8+NKG2D+T细胞极有可能参与了其T1D的疾病进程。本研究表明,随着NOD鼠T1D疾病发生发展,NOD鼠外周血中CD4+NKG2D+T、CD8+NKG2D+T细胞频率均是逐渐上升的。本课题组前期成功制备的IGRP206-214特异性CTL清除的NOD模型鼠较普通NOD鼠在降低NOD鼠血糖及发病率方面均有明显效果,并且CD4+NKG2D+/CD4+T细胞随着模型鼠外周血CD8+NKG2D+/CD8+T细胞频率降低亦下降。这从另一方面证实了CD4+NKG2D+/CD4+T与CD8+NKG2D+/CD8+T细胞之间是存在关系的,且该种关系是与NOD鼠T1D相关的。
在小鼠体内, NKG2D仅仅表达在活化的CD8+T细胞表面[11], 而CD8+T细胞又为T1D的主要效应细胞。将所得的NOD鼠外周血CD4+NKG2D+/CD4+T细胞频率与相应个体同周龄的外周血CD8+NKG2D+/CD8+T细胞频率做线性回归分析,结果显示,二者间呈正向线性相关。那么CD4+NKG2D+/CD4+T细胞对CD8+T细胞的增殖是否起到促进作用呢?结果显示CD4+NKG2D+T细胞可以直接促进CD4+NKG2D-T细胞增殖,但对CD8+T细胞增殖并无直接作用。所以作者推断, NOD鼠体内的CD4+NKG2D+T细胞可能是通过直接对CD4+NKG2D-T细胞作用从而对CD8+T细胞产生作用[12-13]。这个想法在青少年肺炎中被得到了证实[14-15]。
综上所述, NOD鼠外周血中的CD4+NKG2D+T、CD8+NKG2D+T细胞频率随着T1D疾病进程逐渐升高,二者之间呈正向线性关系。该群细胞可以直接促进CD4+NKG2D-T细胞增殖,但对CD8+T细胞增殖则无直接作用。
[1]Wood J R, Miller K M, Maahs D M, et al. Most youth with type 1 diabetes in the T1D Exchange Clinic Registry do not meet American Diabetes Association or International Society for Pediatric and Adolescent Diabetes clinical guidelines[J]. Diabetes care, 2013, 36(7): 2035-2037.
[2]Van Belle T L, Coppieters K T, Von Herrath M G. Type 1 diabetes: etiology, immunology, and therapeutic strategies[J]. Physiological reviews, 2011, 91(1): 79-118.
[3]Ogasawara K, Hamerman J A, Hsin H, et al. Impairment of NK cell function by NKG2D modulation in NOD mice[J]. Immunity, 2003, 18(1): 41-51.
[4]Ogasawara K, Hamerman J A, Ehrlich L R, et al. NKG2D blockade prevents autoimmune diabetes in NOD mice[J]. Immunity, 2004, 20(6): 757-767.
[5]Anderson M S, Bluestone J A. The NOD mouse: a model of immune dysregulation[J]. Annu Rev Immunol, 2005, 23: 447-485.
[6]Sharma N, Markiewicz M A. Constitutive expression of the NKG2D ligand RAE1 within pancreatic islets ameliorates autoimmune diabetes development in non-obese diabetic mice[J]. The Journal of Immunology, 2016, 196(1 Suppl): 49-59.
[7]Van Belle T L, Ling E, Haase C, et al. NKG2D blockade facilitates diabetes prevention by antigen-specific Tregs in a virus-induced model of diabetes[J]. Journal of autoimmunity, 2013, 40: 66-73.
[8]Rodacki M, Svoren B, Butty V, et al. Altered natural killer cells in type 1 diabetic patients[J]. Diabetes, 2007, 56(1): 177-185.
[9]Garcia-Chagollan M, Jave-Suarez L F, Haramati J, et al. An approach to the immunophenotypic features of circulating CD4+NKG2D+T cells in invasive cervical carcinoma[J]. Journal of biomedical science, 2015, 22(1): 1-12.
[10]Wiemann K, Mittrücker H W, Feger U, et al. Systemic NKG2D down-regulation impairs NK and CD8T cell responses in vivo[J]. The Journal of Immunology, 2005, 175(2): 720-729.
[11]Kerstein, Müller, Kabelitz, et al. Effector memory T-cells in the pathogenesis of ANCA-associated vasculitides [J]. Springer-Verlag Berlin Heidelberg, 2016, 75(2): 183-6.
[12]庞春艳, 吕凤凤, 杨麟, 等. α-胞衬蛋白siRNA对干燥综合征模型NOD小鼠IFN-γ和IL-4表达水平及基因沉默效果的影响[J]. 吉林大学学报: 医学版, 2013, 39(3): 548-553.
[13]胡旭君, 宋欣伟. 雷公藤多苷联合甲氨蝶呤对干燥综合征NOD小鼠治疗作用及TNF-α、IL-1β、AQP-5的表达[J]. 中华中医药杂志, 2014(7): 2362-2366.
[14]王贵渠, 赵琎, 徐海伟, 等. C57BL/6. NOD-Aec1Aec2干燥综合征模型小鼠干眼表型及性别差异研究[J]. 第三军医大学学报, 2015, 37(9): 876-880.
[15]邵玲巧, 王倩倩, 郭圆圆, 等. NOD/SCID小鼠中A431侧群与非侧群细胞成瘤组织中EMT相关分子的表达[J]. 南方医科大学学报, 2013, 33(5): 733-737.
WANG Yuhang, MA Minxuan, XU Yawen, LI Kai, PAN Xingyuan,QIAN Li, GONG Weijuan, JI Mingchun
(DepartmentofPathogenicBiologyandImmunology,TheMedicalCollege
ofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
ObjectiveTo explore the relationship between CD4+NKG2D+T and CD8+T cells in NOD rats. MethodsThe frequency of CD4+NKG2D+T and CD8+NKG2D+T cells in peripheral blood of NOD rats in different weeks were dynamically monitored. By using IGRP206-214-SAP NOD rats, the frequencies of CD4+NKG2D+/CD4+T and CD8+NKG2D+/CD8+T cells in peripheral blood were analyzed. CD4+NKG2D+T cells was purified and CFSE CD4+NKG2D-T cells or CD8+T were co-cultured 4 days were marked. The CFSE fluorescence intensity change of CD4+NKG2D-T cells or CD8+T cells were detected. ResultsThe frequency of CD4+NKG2D+/CD4+T and CD8+NKG2D+/CD8+T cells in peripheral blood of female NOD rats during the development of type 1 diabetes disease process gradually increased, and they were positively correlated to the linear. In the NOD rats with IGRP206-214-SAP, the frequency of CD4+NKG2D+/CD4+T cells in peripheral blood was reduced by CD8+NKG2D+/CD8+T cells reduction. Compared with alone CD4+NKG2D-T cells, the proliferation of CD4+NKG2D-T cells was speeded up in cell culture system incubated with CD4+NKG2D+T. CD4+NKG2D+T cells is no direct effect on the CD8+T cell. ConclusionAn increased CD4+NKG2D+T cells subsets in NOD mice might have an effect on CD8+T cells through activation of CD4+NKG2D-T cells.
CD4+NKG2D+T cells; CD8+T cells; T1D; NOD
2016-01-21
国家自然科学基金(30771955)
季明春, E-mail: mcji@yzu.edu.cn
R 392.2
A
1672-2353(2016)19-005-04DOI: 10.7619/jcmp.201619002
