玉林437例高危型人乳头瘤病毒感染与宫颈上皮内瘤变的分析
2016-11-15李继慧黎华辉
李继慧黎华辉
·论著·
玉林437例高危型人乳头瘤病毒感染与宫颈上皮内瘤变的分析
李继慧★黎华辉
目的调查玉林地区妇女生殖道高危型人乳头瘤病毒(human papilloma virus,HPV)感染与宫颈上皮内瘤病变(cervical intraepithelial neoplasia,CIN)的关系。方法应用导流杂交基因芯片技术(HybriMax),对妇科门诊就诊的3 317例有性生活史的妇女,采集宫颈脱落细胞进行HPV分型检测,对检查HPV高危型别阳性者进行宫颈活组织检查。结果自2014年7月至2015年6月期间,共检测我院就诊病例3 317例,检出高危型HPV感染者694例,阳性率为20.92%。对437例进行宫颈活组织检查,CIN 26例,占5.95%(26/437),其中CINⅡ~Ⅲ12例,占2.74%(12/437)。结论玉林地区妇女高危型HPV感染率及高危型HPV感染者宫颈病变检出率均较高,本地区妇女宫颈上皮内瘤病变常见的高危型HPV类型为HPV16、52、58、18、33。
人乳头瘤病毒;宫颈上皮内瘤病变;导流杂交分型技术
宫颈癌是世界范围内最常见的妇科恶性肿瘤之一,其发病率在发展中国家尤为明显。已有明确的证据证明,持续的高危型别人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌发生及进展的最主要因素[1]。目前,根据世界卫生组织(World Health Organization,WHO)的数据显示,至少有13种高危型别的HPV可以导致宫颈癌[2]。相比其它类型癌症,宫颈癌的筛查具有极高的有效性。目前为止,全世界仍然有超过50万女性受到宫颈癌的危害。在发展中国家,宫颈癌仍然是最为常见的发病率和死亡率较高的妇科恶性肿瘤之一[3]。因此,针对女性宫颈癌的预防、筛查及监控工作就显得尤为关键。然而,值得关注的是经济文化较为落后的地区以及农村人口中由宫颈癌引起的高死亡率尤为突出,所以将宫颈癌筛查的研究立足于偏远地区人群就显示出极为重要的作用[3-4]。为了解本地区妇女高危型HPV感染与宫颈上皮内瘤变的相关性,我们应用导流杂交基因芯片技术(HybriMax),针对妇科门诊就诊妇女进行了HPV感染分型的检测,共3 317例,并将高危型HPV感染者进行宫颈活组织检查。通过筛查分析不同高危HPV型别的危害性,进一步指导玉林地区HPV检测及宫颈癌筛查的临床检测及诊断。现将结果整理报道如下。
1 材料方法
1.1 临床样本
样本选取自2014年7月至2015年6月期间,医院妇科门诊就诊有性生活史的妇女共计3 317例,年龄19~63岁,平均年龄40.9岁,自愿接受HPV基因分型检测。6个月后对HPV高危型别阳性者进行回访,其中437名妇女愿意接受在阴道镜下定点取宫颈活体组织进行病理学检查,以确定宫颈上皮内瘤病变(cervical intraepithelial neoplasia,CIN)的程度,并对CIN阳性患者再次进行HPV基因检测。
1.2 HPV基因分型检测
1.2.1 仪器与试剂
HybriMax医用核酸分子快速杂交仪HHM-2型(潮州凯普生物科技股份有限公司)、人类乳头瘤状病毒基因分型检测试剂盒(HPV-21分型检测)(潮州凯普生物化学股份有限公司);DNA扩增仪(Life Express)(杭州博日科技有限公司)。
1.2.2 样本采集
窥器暴露宫颈,使用无菌棉签擦去宫颈口分泌物,利用潮州凯普生物化学有限公司提供的专用毛刷于宫颈鳞柱状交界处旋转3~5圈,取得宫颈管脱落细胞,将取有标本的毛刷放置于对应标号的专用的细胞保存液试管中,4℃保存,2周内完成检测。
1.2.3 检测方法
提取样本DNA后,进行PCR扩增,利用核酸分子快速导流杂交技术,使目的产物定向地穿过固定有特异标记探针的低密度基因芯片薄膜上,从而发生快速杂交,通过标记显色,根据芯片上HPV分型分布相应点进行判断其感染亚型。实验同时检测21种HPV基因型,其中13种高危型(high-risk types,HR-HPV),包括16、18、31、33、35、39、45、51、52、56、58、59、68,5种低危型(lowrisk types,LR-HPV),包括6、11、42、43、44及3种中国人群常见亚型(53、66、CP8304)。具体操作步骤按试剂盒及仪器使用说明进行。
1.3 统计学方法
本报道应用SSPS 17.0统计软件,采用χ2检验对数据进行统计分析。
2 结果
2.1 HPV亚型的感染情况
利用低密度芯片(图1)快速导流杂交的方法,本报道3 317例样本中,HPV阳性率为26.89%(892/ 3 317),其中高危型HPV阳性率为20.92%(694/ 3 317)。高危型HPV各亚型检出情况,见表1。
上述HPV高危型别阳性病例中,有437例高危型别回访患者进行了病理学检查及HPV核酸检测,其中CIN阳性病例共26例,CIN发生率为5.95%(26/437),其中CINⅡ~Ⅲ发生率为2.74%(12/437)。同时,CINⅠ的HPV阳性感染率为35.71%(5/14),CINⅡ~Ⅲ的HPV阳性感染率为83.33%(10/12),见表2。有宫颈上皮内瘤变的病例检出的前6种高危型HPV基因型为52、16、58、18、68、33。利用R×C列联表分析(表3),采用χ2检验对数据进行统计分析,结果显示P=0.02,即CIN与高危型HPV感染密切相关。
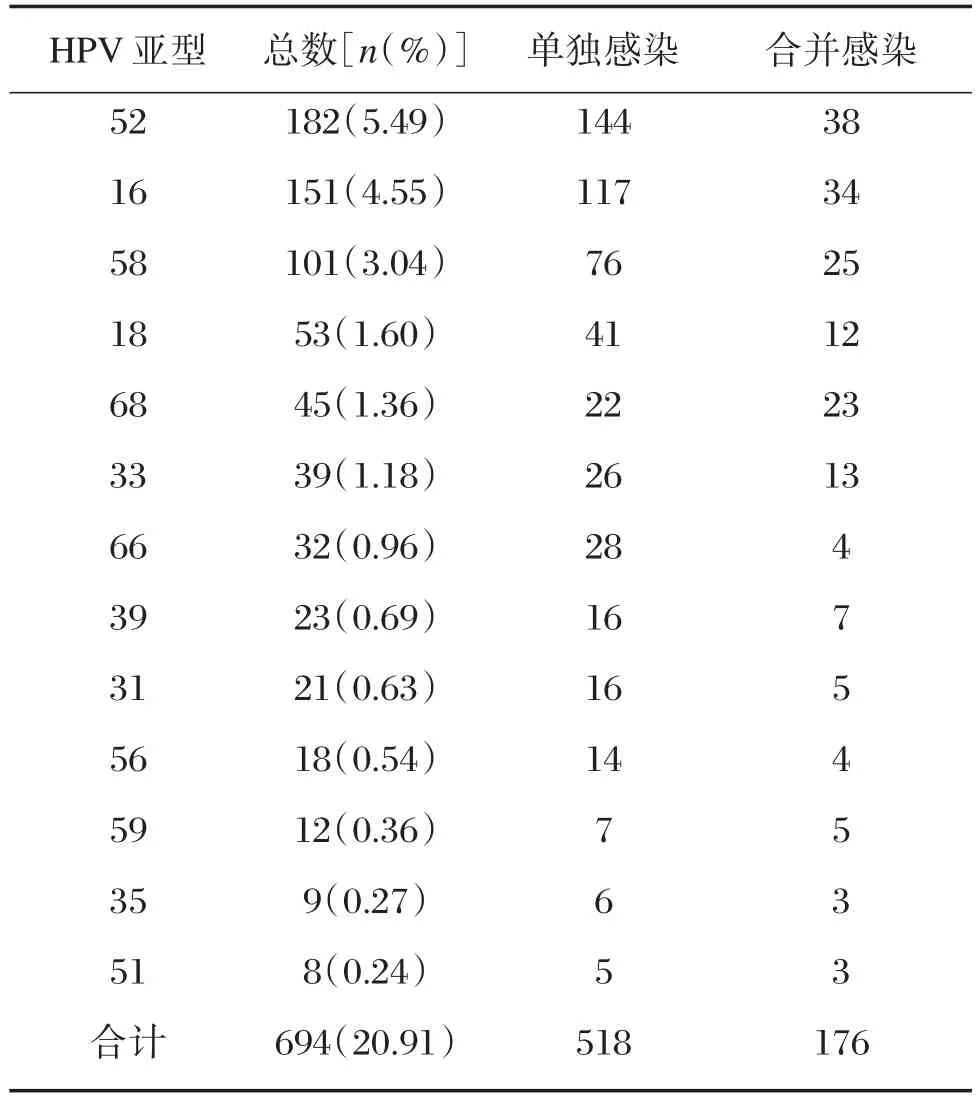
表1 高危型HPV各亚型检出分布Table 1 Distribution of high-risk HPV detection

表2 26例宫颈上皮内瘤变病例HPV感染分布Table 2 Distribution of HPV infection in 26 patients with CIN

表3 χ2检验统计分析Table 3χ2teststatistics analysis
2.2 HPV复合感染情况
在本次调查中,HPV复合感染(一个人同时感染2个或以上的型别,可以是同时感染高危型,也可以是高低危型别同时感染),高危型多重感染占HPV阳性妇女的19.73%(176/892),占被筛查妇女的5.31%。在合并感染中,常见的复合感染类型有HPV52、16、58,68、18、33之间的复合感染及与其它亚型的复合感染(表1)。
2.3 高危型HPV感染与年龄的关系
本次调查对象的年龄分布为19~63岁,高危型HPV感染率在35岁以下及45岁以上妇女中较高,分别为23.63%和21.53%,高危型HPV阳性率在19~35岁、36~45岁以及46~63岁年龄组间比较,见表4。
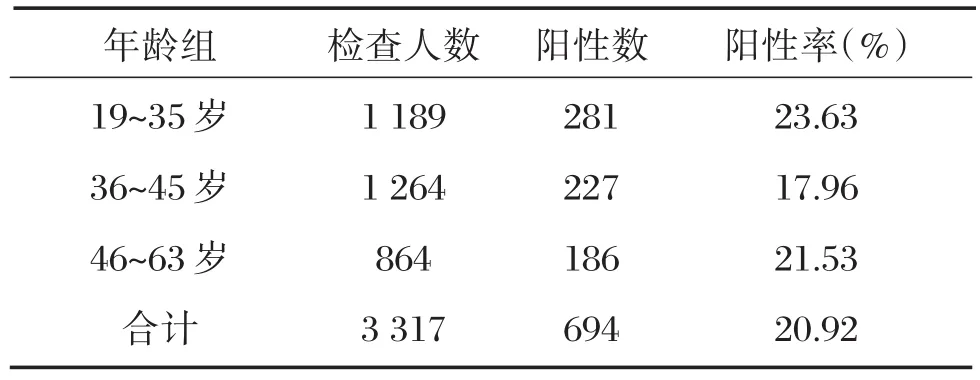
表4 高危型HPV感染在不同年龄段妇女中的分布Table 4 Distribution of high-risk HPV infection in differentage periods
3 讨论
越来越多的证据已经证明,持续的高危型HPV感染会导致恶性宫颈癌症的发生[1]。因此,HPV检测是宫颈癌筛查中必不可少的关键环节。然而,在我国开展的宫颈癌筛查数据显示,宫颈病变的患病率在2.5%~5.9%,表明在中国宫颈病变仍然是严重的生殖健康问题[4-13]。根据我国2015年公布数据显示,全国约有2 814 000例死于癌症,其中女性1 004 400例,约占总死亡病例36%。女性宫颈癌发病人数为98 900例,占女性癌症发病总人数5.6%,死亡病例30 500例,占女性癌症死亡总人数0.3%[4]。从横向的不同地理区域进行分析,华北地区女性宫颈癌发病人数为16 700例,死亡人数6 100例,死亡率约36%;东北地区发病人数10 500例,死亡人数2 400例,死亡率约23%;华东地区发病人数27 600例,死亡人数6 700例,死亡率约24%;华中地区发病人数17 400例,死亡人数4 100例,死亡率约24%;华南地区发病人数8 100例,死亡人数2 300例,死亡率约28%;西南地区发病人数11 300例,死亡人数6 200例,死亡率约55%;西北地区发病人数7 300例,死亡人数2 600例,死亡率约36%。从纵向的不同行政区域来分析,城镇地区宫颈癌发病人数为53 200例,死亡人数13 600例,死亡率约26%;农村地区为45 700例,死亡人数16 900例,死亡率约40%[4]。以上数据指出,城镇地区宫颈癌发病率明显高于农村人口,但死亡率则显著低于农村地区。然而,值得关注的是经济文化较为落后的西南地区以及农村人口中由宫颈癌引起的高死亡率尤为突出,所以将宫颈癌筛查的研究立足于农村人群就显示出极为重要的作用。
过去的研究指出,HPV16与HPV18型别感染在宫颈癌患者中最常见[1-3]。最近的研究则发现,引起宫颈病变包括宫颈癌的高危HPV感染型别在不同地区之间有所差异[7-8]。有文献指出,相较于HPV16与18型别的感染,在亚洲国家HPV52与58型别感染更常见,在上海有42%的宫颈癌标本存在HPV52与58型别感染[8]。另一个来自北京的多中心研究中报道,HPV16、58、33、56及31型别感染在宫颈病变中最常见[11]。一份对广东省潮州市13 750例女性进行HPV筛查的研究发现,感染型别按感染率高低依次为HPV52、16、58、68及33,感染率分别为28%、15%、11%、8%及7%[7]。在华东区域的研究中显示,HPV16、58、33、52及66在CINⅠ患者中检出率最高。而在中国西南地区,HPV16、58、18、52及33型别的感染在宫颈癌病例中最普遍[6]。综上,可以明显发现HPV16和18等型别为中国最常见的高危HPV感染型别。此外,越来越多的研究也表明,中国高危HPV感染分布具有明显的区域性,与生活习惯、年龄、文化水平等因素紧密相关。
本报道中,玉林地区3 317例妇女中宫颈高危型HPV感染率为20.92%,与广东地区20.3%的水平[14]基本一致,略低于广西其他地区23.78%[15]。本报道中高危型HPV阳性标本中,病理学诊断CINⅡ~Ⅲ检出率为2.74%,相较北京地区2.19%的水平明显增高[16]。HPV52、16和58型是玉林地区人群最主要的3个高危型HPV亚型,其在高危型HPV阳性人群中的百分率依次为5.49%、4.55%和3.04%,其次是18型1.60%、68型1.36%,33型1.18%。此外,高危型别HPV感染与宫颈上皮内瘤变,特别是CINⅡ及以上呈高度相关,此结果与以往报道基本一致[7-15](表2)。有宫颈上皮内瘤的病例检出的前3种高危型HPV基因型为52、16、58,应重视这些感染型别的防治。
本次调查发现高危型HPV阳性人群中176例发生多重感染,高危型多重感染占HPV阳性妇女的19.73%。有报道人群中多种HPV复合感染占总HPV感染人数的20%~30%,和单个HPV感染相比,增加了发生癌前病变的风险[17]。多种HPV复合感染可以是同时感染不同的HPV类型,也有可能是多次感染导致[17]。
综上所述,玉林地区高危型HPV检出率相比发达地区明显较高,需要增强科普妇女健康意识与宫颈癌筛查的重要性。其次,感染型别分布与国内其它地区明显不同,其中52、58型别检出率较高,需要对上述型别加以重视与防治。
[1]Arbyn M,Castellsague X,de Sanjose S,etal.Worldwide burden of cervical cancer in 2008[J].Annu Oncol,2011,22(12):2675-2686.
[2]Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer JClin,2015,65(2):87-108.
[3]Banerjee J,M ishra N,Dhas Y.Metagenomics:A new horizon in cancer research[J].Meta Gene,2015,5:84-89.
[4]Chen WQ,Zheng RS,Baade PD,etal.Cancer Statistics in China,2015[J].CA Cancer JClin,2016,66(2):115-132.
[5]王玉丰,林玲,刘春雨,等.三亚地区妇女人乳头瘤病毒感染的分子流行病学调查[J].检验医学,2012,27(8):628-630.
[6]孙晔.586例宫颈疾病患者HPV检测结果分析[J].国际检验医学杂志,2015,36(12):1777-1779
[7]李智敏,罗喜平,毛玲芝,等.广东省潮州市13750例妇女宫颈人乳头瘤病毒感染状况及基因型分析[J].中华妇幼临床医学杂志,2012,8(4):357-360.
[8]Zhang R,Shi TY,Ren Y,et al.Risk factors for human papillomavirus infection in Shanghai suburbs:A population-based study with 10000 women[J].JClin Virol,2013,58(1):144-148.
[9]Hou R,Xu CY,Zhang SW,et al.Distribution of human papillomavirus genotype and cervical neoplasia among women with abnormal cytology in Beijing,China[J].Int JGynaecol Obstet,2012,119(3):257-261.[10]Ding X,Liu Z,Su J,et al.Human papillomavirus type-specific prevalence in women referred for colposcopic examination in Beijing[J].JMed Virol,2014,86(11):1937-1943.
[11]LiCD,Wu MH,Wang JD,et al.A population-based study on the risks of cervical lesion and human papillomavirus infection among women in beijing,people’s republic of China[J].Cancer Epidemiol Biomarkers Prev,2010,19(10):2655-2664.
[12]Wang L,Dai SZ,Chu HJ,etal.Intergration sites and genotype distributions of human papillomavirus in cervical intraepithelial neoplasia[J].Asian Pac JCancer Prev,2013,14(6):3837-3841.
[13]Chen Q,Xie LX,Qing ZR,etal.Epidemiologic characterization of human papillomavirus infection in rural Chaozhou,eastern Guangdong province of China[J]. Plosone,2012,7(2):e32149.
[14]李亚红,李楠,张珍,等.广东地区2782例妇女高危型人乳头瘤病毒感染阳性率和年龄段的关系[J].分子诊断和治疗杂志,2010,2(2):112-115.
[15]刘继秀,莫云,白华,等.广西4874例妇女高危型人乳头瘤病毒感染的流行病学现状及其与宫颈上皮内瘤变的关系[J].实用妇产科杂志,2011,8(27):596-597.
[16]张为远,武明辉,张淞文,等.2007~2008年北京地区25~54岁已婚妇女宫颈上皮内瘤变流行病学现状调查[J].中华妇产科杂志,2010,45(3):892-897.
[17]李继慧,罗宇迪,张炬光,等.3150例妇女宫颈乳头状瘤病毒感染的调查查分析[J].广西医学,2014,5(36):677-679.
Investigation of cervical intraepithelial neoplasia in 437 high-risk human papilloma virus infected patients from Yulin
Li Jihui★,LiHuahui
(Yulin Maternal and Child Care Service Center,Yulin,Guangxi,China,537000)
Objective To investigate the relationships between women high-risk human papilloma virus(HPV)infection and cervical intraepithelial neoplasia(CIN)in Yulin.Methods A total of 3 317 outpatient women with sexual histories were checked for HPV genotyping via DNA flow-through hybridization genotyping technique(HybriMax),and then cervical biopsy had was performed among the women with high-risk HPV infection.Results 694 high-risk HPV infections were detected out of 3 317 patients from July 2014 to June 2015,and the positive HPV rate was 20.92%.The cervical biopsy was performed on 437 patients and the proportion of CIN was5.95%(26/437),including 12 patients with CINⅡ~Ⅲ(2.74%).Conclusion The rate of high-risk HPV infection and proportion of CIN among high-risk HPV infector were higher,and general types of high-risk HPV were HPV16,52,58,18,33 in Yulin district.
Human papilloma virus;Cervical intraepithelial neoplasi;Hybri Max
玉林市妇幼保健院,广西,玉林537000
★通讯作者:李继慧,E-mail:ljhhlc@126.com
