重组大肠杆菌产脂肪氧合酶发酵条件优化
2016-11-14和玉军陆兆新别小妹赵海珍吕凤霞
和玉军,张 充,钱 辉,陆兆新,别小妹,赵海珍,吕凤霞
(南京农业大学食品科技学院,江苏 南京 210095)
重组大肠杆菌产脂肪氧合酶发酵条件优化
和玉军,张 充,钱 辉,陆兆新,别小妹,赵海珍,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
为进一步提高重组大肠杆菌(pET-23a-pse-LOX)产脂肪氧合酶(lipoxygenase,LOX)的酶活力,利用响应面法对其发酵条件进行优化。通过单因素试验确定诱导时机、诱导剂浓度、诱导时间、诱导温度、接种量、培养基初始pH值和装液量对其发酵产酶的影响。在此基础上,采用Plackett-Burman试验设计从7 个因素中筛选出对LOX产量具有显著效应的因素为诱导时机、诱导时间和培养基初始pH值,并利用Box-Behnken试验设计和响应曲面法分析以确定其产酶的最优发酵条件,即诱导时机为菌液OD600nm达到1.6、诱导时间34 h、培养基初始pH 7.0。在此条件下,LOX酶活力为(21 261.60±264.03) U/mL,比优化前的(13 553.96±46.64) U/mL提高了56.87%。
脂肪氧合酶;发酵条件;响应面法;Plackett-Burman试验设计
和玉军, 张充, 钱辉, 等. 重组大肠杆菌产脂肪氧合酶发酵条件优化[J]. 食品科学, 2016, 37(15): 149-155. DOI:10.7506/ spkx1002-6630-201615025. http://www.spkx.net.cn
HE Yujun, ZHANG Chong, QIAN Hui, et al. Optimization of fermentation conditions for lipoxygenase production by recombinant Escherichia coli[J]. Food Science, 2016, 37(15): 149-155. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201615025. http://www.spkx.net.cn
脂肪氧合酶(lipoxygenase,LOX,EC 1.13.11.12),属于氧化还原酶[1],是一类含有非血红素铁,能够专一催化氧化含有cis, cis-1,4-戊二烯结构的多元不饱和脂肪酸,形成具有共轭双键的脂肪酸氢过氧化物的双加氧酶[2]。这种不稳定的氢过氧化物能氧化面筋蛋白质形成二硫键,使蛋白质分子聚合,从而达到增强面筋的作用[3],同时LOX还可以通过偶合反应破坏类胡萝卜素的双键结构,起到漂白面粉的作用[4]。由于LOX兼具面粉强筋和漂白的功效,具有替代化学面粉品质改良剂的潜力,已引起国内外学者广泛关注。目前,市场上商品级LOX多以大豆粉作为酶源,但大豆粉含有多种同工酶,存在成分复杂、效果不佳等缺点[5],限制其在食品工业中广泛应用。
通过LOX基因的克隆与异源表达,获得质量稳定、产量高、成本低的LOX是可以解决上述问题的。其中,来源于植物、动物等真核生物的LOX基因已经在大肠杆菌[6](Escherichia coli,E. coli)、酿酒酵母[7](Saccharomyces cerevisiae)和毕赤酵母[8-9](Pichia pastoris)中实现重组表达,但总体产酶水平不高。原核生物来源的LOX异源表达同样面临表达量低、难分泌至胞外等问题[10]。目前仅有蓝细菌(Cyanobacterium)、念珠藻(Nostoc punctiforme)[11]、铜绿假单胞菌[12-13](Pseudomonas aeruginosa)和鱼腥藻[14-15](Anabaena)来源的原核生物LOX基因 实现了在E. coli、枯草芽孢杆菌(Bacillus subtilis)中异源表达,但产酶水平仍然不高。陆信曜等[13,16]将P. aeruginosa的LOX在大肠杆菌中表达,获得了分泌LOX的重组大肠杆菌,并对其发酵过程进行初步优化,胞外酶活力为8.4 U/mL。张充等[14,17]克隆鱼腥藻Anabaena sp. PCC 7120基因组中LOX基因,构建了原核重组表达载体,胞内LOX活力达6 750 U/mL,并转化B. subtilis WB800,实现LOX在食品级表达系统的异源分泌表达。在此基础上,章栋梁等[18]对重组枯草芽孢杆菌的发酵条件进行优化,胞外酶活力最高为167.32 U/mL。
虽然有关LOX基因的克隆与异源表达的研究已很多,包括胞内和胞外表达,但LOX产量仍不是很高。为了提高LOX的产量,本研究以实验室构建的一株重组大肠杆菌为出发菌株,首先通过单因素试验确定不同因子对发酵产酶的影响,并利用Plackett-Burman设计筛选出对LOX产量具有显著效应的关键因子,然后利用响应曲面法对其进行优化,旨在提高LOX产量,为工业化生产和应用提供依据。
1 材料与方法
1.1菌种、培养基与试剂
重组大肠杆菌pET-23a-pse-LOX,由南京农业大学食品科技学院酶工程研究室构建。
LB培养基(g/L):胰蛋白胨10、酵母提取物5、NaCl 10,pH 7.0,121 ℃灭菌20 min。
发酵培养基(g/L):大豆蛋白胨25、酵母浸膏15、甘油6、KH2PO45、MgSO4•7H2O 2、MnCl2•4H2O 0.05,pH 7.0,121 ℃灭菌20 min。
胰蛋白胨、酵母提取物 青岛生工生物科技有限公司;氨苄青霉素(ampicillin,Amp)、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)北京索莱宝科技有限公司;亚油酸 美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2仪器与设备
Orion 3 STAR pH计 美国Thermo公司;SX-700高压蒸汽灭菌器 日本TOMY公司;SW-CJ-IBU超净工作台 苏州安泰空气技术有限公司;HYG-A全温摇瓶柜 太仓市实验设备厂;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;JY91ⅡDN超声波破碎仪宁波新芝生物科技股份有限公司;UV-2600紫外-可见分光光度计 日本岛津公司;GXZ-9240MBE鼓风干燥箱上海博迅实业有限公司医疗设备厂。
1.3方法
1.3.1菌种活化
将甘油管保藏的重组菌(-70 ℃)转接到LB平板上,37 ℃条件下恒温培养,待平板上长出单菌落后,将单菌落转接至盛有50 mL LB培养基的250 mL摇瓶中,37 ℃、180 r/min振荡培养12 h左右至对数期备用。
1.3.2摇瓶培养
将培养好的种子液接入发酵培养基,37 ℃、180 r/min条件下振荡培养至一定菌体密度后在设定的发酵条件下进行培养。
1.3.3菌体密度与菌体干重的测定
将一定体积的发酵液10 000 r/min离心10 min后弃上清,菌体用蒸馏水洗涤1~2 次,再用蒸馏水复溶后以蒸馏水为空白测定菌体密度OD600nm,同时将菌液在相同条件下离心、洗涤后,将其放置在105 ℃的干燥箱中恒温干燥至恒质量(Δm≤0.3 mg),绘制菌体干重与菌体密度的标准曲线。
1.3.4重组脂肪氧合酶的制备
发酵结束后将发酵液在8 000 r/min离心10 min,收集菌体,用磷酸盐缓冲液(50 mmol/L磷酸氢二钠-磷酸二氢钠缓冲液(phosphate buffered saline,PBS)、0.3 mol/L NaCl和体积分数0.5% Triton X-100混合制备)重悬菌体,超声波破碎菌体(400 W,超声1 s,停顿2 s,共超声30 min),4℃、12 000 r/min离心10 min,收集上清液作为粗酶液[19]。
1.3.5酶活力的测定
亚油酸底物的制备[20]:取25 μL吐温-20分散于8 mL脱氧蒸馏水中,混匀后加入27 μL亚油酸,充分混匀,避免产生气泡,用1.1 mL 0.5 mol/L的NaOH溶液使其澄清,定容到50 mL容量瓶中,4 ℃条件下保存备用。酶活力测定反应体系为:pH 6.0的磷酸盐缓冲液2.78 mL,酶液20 μL,亚油酸钠200 μL,混匀后放入水浴中并开始计时,反应3 min测定234 nm波长处的吸光度变化。LOX酶活力定义[21]:35 ℃条件下1 min内3 mL反应体系在234 nm波长处的吸光度增加0.001作为一个酶活力单位U。
1.3.6单因素试验
1.3.6.1诱导表达条件的确定
根据菌体生长曲线,分别在不同的菌体生长期(OD600nm=0.4、1.5、2.6、3.4、4.2)添加诱导剂,确定最佳诱导时机;在菌体生长的对数期添加不同质量浓度的诱导剂(10、50、100、200、400 μg/mL),确定诱导剂最适质量浓度;在菌体生长的对数期添加一定浓度诱导剂,分别诱导不同时间(8、16、24、32、40 h),确定适宜的诱导时间;添加诱导剂后,分别在不同温度条件下(16、25、30、37 ℃)诱导,确定最适诱导温度。
1.3.6.2接种量对LOX产量及菌体生长的影响
将培养好的种子液按体积分数分别为1%、3%、5%、7%、9%的接种量接入100 mL/250 mL发酵培养基,37 ℃、180 r/min振荡培养至OD600nm为1.5左右,添加IPTG使其终质量浓度为100 μg/mL,诱导17 h后取出离心、破碎获得粗酶液,测定酶活力。
1.3.6.3培养基初始pH值对LOX产量及菌体生长的影响
将配制的培养基在灭菌前分别调节pH值为5.0、6.0、7.0、8.0,然后在16 ℃诱导17 h,经离心、破碎处理后测定粗酶液的酶活力。
1.3.6.4装液量对LOX产量及菌体生长的影响
在250 mL摇瓶中分别装入40、60、80、100、120 mL发酵培养基,在相同条件下16 ℃诱导17 h后离心收集菌体,破碎后测定上清液酶活力。
1.3.7发酵条件的Plackett-Burman试验设计
在单因素试验的基础上,采用Plackett-Burman试验设计对发酵条件的关键因子筛选,其中X1~X4为诱导条件,X5~X7为培养条件,响应值为酶活力,每组试验重复3 次,取平均值,试验因素水平及代码见表1。
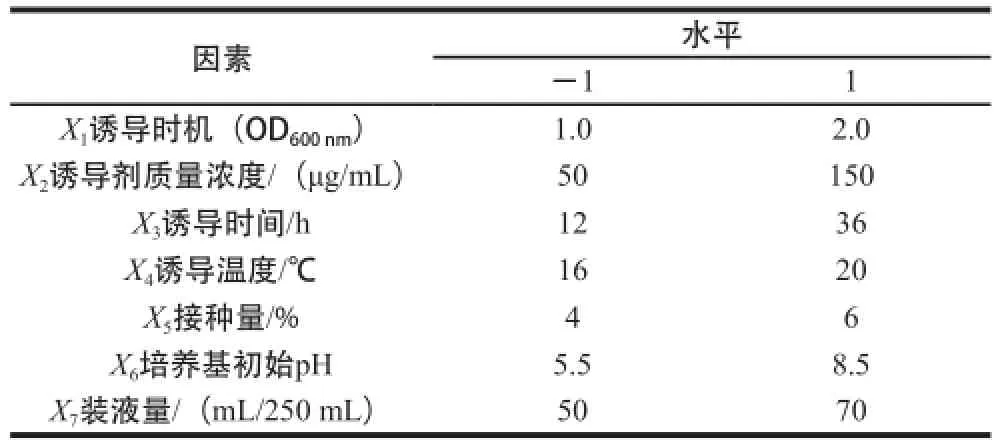
表1 Plackett-Burman试验设计因素水平及代码Table 1 Levels and codes of variables used for Plackett-Burman experimental design sign
1.3.8响应面优化试验
通过Plackett-Burman试验确定发酵条件各因素的影响顺序,选取前3 个主要影响因素:诱导时机、诱导时间和培养基初始pH值,采用响应面Box-Behnken设计三因素三水平试验对其进一步优化,各因子、代码及水平见表2。
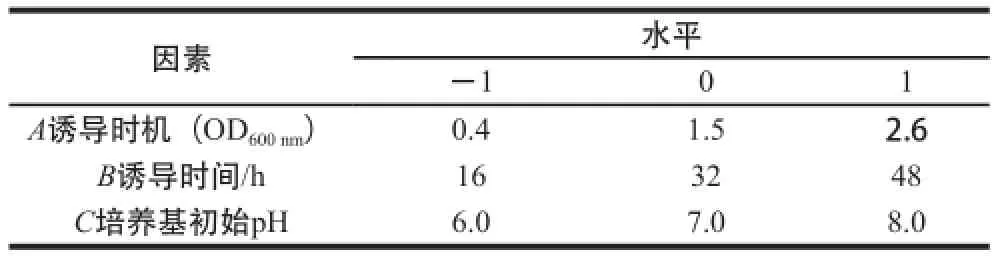
表2 响应面Box-Behnken试验设计因素水平及代码Table 2 Levels and codes of variables used for Box-Behnken response surface methodology
2 结果与分析
2.1诱导表达条件的确定
2.1.1重组菌最佳诱导时机的确定
通过在发酵培养基中测定重组菌的生长曲线,确定其对数生长期的范围,分别选取OD600nm为0.4、1.5、2.6、3.4、4.2时添加终质量浓度为100 μg/mL的IPTG作为诱导剂,16 ℃诱导17 h后测定LOX酶活力和菌体干重,结果如图1所示。
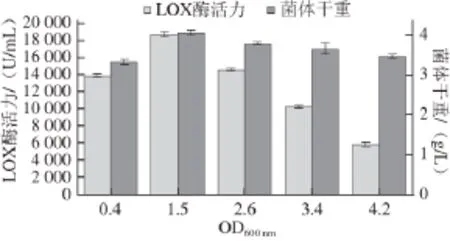
图1 菌株最佳诱导时机的确定Fig. 1 Determination of the optimal starting time of induction
由图1可知,在不同时期添加诱导剂都能诱导表达,但LOX的产量相差甚大。当OD600nm达到1.5左右时,添加IPTG进行诱导产酶,酶活力最高,为(18 710.40±278.32) U/mL。当OD600nm继续增加,菌体干重下降缓慢,而酶活力明显下降。
2.1.2诱导剂最适质量浓度的确定
分别选择IPTG的终质量浓度为10、50、100、200、400 μg/mL,在菌体生长的对数期添加后于16 ℃诱导17 h,取出处理后测定LOX酶活力和菌体干重,结果如图2所示。
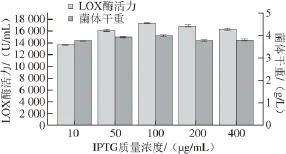
图2 IPTG最适质量浓度的确定Fig. 2 Determination of the optimal concentration of IPTG
由图2可知,诱导剂质量浓度在一定范围内时,目的蛋白的表达随诱导剂质量浓度的增加而增加,当超过100 μg/mL时,LOX酶活力反而出现一定的下降,表明过高的诱导剂质量浓度对目的蛋白的表达有一定的抑制作用。这可能是由于IPTG的质量浓 度过高一方面抑制了菌体生长,另一方面IPTG的剧烈诱导导致目的蛋白合成速率太快,从而在胞内形成不溶性包涵体[22]。菌体干重的变化趋势与酶活力大致相同。
2.1.3诱导时间的确定
在重组菌生长到OD600nm为1.5左右时,加入终质量浓度为100 μg/mL的IPTG,在16 ℃条件下分别诱导8、16、24、32、40 h,取样测定酶活力和菌体干重,结果如图3所示。
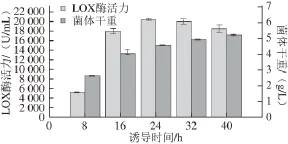
图3 IPTG诱导时间的确定Fig. 3 Determination of the induction duration of IPTG

图4 诱导时间对LOX表达影响的SDS-PAGEE分析Fig. 4 SDS-PAGE analysis of the effect of induction duratione on LOX expression
由图3可知,加入诱导剂诱导24 h后发酵液中的酶活力达到最高,为(20 383.12±189.39) U/mL。诱导8 h时,酶活力较低,随着时间的延长,酶活力逐渐增高,24 h时达到最大,随后开始缓慢下降。这可能是由于宿主细胞中蛋白酶将异源蛋白降解,使目标蛋白表达水平降低,酶活力下降。菌体干重在整个过程中表现为持续增长,待诱导24 h左右,生长速率有所下降,表明菌体开始进入稳定期。由图4可知,诱导24 h时对应的条带中目的蛋白的表达量最高,诱导时间过短或者过长都不利于目的蛋白的积累。
2.1.4诱导温度的确定
温度是保证微生物生长和产物合成所需各种酶活性的重要条件,同时是影响重组蛋白表达的一个重要因素,因此在发酵过程中必须控制合适的温度。本研究分别在16、25、30、37 ℃诱导菌体17 h,LOX酶活力和菌体干重的结果如图5所示。
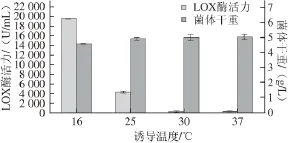
图5 诱导温度的确定Fig. 5 Determination of the optimal induction temperature
由图5可知,采用16 ℃低温诱导表达,酶活力最高为(19 612.80±172.00) U/mL,而温度较高时,LOX的表达受到明显抑制,30 ℃和37 ℃条件下的酶活力基本为零。菌体干重变化不大,随着温度升高,25 ℃后基本无显著差异。这表明低温诱导更有利于重组菌表达目的蛋白,这可能是因为高温下质粒稳定性降低以及重组酶的合成速率太快而在胞内形成包涵体[23]。
通过单因素试验确定重组菌诱导表达条件,即诱导时机OD600nm达到1.5,IPTG质量浓度为100 μg/mL,诱导时间24 h,诱导温度16 ℃。在此条件下,菌体产生的LOX酶活力更高。
2.2接种量对LOX产量及菌体生长的影响
接种量的大小影响发酵的产量和发酵周期。分别将种子液按体积分数1%、3%、5%、7%、9%的接种量接入100 mL/250 mL发酵培养基,结果如图6所示。
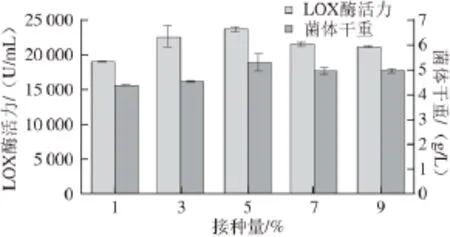
图6 接种量对LOX产量及菌体生长的影响Fig. 6 Effect of inoculum size on cell growth and LOX production
由图6可知,无论是LOX酶活力还是菌体干重,在接种量为5%时两者均最高,接种量太低或者太高都不利于重组菌的生长和外源基因的表达。
2.3培养基初始pH值对LOX产量及菌体生长的影响
培养基的初始pH值对LOX产量及菌体生长的影响很大,发酵过程中需要维持一定的pH值以保证微生物的正常代谢。在配制发酵培养基后,将初始pH值分别调至5.0、6.0、7.0和8.0进行发酵,发酵结束后测定其LOX酶活力和菌体干重,结果如图7所示。
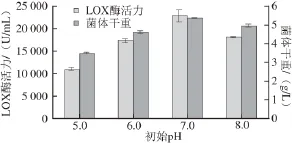
图7 培养基初始pH值对LOX产量及菌体生长的影响Fig. 7 Effect of medium initial pH on cell growth and LOX production
由图7可知,培养基的初始pH值对菌体生长及产酶影响显著,两者趋势基本一致,都呈现出先迅速上升,在pH 7.0时LOX酶活力和菌体干重达最大,分别为(22 780.80±123.55) U/mL和(5.336±0.020) g/L,随后两者都开始降低。因此,培养基的初始pH值应控制在7.0。
2.4装液量对LOX产量及菌体生长的影响
大肠杆菌属于兼性厌氧菌,氧气的供应常常是发酵实验能否成功的重要限制因素之一,而装液量是影响溶解氧的一个重要因素。
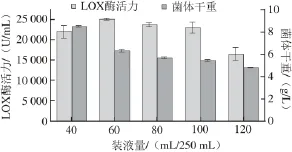
图8 装液量对LOX产量及菌体生长的影响Fig. 8 Effect of medium volume on cell growth and LOX production
由图8可知,LOX酶活力随着装液量增加先上升后逐渐降低,当装液量为60 mL/250 mL时,最有利于重组菌产酶。菌体干重在装液量为40 mL/250 mL时最高,随着装液量的增加,菌体干重持续降低。出现这种现象可能是随着装液量增加,发酵液与空气的接触面积相对减小,摇瓶发酵系统的供氧能力下降;同时随摇瓶装液量增加,单位体积发酵液中的溶氧降低更为明显,因此发酵液中溶氧过低阻 碍细胞生长和外源蛋白的表达;另外还会导致底物的不完全氧化产生多种有机酸,如乙酸等,这些因素都有可能影响LOX的表达及菌体生长[24]。2.5 发酵条件的Plackett-Burman试验
采用Plackett-Burman试验对影响发酵产酶的7 个因素进行筛选,试验结果及预测值见表3,显著性分析结果见表4。
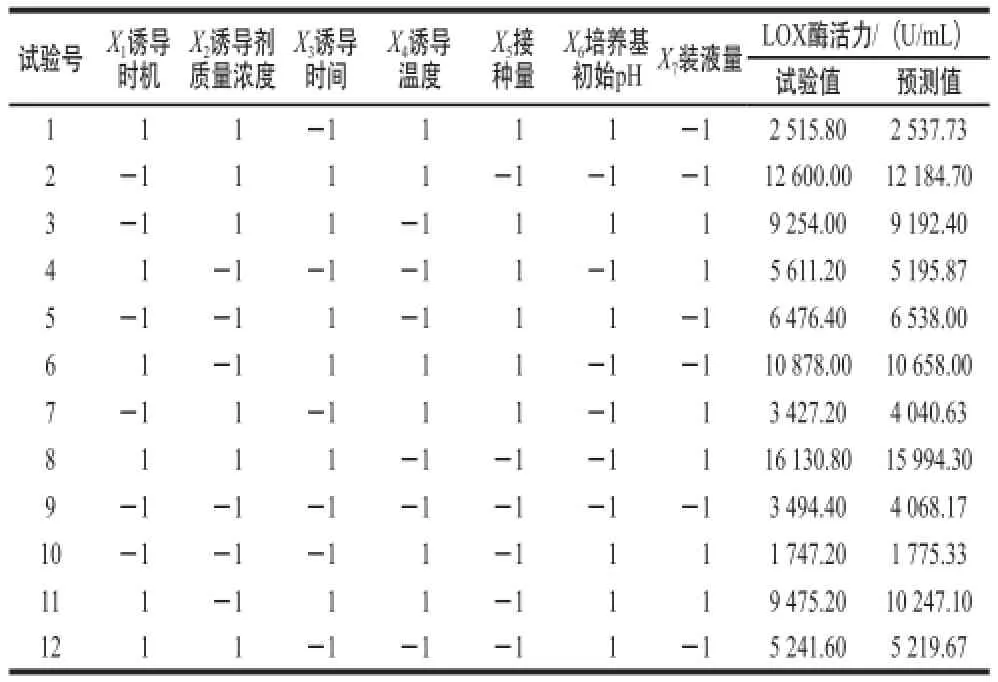
表3 Plackett-Burman试验设计结果及预测值Table 3 Plackett-Burman experimental design with actual and predicted values of LOX activity
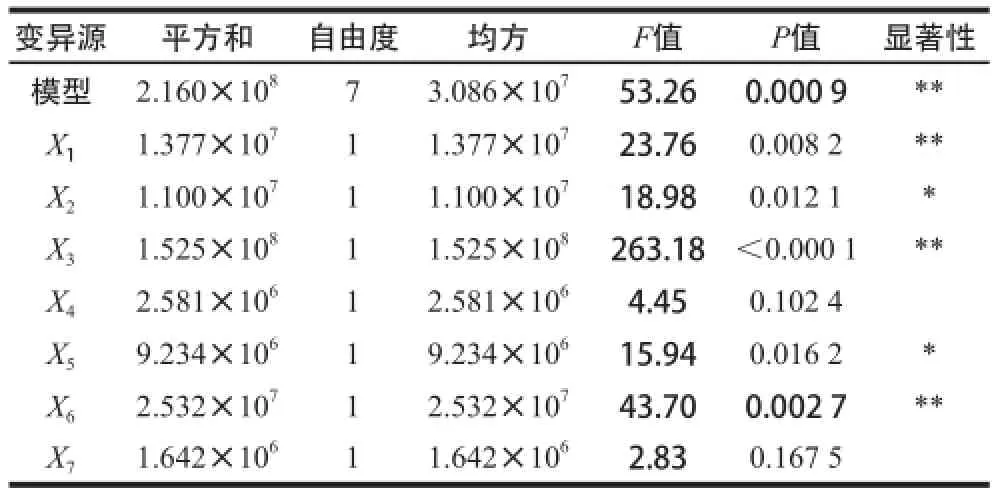
表4 Plackett-Burman试验设计方差分析及其显著性检验Table 4 Analysis of variance and significance test of Plackett-Burman experimental design model
由表4可知,试验模型极显著(P=0.000 9),对重组菌发酵产酶具有显著影响的因子包括诱导时机、诱导剂质量浓度、诱导时间、接种量和培养基初始pH值,其中诱导时机、诱导时间和培养基初始pH值的影响极显著(P<0.01),而诱导温度和装液量的影响是不显著的。在上述5 个具有显著影响的因子中,诱导时机、诱导剂质量浓度和诱导时间均为正效应,所以在后续的响应面试验设计中应将其中心点适当上移,而接种量和培养基初始pH值为负效应,说明它们在水平下限时更有利于重组菌产酶,中心点应适当下移。
2.6响应面试验
2.6.1预测模型建立及显著性检验
根据Plackett-Burman试验结果,选取诱导时机、诱导时间和培养基初始pH值为试验因素,以LOX酶活力Y为响应值,采用Box-Behnken设计响应面试验,试验设计结果及预测值见表5。利用Design-Expert分析软件对表5中的数据进行回归拟合,得到回归方程为:Y=21 900.78+ 1 894.86A+1 637.21B-499.21C+1 128.60AB-813.78AC+98.50BC-11 938.16A2-6 146.17B2-7 369.81C2。
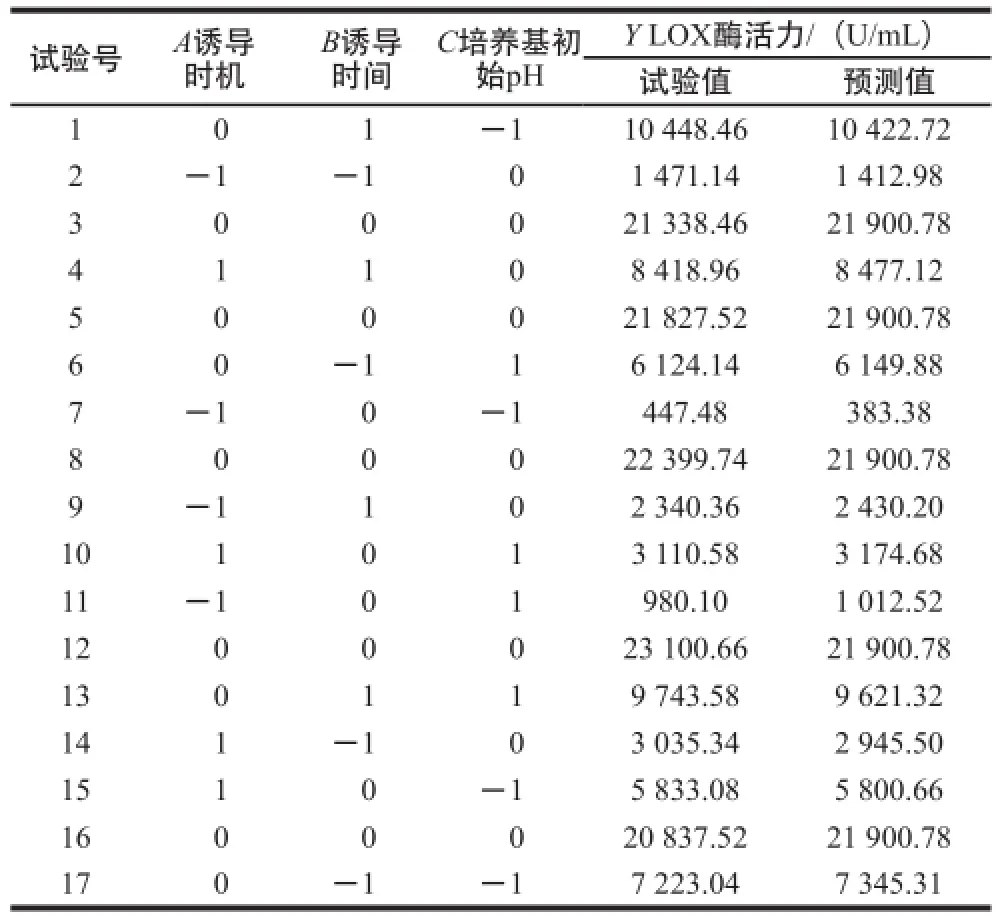
表5 响应面Box-Behnken试验设计结果及预测值Table 5 Box-Behnken design with actual and predicted values of LOX activity
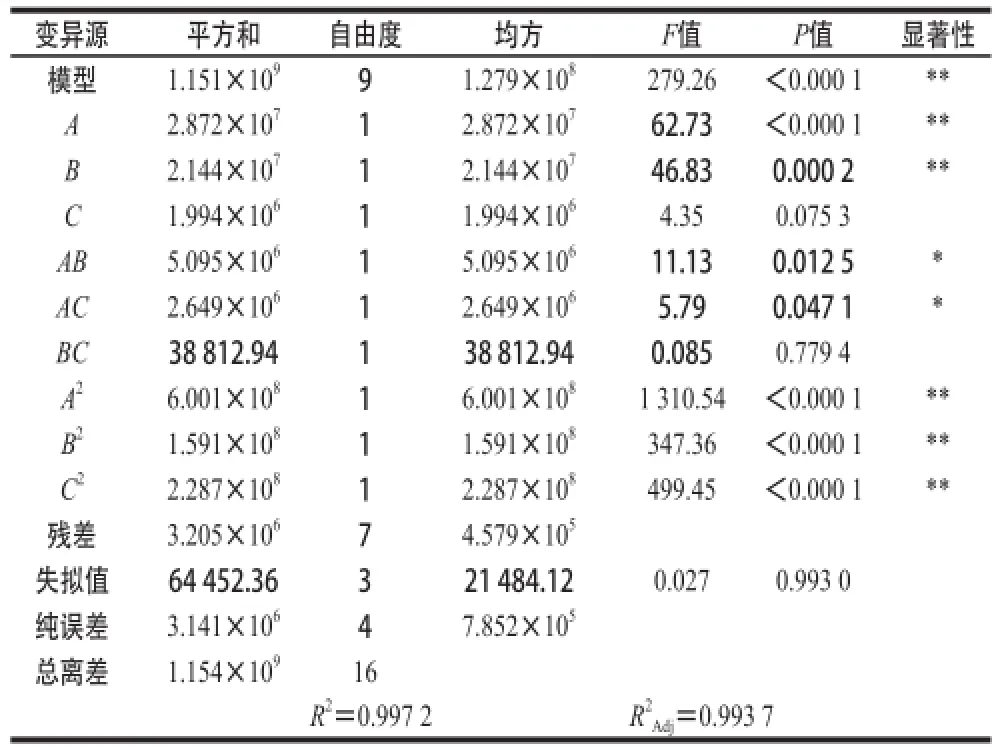
表6 回归模型方差分析及其显著性检验Table 6 Analysis of variance and significance test of Box-Behnken regression model
由表6可知,该模型达到极显著水平(P<0.000 1),失拟项(P=0.993 0>0.05)极不显著,表明试验数据与模型拟合度较高。通过P检验,一次项A、B及二次项A2、B2和C2对酶活力大小有极显著影响,AB、AC对酶活力大小的影响达到显著水平。模型的校正决定系数=0.993 7,表明该模型能够解释99.37%的变异,决定系数R2=0.997 2,表明重组菌发酵产酶量的实测值与预测值之间有很好的拟合度。因此,可以用该模型对重组菌发酵产酶的条件进行分析和预测。
2.6.2响应面分析
由回归方程得到诱导时机、诱导时间和培养基初始pH值这3 个因素间交互作用对重组菌发酵产酶影响的响应曲面图和等高线图,如图9所示。
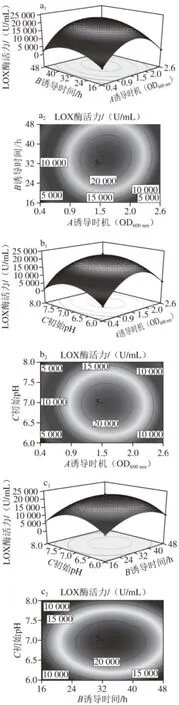
图9 各因素交互作用对LOX酶活力的影响Fig. 9 Effects of interactions among experimental factors on LOX activity
由图9a可知,响应面图的曲面形状较圆,等高线接近圆形,说明诱导时机与诱导时间对LOX酶活力的交互影响不显著,同样,图9b中诱导时机与培养基初始pH值对LOX酶活力的交互作用不显著。当诱导时机处于最佳时间点时,诱导时间与培养基初始pH值对LOX酶活力的交互影响如图9c所示。由于其等高线图呈椭圆形,所以两者的交互作用是显著的。随着诱导时间的延长和培养基初始pH值的升高,LOX酶活力出现先上升后下降的趋势。当诱导时间为34 h,培养基的初始pH值为7.0时,酶活力达到最高。从响应面图中可以看到,诱导时间曲面变化较培养基初始pH值曲面变化更陡,表明诱导时间对于重组菌发酵产酶的影响更显著。
采用Design-Expert软件分析回归方程,得到曲面的极值点为诱导时机OD600nm达到1.6、诱导时间34 h、培养基初始pH 7.0,LOX酶活力预测值为22 108.30 U/mL。为验证结果的可靠性,在最佳条件下进行了3 次重复实验,LOX酶活力为(21 261.60±264.03) U/mL,与预测值的相对误差为3.982%,表明回归方程拟合度较好,可应用于重组大肠杆菌(pET-23a-pse-LOX)产LOX发酵条件的优化。
3 结 论
在单因素试验的基础上,采用Plackett-Burman设计从7 个因素中筛选出对LOX产量具有显著影响的3 个因子,即诱导时机、诱导时间和培养基的初始pH值。利用响应面Box-Behnken设计,以LOX酶活为响应值,建立三因素三水平的响应面模型,通过对其显著性及交互作用的分析,求解回归方程,获得最优发酵条件为诱导时机为发酵液OD600nm达到1.6、诱导时间34 h、培养基初始pH 7.0,经验证实验可知LOX酶活力为(21 261.60±264.03) U/mL,与预测值22 108.30 U/mL基本吻合,比优化前的(13 553.96±46.64) U/mL提高了56.87%,脂肪氧合酶的发酵水平显著提高,将为LOX工业化生产和替代化学面粉改良剂溴酸钾及过氧化苯甲酰提供依据。
[1] 闫静芳, 王红霞, 郭玉鑫, 等. 脂肪氧合酶的研究及应用进展[J]. 食品安全质量检测学报, 2013(3): 799-805.
[2] KUHN H, BANTHIYA S, LEYEN K. Mammalian lipoxygenases and their biological relevance[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2015, 1851(4): 308-330. DOI:10.1016/j.bbalip.2014.10.002.
[3] WANG Xiaoming, LU Fengxia, ZHANG Chong, et al. Effects of recombinated Anabaena sp. lipoxygenase on the protein component and dough rheological property of wheat flour[J]. Journal of Agricultural and Food Chemistry, 2014, 62(40): 9885-9892. DOI:10.1021/jf503238h.
[4] ZHANG Chong, ZHANG Shuang, LU Zhaoxin, et al. Effects of recombinant lipoxygenase on wheat flour, dough and bread properties[J]. Food Research International, 2013, 54(1): 26-32. DOI:10.1016/j.foodres.2013.05.025.
[5] CASEY R, HUGHES R K. Recombinant lipoxygenases and oxylipin metabolism in relation to food quality[J]. Food Biotechnology, 2004,18(2): 135-170. DOI:10.1081/FBT-200025673.
[6] KANAMOTO H, TAKEMURA M, OHYAMA K. Cloning and expression of three lipoxygenase genes from liverwort, Marchantia polymorpha L., in Escherichia coli[J]. Phytochemistry, 2012, 77(1): 70-78. DOI:10.1016/j.phytochem.2012.02.009.
[7] KNUST B, WETTSTEIN D. Expression and secretion of pea-seed lipoxygenase isoenzymes in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 1992, 37(3): 342-351.
[8] CRISTEA M, ENGSTROM A, SU C, et al. Expression of manganese lipoxygenase in Pichia pastoris and site-directed mutagenesis of putative metal ligands[J]. Archives of Biochemistry and Biophysics,2005, 434(1): 201-211. DOI:10.1016/j.abb.2004.10.026.
[9] KELLE S, ZELENA K, KRINGS U, et al. Expression of soluble recombinant lipoxygenase from Pleurotus sapidus in Pichia pastoris[J]. Protein Expression and Purification, 2014, 95(3): 233-239. DOI:10.1016/j.pep.2014.01.004.
[10] 刘松, 陆信曜, 周景文, 等. 脂肪氧合酶结构、分子改造与发酵研究进展[J]. 生物技术通报, 2015, 31(12): 34-41. DOI:10.13560/j.cnki. biotech.bull.1985.2015.12.005.
[11] KOEDUKA T, KAJIWARA T, MATSUI K. Cloning of lipoxygenase genes from a Cyanobacterium, Nostoc punctiforme, and its expression in Eschelichia coli[J]. Current Microbiology, 2007, 54(4): 315-319. DOI:10.1007/s00284-006-0512-9.
[12] VIDAL-MAS J, BUSQUETS M, MANRESA A. Cloning and expression of a lipoxygenase from Pseudomonas aeruginosa 42A2[J]. Antonie van Leeuwenhoek, 2005, 87(3): 245-251. DOI:10.1007/ s10482-004-4021-1.
[13] LU Xinyao, ZHANG Juan, LIU Song, et al. Overproduction,purification, and characterization of extracellular lipoxygenase of Pseudomonas aeruginosa in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2012, 97(13): 5793-5800. DOI:10.1007/s00253-012-4457-6.
[14] ZHANG Chong, TAO Tingting, YING Qi, et al. Extracellular production of lipoxygenase from Anabaena sp. PCC 7120 in Bacillus subtilis and its effect on wheat protein[J]. Applied Microbiology and Biotechnology,2012, 94(4): 949-958. DOI:10.1007/s00253-012-3895-5.
[15] WANG Xiaoming, LU Fengxia, ZHANG Chong, et al. Peroxidation radical formation and regiospecificity of recombinated Anabaena sp. lipoxygenase and its effect on modifying wheat proteins[J]. Journal of Agricultural and Food Chemistry, 2014, 62(7): 1713-1719. DOI:1 0.1021/jf405425c.
[16] 陆信曜, 徐智, 刘松, 等. 重组大肠杆菌生产脂肪氧合酶的发酵优化[J]. 食品科技, 2013, 38(5): 31-36. DOI:10.13684/j.cnki. spkj.2013.05.030.
[17] 张充, 周孝伟, 吕凤霞, 等. 重组鱼腥藻脂肪氧合酶基因的克隆表达、分离纯化及活性分析[J]. 生物工程学报, 2012, 28(4): 440-456. DOI:10.13345/j.cjb.2012.04.006.
[18] 章栋梁, 钟蔚, 张充, 等. 响应面法优化重组枯草芽孢杆菌产脂肪氧合酶条件[J]. 核农学报, 2012, 26(2): 324-329.
[19] GUO Fangfang, ZHANG Chong, BIE Xiaomei, et al. Improving the thermostability and activity of lipoxygenase from Anabaena sp. PCC 7120 by directed evolution and site-directed mutagenesis[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 107: 23-30. DOI:10.1016/ j.molcatb.2014.05.016.
[20] 郭芳芳, 应琦, 张充, 等. 重组脂肪氧合酶基因工程菌破碎条件优化及其酶活力测定方法研究[J]. 食品科学, 2012, 33(23): 160-165.
[21] KERMASHA S, METCHE M. Characterization of seed lipoxygenase of Phaseolus vulgaris cv, Haricot[J]. Journal of Food Science, 1986,51(5): 1224-1227. DOI:10.1111/j.1365-2621.1986.tb13090.x.
[22] MERGULHAO F, SUMMERS D, MONTEIRO G. Recombinant protein secretion in Escherichia coli[J]. Biotechnology Advances,2005, 23(3): 177-202. DOI:10.1016/j.biotechadv.2004.11.003.
[23] de MARCO A. Strategies for successful recombinant expression of disulfide bond-dependent proteins in Escherichia coli[J]. Microbial Cell Factories, 2009, 8(10): 26. DOI:10.1186/1475-2859-8-26.
[24] S☒RENSEN P H, MORTENSEN K K. Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli[J]. Microbial Cell Factories, 2005, 4(1): 1-8. DOI:10.1186/1475-2859-4-1.
Optimization of Fermentation Conditions for Lipoxygenase Production by Recombinant Escherichia coli
HE Yujun, ZHANG Chong, QIAN Hui, LU Zhaoxin, BIE Xiaomei, ZHAO Haizhen, L☒ Fengxia*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
With the aim to further enhance lipoxygenase (LOX) activity produced by recombinant E. coli, response surface methodology was used to optimize the fermentation conditions. First of all, we explored the effects of starting time of induction, inducer concentration, induction duration, induction temperature, inoculum size, medium initial pH and medium volume on LOX production by single factor tests. Three factors with signifi cant impacts on LOX activity including starting time of induction, induction time and medium initial pH were selected out of these seven factors by using Plackett-Burman design. Simultaneously, the optimal conditions for LOX production were determined by Box-Behnken design and response surface methodology as induction starting at OD600nmof 1.6 and lasting for 34 h and medium initial pH of 7.0. The LOX activity was (21 261.60 ± 264.03) U/mL under these conditions, which was improved by 56.87% than that before optimization, (13 553.96 ± 46.64) U/mL.
lipoxygenase; fermentation conditions; response surface methodology; Plackett-Burman design
10.7506/spkx1002-6630-201615025
TS201.3
A
1002-6630(2016)15-0149-07
2016-03-23
国家自然科学基金面上项目(31470095);江苏省科技支撑计划项目(BE2011390)
和玉军(1990—),男,硕士研究生,主要从事食品微生物研究。E-mail:2013108059@njau.edu.cn
吕凤霞(1963—),女,教授,博士,主要从事酶工程研究。E-mail:lufengxia@njau.edu.cn
引文格式:
