黑豆脂氧合酶的制备及其酶学活性的鉴定
2016-11-14崔晓东李玉英王转花
李 茹,崔晓东,李玉英,李 晨,王转花,,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006)
黑豆脂氧合酶的制备及其酶学活性的鉴定
李 茹1,崔晓东2,李玉英2,李 晨1,王转花1,2,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006)
从黑豆种子中分离纯化1 种黑豆脂氧合酶——bsLOX,对其酶学活性及降解花色苷等性质进行初步研究。采用缓冲液抽提、硫酸铵沉淀、透析、阳离子交换层析及凝胶层析等方法纯化出具有β-葡萄糖苷酶活性的bsLOX;分别以亚油酸钠和对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl β-D-glucopyranoside,pNPG)为反应底物鉴定bsLOX的脂氧合酶活性和β-葡萄糖苷酶活性。从黑豆种子中纯化获得的bsLOX在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)图谱显示单一条带,分子质量约为95 kD。酶活性分析表明,纯化的bsLOX以亚油酸钠为底物时,酶活力为13 U/mL;当以pNPG为底物在405 nm波长处检测到了对硝基苯酚的生成,从而推测bsLOX具有β-葡萄糖苷酶活性。高效液相色谱实验结果表明bsLOX可以降解花色苷(矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷)为花色素(矢车菊素、矮牵牛素)。由于降解作用不完全,继而发现花色素能抑制bsLOX的酶活性。bsLOX是黑豆中的一种兼具β-葡萄糖苷酶功能的蛋白质,而花色素可能是天然的bsLOX抑制剂。
黑豆;脂氧合酶;β-葡萄糖苷酶活性;花色苷;花色素
脂氧合酶(lipoxygenase,LOX,ECl.13.11.12),俗称脂肪氧化酶、脂肪加氧酶、脂肪氧合酶或类胡萝卜素氧化酶,广泛存在于哺乳动物、植物和微生物中[1-3]。脂氧合酶在豆类中含量较为丰富,对豆类产品的营养成分及品质会产生较大的影响。植物中LOX是一种非血红素蛋白,它专门催化具有顺,顺-1,4-戊二烯结构的不饱和脂肪酸的加氧反应,其底物主要是亚油酸(linoleic acid)和亚麻酸(lionlenic acid)[4-5]。在LOX作用下,亚油酸和亚麻酸转化成氢过氧化脂肪酸,然后在其他酶的作用下,产生具有特殊风味的酯类物质[6]。大豆中的脂氧合酶研究已经较为透彻。大豆脂氧合酶是一种单一多肽链蛋白,存在着3 种同工酶[7]。大豆LOX-1最适pH值为9.0左右,对亚油酸活性较高,LOX-2和LOX-3对亚油酸甲酯活性比亚油酸稍高,最适pH值分别为6.5和7.0[8]。此外大豆LOX-1能与水溶性硫酸亚油酸酯反应,但LOX-2和LOX-3对硫酸亚油酸酯的催化活性较弱[9]。在大豆产品中,脂肪氧合酶能催化脂肪氧化生成n-己醛和n-戊醛,这些产物是形成豆腥味的主要成分。
黑豆是豆科植物大豆的黑色种子,是一种食药两用的作物。古代医书记载,黑豆具有乌发、补肾、解毒、延年益寿等功效[10];现代中医学也表明黑豆可乌发、活血解毒、明目、软化血管、治疗不孕等[11]。从营养学角度看,黑豆富含蛋白质、脂肪、维生素、微量元素等多种营养成分,同时又具有多种生物活性物质,如异黄酮、皂苷、黑豆色素等[12]。本实验以黑豆种子为原材料,分离纯化得到黑豆脂氧合酶(black soybean lipoxygenase,bsLOX),同时发现bsLOX还具有β-葡萄糖苷酶活性,可以将黑豆种皮中的花色苷水解为等分子花色素和葡萄糖,进而水解的花色素可以抑制脂氧合酶及糖苷酶活性,这为深入研究脂氧合酶的生物学功能及寻找天然的LOX抑制剂提供了理论基础。
1 材料与方法
1.1 材料与试剂
黑豆种子,由山西省农业科学院馈赠。
亚油酸钠 美国Sigma公司;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl β-D-glucopyranoside,pNPG)生工生物工程(上海)股份有限公司;矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、飞燕草素葡萄糖苷、矢车菊素、矮牵牛素、飞燕草素 美国Sigma公司;乙腈、甲酸为色谱纯试剂;其余试剂均为国产分析纯。
1.2 仪器与设备
ÄKTA Explorer蛋白质纯化系统 美国General Electric公司;Agilent 1200系列高效液相色谱仪安捷伦科技有限公司;Lambda 35型紫外-可见分光光度计美国Perkin Elmer公司;Lx800酶标仪 美国Bio-Tek公司。
1.3 方法
1.3.1 LOX的分离纯化
黑豆粉经过缓冲液抽提、盐析、脱盐、离子交换层析、凝胶层析等步骤,获得电泳纯的目的蛋白。采用Folin-酚法测定蛋白浓度[13],分装纯化的蛋白,放置于-20 ℃冰箱备用。
1.3.2 脂氧合酶活性的测定
参照Axelrod等[8]的方法,略作修改,具体操作为:采用3 mL反应体系,其中10 mmol/L亚油酸钠母液50 μL(取28 μL亚油酸钠,缓慢加入8 mL蒸馏水中,再加入36 μL吐温-20,混匀,滴加2 mol/L氢氧化钠至溶液澄清,然后以蒸馏水定容至10 mL),磷酸盐缓冲液(20 mmol/L,pH 6.0)2.75 mL,LOX酶液200 μL。在室温(25 ℃)下反应,于234 nm波长处测定光密度值。加酶液15 s后开始计时,记录3 min(每隔30 s测1 次)内光密度值变化[14],酶活力单位定义为每分钟OD234nm增加0.01为1 个LOX活力单位(U/mL)[15-16]。
1.3.3 β-葡萄糖苷酶活性的测定[17]
采用250 μL反应体系(在酶标板内进行),其中67 mmol/L磷酸缓冲液(pH 5.0)100 μL,1 mg/mL谷胱甘肽溶液10 μL,0.116 mol/L pNPG溶液20 μL,45 ℃保温10 min后,加入LOX溶液20 μL,反应20 min,用0.1 mol/L Na2CO3溶液100 μL终止反应,于405 nm波长处测定在酶的作用下对硝基苯酚的释放量;用对硝基苯酚纯品配制不同浓度(0、2、4、6、8、10、12 μmol/L)的标准溶液,绘制标准曲线;得出回归方程y=kx+b,其中y为A405nm,x为对硝基苯酚浓度/(μmol/L),k为斜率,b为截距。利用公式计算被测样品的酶活力。酶活力单位定义为每毫升酶液1 min内水解产生1 μmol对硝基苯酚为1 个活力单位(U/mL)。酶活力计算公式如下:

式中:k为对硝基苯酚-吸光度标准曲线的斜率;b为对硝基苯酚-吸光度标准曲线的截距;A405nm为405 nm波长处的吸光度;V为反应体系中酶液体积/mL;N为粗酶液的浓缩倍数;t为反应时间/min。
1.3.4 脂氧合酶对花色苷的降解
脂氧合酶对花色苷的降解采用高效液相色谱(high performance liquid chromatography,HPLC)法分析。标准品溶液的制备:精确称取一定质量的花色苷(矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、飞燕草素葡萄糖苷)和花色素(矢车菊素、矮牵牛素、飞燕草素)标准品,用酸性甲醇(色谱级)溶解,配制质量浓度为 0.1 mg/mL的标准品储备液,避光(锡箔纸包裹),-20 ℃保存。
样品溶液的制备:67 mmol/L磷酸钾缓冲液(pH 5.0)70 μL,1 mg/mL谷胱甘肽溶液10 μL、1 mg/mL的色素糖苷(矢车菊-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、飞燕草素葡萄糖苷)溶液50 μL,45 ℃保温20 min后加入1 mg/mL的β-葡萄糖苷酶溶液20 μL,反应30 min,用0.1 mol/L的Na2CO3溶液100 μL终止反应。上样前均用孔径为0.22 μm的滤膜过滤。
实验采用梯度洗脱程序:流动相A:5%的甲酸溶液(色谱级);流动相B:100%的乙腈(色谱级);进样量为10 μL;检测波长为513 nm;柱温为25 ℃;流速为0.8 mL/min;洗脱梯度程序:90% A、10% B洗脱8 min,85% A、15% B洗脱15 min, 80% A、20% B洗脱17 min,直至最终洗脱完成。
1.3.5 花色素对脂氧合酶活性的影响
将纯化的bsLOX分别与不同浓度的花色素(矢车菊素、矮牵牛素、飞燕草素)室温孵育30 min,实验组中花色素与bsLOX浓度比分别为0.1∶1、0.5∶1、1∶1,对照组不加花色素。分别按照1.3.2节和1.3.3节的方法测定并计算bsLOX的酶活力。
2 结果与分析
2.1 bsLOX的纯化及活性测定结果
经过粗提、硫酸铵沉淀、透析,获得的粗蛋白经离子交换层析和凝胶层析纯化后获得纯度较高的蛋白质,该蛋白质经10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)分离后呈现单一条带(图1,泳道 4),分子质量约为95 kD。

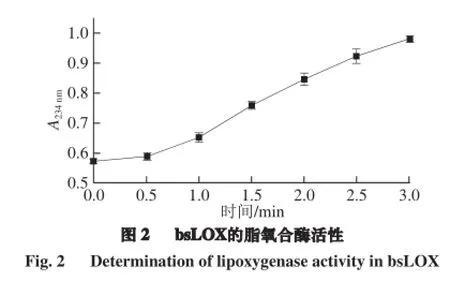
LOX可以专一地催化多元不饱和脂肪酸氧化形成具有共轭双键的过氧化物,此化合物在234 nm波长处有特征吸收峰。分光光度法测定的是酶催化反应的初期产物。吸收值的大小与酶活力呈正相关,可用分光光度计定量测定。该方法的显著优点是可连续测定。依据该实验原理,按照1.3.2节的方法,检测3 min内A234nm的变化。由图2可知,随着时间的增加,A234nm值越来越大,说明生成的过氧化物也越来越多,计算得出bsLOX的酶活力为13 U/mL,显示了较高的脂氧合酶活性。
2.2 β-葡萄糖苷酶的活性
为了判断bsLOX的β-葡萄糖苷酶活性,本实验选用pNPG作为反应底物[18]。pNPG是一种小分子化合物,在β-葡萄糖苷酶催化下脱去一分子葡萄糖,生成的对硝基苯酚在405 nm波长处有特征吸收[19]。按照1.3.3节的方法绘制对硝基苯酚的标准曲线,依据回归方程y=0.007 8x+ 0.038 7(R2=0.964 4),求出反应体系中在酶的催化下对硝基苯酚的生成,相应酶活力为99.6 U/mL,表明bsLOX还兼有β-葡萄糖苷酶的活性。
2.3 bsLOX对花色苷的降解
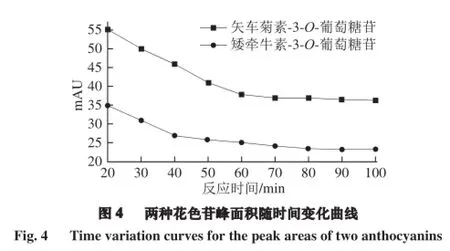
采用HPLC检测bsLOX对花色苷的降解作用。由图3A~C可知,底物矢车菊素-3-O-葡萄糖苷和反应产物矢车菊素的保留时间分别是15.728 min和31.204 min。向底物矢车菊素-3-O-葡萄糖苷溶液中加入bsLOX,反应20 min后,HPLC色谱图在保留时间31.286 min时出现峰值,确定为矢车菊素,表明LOX催化矢车菊素-3-O-葡萄糖苷生成了矢车菊素。同样,由图3D~F可知,bsLOX还可以催化矮牵牛素-3-O-葡萄糖苷(保留时间为19.353 min)降解为矮牵牛素(保留时间为34.458 min)。当反应时间逐渐延长至约60 min时,2 种底物含量都不再减少(图 4)。由此可知,bsLOX可以水解矢车菊素-3-O-葡萄糖苷和矮牵牛素-3-O-葡萄糖苷中的糖苷键,具有β-葡萄糖苷酶活性。同时发现,随着反应时间的增长,bsLOX并不能将2 种底物彻底水解,猜想可能是产物矢车菊素和矮牵牛素对bsLOX的酶活有抑制作用,因此本实验进一步研究了花色素对bsLOX酶活性的影响。


2.4 花色素对bsLOX活性的影响
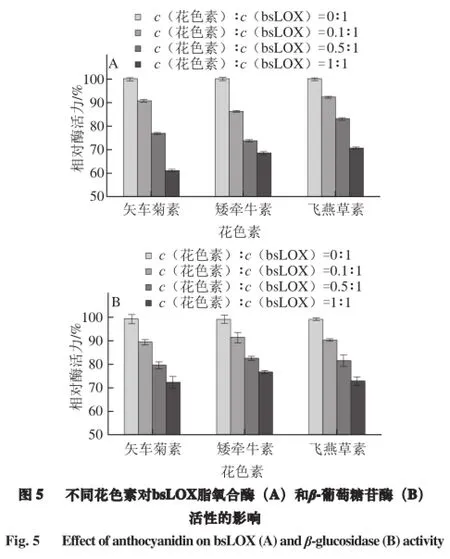
分别向bsLOX溶液中加入不同浓度的矢车菊素、矮牵牛素和飞燕草素,分别测定3 种花色素存在下对bsLOX 2 种酶活力的影响。由图5A可知,随着c(花色素)∶c(bsLOX)的比值增大,脂氧合酶的活性逐渐降低,当浓度比为1∶1时,矢车菊素、矮牵牛素、飞燕草素对bsLOX的抑制率分别达到41.1%、33.8%和31.8%。同样,由图5B可知,β-葡萄糖苷酶的活性也在逐步减弱,当c(花色素)∶c(bsLOX)的比值为1∶1时,矢车菊素、矮牵牛素、飞燕草素对bsLOX的β-葡萄糖苷酶活性的抑制率分别达到27.5%、23%和27%。由此说明,矢车菊素、矮牵牛素和飞燕草素都具有抑制bsLOX酶活力的功能,可能是bsLOX的天然抑制剂。
3 讨 论
LOX普遍存在于高等植物中,与植物的成熟和衰老等有关,是影响新陈代谢和细胞分裂的信号分子,LOX与植物的成熟、衰老密切相关,在植物受到机械伤害和病虫侵染时能产生信号分子进行调节[20]。而大豆则被认为是很好的脂氧合酶的来源。本实验采用粗提及离子交换柱层析等步骤,从黑豆种子中获得1 种分子质量约为95 kD的bsLOX,纯化的蛋白以亚油酸钠为底物证明其具有脂氧合酶活性,分子大小及酶活性与Zhang Chong等[21]的报道相一致。脂氧合酶可能兼具多种酶功能,为了揭示和拓宽本实验获得的LOX的生物学功能,实验以pNPG为底物,初步探讨了bsLOX的β-葡萄糖苷酶活性。结果表明,bsLOX能水解底物中的葡萄糖苷键,具有β-葡萄糖苷酶的活性。之后又将bsLOX分别作用于矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷等花色苷,发现bsLOX可以水解矢车菊素-3-O-葡萄糖苷和矮牵牛素-3-O-葡萄糖苷,分别产生矢车菊素和矮牵牛素。据文献报道,塔罗科的西西里血橙的果汁和成熟的水果中的β-葡萄糖苷酶也可降解花色苷[22]。本实验发现,虽然bsLOX具有水解糖苷键的功能,但水解作用不完全,由此猜想是否产生的花色素对bsLOX的酶活有反馈抑制作用。本实验发现,花色素矢车菊素、矮牵牛素和飞燕草素对bsLOX的脂氧合酶以及β-葡萄糖苷酶的活性均有不同程度的抑制作用,证实来自黑豆中的bsLOX不仅兼有β-葡萄糖苷酶的活性,而且该酶的水解产物还可部分抑制酶的活性,从而在生物体内起到了自我调节控制的作用。大量研究表明,脂氧合酶对于食品营养的影响主要表现为:其催化产物对VA有破坏作用;减少了食品中必需不饱和脂肪酸的含量;作用于必需氨基酸,降低了蛋白质的营养价值及功能特性[23]。因此,寻找一些天然的LOX抑制剂非常重要。本实验发现矢车菊素、矮牵牛素和飞燕草素可能是bsLOX的天然抑制剂,但是其他物种来源的LOX是否也具有β-葡萄糖苷酶活性,以及催化产物对酶本身的调控作用有待深入的研究。
[1] BRASH A R. Lipoxygenases: occurrence, functions, catalysis, and acquisition of substrate[J]. Journal of Biological Chemistry, 1999,274(34): 23679-23682. DOI:10.1074/jbc.274.34.23679.
[2] FEUSSNER I, WASTERNACK C. The lipoxygenase pathway[J]. Annual Review of Plant Biology, 2002, 53(1): 275-297. DOI:10.1146/ annurev.arplant.53.100301.135248.
[3] OLIW E H. Plant and fungal lipoxygenases[J]. Prostaglandins & Other Lipid Mediators, 2002, 68/69: 313-323. DOI:10.1016/S0090-6980(02)00037-0.
[4] HILDSBRAND D F. Lipoxygenases[J]. Physiologia Plantarum, 1989,76(2): 249-253. DOI:10.1111/j.1399-3054.1989.tb05641.x.
[5] GÖBEL C, FEUSSNER I, ROSAHL S. Lipid peroxidation during the hypersensitive response in potato in the absence of 9-lipoxygenases[J]. Journal of Biological Chemistry, 2003, 278(52): 52834-52840. DOI:10.1074/jbc.M310833200.
[6] 陈书婷, 孔祥珍, 华欲飞, 等. 大豆脂肪氧合酶催化合成亚麻酸氢过氧化物的研究[J]. 中国油脂, 2011, 36(4): 27-30.
[7] 曹慧, 王永章. 脂氧合酶研究进展(综述)[J]. 安徽农业大学学报,2001, 28(2): 219-222. DOI:10.3969/j.issn.1672-352X.2001.02.026.
[8] AXELROD B, CHEESBROUGH T M, LAASKO S. Lipoxygenase from soybeans[J]. Methods Enzymol, 1981, 71: 441-446. DOI:10.1016/0076-6879(81)71055-3.
[9] 田其英, 华欲飞. 大豆脂肪氧合酶研究进展[J]. 粮食与油脂,2006(8): 6-9. DOI:10.3969/j.issn.1008-9578.2006.08.002.
[10] 王寅, 张坤, 赵晋. 黑豆的营养价值及在食品中的开发应用[J]. 中国食品添加剂, 2007(6): 132-135. DOI:10.3969/ j.issn.1006-2513.2007.06.026.
[11] 陈长应. 黑豆皮中花青素的提取及测定的研究[J]. 中国调味品,2013, 38(12): 91-94. DOI:10.3969/j.issn.1000-9973.2013.12.023.
[12] 聂刚, 刘朝霞, 杜双奎, 等. 陕北小粒黑豆营养成分分析与评价[J].营养学报, 2014, 36(5): 511-513. DOI:10.13325/j.cnki.acta.nutr. sin.2014.05.023.
[13] LOWRY O, FARR A, RANDALL R, et al. Protein measurement with the Folin phenol reagent[J]. The Journal of Biological Chemistry,1951, 193(1): 265-275.
[14] 张雅君, 杨选, 杨震, 等. 花生发芽过程中脂氧合酶活力的变化[J].食品科学, 2015, 36(11): 182-186. DOI:10.7506/spkx1002-6630-201511035.
[15] 李强, 吴晓露, 李红伟, 等. 黄瓜果实脂氧合酶活性测定方法的建立[J]. 东北农业大学学报, 2008, 39(5): 62-65. DOI:10.3969/ j.issn.1005-9369.2008.05.014.
[16] 李铭韧, 史国安. 牡丹花瓣脂氧合酶测定方法的研究[J]. 山东农业科学, 2010(9): 91-94. DOI:10.3969/j.issn.1001-4942.2010.09.029.
[17] 马腾臻, 杨学山, 张莉, 等. 红佳酿酵母β-葡萄糖苷酶活性测定及产酶特性[J]. 食品与发酵工业, 2014, 40(10): 37-42.
[18] 易松强, 郑火青, 张翠平, 等. 蜂蜜中β-葡萄糖苷酶活性测定及其来源分析[J]. 食品科学, 2010, 31(19): 241-244. DOI:10.7506/spkx1002-6630(2010)19-0241-04.
[19] 李华, 高丽. β-葡萄糖苷酶活性测定方法的研究进展[J]. 食品与生物技术学报, 2007, 26(2): 108-114. DOI:10.3321/ j.issn:1673-1689.2007.02.023.
[20] BAYSAL T, DEMIRDÖVEN A. Lipoxygenase in fruits and vegetables: a review[J]. Enzyme and Microbial Technology, 2007,40(4): 491-496. DOI:10.1016/j.enzmictec.2006.11.025.
[21] ZHANG C, TAO T, YING Q, et al. Extracellular production of lipoxygenase from Anabaena sp. PCC 7120 in Bacillus subtilis and its effect on wheat protein[J]. Applied Microbiology and Biotechnology,2012, 94(4): 949-958. DOI:10.1007/s00253-012-3895-5.
[22] BARBAGALLO R N, PALMERI R, FABIANO S, et al. Characteristic of β-glucosidase from Sicilian blood oranges in relation to anthocyanin degradation[J]. Enzyme and Microbial Technology, 2007, 41(5): 570-575. DOI:10.1016/j.enzmictec.2007.05.006.
[23] 章银良, 闫克玉, 马庆一. 脂氧合酶活性研究及其对食品质量的影响[J]. 食品工业科技, 2002, 23(7): 22-24. DOI:10.3969/ j.issn.1002-0306.2002.07.007.
Preparation and Identification of a Black Soybean Lipoxygenase
LI Ru1, CUI Xiaodong2, LI Yuying2, LI Chen1, WANG Zhuanhua1,2,*
(1. College of Life Science, Shanxi University, Taiyuan 030006, China; 2. Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Shanxi University, Taiyuan 030006, China)
Objective: To extract and purify black soybean lipoxygenase (bsLOX) containing β-glucosidase activity and investigate its anthocyanins-degrading properties and enzymatic activity. Methods: Purification of bsLOX was carried out by buffer extraction, ammonium sulfate precipitation, dialysis, cation exchange chromatography and gel filtration chromatography. The activities of lipoxygenase and β-glucosidase in bsLOX were analyzed by using sodium linoleate and p-nitrophenyl β-D-glucopyranoside (pNPG) as substrates, respectively. An LOX from black soybean seeds was obtained,which showed a single band in SDS-PAGE, with approximate molecular weight of 95 kD. The purified protein had a lipoxygenase activity of approximately 13 U/mL, and could produce nitro phenol using pNPG as substrate as detected at 405 nm, suggesting that bsLOX had β-glucosidase activity. HPLC results showed that bsLOX could only degrade part of anthocyanins (cyanidin-3-O-glucoside and petunidin-3-O-glucoside) into aglycone anthocyanidins (cyanidin and petunidin)and glucose; in turn, the residual anthocyanidins could inhibit the activity of bsLOX. Conclusion: LOX in black soybean may be a kind of protein with a variety of enzymatic functions, while anthocyanidins may be a natural bsLOX inhibitor.
black soybean; lipoxygenase; β-glucosidase activity; anthocyanin; anthocyanidins
10.7506/spkx1002-6630-201609029
Q554
A
1002-6630(2016)09-0155-05
李茹, 崔晓东, 李玉英, 等. 黑豆脂氧合酶的制备及其酶学活性的鉴定[J]. 食品科学, 2016, 37(9): 155-159. DOI:10.7506/ spkx1002-6630-201609029. http://www.spkx.net.cn
LI Ru, CUI Xiaodong, LI Yuying, et al. Preparation and identification of a black soybean lipoxygenase[J]. Food Science, 2016,37(9): 155-159. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609029. http://www.spkx.net.cn
2015-09-16
国家自然科学基金面上项目(31171659);国家自然科学基金青年科学基金项目(31300653);山西省科技创新项目(2014091028;2015021047)
李茹(1990—),女,硕士研究生,研究方向为生物活性物质。E-mail:892790990@qq.com
*通信作者:王转花(1956—),女,教授,博士,研究方向为蛋白质工程与生物活性物质。E-mail:zhwang@sxu.edu.cn
