紫薯花青素的提取及其在VC含量测定中的应用
2016-11-14郭彩华卢珍华陈昭华陈庆绸熊何健
郭彩华,卢珍华,伍 菱,陈昭华,陈庆绸,熊何健*
(集美大学食品与生物工程学院,福建 厦门 361021)
紫薯花青素的提取及其在VC含量测定中的应用
郭彩华,卢珍华,伍 菱,陈昭华,陈庆绸,熊何健*
(集美大学食品与生物工程学院,福建 厦门 361021)
从紫薯中提取花青素,该花青素在530 nm波长处有特征吸收峰,分子质量范围在850~1 020 u之间。利用紫薯花青素替代GB/T 6195—1986《水果、蔬菜维生素C含量测定法(2,6-二氯靛酚测定法)》测定夏橙和西红柿中VC含量。结果表明:夏橙和西红柿中VC的含量分别为(25.33±0.34)、(20.41±0.32) mg/100 g;紫薯花青素法的加标回收率为95.4%~98.6%,相对标准偏差(relative standard deviation,RSD)为1.18%~1.22%;2,6-二氯靛酚法的加标回收率为96.5%~98.7%,RSD为0.86%~0.88%。建立的利用紫薯花青素替代GB/T 6195—1986中2,6-二氯靛酚测定水果、蔬菜中VC含量的方法具有安全、廉价的特点,其准确度与2,6-二氯靛酚法滴定法相当。
紫薯;花青素;GB/T 6195—1986;2,6-二氯靛酚;VC
紫薯(Ipomoea batatas)又称黑薯,薯肉呈紫色至深紫色,富含淀粉、蛋白质、果胶、维生素及多种矿物质,同时还含有花青素。一般成熟紫薯中花青素类色素的含量为0.2%~0.8%,有些品种能高达1.2%。国内外对紫薯花青素的提取以及生理活性进行了一系列的研究,有关此类色素的分子结构和组分分析的研究也取得了一定的进展[1-6]。紫薯色素易溶于水,属非脂溶性色素[7],其存在形式是花色苷,花色苷是花青素(花色素)与糖以糖苷键结合而成的一类化合物,紫薯花色苷色素中的主体结构吡喃环上有一个四价氧原子[8-12]。方夏等[13]报道大红月季花色素可以代替中性红指示剂在酸碱滴定中充当酸碱指示剂,但关于紫薯花青素充当氧化剂的应用研究还没见报道。本实验探讨从紫薯中提取制备花青素的方法,研究花青素的基本性质,分析其代替GB/T 6195—1986《水果、蔬菜维生素C含量测定法(2,6-二氯靛酚滴定法)》[14]中所用的2,6-二氯靛酚定量测定VC的效果。2,6-二氯靛酚为有机合成色素,价格昂贵,且会刺激人体的眼睛、呼吸道和皮肤。而紫薯花青素具有资源丰富、安全性好的优点。
1 材料与方法
1.1 材料与试剂
紫薯 厦门市集美区新华都超市,购买时间为3—7月,个体质量为(250±50) g。
夏橙、西红柿 厦门市集美区菜市场,购买时间为5—7月。夏橙个体质量为(200±20) g;西红柿个体质量为(180±10) g。
2,6-二氯靛酚、细胞色素c 美国Sigma公司;Sephedex G-25凝胶 美国GE Healthcare公司;蓝葡聚糖2000 美国Pharmacia公司;抗坏血酸(纯度≥99.7%)国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
CARY50紫外-可见分光光度计 美国Varian公司;Milli-Qcentury超纯水系统 美国Millipore公司;SY-1-2型电热式恒温水浴锅(箱) 天津欧诺仪器股份有限公司;SG260-A榨汁搅拌器 顺德市方胜电器实业有限公司;UV-5200紫外-可见分光光度计 厦门柏嘉生物科技有限公司;DHG-9146A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;pH计 奥豪斯仪器(上海)有限公司;湘仪 L-550离心机 厦门亿辰科技有限公司。
1.3 方法
1.3.1 紫薯花青素的提取工艺流程
紫薯洗净后削皮、切块、粉碎,加入体积分数0.2% HCl溶液浸泡,先浸泡1 h再搅拌提取2 h,于4 000 r/min离心5 min,取上清液,即为色素粗提液,再浓缩处理,于80 ℃水浴12 h,所得浓缩液过Sephadex G-25柱进行纯化,收集过滤液,再次浓缩处理,于80 ℃条件下水浴12 h,最后于烘箱中60 ℃干燥3 h,获得紫薯花青素制品。
1.3.2 紫薯花青素分子质量分布的测定
采用分子排阻色谱法[15-16]测定紫薯花青素分子质量分布,分别将已知分子质量的蓝葡聚糖2000(2 000 000 u)、细胞色素c(13 000 u)、VB12(1 350 u)、溴酚蓝(670 u)、考马斯亮蓝G250(854 u)溶解于超纯水中,各自的质量浓度为4.0 g/L。上Sephadex G-25凝胶柱(1.0 cm×25 cm),以超纯水洗脱,上样量0.5 mL,流速0.5 mL/min,自动部分收集仪收集洗脱液,根据颜色,计算各自的洗脱体积。蓝葡聚糖2000的洗脱体积记作V0,细胞色素c、VB12、溴酚蓝、考马斯亮蓝G250的洗脱体积记作Ve,绘制分子质量标准曲线。根据紫薯花青素溶液的洗脱体积,确定紫薯花青素分子质量的分布。
1.3.3 紫薯花青素基本性质研究
1.3.3.1 紫薯花青素的光谱性质
用移液管分别移取2.5、5.0、12.5 mL的色素粗提液于25 mL容量瓶中,用体积分数0.2%的HCl溶液定容至刻度。利用CARY50紫外-可见分光光度计,在室温下以0.2% HCl溶液做基线校正,于200~700 nm波长范围内对色素粗提稀释液进行光谱扫描。
1.3.3.2 pH值对紫薯花青素色泽的影响
用广泛缓冲液(pH 2.6~12.0),每升混合液内含柠檬酸6.008 g、磷酸二氢钾3.89 g、硼酸1.769 g、巴比妥5.266 g,每100 mL混合液滴加一定量的0.2 mol/L NaOH溶液即得到所需的pH值。将紫薯花青素制品分别溶于不同pH值的缓冲液中,测定所得液体的pH值并注意观察花青素的色泽变化。
1.3.3.3 紫薯花青素与氧化剂和还原剂的反应
配制0.01 mol/L pH 2.0的HCl溶液,以此作为溶剂,配制质量分数0.05%、0.1%、0.2%、0.5%的Na2SO3溶液,和体积分数0.05%、0.1%、0.2%、0.5% 的H2O2溶液。将配制好的溶液分别倒入已编号的烧杯中,称取一定量的紫薯花青素制品置于相应的烧杯中并用玻璃棒搅拌至溶解。以溶于0.01 mol/L盐酸溶液的花青素为对照组。置于室温避光的环境下放2 h,测定530 nm波长处的吸光度。
1.3.4 紫薯花青素滴定法的精密度和准确度
为了探究紫薯花青素能否替代GB/T 6195—1986《水果、蔬菜维生素C含量测定法(2,6-二氯靛酚滴定法)》中的2,6-二氯靛酚,进行了替代后的精密度和准确度分析(简称紫薯花青素滴定法)。
1.3.4.1 精密度实验
称取100 g的夏橙和西红柿可食部分,放入SG260-A榨汁搅拌器中,加体积分数1% 100 mL的HCl溶液做浸提剂,迅速捣成匀浆后4 000 r/min离心处理3 min,上清液过滤,移取40 mL过滤液于200 mL容量瓶用1% HCl溶液稀释至刻度。吸取6 份10 mL稀释液放入6 个50 mL锥形瓶中,分别用已用标准VC标定过的2,6-二氯靛酚溶液滴定,直至溶液呈粉红色15 s不褪色为止。另吸取6 份10 mL稀释液放入6 个50 mL锥形瓶中,分别用已用标准VC标定过的紫薯花青素溶液滴定,直至溶液呈粉红色15 s 不褪色为止。同时用1% HCl溶液做空白实验。
1.3.4.2 准确度实验
取夏橙和西红柿稀释液(制备方法同1.3.4.1节),用2,6-二氯靛酚溶液滴定法测定,用mg/100 g可食部分表示本底值。向夏橙和西红柿的100 g可食部分得到的过滤液中分别添加标准VC,使最终标准VC的加入量为10、20、30 mg/100 g可食部分,此液称为混合液。取40 mL混合液于200 mL容量瓶用1% HCl溶液稀释至刻度。余下步骤参照GB/T 6195—1986。
1.3.4.3 夏橙和西红柿中VC含量的计算
配制标准抗坏血酸溶液,根据GB/T 6195—1986所描述的方法和公式(1)计算2,6-二氯靛酚和紫薯花青素的滴定度,再根据公式(2)计算夏橙和西红柿的VC含量。
式中:T为每毫升2,6-二氯靛酚或紫薯花青素溶液相当于抗坏血酸的毫克数/(mg/mL);ρ为抗坏血酸的质量浓度/(mg/mL);V为吸取抗坏血酸的体积/mL;V1为滴定抗坏血酸溶液所用2,6-二氯靛酚或紫薯花青素溶液的体积/mL;V2为滴定空白所用2,6-二氯靛酚或紫薯花青素溶液的体积/mL。
式中:V为滴定样液时消耗2,6-二氯靛酚或紫薯花青素溶液的体积/mL;V0为滴定空白时消耗2,6-二氯靛酚或紫薯花青素溶液的体积/mL;T为2,6-二氯靛酚或紫薯花青素溶液的滴定度/(mg/mL);A为稀释倍数;m为样品质量/g。
2 结果与分析
2.1 紫薯花青素的提取工艺参数及结果
通过预实验得到的提取紫薯花青素的关键工艺参数:1)料液比:加入的体积分数0.2% HCl溶液,以1∶20(m/V)效果好,即1 g的紫薯加入20 mL盐酸溶液;2)盐酸浸泡:在40 ℃的水浴条件下,先浸泡1 h后再搅拌提取2 h(每隔15 min,搅拌1 min);3)浓缩处理:浸泡液放在烧杯中在恒温水浴锅中进行敞开浓缩,设定温度80 ℃,时间12 h;4)过柱纯化:将获得的浓缩液经Sephadex G-25柱(3.0 cm×60 cm),上样量3.0 mL,用0.2% HCl溶液作为洗脱剂,流速2 mL/min,自动部分收集仪收集洗脱液,每管收集2 mL。重复10 次,合并颜色为紫红色的洗脱液,再次敞开蒸发得到纯化的色素液;5)紫薯花青素的制备:将纯化的色素液置于烘箱中干燥(60 ℃干燥3 h),得到紫薯花青素制品。
本实验所用的方法属于溶剂提取法。溶剂提取法是国内外关于花青素提取方面报道最多的,花青素在酸性条件下稳定性较好,利用盐酸化甲醇、柠檬酸、酒精、盐酸水溶液等提取剂都能得到较好的提取结果[7-12,17]。本实验以0.2% HCl溶液为提取剂和过柱用的洗脱剂,既是为了好的提取效果也是为了减少对环境的污染;在80 ℃恒温水浴锅中敞开蒸发进行浓缩,避免了减压浓缩时由于紫薯中存在的皂苷类易起泡蒸发而引起的色素损失。用Sephadex G-25柱纯化色素粗提液,优点在于Sephadex G-25是具有分子筛性质的固定相,与色素之间没有化学反应,能提高色素的得率。100 g紫薯经稀盐酸浸提、过柱、浓缩、干燥后,可得(0.65±0.07) g花青素制品,为膏状的红褐色色素。
2.2 紫薯花青素的分子质量
在分子排阻色谱法实验中,绘制的分子质量标准曲线为y=-1.339x+5.539(R2=0.998 3),其中x为紫薯花青素分子质量的对数值(lg Mr),y为Ve/V0。根据花青素溶液的洗脱体积,参考分子质量标准曲线,确定花青素分子质量的范围,主要在850~1 020 u之间。
2.3 紫薯花青素的基本性质
2.3.1 花青素的光谱性质
图1中的3 条曲线分别表示不同花青素质量浓度下的吸收光谱特征。紫薯花青素的紫外-可见吸收光谱结果说明色素在紫外波长下有大量的吸收,这与花色苷的结构相符合。在可见光区域,波长为530 nm处有一特征吸收峰,说明所提取的紫薯花青素的最大吸收波长在530 nm处。
2.3.2 pH值与紫薯花青素溶液颜色的关系

紫薯花青素在不同的介质中表现出不同的颜色,是因为不同的pH值环境使花青素存在形式发生了变化[18],从而呈现出不同的颜色。正因为紫薯花青素在不同pH值环境中如此的表现,使它具备了充当酸碱指示剂的基本特征。由表1可知,紫薯花青素溶液在酸性溶液(pH 1.0~5.0)中呈红色,在碱性溶液(pH 9.0~10.0)中呈蓝绿色,这与2,6-二氯酚靛酚在酸、碱两性中所呈现的颜色非常相似。染料2,6-二氯靛酚的颜色受介质的酸度影响,在碱性溶液中呈深蓝色,在酸性介质中呈浅红色[14]。
2.3.3 紫薯花青素与氧化剂和还原剂的反应结果
以Na2SO3为还原剂,H2O2为氧化剂来考察还原剂和氧化剂对花青素颜色稳定性的影响。由图2可知,随着Na2SO3质量分数的增加,色素溶液的颜色有着明显的变化,从原先的艳红色渐渐变为无色,当Na2SO3质量分数为0.5%时,A530mn值只有0.077±0.013,肉眼观察为无色。相比之下H2O2的加入对色素溶液的影响没那么大,由图3可知,在H2O2的体积分数为0.5%时,A530mn值为0.424±0.028。尽管Wesche-Ebeling等[19]研究发现H2O2可引起花色苷的降解,但对花青素颜色稳定性的影响比Na2SO3还是小得多。
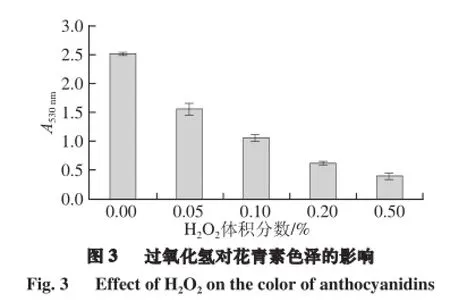
由于亚硫酸钠还原性极强,而紫薯花青素可以充当氧化剂,在与亚硫酸钠的氧化还原反应中得到了电子,导致紫薯花色苷色素中主体结构吡喃环上的四价氧原子的化合价降低。紫薯花青素能充当氧化剂的特性,与GB/T 6195—1986中的2,6-二氯靛酚也相似,2,6-二氯靛酚的颜色也取决于其氧化还原状态,氧化态在酸性介质中为红色,还原态变为无色[14]。由上文可知,对照组是红色,而当加入的Na2SO3质量分数为0.5%时,紫薯花青素变为无色,说明花青素此时处于还原态。
2.4 紫薯花青素滴定法的精密度和准确度
2.4.1 方法精密度
取夏橙和西红柿稀释液各12 份,6 份利用2,6-二氯靛酚滴定法测定,另6 份利用紫薯花青素滴定法进行测定。在测定中发现紫薯花青素与VC的反应完全、迅速,耗时与GB/T 6195—1986中2,6-二氯靛酚的作用时间相当。测定结果见表2。

由表2可知,两种方法平行样测定都有较好的重现性。花青素替代GB/T 6195—1986中2,6-二氯靛酚测定的夏橙和西红柿中VC含量分别为(25.33±0.34)、(20.41±0.32) mg/100 g;而2,6-二氯靛酚测定夏橙和西红柿中VC的含量分别为(25.28±0.46)、(20.25±0.21) mg/100 g。精密度实验的相对标准偏差2,6-二氯靛酚法为1.04%~1.82%,紫薯花青素法为1.35%~1.59%,均小于2%,说明用紫薯花青素替代GB/T 6195—1986中2,6-二氯靛酚是可行的,替代后重现性高。
2.4.2 方法准确度
为了确认方法的可靠性,进行了加标回收实验,结果见表3。紫薯花青素法的加标回收率在95.4%~98.6%,相对标准偏差为1.18%~1.22%;2,6-二氯靛酚法的加标回收率在96.5%~98.7%,相对标准偏差为0.86%~0.88%。两种方法测定的结果十分接近。食品中VC含量的测定方法有滴定法、光度分析法、高效液相色谱法和电化学法[20]。滴定法最为经典,滴定法中又以GB/T 6195—1986法最为简便、快速。高效液相色谱法和电化学法是近年来发展的新方法,王艳颖等[21]报道高效液相色谱测定草莓中VC含量,其加标回收率为97.4%~102.1%,相对标准偏差小于3%;孙德坤等[22]报道的褪色光度法测定果蔬中VC含量的方法其回收率94.03%~98.90%;王佳露等[23]等建立了极谱法测定VC含量的方法,实验中对芒果中的VC含量进行7 次平行实验,相对偏差为0.665%,回收率为93.4%~95.8%;左国强等[24]利用高锰酸钾褪色光度法测定梨中VC含量,其回收率为101%~105%,相对标准偏差为1.13%;胡文娜等[25]利用黄瓜、柑橘等果蔬对Ag/聚L-甲硫氨酸复合修饰电极法测定VC含量的准确度进行了验证,回收率为95.6%~98.3%,相对标准偏差为1.1%~3.0%。本实验结果与文献的数据相比较,从精密度和准确度分析紫薯花青素滴定法用于水果、蔬菜中VC含量的检测是可行和可靠的。
3 结 论
100 g紫薯经稀盐酸浸提、过柱、浓缩、干燥等工艺处理后可得花青素为0.65 g。以紫薯为原料提取花青素,具有资源丰富、提取简便、色彩鲜艳、对环境无污染、安全性好的优点。
花青素替代GB/T 6195—1986中2,6-二氯靛酚测定夏橙和西红柿中VC含量,结果表明精密度实验的相对标准偏差小于2%,替代后重现性高。紫薯花青素法和2,6-二氯靛酚法的加标回收率结果接近,花青素替代GB/T 6195—1986中2,6-二氯靛酚后的方法准确度高。
本实验所建立的利用紫薯花青素替代GB/T 6195—1986中2,6-二氯靛酚测定水果、蔬菜中VC含量的方法具有安全、廉价、准确度与2,6-二氯靛酚法滴定法相当的特点。
[1] SUDA I, OKI T, MASUDA M, et al. Physiological functionality of purple-fleshed sweet potatoes containing anthocyanins and their utilization in foods[J]. Japan Agricultural Research Quarterly, 2003,37(3): 167-173. DOI:10.6090/jarq.37.167.
[2] 杨朝霞, 王亦军, 高磊. 紫甘薯花色苷色素研究进展[J]. 青岛大学学报(工程技术版), 2004, 19(2): 32-36. DOI:10.3969/ j.issn.1006-9798.2004.02.008.
[3] OKI T, SUDA I, TERAHARA N, et al. Determination of acylated anthocyanin in human urine after ingesting a purple-fleshed sweet potato beverage with various contents of anthocyanin by LC-ESI-MS/ MS[J]. Bioscience, Biotechnology and Biochemistry, 2006, 70(10):2540-2543. DOI:10.1271/bbb.60187.
[4] 孙建霞, 张燕, 胡小松, 等. 花青素的提取、分离以及纯化方法研究进展[J]. 食品与发酵工业, 2008, 34(8): 111-117.
[5] 杨颖, 夏其乐, 陈剑兵, 等. 紫薯花色苷的理化性质研究[J]. 食品工业科技, 2009, 30(11): 251-253; 256.
[6] 胡梦琳, 杨甲甲, 代涛, 等. 紫薯色素两种提取方法的比对研究[J].食品科学, 2011, 32(6) : 247-249.
[7] 陆国权, 李秀玲. 紫甘薯红色素与其他同类色素的稳定性比较[J]. 浙江大学学报(农业与生命科学版), 2001, 27(6): 635-638. DOI:10.3321/ j.issn:1008-9209.2001.06.013.
[8] TSUKUI A, KUWANO K. Anthocyanin pigment isolated from purple root of sweet potato[J]. Home Econnomics of Japan, 1983, 34(3): 21-27.
[9] ODAKE K, TERAHARA N, SAITO N, et al. Chemical structures of two anthocyanins from purple sweet potato, Ipomoea batatas[J]. Phytochemistry, 1992, 31(6): 2127-2130. DOI:10.1016/0031-9422(92)80378-R.
[10] GODA Y, SHIMIZU T, KATO Y, et al. Two acylated anthocyanins from purple sweet potato[J]. Phytochemistry, 1997, 44(1): 183-186. DOI:10.1016/S0031-9422(96)00533-X.
[11] TERAHARA N, SHIMIZU T, KATO Y. Six diacylated anthocyanins from the storage roots of purple sweet potato, Ipomoea batatas[J]. Bioscience, Biotechnology, and Biochemistry, 1999, 63(8): 1420-1424. DOI:10.1271/bbb.63.1420.
[12] TERAHARA N, KOUCZAK-ISLAM I, NAKATANI M, et al. Anthocyanins in callus induced from purple storage root of Ipomoea batatas L.[J]. Phytochemistry, 2000, 54(8): 919-922. DOI:10.1016/ S0031-9422(00)00099-6.
[13] 方夏, 钱惠菊, 李燕, 等. 大红月季花色素指示剂的研究[J]. 江苏教育学院学报(自然科学版), 2006, 23(4) : 9-11.
[14] GB/T 6195—1986 水果、蔬菜维生素C含量测定法(2, 6-二氯靛酚滴定法)[S].
[15] SHINGEL K I, TSARENKOV V M, PETROV P T. Size-exclusion chromatography study of the molecular-weight distribution of gammairradiated pullulan[J]. Carbohydrate Research, 2000, 324(4): 283-287.
[16] 何忠效. 生物化学实验技术[M]. 北京: 化学工业出版社, 2004: 129-137;354-356.
[17] 阳翠, 秦廷豪, 李晓梅, 等. 紫甘薯花青素提取工艺参数优化[J]. 西南师范大学学报(自然科学版), 2013, 38(7): 69-72. DOI:10.3969/ j.issn.1000-5471.2013.07.013.
[18] 庞志申. 花色苷研究概况[J]. 北京农业科学, 2000, 18(5): 37-42.
[19] WESCHE-EBELING P, MONTGOMERY M W. Strawberry polyphenoloxidase: its role in anthocyanin degradation[J]. Journal of Food Science, 1990, 55(3): 731-734.
[20] 何保山, 张长辉, 左春艳, 等. 食品中维生素C含量检测研究进展[J].江西农业学报, 2010, 22(10): 111-114; 117.
[21] 王艳颖, 姜国斌, 胡文忠, 等. 高效液相色谱法测定草莓中维生素C含量[J]. 大连大学学报, 2006, 27(2): 21-22; 26.
[22] 孙德坤, 许月明, 吴定. 褪色光度法测定果蔬中VC的含量[J].食品工业科技, 2003, 24(5): 93-94; 98. DOI:10.3969/ j.issn.1002-0306.2003.05.048.
[23] 王佳露, 刘军. 极谱法检测芒果中的维生素C[J]. 齐齐哈尔医学院学报, 2008, 29(22) : 27-48.
[24] 左国强, 张晓杰. 高锰酸钾褪色光度法测定梨中维生素C含量[J]. 洛阳理工学院学报(自然科学版) , 2015, 25(1): 13-15.
[25] 胡文娜, 郑丹丹. Ag/聚L-甲硫氨酸复合修饰电极的制备及其用于果蔬中维生素C的测定[J]. 皖西学院学报, 2015, 31(2): 72-75. DOI:10.3969/j.issn.1009-9735.2015.02.016.
Anthocyanins from Purple Sweet Potato (Ipomoea batatas) and Its Application in VC Quantification
GUO Caihua, LU Zhenhua, WU Ling, CHEN Zhaohua, CHEN Qingchou, XIONG Hejian*
(College of Food and Biological Engineering, Jimei University, Xiamen 361021, China)
Anthocyanins were extracted from purple sweet potato (Ipomoea batatas) using an environmentally friendly process. The anthocyanins exhibited characteristic absorption peak at 530 nm, having a molecular weight in the range of 850-1 020 u. The content of vitamin C in Valencia orange and tomato was determined by a new titration method using the anthocyanins extracted from purple sweet potato in place of 2,6-dichloroindophenol as described in the Chinese national standard GB/T 6195-1986. The results showed that vitamin C was (25.33 ± 0.34) mg/100 g in Valencia orange and (20.41 ± 0.32) mg/100 g in tomato. The spiked recoveries of VC with purple sweet potato anthocyanins ranged from 95.4% to 98.6%,with relative standard deviation (RSD) of 1.18%-1.22%, while those with 2,6-dichloroindophenol titration were between 96.5% and 98.7% with RSD of 0.86%-0.88%. The anthocyanin titration method was safe and low-cost with an accuracy equivalent to that of 2,6-dichloro-indophenol titration.
Ipomoea batatas; anthocyanins; GB/T 6195-1986; 2,6-dichloroindophenol; vitamin C
10.7506/spkx1002-6630-201609025
TS255
A
1002-6630(2016)09-0134-05
郭彩华, 卢珍华, 伍菱, 等. 紫薯花青素的提取及其在VC含量测定中的应用[J]. 食品科学, 2016, 37(9): 134-138. DOI:10.7506/spkx1002-6630-201609025. http://www.spkx.net.cn
GUO Caihua, LU Zhenhua, WU Ling, et al. Anthocyanins from purple sweet potato (Ipomoea batatas) and its application in VC quantification[J]. Food Science, 2016, 37(9): 134-138. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609025. http://www.spkx.net.cn
2015-08-16
福建省自然科学基金资助项目(2013J01134)
郭彩华(1963—),女,副教授,硕士,主要从事食品生物化学研究。E-mail:chguo@jmu.edu.cn
*通信作者:熊何健(1968—),男,研究员,硕士,主要从事食品化学与营养研究。E-mail:hjxiong@jmu.edu.cn
