低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响
2016-11-14连燕娜高丽萍高兆兰
连燕娜,高丽萍,郭 豫,高兆兰,金 玉
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响
连燕娜,高丽萍*,郭 豫,高兆兰,金 玉
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
目的:探讨低聚体葡萄籽原花青素(grape seed proanthocyanidins extract,GSPE)及其结构单元儿茶素(catechin,C)对顺铂(cis-dichlorodiamineplatinum (II),DDP)损伤HEK293人胚肾细胞的保护作用以及对DDP抗A549人肺腺癌细胞活性的影响。方法:体外培养HEK293细胞和A549细胞,以DDP建立损伤模型,分别用不同质量浓度的低聚体GSPE和儿茶素对细胞进行预处理,四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法测定细胞抑制率和存活率。结果:当低聚体GSPE质量浓度为16 mg/L时,对DDP诱导的HEK293细胞损伤的保护作用最佳,与DDP损伤组相比有显著差异(P<0.05),并且在达到此质量浓度时可显著增强DDP对A549细胞的损伤效果(P<0.05)。相同条件下儿茶素对DDP诱导的HEK293细胞损伤无显著影响(P>0.05)。结论:体外培养条件下,一定质量浓度的低聚体GSPE对DDP诱导的HEK293细胞损伤具有一定的保护作用,同时能增强DDP对A549细胞的杀伤作用。儿茶素对DDP诱导HEK293细胞损伤的保护作用不明显。
低聚体葡萄籽原花青素;儿茶素;顺铂;肾毒性
顺铂(cis-dichlorodiamineplatinum (Ⅱ),DDP)是一种被广泛应用的抗癌药物,已在多种恶性肿瘤的治疗中取得了显著疗效,如乳腺癌、肺癌、卵巢癌等,它是目前有效的抗肿瘤药物之一[1-2]。但DDP有明显的毒性,如肾毒性、耳毒性、心脏毒性等[3-5]。由于DDP在肾脏中的聚集浓度最高,约为在血清中浓度的5 倍,因此肾毒性是DDP临床应用受限制的主要因素[6]。
葡萄籽原花青素(grape seed procyanidins extract,GSPE)是从葡萄籽中提取的黄酮类物质,具有多种重要生物活性。近年来的研究表明,GSPE具有抗氧化、清除自由基、抗炎、保护心血管、降血脂、抗肿瘤等功能[7-11]。葡萄籽中含量最丰富且研究最多的是黄烷醇及其低聚物等黄酮类物质[12]。黄烷醇单体包括儿茶素(catechin,C)、表儿茶素(epicatechin,EC)和表儿茶素没食子酸酯(epigallocatechin gallate,EGCG)。不同数量的黄烷醇单体聚合构成原花青素,生物活性较强的是低聚体原花青素。
本课题组前期的研究表明GSPE可有效拮抗DDP诱导的肾损伤[13],但由于GSPE结构的复杂性,其确切的有效成分尚不完全清楚。儿茶素是构成GSPE的单体成分之一。儿茶素类化合物因具有多种生物活性,如抗氧化、保护心血管、保护肝脏、抗炎、抗衰老等[14-15],现已引起国内外研究者的普遍重视,但其对DDP诱发肾损伤的影响及对DDP抗癌效果的影响尚未见报道。因此本研究拟采用体外细胞培养法探讨低聚体GSPE和儿茶素对DDP诱导的HEK293人胚肾细胞损伤的保护作用,以及对DDP体外杀伤A549人肺腺癌细胞的影响。
1 材料与方法
1.1 材料与试剂
HEK293人胚肾细胞、A549人肺腺癌细胞购自中国医学科学院基础医学研究所北京协和医学院基础学院细胞中心。
DDP(批号:406022CF,注射用冻干粉剂) 齐鲁制药有限公司;低聚体GSPE(纯度>95%,高效液相色谱(high performance liquid chromatography,HPLC)级,其中二聚体56%、三聚体12%、四聚体6.6%、单体和其他大分子寡聚体20.4%(HPLC检测)) 天津尖峰天然产物研究开发有限公司;儿茶素(纯度>98%,HPLC检测) 成都曼斯特生物科技有限公司;DMEM培养基、0.25%胰酶 美国Genview公司;胎牛血清 浙江天杭生物科技有限公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Sigma公司。
1.2 方法
1.2.1 细胞培养
HEK293细胞和A549细胞用含15%胎牛血清的DMEM培养基于37 ℃、含5% CO2的孵育培养箱中培养,取处于指数生长期的细胞用于实验。
1.2.2 DDP对细胞的毒性作用测定
取100 μL(1h105个/mL)处于指数生长期的细胞接种到96 孔板中,待细胞生长至融合状态时,弃原培养液,加入100 μL含不同质量浓度DDP的无血清DMEM培养基,其中对照组的DMEM培养基中不加DDP,每组设 6 个复孔,在37 ℃、含5% CO2和饱和湿度的培养箱中培养24 h后测定细胞抑制率。
1.2.3 低聚体GSPE和儿茶素对细胞存活率的影响
将100 μL(1h105个/mL)处于指数生长期的细胞接种到96 孔板中,待细胞生长至融合状态时,弃原培养液,加入100 μL含不同质量浓度低聚体GSPE和儿茶素的无血清DMEM培养基,其中对照组的DMEM培养基中不加低聚体GSPE和儿茶素,每组设6 个复孔,在37 ℃、含5% CO2和饱和湿度的培养箱中培养24 h后测定细胞存活率。
1.2.4 低聚体GSPE和儿茶素对DDP诱导细胞损伤的影响
将100 μL(1h105个/mL)处于指数生长期的细胞接种到96 孔板中,待细胞生长至融合状态时,进行分组:1)对照组:DDP终质量浓度为0 mg/L,GSPE或儿茶素终质量浓度为0 mg/L;2)DDP组:HEK293细胞DDP终质量浓度为20 mg/L,A549细胞DDP终质量浓度为10 mg/L;3)DDP+GSPE或儿茶素组:在加DDP前4 h加入不同质量浓度GSPE或儿茶素孵育细胞。每组设6 个复孔,加入DDP后在37 ℃、含5% CO2和饱和湿度的培养箱中培养24 h测定细胞存活率。
1.2.5 MTT法测定细胞存活率和细胞抑制率
细胞经药物处理24 h后,向培养基中加入MTT,使之终质量浓度为0.5 g/L,于37 ℃、含5% CO2的孵育培养箱中培养4 h,弃上清液并加入二甲基亚砜(100 μL/孔),振荡混匀10 min,用酶标仪(测定波长570 nm,参比波长630 nm)测定吸光度(A)。按照公式(1)、(2)计算细胞存活率和细胞抑制率。

1.3 数据统计处理
2 结果与分析
2.1 低聚体GSPE和儿茶素对DDP诱导HEK293细胞损伤的保护作用
2.1.1 DDP对HEK293细胞的毒性作用

图1 DDP对HEK293细胞的毒性作用Fig.1 Toxic effect of DDP on HEK293 cells
如图1所示,随着DDP质量浓度升高,细胞抑制率也逐渐增大。当DDP质量浓度为60 mg/L时,对HEK293细胞抑制率达到最高,为0.85f0.03。当DDP质量浓度为20 mg/L时,对HEK293细胞抑制率接近最大值的一半,因此选用20 mg/L作为建立HEK293细胞DDP损伤模型的质量浓度。
2.1.2 低聚体GSPE对HEK293细胞存活率的影响

图2 不同质量浓度低聚体GSPE对HEK293细胞存活率的影响Fig.2 Effect of GSOPE on the viability of HEK293 cells
如图2所示,随着低聚体GSPE质量浓度的升高,HEK293细胞存活率逐渐增大,当GSPE质量浓度为5 mg/L时,HEK293细胞存活率达到最大,比对照组升高0.27f0.06,且与对照组(0.0 mg/L)相比具有显著差异(P<0.05)。当GSPE质量浓度继续增大时,HEK293细胞存活率逐渐降低,当GSPE质量浓度高于50 mg/L时,HEK293细胞存活率显著低于对照组(P<0.05)。即GSPE在一定质量浓度范围内可促进HEK293细胞增殖。
2.1.3 儿茶素对HEK293细胞存活率的影响
如图3所示,随儿茶素质量浓度的升高,HEK293细胞存活率逐渐增大,当儿茶素质量浓度为20 mg/L时,HEK293细胞存活率达到最大,比对照组升高0.41f0.16,且与对照组相比具有显著差异(P<0.05)。以上结果说明儿茶素在一定质量浓度范围内可促进HEK293细胞增殖。

图3 不同质量浓度儿茶素对HEK293细胞存活率的影响Fig.3 Effect of catechin on the viability of HEK293 cells
2.1.4 低聚体GSPE对DDP诱导HEK293细胞损伤的保护作用

图4 不同质量浓度低聚体GSPE对DDP诱导HEK293细胞损伤的Fig.4 Protective effect of GSOPE on DDP-induced toxicity in HEK293 cells
如图4所示,用终质量浓度为20 mg/L的DDP建立HEK293细胞损伤模型,用不同质量浓度的低聚体GSPE拮抗DDP引起的细胞毒性。在一定质量浓度范围内,低聚体GSPE可有效保护DDP引起的HEK293细胞损伤,增加细胞存活率。当低聚体GSPE质量浓度为16 mg/L时,其对HEK293细胞的保护作用最佳,与DDP组相比具有显著差异(P<0.05),HEK293细胞存活率增加了0.21f0.05。
2.1.5 儿茶素对DDP诱导HEK293细胞损伤的保护作用

图5 不同质量浓度儿茶素对DDP诱导HEK293细胞损伤的保护作用Fig.5 Protective effect of catechin on DDP-induced toxicity in HEK293 cells
如图5所示,用终质量浓度为20 mg/L的DDP建立HEK293细胞损伤模型,DDP组细胞存活率显著低于对照组(P<0.05)。而不同质量浓度儿茶素对DDP诱导的HEK293细胞损伤没有显著影响。说明儿茶素对DDP诱导HEK293细胞损伤没有保护作用。
2.2 低聚体GSPE和儿茶素对DDP杀伤A549细胞的影响
2.2.1 DDP对A549细胞的杀伤作用

图6 DDP对A549细胞的抑制作用()Fig.6 Inhibitory effect of DDP on the growth of A549 cells ()
如图6所示,随着DDP质量浓度升高,其对A549细胞抑制率逐渐增大。当DDP质量浓度为30 mg/L时,其对A549细胞抑制率达到最高,为0.85f0.04。当DDP质量浓度为10 mg/L时,其对A549细胞抑制率接近最大值的一半,因此选用10 mg/L作为建立A549细胞DDP损伤模型的质量浓度。
2.2.2 低聚体GSPE对A549细胞的抑制作用

图7 不同质量浓度低聚体GSPE对A549细胞的抑制作用()Fig.7 Inhibitory effect of GSOPE on the growth of A549 cells)
如图7所示,当低聚体GSPE质量浓度≤5 mg/L时,其对A549细胞没有显著的抑制作用(P>0.05)。当低聚体GSPE质量浓度高于5 mg/L时,其对A549细胞抑制率显著高于对照组(P<0.05)。即一定质量浓度的低聚体GSPE可以抑制A549细胞增殖。
2.2.3 儿茶素对A549细胞的抑制作用
如图8所示,当儿茶素质量浓度≤320 mg/L时,其对A549细胞没有显著的抑制作用。当儿茶素质量浓度达到640 mg/L时,其对A549细胞抑制率显著高于对照组(P<0.05)。即640 mg/L的儿茶素可抑制A549细胞生长,而≤320 mg/L的儿茶素对A549细胞增殖没有显著影响。
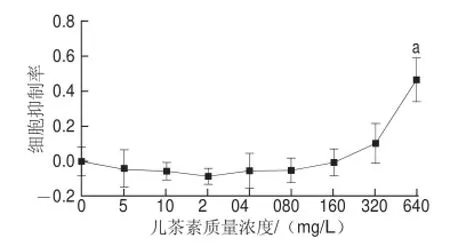
图8 不同质量浓度儿茶素对A549细胞的抑制作用(x±s,n=5)Fig.8 Inhibitory effect of catechin on the growth of A549 cells (x± s, n = 5)
2.2.4 低聚体GSPE对DDP杀伤A549细胞的影响

图9 低聚体GSPE对DDP杀伤A549细胞的影响(x±s,n=5)Fig.9 Effect of GSOPE on DDP-induced toxicity in A549 cells (x± s, n = 5)
如图9所示,用终质量浓度为10 mg/L的DDP建立A549细胞损伤模型。当低聚体GSPE质量浓度低于8 mg/L时,其对A549细胞抑制率与DDP组没有显著差异,当低聚体GSPE质量浓度高于16 mg/L时,其对A549细胞抑制率显著高于DDP组(P<0.05),且随GSPE质量浓度的增大,A549细胞抑制率逐渐增大,说明当低聚体GSPE高于一定质量浓度时,可增加A549细胞对DDP的敏感性,协同DDP杀伤A549细胞。
2.2.5 儿茶素对DDP杀伤A549细胞的影响

图10 儿茶素对DDP杀伤A549细胞的影响(x±s,n=5)Fig.10 Effect of catechin on DDP-induced toxicity of A549 cells (x± s, n = 5)
如图10所示,用终质量浓度为10 mg/L的DDP建立A549细胞损伤模型,DDP组A549细胞抑制率显著高于对照组(P<0.05),说明DDP可有效损伤A549细胞,而不同质量浓度的儿茶素对DDP诱导的A549细胞损伤没有显著影响。
3 讨 论
DDP是临床上被广泛应用的抗肿瘤药物之一,随着研究的深入,DDP抗肿瘤作用的机制越来越清楚。DDP进入机体后,在细胞外高氯离子环境中,大部分以原形化合物的形式存在。在有机阳离子转运体2(organic cation transporter 2,OTC2)或铜离子转运体1(copper transporter 1,Ctr1)的介导下,DDP可穿过细胞膜进入细胞内部[6]。DDP进入细胞后,氯离子会很快被水分子取代,DDP被水化后形成亲电子的活化形式。活化的DDP可与核酸分子上的巯基或嘌呤碱基的N7供氮活性中心反应,形成链内或链间加合产物,从而造成癌细胞的DNA损伤,阻止癌细胞分裂或诱导癌细胞凋亡[1]。
有研究表明,有些多酚类物质可以通过改变基因的甲基化状态或调节核因子的表达量来增强癌细胞对DDP的敏感性[16-17]。此外,一些黄烷醇等多酚类物质本身可以通过增强正常细胞的抗氧化能力、阻滞癌细胞的细胞周期以及降低癌细胞的转移和扩散等作用来达到一定的抗癌效果[18-20]。本研究表明,一定质量浓度的低聚体GSPE预处理A549细胞后,可增强DDP对A549细胞的杀伤作用,提示低聚体GSPE可增强DDP的抗肿瘤作用。
随着DDP的广泛应用,其肾毒性越来越被人们所重视。DDP的肾毒性与多种因素有关,其中氧化应激和细胞凋亡是DDP诱导肾毒性的主要原因之一。DDP的亲核氨基可与水分子作用产生大量的自由基,导致细胞线粒体损伤、抗氧化酶活性下降,最终导致细胞凋亡等[21-22]。低聚体GSPE主要是通过增强细胞抗氧化活性来保护DDP诱导的HEK293细胞损伤。孙芸等[23]研究表明,聚合度对GSPE的抗氧化活性影响较大,单体的抗氧化活性低于二聚体。本研究结果显示,低聚体GSPE可有效保护DDP诱导的HEK293细胞损伤,儿茶素对DDP诱导的HEK293细胞损伤没有显著影响。
当低聚体GSPE质量浓度为16 mg/L时,可有效保护DDP诱导的HEK293细胞损伤,而在此质量浓度下,低聚体GSPE又可增强DDP对A549细胞的杀伤作用。而儿茶素对DDP诱导的HEK293细胞和A549细胞损伤都没有显著影响。因此,低聚体GSPE和儿茶素虽然都属于黄烷醇类物质,结构有一定的相似性,但在对DDP所致肾损伤和DDP抗癌作用方面的影响上却起着不同的作用。本研究结果表明,低聚体GSPE既能拮抗DDP诱导的肾损伤,又能增强DDP对A549的抑制作用,其确切的作用机制还有待于进一步研究,儿茶素对DDP诱导的肾细胞损伤没有显著保护作用。
[1] DASARI S, TCHOUNWOU P B. Cisplatin in cancer therapy: molecular mechanisms of action[J]. European Journal of Pharmacology, 2014, 740: 364-378. DOI:10.1016/ j.ejphar.2014.07.025.
[2] 陈鸿利, 吾麦尔江, 艾麦提, 等. 顺铂类抗肿瘤药物研究进展[J]. 承德医学院学报, 2005, 22(2): 150-153. DOI:10.3969/ j.issn.1004-6879.2005.02.037.
[3] YOUSEF M I, HUSSIEN H M. Cisplatin-induced renal toxicity via tumor necrosis factor-alpha, interleukin 6, tumor suppressor P53, DNA damage, xanthine oxidase, histological changes, oxidative stress and nitric oxide in rats: protective effect of ginseng[J]. Food and Chemical Toxicology, 2015, 78: 17-25. DOI:10.1016/j.fct.2015.01.014.
[4] DEMKOW U, STELMASZCZYK E A. Cardiotoxicity of cisplatinbased chemotherapy in advanced non-small cell lung cancer patients[J]. Respiratory Physiology & Neurobiology, 2013, 187(1): 64-67. DOI:10.1016/j.resp.2013.03.013.
[5] TROPITZSCH A, ARNOLD H, BASSIOUNI M, et al. Assessing cisplatin-induced ototoxicity and otoprotection in whole organ culture of the mouse inner ear in simulated microgravity[J]. Toxicology Letters, 2014, 227(3): 203-212. DOI:10.1016/j.toxlet.2014.03.022.
[6] ELJACK N D, MA H Y, DRUCKER J, et al. Mechanisms of cell uptake and toxicity of the anticancer drug cisplatin[J]. Metallomics,2014, 6(11): 2126-2133. DOI:10.1039/c4mt00238e.
[7] LUAN Yunyan, LIU Zimin, ZHONG Jinyi, et al. Effect of grape seed proanthocyanidins on tumor vasculogenic mimicry in human triple-negative breast cancer cells[J]. Asian Pacific Journal of Cancer Prevention, 2015, 16(2): 531-535.
[8] MA Jia, FANG Binbin, ZENG Fangpeng, et al. Grape seed proanthocyanidins extract inhibits pancreatic cancer cell growth through down-regulation of miR-27a expression[J]. Journal of Central South University (Medical Sciences), 2015, 40(1): 46-52. DOI:10.11817/j.issn.1672-7347.2015.01.008.
[9] PONS Z, GUERRERO L, MARGALEF M, et al. Effect of low molecular grape seed proanthocyanidins on blood pressure and lipid homeostasis in cafeteria diet-fed rats[J]. Journal of Physiology and Biochemistry, 2014, 70(2): 629-637. DOI:10.1007/s13105-014-0329-0.
[10] SHAO Zuohui, VANDEN H T, LI Changqing, et al. Synergistic effect of Scutellaria baicalensis and grape seed proanthocyanidins on scavenging reactive oxygen species in vitro[J]. American Journal of Chinese Medicine, 2004, 32(1): 89-95. DOI:10.1142/ S0192415X04001722.
[11] 陈茵茹, 康健, 赵芙蓉. 赤霞珠葡萄籽原花青素抗菌抗氧化活性研究[J]. 食品科技, 2014, 39(2): 209-215.
[12] 温建辉, 刘冷. 葡萄籽成分的开发与综合利用[J]. 晋中学院学报,2014(3): 32-36; 81. DOI:10.3969/j.issn.1673-1808.2014.03.009.
[13] 李贞, 高丽萍, 冷洪涛, 等. 葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 食品科学, 2011, 32(7): 315-318.
[14] HARA Y. Tea catechins and their applications as supplements and pharmaceutics[J]. Pharmacological Research, 2011, 64(2): 100-104. DOI:10.1016/j.phrs.2011.03.018.
[15] INIGUEZ F F, SOTO V H, PERALTA E, et al. Antioxidant activity and diffusion of catechin and epicatechin from antioxidant active films made of poly (L-lactic acid)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(26): 6515-6523. DOI:10.1021/jf300668u.
[16] ZHANG Youwei, WANG Xiang, HAN Liang, et al. Green tea polyphenol EGCG reverse cisplatin resistance of A549/DDP cell line through candidate genes demethylation[J]. Biomedicine & Pharmacotherapy, 2015, 69: 285-290. DOI:10.1016/ j.biopha.2014.12.016.
[17] OHNUMA T, MATSUMOTO T, ITOI A, et al. Enhanced sensitivity of A549 cells to the cytotoxic action of anticancer drugs via suppression of Nrf2 by procyanidins from cinnamomi cortex extract[J]. Biochemical and Biophysical Research Communications,2011, 413(4): 623-629. DOI:10.1016/j.bbrc.2011.09.014.
[18] 梁慧敏, 时小燕. 原花青素对人肝癌细胞SMMC-7721增殖及凋亡的作用[J]. 山东医药, 2010, 50(49): 4-6.
[19] UCHINO R, MADHYASTHA R, MADHYASTHA H, et al. NFκB-dependent regulation of urokinase plasminogen activator by proanthocyanidin-rich grape seed extract: effect on invasion by prostate cancer cells[J]. Blood Coagulation & Fibrinolysis, 2010,21(6): 528-533. DOI:10.1097/MBC.0b013e32833a9b61.
[20] MEERAN S M, KATIYAR S K. Cell cycle control as a basis for cancer chemoprevention through dietary agents[J]. Frontiers in Bioscience, 2008, 13: 2191-2202.
[21] CHIRINO Y I, PEDRAZA C J. Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity[J]. Experimental and Toxicologic Pathology, 2009, 61(3): 223-242. DOI:10.1016/j.etp.2008.09.003.
[22] AKSOY A N, KABIL K S, BATMAZ G, et al. The role of antioxidant activity in the prevention and treatment of infertility caused by cisplatin in rats[J]. Gynecologic and Obstetric Investigation, 2015,79(2): 119-125. DOI:10.1159/000367657.
[23] 孙芸, 徐宝才, 谷文英, 等. 葡萄籽原花青素的聚合度与抗氧化活性关系[J]. 食品与发酵工业, 2006, 32(10): 41-46.
Protective Effect of Grape Seed Oligomeric Proanthocyanidins Extract against Cisplatin-Induced Nephrotoxicity in HEK293 Cell and Effect on Anticancer Activity of Cisplatin in Human Lung Cancer Cells
LIAN Yanna, GAO Liping*, GUO Yu, GAO Zhaolan, JIN Yu
(Beijing Municipal Key Laboratory of Biological Active Substances and Functional Food, College of Applied Arts and Science,Beijing Union University, Beijing 100083, China)
Objective: To investigate the protective effect of grape seed oligomeric proanthocyanidins extract (GSOPE) and catechin (C) against cisplatin (DDP)-induced nephrotoxicity in human embryonic kidney (HEK) 293 cells and its effect on anticancer activity of DDP in human lung cancer A549 cells. Methods: HEK293 cells and A549 cells were cultured in vitro. The protective effects of GSOPE and catechin at various concentrations on DDP-induced HEK293 cells and their synergistic interaction with DDP against A549 cells were evaluated by MTT assay. Results: GSOPE at 16 mg/L could significantly protect DDP-induced HEK239 cells from death (P < 0.05), and the protective effect was better than that of other groups. GSOPE at 16 mg/L could also significantly enhance DDP-induced A549 cell death (P < 0.05). On the other hand, catechin had no influence on DDP-induced HEK293 cell death. Conclusion: In vitro, GSOPE, rather than catechin, can protect DDP-induced nephrotoxicity and can enhance DDP-induced lung cancer cell death.
grape seed oligomeric proanthocyanidins extract (GSOPE); catechin; cisplatin; nephrotoxicity
10.7506/spkx1002-6630-201607033
Q946.8
A
1002-6630(2016)07-0182-05
连燕娜, 高丽萍, 郭豫, 等. 低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J]. 食品科学, 2016,37(7): 182-186. DOI:10.7506/spkx1002-6630-201607033. http://www.spkx.net.cn
LIAN Yanna, GAO Liping, GUO Yu, et al. Protective effect of grape seed oligomeric proanthocyanidins extract against cisplatin-induced nephrotoxicity in HEK293 cell and effect on anticancer activity of cisplatin in human lung cancer cells[J]. Food Science, 2016, 37(7): 182-186. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607033. http://www.spkx.net.cn
2015-05-12
北京市自然科学基金资助项目(7163211)
连燕娜(1987—),女,硕士,研究方向为生物活性物质对机体的生化作用。E-mail:lianyanna2009@sina.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为生物活性物质对机体的生化作用。E-mail:gaolip62@163.com
