ε-聚赖氨酸与羧甲基纤维素钠的相互作用
2016-11-14冯李院关郁芳颜才植叶发银赵国华
冯李院,关郁芳,颜才植,叶发银,3,赵国华,3,
(1.西南大学食品科学学院,重庆 400715;2.贵州省农业科学院 贵州生物技术研究所,贵州 贵阳 550006;3.重庆市特色食品工程技术研究中心,重庆 400715)
ε-聚赖氨酸与羧甲基纤维素钠的相互作用
冯李院1,关郁芳2,颜才植1,叶发银1,3,赵国华1,3,*
(1.西南大学食品科学学院,重庆 400715;2.贵州省农业科学院 贵州生物技术研究所,贵州 贵阳 550006;3.重庆市特色食品工程技术研究中心,重庆 400715)
以ε-聚赖氨酸(ε-polylysine,ε-PL)与羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)相互作用体系的混浊度、Zeta电位和粒度为指标,研究了CMC-Na的取代度(degree of substitution,DS)和相对分子质量对ε-PL/CMC-Na相互作用体系的影响。结果表明,在pH 4.0时,ε-PL与CMC-Na之间的静电相互作用主要依赖于ε-PL氨基与CMC-Na羧基的物质的量比;同时,CMC-Na的取代度和相对分子质量均对ε-PL/CMC-Na相互作用具有显著影响,且CMC-Na取代度对体系稳定性的影响更大。
ε-聚赖氨酸;羧甲基纤维素钠;Zeta电位;取代度
ε-聚赖氨酸(ε-polylysine,ε-PL)是赖氨酸的直链状聚合物,是由赖氨酸通过其ε-氨基和α-羧基酰胺化形成的具有抑菌功效的寡肽。ε-PL属阳离子型聚电解质,呈淡黄色粉末状、稍有苦涩味、吸湿性强,早在20世纪80年代就已经应用于食品工业。研究发现,ε-PL具有抑菌谱广、安全性高、水溶性好和热稳定性好等优点[1]。羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)属阴离子型聚合物,呈白色或微黄色粉末、粒状或纤维状固体,且无臭、无味、无毒,能吸水膨胀,在水中可溶胀形成透明的黏稠胶液,水悬液pH值在6.5~8.5之间[2]。CMC-Na中羧基的pKa值为4.0,它对CMC-Na的理化性质有着重要影响[3]。CMC-Na是具有增稠、悬浮、乳化、稳定、成膜等多种功能的食品添加剂[4]。由于ε-PL含有游离氨基,当其溶液的pH值小于其氨基的pKa值(9.0)时便荷带正电荷。这一特性决定了它能与食品中的荷负电荷物质(如CMC-Na)产生静电相互作用。ε-PL主要是通过其吸附在细菌表面而发挥抗菌性,而当其与食品中的荷负电荷物质发生相互作用时便会影响其在细菌表面的吸附,从而使其抗菌性受到影响[5-9]。
以前的研究表明在食品体系中,阴离子型聚合物能与阳离子型聚合物发生静电相互作用而形成复合物,且复合物的状态(溶解或沉淀)与复合体系中阳离子/阴离子物质的量比、pH值以及聚合物的结构(如取代度(degree of substitution,DS)和相对分子质量(relative molecular weight,Mr))等有关[10]。ε-PL与果胶[11-12]、卡拉胶[13]、阿拉伯胶[14]等阴离子型聚合物之间的相互作用已得到系统研究。这些相互作用都属于静电相互作用,且作用强度主要取决于体系中的阳离子/阴离子对的数量[15-16]。但有关ε-PL与CMC-Na的相互作用未见研究报道。本研究拟在pH 4.0及不同氨基/羧基物质的量比(n氨基/n羧基)条件下,研究CMC-Na的DS和相对分子质量对ε-PL和CMC-Na相互作用体系的混浊度、Zeta电位和粒度的影响,从而为在含有CMC-Na的液态食品体系中ε-PL的合理使用奠定基础。
1 材料与方法
1.1 材料与试剂
ε-PL(纯度99%) 郑州拜纳佛生物工程股份有限公司;CMC-Na(纯度94%,分别为DS=0.7,Mr= 25 000;DS=0.7,Mr=90 000;DS=1.2,Mr=90 000)阿拉丁试剂有限公司。
1.2 仪器与设备
电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;电子天平 北京赛多利斯仪器系统有限公司;HH-2恒温水浴锅 金坛市富华仪器有限公司;Zetasizer Nano-ZS90纳米粒径电位分析仪 英国马尔文仪器有限公司;UV-2450紫外分光光度计 日本岛津公司;XW-80A漩涡振荡器 上海精科实业有限公司。
1.3 方法
1.3.1 ε-PL/CMC-Na相互作用体系
配制一定质量浓度的CMC-Na溶液,并将其与0.2 g/L的ε-PL溶液等体积混合,漩涡振荡,即制得具有特定n氨基/n羧基的ε-PL/CMC-Na复合体系。在研究CMC-Na的DS和Mr对ε-PL/CMC-Na复合作用的影响中,采用相同DS=0.7、不同Mr(分别为25 000和90 000)的CMC-Na;同理采用相同Mr=90 000、不同DS(分别为0.7和1.2)的CMC-Na研究其对ε-PL/CMC-Na相互作用体系的影响。
1.3.2 相互作用相关指标的测定
将配制好的复合溶液于室温下放置24 h后,用蒸馏水作为对照,以UV-2450紫外分光光度计在600 nm波长处测定的吸光度表示为ε-PL/CMC-Na复合体系的混浊度;体系中复合粒子的Zeta电位和粒度的测定均采用Zetasizer Nano-ZS90纳米粒径电位分析仪进行分析[17],测试条件为:氩离子激光器,波长670 nm,温度(25f0.1) ℃,动态光散射角度为90。。
1.4 数据分析
2 结果与分析
2.1 ε-PL/CMC-Na相互作用对n氨基/n羧基的依赖性
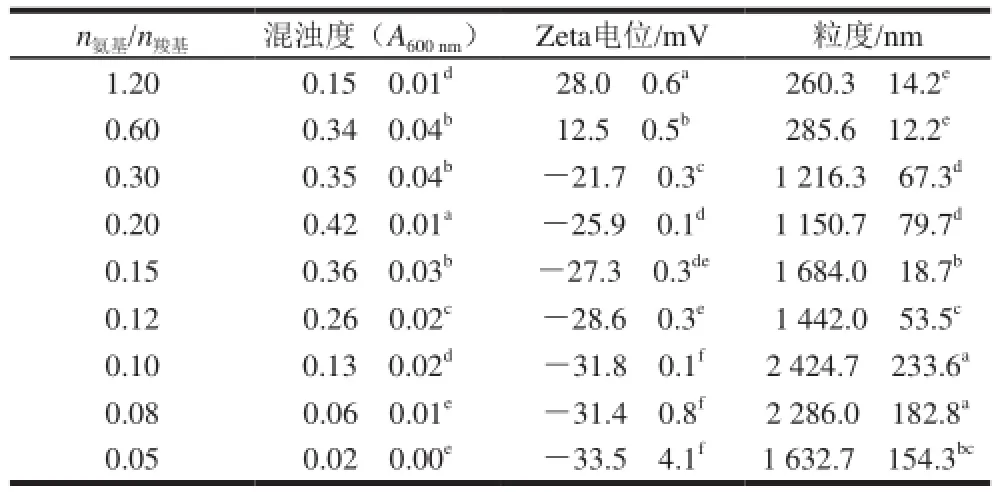
表1 n氨基/n羧基对复合溶液混浊度、Zeta电位和粒度的影响Table 1 Effect of molar ratio of amino groups to carboxyl groups on the turbidity,ζ-potential and particle size of complex solution
由表1可知,n氨基/n羧基对ε-PL/CMC-Na复合溶液的混浊度、复合物的Zeta电位和粒度具有显著性影响。首先,在较低的n氨基/n羧基范围内(0.05~0.20),随着n氨基/n羧基的增加,复合体系的混浊度呈增大趋势,说明ε-PL与CMC-Na发生相互作用并形成了复合物颗粒;当n氨基/n羧基达到0.30时,复合溶液则出现少许沉淀,说明生成了不溶性的ε-PL/CMC-Na复合物颗粒而最终集聚形成沉淀;但当n氨基/n羧基进一步增大(≥0.60)时,体系的混浊度却呈下降趋势,这可能是过高的n氨基/n羧基使复合物的Zeta电位增加,颗粒之间斥力增强,颗粒趋于分散的结果。
对存在于液体中的粒子而言,其Zeta电位愈高,颗粒的分散稳定性越好。一般认为,颗粒的Zeta电位的绝对值大于20 mV是其稳定悬浮稳定的有利条件[18]。由表1可知,在较低n氨基/n羧基范围内(0.05~0.30),复合物粒子带负电荷;而当n氨基/n羧基≥0.60时,复合物粒子带正电荷。由此可见,较低或较高的n氨基/n羧基都有利于形成稳定的ε-PL/CMC-Na复合体系,而n氨基/n羧基在中等水平时,复合体系的稳定性最差。同时,当n氨基/n羧基≤0.30时,复合物的平均粒度都明显大于n氨基/n羧基为0.60和1.20时的。这可能是两方面共同作用的结果:1)在低n氨基/n羧基时,CMC-Na的浓度很大,体系黏度高,一旦与ε-PL接触易形成大颗粒的复合物;2)复合过程是在pH 4.0时进行的,此条件下ε-PL氨基的解离度明显高于CMC-Na羧基的解离度,这导致颗粒之间的斥力更强,受此作用颗粒压紧收缩而体积大幅度减小。
2.2 CMC-Na取代度对ε-PL/CMC-Na相互作用的影响
2.2.1 CMC-Na取代度对ε-PL/CMC-Na体系混浊度的影响
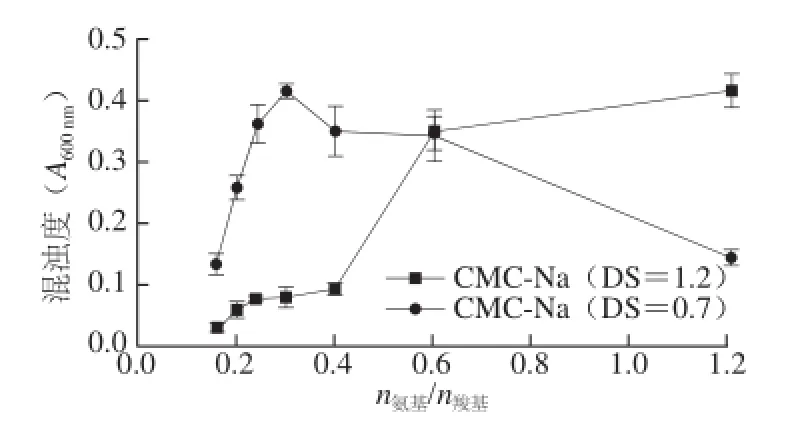
图1 CMC-Na取代度对ε-PL/CMC-Na体系混浊度的影响Fig.1 Effect of DS of CMC-Na on the turbidity of ε-PL/CMC solution
由图1可知,CMC-Na的DS对ε-PL/CMC-Na体系有显著的影响。与之前一样,DS为0.7的CMC-Na与ε-PL相互作用体系的混浊度先随n氨基/n羧基的增加而增加;而后随n氨基/n羧基的增加而降低;复合体系经历混浊、部分颗粒聚集沉淀和逐渐澄清3 个阶段。与此不同,在本实验的n氨基/n羧基范围内,DS为1.2的CMC-Na与ε-PL相互作用体系的混浊度随n氨基/n羧基的增加一直呈上升趋势。这说明ε-PL/CMC-Na复合体系的混浊度与CMC-Na的特性和结构有关[19]。究其原因,主要是当CMC-Na的DS增大时,在相同n氨基/n羧基下,体系中CMC-Na的浓度会变低,这可能直接降低了体系的黏度和体系中粒子的数目,使体系中粒子不易聚集而沉淀[20-21]。
2.2.2 CMC-Na取代度对ε-PL/CMC-Na复合物Zeta电位的影响
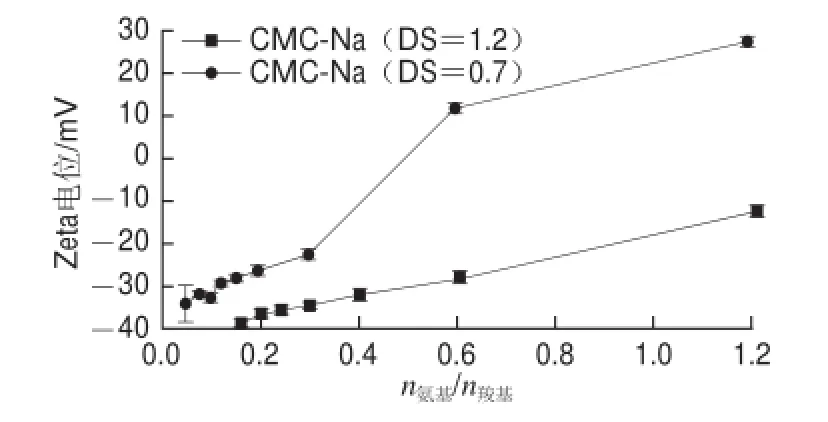
图2 CMC-Na取代度对ε-PL/CMC-Na体系复合粒子Zeta电位的影响Fig.2 Effect of DS of CMC-Na on the Zeta-potential of particles in ε-PL/CMC-Na solution
图2 为CMC-Na取代度对ε-PL/CMC-Na复合粒子Zeta电位的影响。DS为0.7和1.2的CMC-Na与ε-PL的复合粒子的Zeta电位都随n氨基/n羧基的增大而呈上升趋势。但DS为0.7的CMC-Na与ε-PL的复合粒子Zeta电位随n氨基/n羧基上升的速率比DS为1.2的CMC-Na与ε-PL的复合粒子要快。这说明在相同n氨基/n羧基时,低取代度的CMC-Na(DS=0.7)比高取代度的CMC-Na(DS=1.2)更容易与ε-PL发生相互作用而形成复合粒子。
2.2.3 CMC-Na取代度对ε-PL/CMC-Na复合物粒度的影响
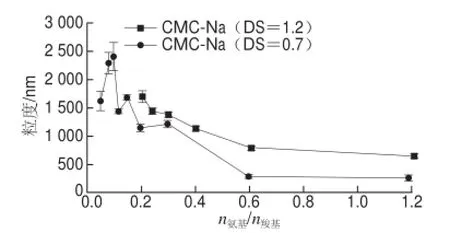
图3 CMC-Na取代度对ε-PL/CMC-Na体系复合粒子粒度的影响Fig.3 Effect of DS of CMC-Na on the size of particles in ε-PL/CMC-Na solution
由图3可知,在较低的n氨基/n羧基范围内,高取代度的CMC-Na(DS=1.2)与ε-PL形成复合粒子的平均粒径波动非常大,而高取代度的CMC-Na(DS=1.2)与ε-PL形成复合粒子的平均粒径随时间的变化波动更为剧烈,甚至无法获得可信赖的数据。但在n氨基/n羧基为0.20~1.20的范围内,ε-PL/CMC-Na体系的粒径趋于平稳,且随n氨基/n羧基的增加而呈下降趋势。但在相同n氨基/n羧基时,取代度小的CMC-Na(DS=0.7)形成的粒子比取代度高的CMC-Na(DS=1.2)具有更小的平均粒径。
2.3 CMC-Na相对分子质量对ε-PL/CMC-Na相互作用的影响
2.3.1 CMC-Na相对分子质量对ε-PL/CMC-Na体系混浊度的影响
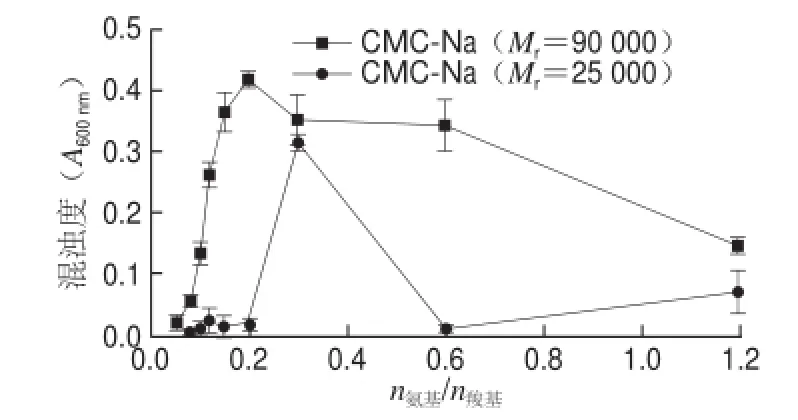
图4 CMC-Na相对分子质量对ε-PL/CMC-Na体系混浊度的影响Fig.4 Effect of molecular weight of CMC-Na on the turbidity of ε-PL/CMC-Na solution
由图4可知,不同Mr的CMC-Na与ε-PL复合体系的混浊度随n氨基/n羧基的变化趋势不尽相同。高Mr的CMC-Na(Mr=90 000)体系的混浊度随n氨基/n羧基呈先增加(0.05~0.20范围)后降低(0.20~1.20范围)的趋势。对于低Mr的CMC-Na(Mr=25 000)的体系,其混浊度在n氨基/n羧基=0.05~0.20范围内维持的非常低,基本为透明溶液;在此后的n氨基/n羧基区间(0.2~0.6)内呈急剧上升紧接着急剧下降的趋势。
2.3.2 CMC-Na相对分子质量对ε-PL/CMC-Na复合物Zeta电位的影响
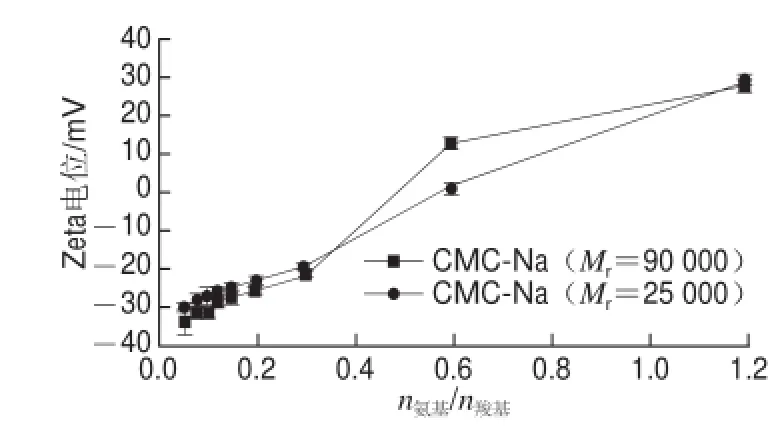
图5 CMC-Na相对分子质量对ε-PL/CMC-Na复合粒子Zeta电位的影响Fig.5 Effect of molecular weight of CMC-Na on the Zeta-potential of particles in ε-PL/CMC-Na solution
由图5可知,不同Mr的CMC-Na与ε-PL的复合体系中粒子Zeta电位随n氨基/n羧基的增加都呈上升趋势。两条曲线极近重叠,说明在相同n氨基/n羧基时,CMC-Na的Mr对其与ε-PL形成的复合粒子的Zeta电位影响不显著。
2.3.3 CMC-Na相对分子质量对ε-PL/CMC-Na复合物粒度的影响
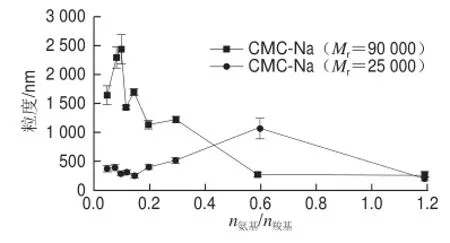
图6 CMC-Na相对分子质量对ε-PL/CMC-Na体系复合粒子粒度的影响Fig.6 Effect of molecular weight of CMC-Na on the size of particles in ε-PL/CMC-Na solution
如图6所示,CMC-Na的Mr对其与ε-PL形成的复合粒子的粒径有显著影响。当n氨基/n羧基小于0.2时,ε-PL与具有高Mr的CMC-Na形成的复合粒子明显比与低Mr的CMC-Na形成的大。同时也发现在n氨基/n羧基范围内,ε-PL与高Mr的CMC-Na形成的复合粒子的粒径变化大,测定结果误差较大,说明体系中粒子动态变化幅度大,稳定性差。相比之下,ε-PL与低Mr的CMC-Na形成的复合粒子的粒径在此n氨基/n羧基范围内都保持在一个较小的水平上(约300 nm),且保持稳定。在随后的n氨基/n羧基范围内(0.20~1.20),高Mr的CMC-Na与ε-PL形成的复合粒子的粒径随n氨基/n羧基增大呈持续下降趋势,而低Mr的 CMC-Na与ε-PL形成的粒子的粒径随n氨基/n羧基增大呈现先增大后减小的趋势。
3 结 论
阳离子型聚合物ε-PL与阴离子型聚合物CMC-Na在pH 4.0的水溶液中能发生静电相互作用,并且ε-PL/CMC-Na复合体系的混浊度、Zeta电位和粒度主要依赖于体系中ε-PL氨基和CMC-Na羧基的物质的量比(n氨基/n羧基)。同时,CMC-Na的取代度和相对分子质量对二者相互作用有显著影响,且总体来看取代度对体系稳定性的影响更大。从实际应用前景来看,本研究结果能为以CMC-Na为稳定剂或乳化剂的液态食品体系(如软饮料、茶饮料和果蔬饮料等)中合理使用ε-PL作为防腐剂提供理论支撑。即通过控制食品体系中ε-PL与CMC-Na的相互作用,既能有效发挥ε-PL的抗菌性又能使食品体系保持良好的外观和品质。
[1] TAKEHARA M, HIBINO A, SAIMURA M, et al. High-yield production of short chain length poly(ε-L-lysine) consisting of 5-20 residues by Streptomyces aureofaciens, and its antimicrobial activity[J]. Biotechnology Letters, 2010, 32(9): 1299-1303. DOI:10.1007/s10529-010-0294-9.
[2] 李静, 杜柏桥, 黄龙, 等. 羧甲基纤维素钠溶液的流变性质及其在酸性乳饮料中的应用[J]. 食品科学, 2007, 28(11): 56-59. DOI:10.3321/j.issn:1002-6630.2007.11.007.
[3] BOUCHARD D C, LAVY T L. Hexazinone adsorptiondesorption studies with soil and organic adsorbents[J]. Environmental Quality, 1985, 14(2): 181-186. DOI:10.2134/ jeq1985.00472425001400020006x.
[4] BAYARRI S, GONZÁLEZ-TOMÁS L, COSTEL E. Viscoelastic properties of aqueous and milk systems with carboxymethyl cellulose[J]. Food Hydrocolloids, 2009, 23(2): 441-450. DOI:10.1016/ j.foodhyd.2008.02.002.
[5] ZINOVIADOU K G, KOUTSOUMANIS K P, BILIADERIS C G, et al. Physical and thermo-mechanical properties of whey protein isolate films containing antimicrobials, and their effect against spoilage flora of fresh beef[J]. Food Hydrocolloids, 2010, 24(1): 49-59. DOI:10.1016/j.foodhyd.2009.08.003.
[6] YU H, LI J, SHI K, et al. Structure of modified ε-polylysine micelles and their application in improving cellular antioxidant activity of curcuminoids[J]. Food & Function, 2011, 2(7): 373-380. DOI:10.1039/ C1FO10053J.
[7] YOSHIDA T, NAGASAWA T. ε-Poly-L-lysine: microbial production, biodegradation and application potential[J]. Appled Microbiology Biotechnology, 2003, 62(1): 21-26. DOI:10.1007/s00253-003-1312-9.
[8] SHIH I, SHEN M, VAN Y, et al. Microbial synthesis of poly (ε-lysine) and its various applications[J]. Bioresource Technology, 2006, 97(9): 1148-1159. DOI:10.1016/j.biortech.2004.08.012.
[9] SHUKLA S C, SINGH A, PANDEY A K, et al. Review on production and medical applications of ε-polylysine[J]. Biochemical Engineering Journal, 2012, 65: 70-81. DOI:10.1016/j.bej.2012.04.001.
[10] CHANG Y H, McLANDSBOROUGH L, McCLEMENTS D J, et al. Interactions of a cationic antimicrobial (ε-polylysine) with an anionic biopolymer (pectin): an isothermal titration calorimetry, microelectrophoresis, and turbidity study[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5579-5588. DOI:10.1021/ jf104299q.
[11] CHANG Y, LYNNE M, McCLEMENTS D J, et al. Cationic antimicrobial (ε-polylysine)-anionic polysaccharide (pectin) interactions: influence of polymer charge on physical stability and antimicrobial efficacy[J]. Journal of Agricultural and Food Chemistry,2012, 60(7): 1837-1844. DOI:10.1021/jf204384s.
[12] CHANG Y, McLANDSBOROUGH L, McCLEMENTS D J, et al. Physicochemical properties and antimicrobial efficacy of electrostatic complexes based on cationic ε-polylysine and anionic pectin[J]. Journal of Agricultural and Food Chemistry, 2011, 59(12): 6776-6782. DOI:10.1021/jf201162g.
[13] GIROD S, BOISSIERE M, LONGCHAMBON K, et al. Polyelectrolyte complex formation between iota-carrageenan and poly(L-lysine) in dilute aqueous solutions: a spectroscopic and conformational study[J]. Carbohydrate Polymers, 2004, 55(1): 37-45. DOI:10.1016/j.carbpol.2003.07.006.
[14] CHANG Y, McLANDSBOROUGH L, McCLEMENTS D J, et al. Antimicrobial delivery systems based on electrostatic complexes of cationic ε-polylysine and anionic gum arabic[J]. Food Hydrocolloids, 2014, 35: 137-143. DOI:10.1016/j.foodhyd.2013.05.004.
[15] QIU H Y, HE L M. Synthesis and properties study of carboxymethyl cassava starch[J]. Polymers for Advanced Technologies, 1999, 10(7): 468-472. DOI:10.1002/(SICI)1099-1581(199907)10:7<468::AIDPAT898>3.0.CO;2-W.
[16] SPYCHAJ T, WILPISZEWSKA K, ZDANOWICZ M, et al. Medium and high substituted carboxymethyl starch: synthesis, characterization and application[J]. Starch-Stärke, 2013, 65(1/2): 22-33. DOI:10.1002/star.201200159.
[17] ASKER D, WEISS J, McCLEMENTS D J, et al. Analysis of the interactions of a cationic surfactant (lauric arginate) with an anionic biopolymer (pectin): isothermal titration calorimetry, light scattering, and microelectrophoresis[J]. Langmuir, 2008, 25(1): 116-122. DOI:10.1021/la803038w.
[18] JACOBS C, MÜLLER R H. Production and characterization of a budesonide nanosuspension for pulmonary administration[J]. Pharmaceutical Research, 2002, 19(2): 189-194. DOI:10.1023/ A:1014276917363.
[19] TURGEON S L, SCHMITT C, SANCHEZ C, et al. Proteinpolysaccharide complexes and coacervates[J]. Current Opinion Colloid and Interface Science, 2007, 12(4/5): 166-178. DOI:10.1016/ j.cocis.2007.07.007.
[20] KITTIPONGPATANA O S, SIRITHUNYALUG J, LAENGER R, et al. Preparation and physicochemical properties of sodium carboxymethyl mungbean starches[J]. Carbohydrate Polymers, 2006, 63(1): 105-112. DOI:10.1016/j.carbpol.2005.08.024.
[21] BERT V, FRITZ L, WALDEMAR L, et al. Highly substituted carboxymethyl starch[J]. Starch-Stärke, 2004, 56(7): 307-314. DOI: 10.1002/star.200300266.
Interaction between Sodium Carboxymethyl Cellulose and ε-Polylysine
FENG Liyuan1, GUAN Yufang2, YAN Caizhi1, YE Fayin1,3, ZHAO Guohua1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Guizhou Institute of Biotechnology, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China; 3. Chongqing Engineering Research Center of Regional Food, Chongqing 400715, China)
The interaction between food ingredients is one of the research focuses in food science. ε-Polylysine (ε-PL), as a food additive, is a cationic polyelectrolyte with excellent antimicrobial properties, and it can interact with anionic polymers such as sodium carboxymethylcellulose (CMC-Na) to affect its antimicrobial properties and the stability of related food systems. In this study, the effects of degree of substitution (DS) and molecular weight of CMC-Na on the interaction between ε-PL and CMC-Na as indicated by turbidity, Zeta potential and particle size were investigated. Results revealed that the electrostatic interaction between ε-PL and CMC-Na mainly depended on the molar ratio of cationic amino groups in ε-PL to carboxyl anion groups in CMC-Na. In addition, both DS and molecular weight of CMC-Na exerted a serious impact on the interaction between ε-PL and CMC-Na and the effect of DS was more significant.
ε-polylysine; sodium carboxymethylcellulose; Zeta potential; degree of substitution
10.7506/spkx1002-6630-201607001
TS202.3
A
1002-6630(2016)07-0001-05
冯李院, 关郁芳, 颜才植, 等. ε-聚赖氨酸与羧甲基纤维素钠的相互作用[J]. 食品科学, 2016, 37(7): 1-5. DOI:10.7506/ spkx1002-6630-201607001. http://www.spkx.net.cn
FENG Liyuan, GUAN Yufang, YAN Caizhi, et al. Interaction between sodium carboxymethyl cellulose and ε-polylysine[J]. Food Science, 2016, 37(7): 1-5. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607001. http://www.spkx.net.cn
2015-05-30
国家自然科学基金面上项目(31371737);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
冯李院(1992—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:fengliyuan2009@163.com
*通信作者:赵国华(1971—),男,教授,博士,研究方向为碳水化合物化学与营养。E-mail:zhaoguohua1971@163.com
