丝状真菌液体深层发酵菌丝体形态控制研究进展
2016-11-14蒋雪薇许延涛罗晓明
蒋雪薇 李 浩 杨 琛 许延涛 罗晓明
(长沙理工大学化学与生物工程学院, 湖南 长沙 410114)
丝状真菌液体深层发酵菌丝体形态控制研究进展
蒋雪薇 李 浩 杨 琛 许延涛 罗晓明
(长沙理工大学化学与生物工程学院, 湖南 长沙 410114)
丝状真菌广泛用于工业发酵生产中,其菌丝体形态与发酵液粘度、目的产物产量有着密切关系,是发酵过程控制的关键因素之一。文章综述了丝状真菌液体深层发酵中菌丝体的形态特征及其分析与表征方法、菌丝球形成机理及菌丝体形态控制对发酵影响的研究进展,指出量化描述丝状真菌的生长是精确控制发酵过程的基础。
丝状真菌;液体深层发酵;菌丝体形态控制
丝状真菌在医药、食品、农业以及环保等发酵工业上应用十分广泛,是工业大宗发酵产品的主要贡献者之一,其可以生产许多具有重要经济价值的代谢产物,如抗生素、有机酸、酶制剂等,具有巨大的工业和社会价值[1-2]。丝状真菌在液体深层发酵中,菌丝体形态特征及菌丝体生理特性是重要参数,这些参数的变化会对发酵产物的积累产生较大的影响,其中菌丝体形态的变化主要是通过影响发酵液粘度为主的流变学参数来影响发酵产物的积累[3]。发酵液流变学特性的变化会导致发酵过程中传质效果变化,致使营养物质、氧等底物的吸收及产物的生成发生变化,从而导致代谢途径发生改变,甚至产生有害的副产物,最终影响到目标产物的产率[4-5]。另外,菌丝体的形态还会对下游提取工艺产生影响,从而影响到产物提取收率[6-7]。可以说,丝状真菌液体深层发酵中,菌丝体形态控制是目标产物收获量控制的关键之一[8-9]。
1 丝状真菌液体深层发酵菌丝体的形态特征及菌丝球形成机理
1.1 形态特征
摇瓶发酵中,由于丝状真菌的生长条件受到人为调控,其菌丝体形态会随培养基组成、培养条件等的不同而出现不同形态,可能出现无分支的菌丝、有分支且结构复杂的菌丝、菌丝团块、菌丝球等形态,表现出不同大小、密度及表面结构[10-11];此外,随时间变化,不同生长时期的菌丝体内部结构也会发生改变。因此,丝状真菌在液体深层发酵中菌丝体通常呈现出絮状、团状和球状3种形态(图1)[12]。不同的菌丝体形态其产物也会产生变化,可以说,丝状真菌目标产物的获得常常要有有利于产物形成的最佳菌丝体形态[13],如分散的菌丝体有利于淀粉酶、糖化酶的产生,而菌丝球则有利于丝状真菌进行深层发酵产抗生素、有机酸及酶制剂等[9,14]。
菌丝体形态对发酵液的粘度影响较大。在大多数发酵生产中,丝状真菌菌丝若形成絮状的菌丝体,会造成发酵液粘度增大,不利于营养物质和氧气的溶解、传递及分布,从而降低好氧发酵产物的产量,严重时甚至会导致产物产率极低[15]。若菌丝体形态为过于紧密的团块状,在团块内部,营养物质及氧气传递受阻,会导致内部出现营养匮乏及缺氧状态,影响菌丝体生长及产物合成,有时还会造成团块内部菌丝体发生自溶现象[16]。液体深层发酵的孢子萌发出菌丝及菌丝延长的过程中,在孢子聚集及搅拌等机械力作用下,发酵液中的菌丝还可以形成大小适中的菌丝球,此时发酵液的传质效果好,菌丝体生长旺盛,目标代谢产物合成效率高。可以说,菌丝体形态是工业发酵中获得目标产物产量最大化的重要影响因素[17-18]。
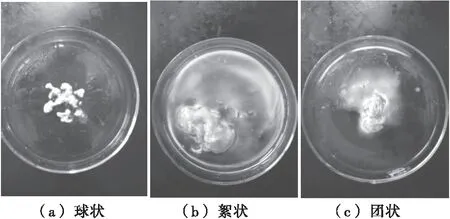
图1 丝状真菌液体深层发酵中菌丝体的不同形态
Figure 1 The different mycelial morphologyof filamentous fungi in submerged fermentation
1.2 菌丝球的形成机理
丝状真菌菌丝体在液体深层发酵中形成不同形态,既与发酵环境作用有关,也跟菌丝体自身某些生理活动有联系[19-20]。虽然菌丝球形成的条件有很多,但其成球的类型一般有两种,即孢子聚集型和菌丝体聚集型[21-22]。Lin等[23]采用PARSIVAL软件拟合黑曲霉胞子聚集后萌发成球的两个阶段,发现黑曲霉菌丝成球不仅与孢子聚集有关,而且还和菌丝生长蔓延关系密切,而菌丝球又可以分为表面光滑型和粗糙型,这与其所处的环境是相关的。Li等[24]研究表明,在搅拌剪切力的作用下菌丝球继续生长时,需经受住更强的环境外力,此时菌丝球会变得光滑、致密、酶活降低,这可能是其通过改变自身的形态结构以适应环境条件。综合而言,菌丝球形成的主要影响因素有孢子聚集、菌丝蔓延速率及程度、机械搅拌作用等。
2 丝状真菌菌丝体形态分析与表征方法
2.1 菌丝体形态的分析方法
丝状真菌菌丝体形态特征最常见的分析方法有直接观测法、图像分析法等。直接观测法是最为原始也最为基本的形态分析研究手段,分为肉眼观察与显微镜观测两种,显微镜观测是研究微生物微观形貌特征最常用的方式。这些传统的分析观测手段更多的是凭直观、凭经验,得到的观测数据不仅少,其准确性也有待提升,不利于形成较为精确的量化数据。
图像分析法是20世纪80年代引入的一种新的分析方法,其基本步骤有:显微图像拍摄、显微图像分区、目标定位、检测与分析等[18]。图像分析方法最初属于半自动化方法,倘若菌丝拥有不短的分枝长度,则结果会更为准确,但它却不适合对菌丝团体进行观测分析,并且基本需要人工较为繁琐的操作[25]。而全自动化方法可以测算出菌丝体的大多数形态参数,但还是需要对菌丝体轮廓进行人为的标定[26]。由于检测方法的单一性,难以对所有菌丝体形态进行很好地测算,菌丝聚集团体的分析就更为少见。Reichi等[27]通过图像分析表征了链霉菌属S.tendae菌丝体在液体深层发酵培养过程中菌丝球的大小、含量以及形态特征;Treskatis等[28]运用在线数字图像分析和模型识别系统方法,描述了液体深层发酵过程中丝状微生物的形态特性。
2.2 菌丝体形态的表征方法
发酵过程中,丝状真菌菌丝的生长蔓延是以其尖端生长的形式进行的。蔓延后的丝状真菌形态各不相同,既有单细胞结构,又有多细胞结构,其生长方式异常复杂,故菌丝体形态难以准确表征。近些年,有学者[14,29]通过选取不同的参数,对不同类型的菌丝体形态进行量化描述,取得了一些进展。
随着显微图像分析技术的进步,通过合理选取适当的参数,借助图像分析软件对菌体的特征进行测量分析,得到大量的量化数据,推动了液体深层发酵中菌丝体形态学研究的进步。借助图像分析系统,目前可用于描述菌丝体形态学特征的参数有菌丝长度、菌丝体面积、周长、紧密度、分枝频率等,其中菌丝球可以选用直径、长轴、短轴、周长、面积以及面积比等作为量化描述的参数。已报道的定量描述丝状真菌形态的参数及量化程度见表1[30-33]。
3 丝状真菌液体深层发酵菌丝体形态对发酵的影响
丝状真菌可用于许多产物的发酵法生产中。发酵过程中由于条件的变化,会使菌丝体形态发生变化,从而导致发酵液中营养物质传递以及溶氧值发生较大变化,发酵生产能力也因此发生较大的差异,故菌丝体形态变化是大规模工业发酵生产最值得关注的因素之一。
3.1 菌丝体形态对发酵液流变学特性的影响
丝状真菌的发酵液中存在大量菌丝体,菌丝体在摇瓶振荡或发酵罐中搅拌桨叶的搅拌作用下相互缠绕,会使发酵液变得粘稠,影响传质,不利于大规模的工业生产[34]。目前,许多丝状真菌的发酵过程中均采用菌丝球发酵生产目标产物,以降低发酵液的粘度,L-乳酸生产就是其中之一[35]。根据颗粒悬浮液理论,菌丝球内部都包含有一定体积的流体,称之为排出体积,其大小对菌丝球的柔性和结构参数有较大影响,可以认为菌丝球是具有一定柔性的球型颗粒[36-37]。菌丝球这种柔性颗粒的大小直接影响了发酵液的传质,在发酵过程中,适宜大小的菌丝球有利于传质,有研究[38]证明,L-乳酸发酵中菌丝在玉米芯固定化发酵能形成0.5~5.0 mm的菌丝球,此时L-乳酸积累最大。这是因为菌丝球所占发酵液内体积比较小,而且呈颗粒状不会向四周散漫开,这样发酵液的粘度相较于絮状或团块状等形态情况下不会大幅度提升。一方面,菌丝体自身形态会影响发酵液的流变学特性,而另一方面,菌丝体各种形态的形成也是由不同发酵环境作用的结果。除孢子聚集、菌丝蔓延速率及程度、机械搅拌作用等主要因素影响丝状真菌菌丝体形态,从而影响发酵液流变学特性外,微生物在发酵过程中产生的其它各种副产物,也会对发酵液性质变化起到作用[39]。
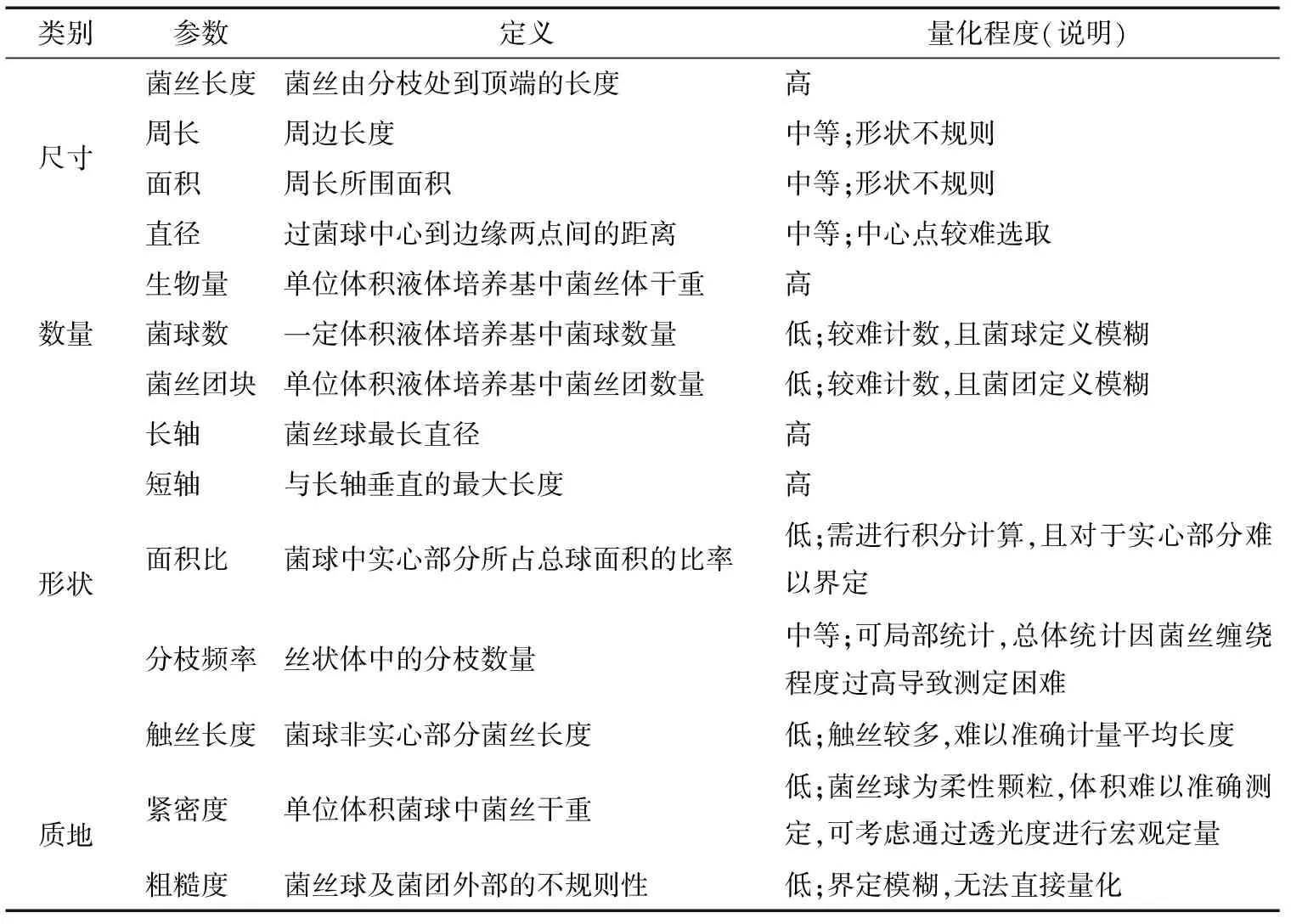
表1 图像分析中的菌丝体形态参数及其量化程度
3.2 菌丝体形态对发酵产物积累的影响
不同的丝状真菌菌丝体形态在液体深层发酵中对产物的累积会产生很大的影响。Yu等[40]在氨浓度为0.1 g/L以上的培养基中利用米根霉成絮状形态进行培养,pH保持在4.4左右,首批生产乳酸含量达到109 g/L,糖酸转化率达87%。蒋雪薇等[41]在米根霉发酵产L-乳酸中添加表面活性剂吐温-80使菌丝成球,优化发酵条件后发现,在吐温-80用量0.5 g/L、摇瓶转速200 r/min、接种量7%、(NH4)2SO4质量浓度4 g/L时,菌丝球数量达115 mL-1,球体平均直径为1.2 mm,乳酸产量达78.9 g/L。赵龙等[38]进一步探究了以玉米芯为载体固定米根霉发酵L-乳酸的工艺条件,结果表明,玉米芯与葡萄糖质量为1∶4时米根霉形成直径为0.5~1.0 mm菌丝球,此时葡萄糖对L-乳酸的转化率高达82.5%,其产酸达到34.68 g/L。Jun Yang等[42]通过海洋真菌Curvulariasp.IFB-Z10的菌丝体形态的控制来对其产杀菌生物碱性能进行改进,在加入200目的滑石粉(5 g/L)后发现,菌丝球直径大幅度减少,而目标产物的产量增长到33.05 mg/L,为对照组的1.9倍。这说明,相同菌丝体形态下不同的形态参数如菌丝球大小、菌球密度等对产物积累影响极大。
4 总结与展望
综上所述,丝状真菌会根据环境而呈现不同的菌丝体形态,而这一形态主要通过影响发酵液的流变特性来影响产物的合成和提取。菌丝体呈球状时发酵液粘度低,有利于传质,是大多数工业发酵提高产量的优选形态。然而,目前已有的关于丝状真菌菌丝形态的研究报道,大多数只针对培养基pH与成分、接种孢子、搅拌速率等外在环境因素对菌丝球形态的影响开展研究,对于菌丝成球深层次上的机理研究较少。随着计算机及显微图像分析技术的进步,借助这些手段,结合微生物内在的生理因素研究,能更科学地对丝状真菌的生长过程进行量化描述,实现液体深层培养环境中菌丝生长及其形态的数学表达,为丝状真菌工业化生产过程控制提供更多的控制参数及更为精确的控制方法。
[1] MEYER V, WU Bo, RAM ARTHUR F J.Aspergillusas a multipurpose cell factory: current status and perpectives[J]. Biotechnol Lett, 2011, 33(3): 469-476.
[2] MYER V. Genetic engineering of filamentous fungi-progress, obstacles and future trends[J]. Biotechnol Adv, 2008, 26: 177-185.
[3] WUCHERPFENNIG T, KIEP K A, DRIOUCH H, et al. Chapter 4-morphology and rheology in filamentous cultivations[J]. Advances in Applied Microbiology, 2010, 72: 89-136.
[4] OLSVIK E, KRISTIANSEN B. Rheology of filamentous fermentations[J]. Biotechnology Advances, 1994, 12(1): 1-39.
[5] CALVO A M, WILSON R A, BOK J W, et al. Relationship between secondary metabolism and fungal development[J]. American Society for Microbilogy, 2002, 66(3): 447-459.
[6] PAPAGIANNI M, JOSHI N, MOO-YOUNG M. Comparative studies on extracellular protease secretion and glucoamylase production by free and immobilizedAspergillusnigerculture[J]. Journal of Industrial Microbiology & Biotechnolgy, 2002, 29(5): 259-263.
[7] RINAS U, EL-ENSHASY H, EMMLER M, et al. Model - basedperdiction of substrate conversion and protein synthesis andexcretion in recombinant iopellets[J]. Chem. Eng. Sci., 2005, 60: 2 729-2 739.
[8] WANG L P, RIDGWAY D, GU T Y, et al. Bioprecessing strategies to improve heterologous protein production in filamentous fungal fermentations[J]. Biotechnol Adv, 2005, 23(2): 115-129.[9] METWLLY M. Glucoamylase production in continuous culture ofAspergillusnigerwith special emphasis on growth parameters[J]. Microbilogy & Biotechnolgy, 1998, 14(1): 113-118.
[10] RIMS U, EL-ENSHASY H, EMMLER M, et al. Model-based perdiction of substrate conversion and protein synthesis and excretion in recombinant iopellets[J]. Chem. Eng. Sci., 2005, 60(10): 2 729-2 739.
[11] BARRY D J, CHAN C, WILLIAMS G A. Morphological quantification of filamentous fungal development using membrane immobilization and automatic image analysis. Journal of Industrial Microbiology & Biotechnology, 2009, 36:787.
[12] DU J X, CAO N J, GONG C S, et al. Production ofL-Lactic acid by phizopus oryzae in a bubble column ferm entor[J]. Appl Biochem Biotechnol, 1998, 70(72): 323-329.
[13] VILLENA G K, GUTIÉRREZ-CORREA M. Morphological patterns ofAspetgillusnigerbiofilms and pellets related to lignocellulolytic enzyme productivities[J]. Applied Microbiology, 2007, 45(3): 231-237.
[14] LU Fei, PING Kang-kang, WEN Ling, et al. Enhancing gluconic acid production by controlling the morphology of Aspergillus niger in submerged fermentation[J]. Process Biochemistry, 2015, 50(9): 1 342-1 348.
[15] LIU Yan, LIAO Wei, CHEN Shu-lin. Study of pellet formation of filamentous fungi Rhizopus oryzae using a multiple logistic regression model[J]. Biotechnology and Bioengineering, 2008, 99(1): 117-128.
[16] BRAAKSMA Machtelt, SMILDE Age K, VAN-DER-WERF M J, et al. The effect of environmental conditions on extracellular protease activity in controlled fermentations ofAspergillusniger[J]. Microbilogy, 2009, 155(10): 3 430-3 439.[17] DOMINGUES F C, QUEIROZ J A, CABRAL J M S, et al. The influence of culture conditions on mucelial structure and cellulose production by Trichoderma reesi Rut C-30[J]. Enzyme and Microbial Technology, 2000, 26(5/6): 394-401.
[18] ADAMS H L, THOMAS C R. The use of image analysis for morphological measurements on filamentous microorganisms[J]. Biotechnology and Bioengineering, 1988, 32(5): 707-712.
[19] RILEY G L, TUCKER K G, PAUL G C, et al. Effect of biomass concentration and mycelial morphology on fermentation broth rheology[J]. Biotechnol Bioeng, 2000, 68(2): 160-172.
[20] BRAUN S, VECHT-LIFSHIT Z S E. Mycelial morphology and metabolite production[J]. TIBTECH, 1991, 9(1): 63-68.
[21] WARGENAU A, FLEIßNER André, BOLTEN C J, et al. On the origin of the electrostatic surface potential ofAspergillusnigerspores in acidic environments[J]. Research in Microbiology, 2011,162(10): 1 011-1 017.
[22] METZ B, KOSSEN N W F. The growth of molds in the form of pellets: A literature review[J]. Biotechnol and Bioeng, 1997, 110(6): 781-799.
[23] LIN P J, GRIMM L H, WULKOW M, et al. Population balance modeling of the conidial aggregation ofAspergillusniger[J]. Biotechnology and Bioengineering, 2008, 99(2): 341-350.
[24] LI Z J, SHUKLA V, FORDYCE A P, et al. Fungal morphology and fragmentation behavior in a fed-batchAspergillusoryzaefermentation at the production scale[J]. Biotechnol Bioeng, 2000, 70(3): 300-312.
[25] BARRY D J WILLIAMS G A. Microscopic characterization of filamentous microbes: towards fully automated morphological quantification through image analysis[J]. J. Microsc., 2011, 244(1): 1-20.
[26] 唐文俊, 夏建业, 储炬, 等. 黑曲霉发酵过程中菌体形态的分析方法建立及应用[J]. 生物工程学报, 2015(2): 291-299.
[27] REICHL U, KING R, GILLES E D. Characterization of pellet morphology during submerged growth of Streptomyces tendae by image analysis[J]. Biotechnol. and Bioeng., 1992, 39(2): 164-170.
[28] TRESKATIS S K, ORGELDINGER V, WOLF H, et al. Morphological characterization of filamentous microorganisms in submerged cultures by on-line digital image analysis and pattern recognition[J]. Biotechnol. and Bioeng., 1997, 53(2): 191-201.[29] YU L, CHAO Y, WENSEL P, et al. Hydrodynamic and kinetic study of cellulase production by Trichoderma reesei with pellet morphology[J]. Biotechnol Bioeng, 2012, 109(7): 1 755-1 768.
[30] FENG Kuo-ching, ROU Tzyy-min, LIU Bing-lan, et al. Effect of fungal pellet size on the high yield production of destruxin B byMetarhiziumanisopliae[J]. Enzyme and Microbial Technology, 2004, 34(1): 22-25.
[31] ANURADHA K, NAGAPADMA P, VENKATESHWAR S, et al. Effect of physical factors on pellet morphology of Aspergillus awamori MTCC 9166 and polygalacturonase production[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 271-274.[32] LIN P J, SCHOLZ Alexandra, KRULL Rainer. Effect of volumetric power input by aeration and agitation on pellet morphology and product formation ofAspergillusniger[J]. Biochemical Engineering Journal, 2010, 49(2): 213-220.
[35] 赵龙, 蒋雪薇, 盛灿梅, 等. 玉米芯载体固定化米根霉发酵L-乳酸工艺的研究[J]. 食品与机械, 2012, 28(3): 226-229, 239.
[36] FENG Kuo-ching, ROU Tzyy-min, LIU Bing-lan, et al. Effect of fungal pellet size on the high yield production of destruxin B byMetarhiziumanisopliae[J]. Enzyme and Microbial Technology, 2004, 34(1): 22-25.[37] VILLENA G K, GUTIÉRREZ-CORREA M. Morphological patterns ofAspetgillusnigerbiofilms and pellets related to lignocellulolytic enzyme productivities[J]. Applied Microbiology, 2007, 45(3): 231-237.
[38] 赵龙, 蒋雪薇, 边佳为, 等. 玉米芯载体吸附法固定化米根霉发酵L-乳酸的工艺条件[J]. 食品科学, 2013(7): 201-205.
[39] ESPINOSA-ORTIZ E J, RENE E R, PAKSHIRAJAN K, et al. Fungal pelleted reactors in wastewater treatment: Applications and perspectives[J]. Chemical Engineering Journal, 2016, 283: 553-571.
[40] YU Mei-ching, WANG R C, WANG Chung-yih,et al. Enha-nced production of L(+)-lactic acid by floc-form culture of Rhizopus oryzae[J]. Journal of the Chinese Institute of Chemieal Engineers, 2007, 38(3/4): 223-228.
[41] 蒋雪薇, 罗晓明, 盛灿梅, 等. 米根霉L-乳酸发酵菌丝球形成条件的研究[J]. 食品科学, 2010(15): 216-220.
[42] YANG Jun, JIAO Rui-hua, YAOA Ling-yun, et al. Control of fungal morphology for improved production of a novel antimicrobial alkaloid by marine-derived fungus Curvularia sp.IFB-Z10 under submerged fermentation[J]. Process Biochemistry, 2016, 51: 185-194.
Progress in research of mycelial morphology control of filamentous fungiin submerged fermentation
JIANG Xue-weiLIHaoYANGChenXUYan-taoLUOXiao-ming
(CollegeofChemistry&Bioengineering,ChangshaUniversityofScience&Technology,Changsha,Hunan410004,China)
Filamentous fungi are widely used in industrial fermentation. Its mycelial morphology is closely combined with objective product yield and fermented liquid viscosity, and it is one of the key factors in the fermentation process control. In this paper, the research progress was reviewed on the mycelia of filamentous fungi in the submerged fermentation,including its morphological characteristics, the analysis and characterization methods, the mechanism of mycelial pellet formation, and the influence of mycelial morphology control in fermentation. Therefore, the author indicated that quantitative description the growth of filamentous fungi was the foundation of precision control on fermentation process.
filamentous fungi; submerged fermentation; mycelial morphology control
湖南省科技计划项目(编号:2013FJ4036);清远市科技计划项目(编号:2013A024,2014A023)
蒋雪薇,女,长沙理工大学副教授,博士,硕士生导师。
罗晓明(1968—),男,长沙理工大学副教授,硕士。
E-mail:csluoxm@sina.com
2016—05—12
