基于vvhA基因检测创伤弧菌实时荧光PCR方法的建立
2016-11-14徐义刚邱索平高会江高慎阳
徐义刚 邱索平 王 昱 高会江 高慎阳
(1.海南出入境检验检疫局检验检疫技术中心,海南 海口 570311;2. 东北农业大学动医学院,黑龙江 哈尔滨 150001;3. 从化出入境检验检疫局,广东 从化 510900;4. 重庆出入境检验检疫局检验检疫技术中心,重庆 404100;5. 中国农业科学院北京畜牧兽医研究所牛遗传育种研究室,北京 100193;6. 辽宁医学院畜牧兽医学院,辽宁 锦州 121001)
基于vvhA基因检测创伤弧菌实时荧光PCR方法的建立
徐义刚2邱索平3王 昱4高会江5高慎阳6
(1.海南出入境检验检疫局检验检疫技术中心,海南 海口 570311;2. 东北农业大学动医学院,黑龙江 哈尔滨 150001;3. 从化出入境检验检疫局,广东 从化 510900;4. 重庆出入境检验检疫局检验检疫技术中心,重庆 404100;5. 中国农业科学院北京畜牧兽医研究所牛遗传育种研究室,北京 100193;6. 辽宁医学院畜牧兽医学院,辽宁 锦州 121001)
为建立创伤弧菌(VV)的快速检测方法,根据vvhA基因序列设计合成引物和探针,建立实时荧光PCR方法。结果显示:所建立的方法能特异扩增出VV标准阳性菌株,而对其它14种菌株没有扩增;该方法的灵敏度为15 CFU/mL;稳定性和重复性试验结果表明,同一样品重复检测4次Ct 值(循环阈值)的变异系数均小于2%;利用该检测方法对采集的156份样品进行检测,共计检出2份VV阳性样品,与行标法(SN/T 1870—2007)检测结果一致。该检测方法灵敏度高、特异性强,具有良好的实用性。
创伤弧菌;vvhA基因;实时荧光定量PCR
创伤弧菌(vibrio vulnificus,VV)是一种有荚膜的革兰氏阴性菌,广泛分布于蟹、虾、牡蛎等水生动物中,如果人类食用VV污染的食品会引发胃肠炎,严重时还会引发败血症[1-2],病死率高达到50% 以上[3-4],是对人类身体健康危害很严重的一种食源性致病菌。近几年来,中国沿海地区由VV感染引起的人类食物中毒事件频繁发生[5-7]。所以,建立一种能够快速、准确检测VV的方法刻不容缓。
实时荧光PCR方法由于灵敏度、特异性和精准度都比较高,现今已成为病原体检测的重要方法,并且发展迅速,在生命科学研究的各个领域都得到了广泛应用[8]9-11。针对检测靶基因的选择,溶细胞素被认为是VV感染的主要致病因子之一[9],是由结构基因vvhA编码的一种细胞外蛋白质,vvhA基因具有良好的种特异性和保守性[10-11],因此本研究选择vvhA基因作为检测的靶基因,建立检测VV的实时荧光PCR检测方法,并确定反应的最佳条件。为了提高VV的检测效率和检测的准确度,本研究根据VV 的vvhA基因设计合成探针和引物,建立了检测VV的实时荧光PCR方法,并对反应体系进行优化,对方法的特异性、敏感性、稳定性以及重复性进行验证实验,最终建立一种行之有效的检测方法,旨在为快速准确检测VV提供有力的技术支持。与已有的相关报道对比,本研究有针对性的注重了引物和探针的设计,使检测方法的特异性在整体上有所提高。
1 材料与方法
1.1 菌种及临床样品
创伤弧菌、霍乱弧菌、溶藻弧菌、空肠弯曲菌、志贺氏菌和金黄色葡萄球菌等14种常见的致病菌的标准菌株:美国典型菌种保藏中心(ATCC);
沙门氏菌:中国医学微生物菌种保藏管理中心(CMCC);
156份水产品(包括海鱼、鲍鱼、泥螺、虾、蟹、海水、蛏子、蛤蜊等):来自于水产品养殖场和水产品流通市场。
1.2 试剂和仪器
增菌培养基BPW和细菌培养基:北京中科质检生物技术有限公司;
核酸提取试剂盒:北京天根生化科技有限公司;
Taq酶、MgCl2和dNTP:北京合生基因科技有限公司;
实时荧光PCR仪:7500型,美国ABI公司。
1.3 方法
1.3.1 引物和探针设计 根据GenBank中已经发表的VVvvhA基因序列(KC821520.1) 进行引物和探针的设计并且参考吴增辉[8]11-15的研究进行设计。
引物: F: TGTTTATGGTGAGAACGGTGACA
R: TTCTTTATCTAGGCCCCAAACTTG
探针:Fam- CCGTTAACCGAACCACCCGCAA -TAMRA1.3.2 实时荧光PCR反应模板的制备 将15种标准菌株分别接种到5 mL的增菌培养基中进行增菌,在37 ℃下培养12 h,各取1 mL菌液提取细菌基因组DNA,根据试剂盒说明书的步骤进行,核酸提取后放入-20 ℃冰箱保存备用。临床样品的细菌核酸的提取采用煮沸法进行。
1.3.3 反应体系中基本参数的优化 对rTaq酶、Mg2+、dNTPs、引物、探针浓度进行优化。在Mg2+(25 mmol/μL) 用量范围2~5 μL,以每0.5 μL递增;在rTaq酶(5 U/μL) 用量范围0.25~1.00 μL,以每0.25 μL递增;在dNTP (2.5 mmol /μL )用量范围1.0~3.0 μL,以每0.50 μL递增;探针(20 μmol/μL)用量范围0.1~0.5 μL,以每0.1 μL递增;引物(10 pmol/μL)用量范围0.5~1.0 μL,以每0.1 μL递增;每个参数的用量重复3次,最后计算出Ct平均值,确定这5个反应参数的最佳用量。
1.3.4 特异性检测试验 采用试剂盒法提取1.1.1节中菌株的核酸作为模板,进行实时荧光PCR 扩增,评价试验检测的特异性。
1.3.5 敏感性检测试验 10倍梯度稀释菌液并且按核酸提取试剂盒要求分别提取每级稀释度细菌DNA,各取2.00 μL作为模板按优化好的体系条件进行实时荧光PCR检测。
1.3.6 稳定性和重复性试验 取3个不同浓度的样品作为模板进行重复性试验,每个浓度做3个平行,重复4次。收集数据,计算组内、组间变异系数,评价试验的稳定性和重复性。1.3.7 样品检测 将采集来的水海产品156份,经过匀浆机研磨处理后,用营养肉汤在37 ℃培养箱内培养6 h,利用煮沸法提取核酸,然后利用实时荧光PCR方法进行检测,检测结果用行标法(SN/T 1870—2007)进行再一次的检验,验证所建立的实时荧光PCR方法检测的实用性和准确性。
2 结果与分析
2.1 VV实时荧光PCR检测方法的建立
rTaq酶、Mg2+、dNTPs、引物、探针浓度直接影响实时荧光PCR反应的扩增效果,尤其是Mg2+的浓度是影响Taq酶活性发挥的主要因素,浓度过高会增加实时荧光PCR反应的非特异性扩增,浓度过低会影响Taq酶活性发挥。所以,PCR反应体系中每种物质浓度的选择都是非常重要的。经过反应体系的优化建立如下反应体系:rTaq酶(5 U/μL)0.50 μL,Mg2+(25 mmol)2.50 μL,dNTP(2.5 mmol)2.00 μL,探针(20 μmol/μL)0.30 μL,VVF/VVR(10 pmol/μL)1.00 μL,DNA 模板2.00 μL,DEPC水补充至25 μL。具体的反应过程:95 ℃预变性5 min;95 ℃变性3 s,60 ℃退火40 s(此步骤收集荧光信号),72 ℃延伸30 s,进行40个循环。
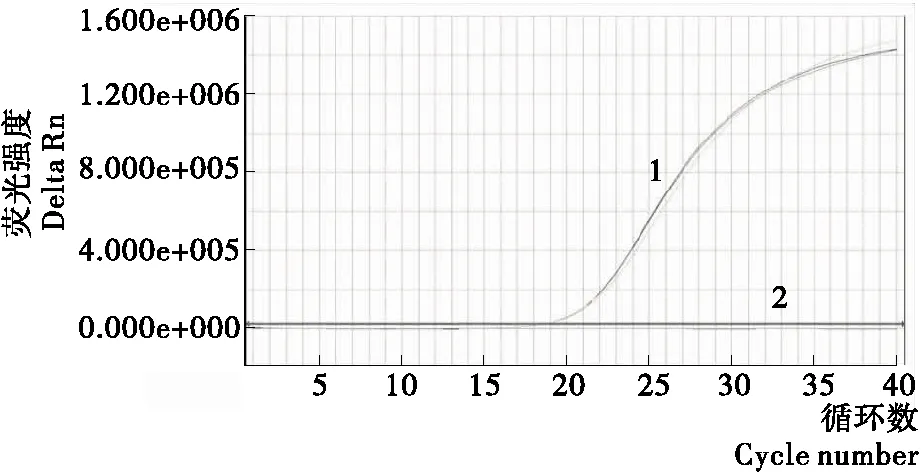
1. VV 2. 阴性对照
Figure 1 Determine the reaction system and the reaction conditions of a dual real-time PCR
2.2 特异性检测试验
应用建立的实时荧光PCR检测方法对15株标准菌株进行扩增试验显示,只有VV出现了特异性的扩增曲线,其他菌株和空白对照都没有出现特异性荧光信号。说明本研究所建立的检测方法具有很好的特异性(见图2)。
2.3 敏感性检测试验
10倍梯度稀释菌液并且按核酸提取试剂盒要求分别提取每级稀释度细菌DNA,各取2.00 μL 作为模板按优化好的体系条件进行实时荧光PCR检测。检测结果显示,菌体浓度在1.50×101CFU/mL时依然可以出现扩增曲线,在其浓度以下都没有出现特异性荧光信号(图3),因此,本研究所建立的检测方法的灵敏度为15 CFU/mL,表明该方法具有很高的灵敏度;本研究VV检测的灵敏度与金玉娟等[12]和张晶等[13]建立的实时荧光定量PCR方法检测的灵敏度进行比较,这3种实时荧光PCR检测方法的灵敏度相当,都具有较高的灵敏度。
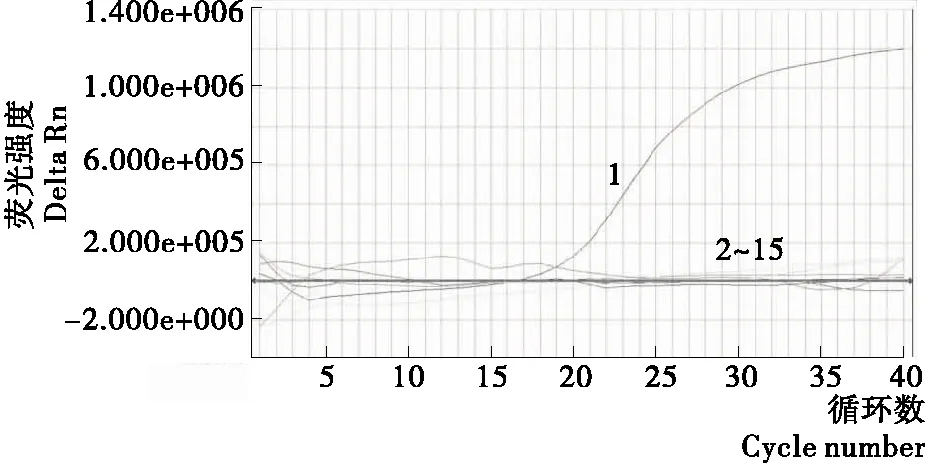
图2 VV实时荧光PCR特异性试验扩增曲线
Figure 2 Specificity test curve of a dual real-time PCR
1. VV 2~15. 肠侵袭性大肠杆菌、霍乱弧菌、空肠弯曲菌、金黄色葡萄球菌、沙门氏菌、变形杆菌、阪崎肠杆菌、单增李斯特氏菌、志贺菌、副溶血弧菌、产肠毒素大肠杆菌、小肠结肠炎耶尔森氏菌、肠出血性大肠埃希菌O157:H7、粘质沙雷菌1~7. 菌体浓度分别为1.5×106,1.5×105,1.5×104,1.5×103,1.5×102,1.5×101,1.5×100CFU/mL
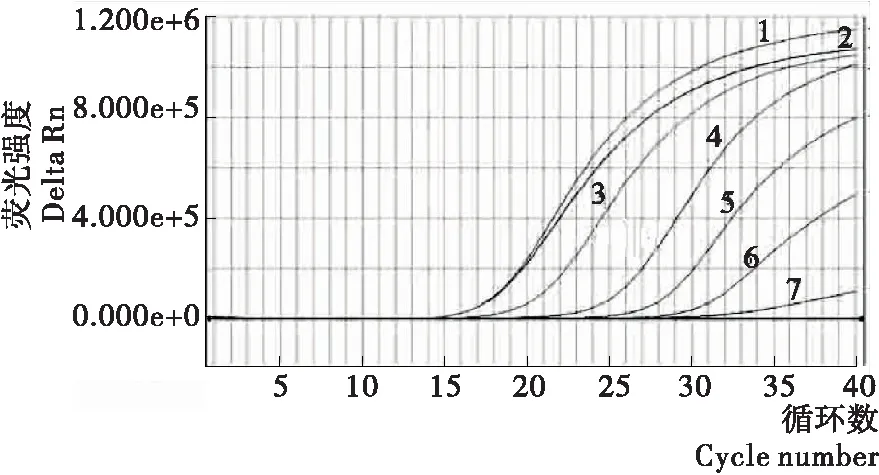
图3 VV菌液稀释法实时荧光PCR灵敏度试验扩增曲线
Figure 3 Sensitivity test curve of a dual real-time PCR
2.4 稳定性和重复性试验
选取1.50×107,1.50×105,1.50×103CFU/mL 3个浓度的阳性模板进行组内和组间重复性试验,计算出组内和组间CT 值的变异系数分别为0.34%~1.05%,0.38%~0.76% (表1),均小于2%,表明所建立的方法具有比较好的稳定性和重复性。
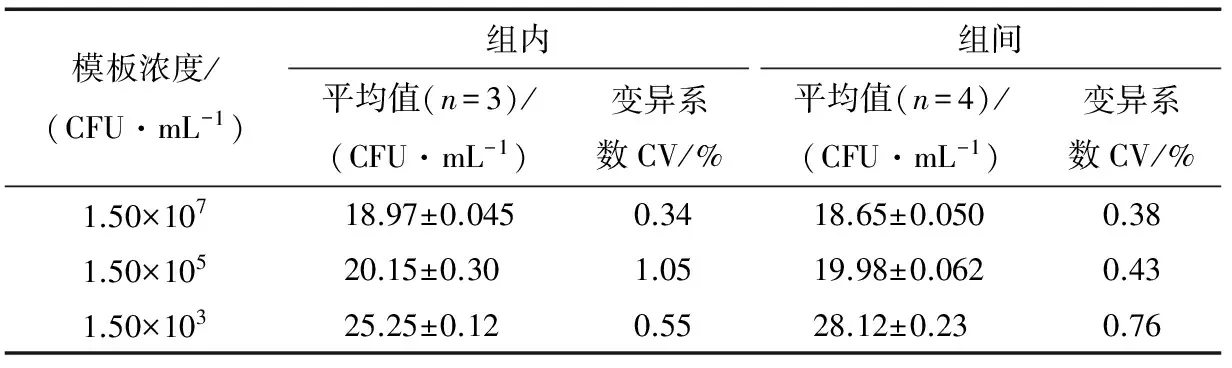
表1 稳定性和重复性试验
2.5 临床样品的检测试验
分别对156份采集来的样本用本研究建立的实时荧光PCR检测方法和行标法(SN/T 1870—2007)进行检测,检出2份阳性样本,两种方法所得的检测结果的一致(图4、5),表明该方法具有很强的应用性。
3 结论
本研究所建立的基于vvhA基因特异性检测VV实时荧光PCR方法,灵敏度高、特异性强、重复性好,具有良好的实用性,适合在食品微生物检测部门推广应用。该方法与普通PCR方法相比,提高了检测的灵敏度和特异性,并且不需要对PCR扩增产物进行后处理,有效地解决了PCR产物易污染造成的假阳性和不能准确定量的问题。该方法的建立为VV的快速检测提供了新的技术手段。
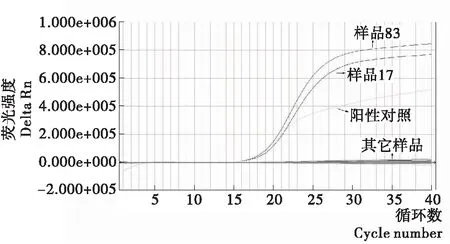
图4 VV实时荧光PCR对样品检测试验扩增曲线
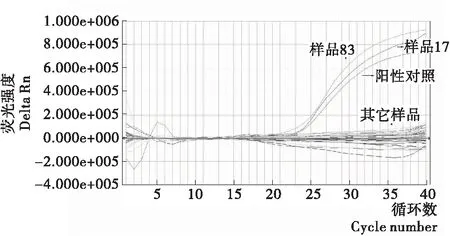
图5 VV行标法对样品检测试验扩增曲线
[1] 毛晶晶, 佘锐萍, 曹杰, 等. 某规模化奶牛场STEC和创伤弧菌流行情况调查[J]. 中国奶牛, 2013, 3(1): 1-3.
[2] BISHARAT N, COHEN D I, HARDING R M, et al. HybridVibriovulnificus[J]. Emerging Infectious Diseases, 2005, 11(1): 30-35.
[3] 潘军航, 梅玲玲, 朱敏, 等. 舟山市售牡蛎中创伤弧菌污染的定量分析[J]. 中国卫生检验杂志, 2009, 19(12): 2 760-2 761.
[4] 李萌立, 李忠海, 李节, 等. 量子点荧光探针技术在食源性致病菌检测中的应用[J]. 食品与机械, 2013, 29(5): 241-244.
[5] 姜英辉, 房保海, 雷质文, 等. 细菌活的非可培养状态的分子生物学检测技术研究进展[J]. 食品科学, 2011, 32(15): 308-311.
[6] 杨文鸽, 孙翠玲, 潘云娣, 等. 水产品中致病微生物的快速检测方法[J]. 中国食品学报, 2006, 6(1): 402-406.
[7] 徐义刚, 李苏龙, 杨君宏, 等. 水产品中创伤弧菌DNA环介导恒温扩增快速检测方法的建立及初步应用[J]. 中国生物工程杂志, 2010, 30(6): 96-102.
[8] 吴增辉. 基于vvhA基因TaqMan实时荧光定量PCR快速检测创伤弧菌的研究[D]. 杭州: 浙江大学, 2007.
[9] 张慧, 郑晓东, 蒋侃, 等. 实时荧光PCR法快速检测耐热霉菌费氏新萨托菌[J]. 食品与机械, 2013, 29(3): 79-82.
[10] CHUNG P H, CHUSNG S K, TSANG T, et al. Cutaneous injury andVibriovulnificusinfection [J]. Emerg Infect Dis, 2006, 12(8): 1 302-1 303.
[11] PANICKER G, BEJ A K. Real-time PCR detection ofVibriovulnificusin oysters:comparison of oligonucleotide primers and probes targetingvvhA[J]. Appl Environ Microbiol, 2005, 71(10): 5 702-5 709.
[12] 金玉娟, 甘莉萍, 杨慧, 等. 双重实时荧光PCR 检测副溶血性弧菌和创伤弧菌方法的建立[J]. 热带医学杂志, 2014, 14(10): 1 296-1 302.
[13] 张晶, 周勇, 陶霞, 等. 创伤弧菌PMA RTi-PCR检测技术的建立[J]. 中国人兽共患病学报, 2013, 29(1): 54-58.
Establishment of a quantitative real-time PCR for detecting vvhA gene in Vibrio vulnificus
XUYi-gang2QIUSuo-ping3WANGYu4GAOHui-jiang5GAOShen-yang6
(1.AnimalQuarantineLab,Inspection&QuarantineTechnologyCenterofHainanEntry-ExitInspection&QuarantineBureau,Haikou,Hainan570311,China; 2.CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin,Heilongjinag150001,China; 3.ConghuaEntry-ExitInspection&QuarantineBureau,Conghua,Guangdong510900,China; 4.AnimalQuarantineLab,Inspection&QuarantineTechnologyCenterofChongqingEntry-ExitInspection&QuarantineBureau,Chongqing404100,China; 5.LaboratoryofBovineGeneticsandBreeding,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China; 6.DepartmentofAnimalHusbandry&VeterinaryMedicine,LiaoningMedicalUniversity,Jinzhou,Liaoning121001,China)
To establish a rapid assay forVibriovulnificus(V.vulnificus) detection, a quantitative real-time PCR (qRT-PCR) method was developed targetingvvhAgene ofV.vulnificus. The results showed that the tests for 15 strains of different bacteria by using this method, only the ones ofV.vulnificuswere positive, indicating high specificity of qRT-PCR. Moreover, the sensitivity of this specific method was 15 CFU/mL. Further stability and reproducibility test results showed that the coefficient of variation of Ct values of four duplicates were less than 2%. In addition, a total 2 positive samples forV.vulnificuswere detected from 156 clinical samples by this method, and the results were in accordance with those by SN/T 1870-2007 standard detections. Therefore, the qRT-PCR method provides a novel rapid and sensitive detection method forV.vulnificusinfection.
vvhAgene; quantitative real-time PCR
海南省社会发展科技专项(编号:2015SF29);国家质检总局科技项目(编号:2013IK031,2013IK051,2015IK089);重庆市科技计划项目(编号:cstc2014yykfA80017);海南省应用技术研究与开发专项项目(编号:ZDXM20130025);广东检验检疫局科技计划项目(编号:2013GDK04,2015GDK53)
李丹丹,女,海南出入境检验检疫局高级兽医师,博士。
徐义刚(1978-),男,东北农业大学教授,博士。
E-mail: 108074182@qq.com
2016-01-06
