相转移催化分离山苍子油中柠檬醛的研究
2016-11-14付红军彭湘莲旷春桃钟海雁
付红军彭湘莲 旷春桃 钟海雁
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004;3. 中南林业科技大学材料科学与工程学院,湖南 长沙 410004)
相转移催化分离山苍子油中柠檬醛的研究
付红军1,2彭湘莲1,2旷春桃3钟海雁1,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004;3. 中南林业科技大学材料科学与工程学院,湖南 长沙 410004)
以随意甲基化β-环糊精(RM-β-CD)为相转移催化剂,经加成、水解等反应分离山苍子油中的柠檬醛;采用单因素试验和Box-behnken试验设计优化其分离工艺。结果表明:优化工艺条件为反应时间3.3 h, RM-β-CD用量为柠檬醛物质的量的0.65%(摩尔分数),反应温度15.0 ℃,该条件下柠檬醛纯度为96.50%,平均得率为86.60%,该模型预测值与实际值一致。该方法是一种高效、简便的分离山苍子油中柠檬醛的方法。
山苍子油;柠檬醛;相转移催化;随意甲基化β-环糊精
柠檬醛(化学名:3,7-二甲基-2,6-辛二烯醛)是一种α,β-不饱和醛,呈浓郁柠檬香味。柠檬醛具有抗菌[1-2]、抗氧化[3]、驱避昆虫[4]和抗肿瘤[5]等多种生物活性,同时也是一种食用香料以及合成紫罗兰酮系列香料、维生素A和二氢猕猴桃内酯的中间体[6-9]。中国的山苍子资源丰富,山苍子油中柠檬醛含量大于60%,因此,山苍子油中柠檬醛的分离纯化,对于山苍子油的精深产品开发以及林区的经济发展和农民增收具有积极意义。
山苍子油中柠檬醛的分离方法主要有减压蒸馏法、化学加成法等。贾绍义等[10]采用磁化处理山苍子油,然后减压蒸馏分离柠檬醛,柠檬醛纯度比未经磁化处理的产品高2.0%~2.7%,但减压蒸馏法操作温度高,柠檬醛容易发生聚合、热分解等。沙勇等[11]采用短程蒸馏技术分离山苍子油中柠檬醛,柠檬醛收率为60%,纯度96%以上,但该方法设备投资大,能耗高。尹显洪等[12]采用化学加成法纯化山苍子油中的柠檬醛,柠檬醛收率为78.0%,纯度为94.2%,但该反应是多相反应,相际间传质慢,导致其反应时间长。相转移催化剂β-环糊精及其衍生物具有外亲水、内疏水的空腔结构,可与客体分子形成超分子包合物,起到相转移催化剂的作用,从而提高反应速率和选择性。韩艳利等[13]采用相转移催化剂分离山苍子油中柠檬醛,分离效果良好,得率为85.80%,反应条件对得率影响显著,山苍子油中部分柠檬醛没有得到有效的回收利用,因此,有必要进一步优化山苍子油中柠檬醛的分离工艺,进而提高山苍子油加工利用的经济效益。
本研究拟以随意甲基化β-环糊精为相转移催化剂,从山苍子油中分离柠檬醛,并采用单因素试验和Box-behnken试验设计优化其分离工艺,旨在提供一种高效、简便的分离山苍子油中柠檬醛的方法,为山苍子油的精深产品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
山苍子油:实验室自制,从湖南湘西自治州产山苍子果实中提取;
β-环糊精(β-CD):分析纯,天津市光复精细化工研究所;
羟丙基β-环糊精(HP-β-CD)、随意甲基化β-环糊精(RM-β-CD):化学纯,西安敬业生物药物科技有限公司;
聚乙二醇400(PEG400):分析纯,国药集团化学试剂有限公司;
苄基三乙基氯化铵(TEBAC):化学纯,国药集团化学试剂有限公司;
其它试剂均为分析纯。
1.1.2 主要仪器设备
气相色谱仪:7890Ⅱ型,上海天美科学仪器有限公司;
低温恒温槽:RG-0515型,常州荣冠实验分析仪器厂;
电子天平:ES200HA型,长沙湘平科技发展有限公司。
1.2 方法
1.2.1 山苍子油中柠檬醛的分离 称取10.0 g山苍子油加入四口烧瓶中,加入溶解在150 mL蒸馏水中的化学计量的亚硫酸钠和碳酸氢钠以及相转移催化剂,在试验温度下搅拌反应。反应完成后,将反应混合物转入分液漏斗,静置分层,分出油相,再用石油醚萃取水相2次。水相中加入化学计量的NaOH,搅拌反应,当NaOH全部溶解且反应液变成乳白色后,转移至分液漏斗,静置分层,分出下层水相,上层油相为分离的柠檬醛,相转移催化分离山苍子油中柠檬醛的工艺路线见图1。
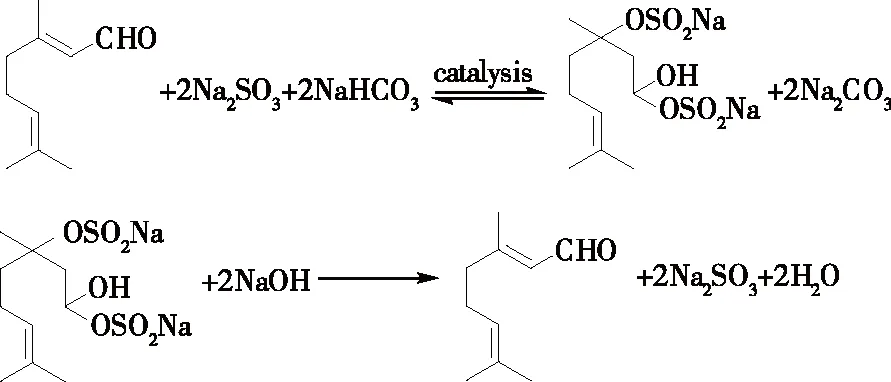
图1 相转移催化分离山苍子油中柠檬醛的工艺路线
1.2.2 单因素试验设计 以相转移催化剂种类、相转移催化剂用量、反应时间和反应温度为因素,考察各因素对山苍子油中柠檬醛分离的影响。
(1) 相转移催化剂种类对山苍子油中柠檬醛分离的影响:固定反应时间3.0 h,反应温度10 ℃,催化剂用量为柠檬醛物质的量的1.0%(摩尔分数,下同),考察相转移催化剂(β-CD、HP-β-CD、RM-β-CD、PEG400、TEBAC)对山苍子油中柠檬醛分离的影响。
(2) 相转移催化剂用量对山苍子油中柠檬醛分离的影响:固定相转移催化剂RM-β-CD,反应时间3.0 h,反应温度10 ℃,考察RM-β-CD用量(分别为柠檬醛物质的量的0.1%,0.5%,1.0%,2.0%,3.0%)对山苍子油中柠檬醛分离的影响。
(3) 反应时间对山苍子油中柠檬醛分离的影响:固定相转移催化剂RM-β-CD,RM-β-CD用量为柠檬醛物质的量的1.0%,反应温度10 ℃,考察反应时间(3.0,3.5,4.0,4.5 h)对山苍子油中柠檬醛分离的影响。
(4) 反应温度对山苍子油中柠檬醛分离的影响:固定相转移催化剂RM-β-CD,RM-β-CD用量为柠檬醛物质的量的1.0%,反应时间4.0 h,考察反应温度(5,10,15,20 ℃)对山苍子油中柠檬醛分离的影响。
1.2.3 响应面优化 根据单因素试验结果,选取催化剂用量、反应时间和反应温度3个影响因素,采用Box-Behnken试验设计优化分离工艺,以柠檬醛得率和纯度为响应值,进行响应面试验并对其数据进行回归分析,优化山苍子油中柠檬醛的分离条件[14]。
气相色谱(GC)法测定产品中柠檬醛纯度,柠檬醛得率按式(1)计算:
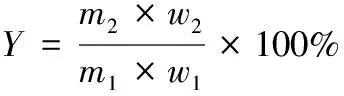
(1)
式中:
Y——柠檬醛得率,%;
m1——加入山苍子油质量,g;
m2——分离后产品的质量,g;
w1——山苍子油中柠檬醛含量,%;
w2——产品中柠檬醛含量,%。
1.2.4 柠檬醛含量的测定 根据文献[15]修改如下:色谱柱TM1701(30 m×0.20 mm×0.25 μm);进样口温度260 ℃;FID检测器温度280 ℃;升温程序:初温80 ℃,保持2 min,10 ℃/min升温,至100 ℃,保持3 min,15 ℃/min升温,至130 ℃,保持1 min,25 ℃/min升温,至230 ℃,保持6 min;定量分析方法:峰面积归一化法。
2 结果与分析
2.1 山苍子油中柠檬醛含量
按1.2.4方法测定山苍子油中柠檬醛含量,GC图见图2。结果表明,山苍子油中各组分峰能够基线分离,山苍子油中柠檬醛含量为74.80%。
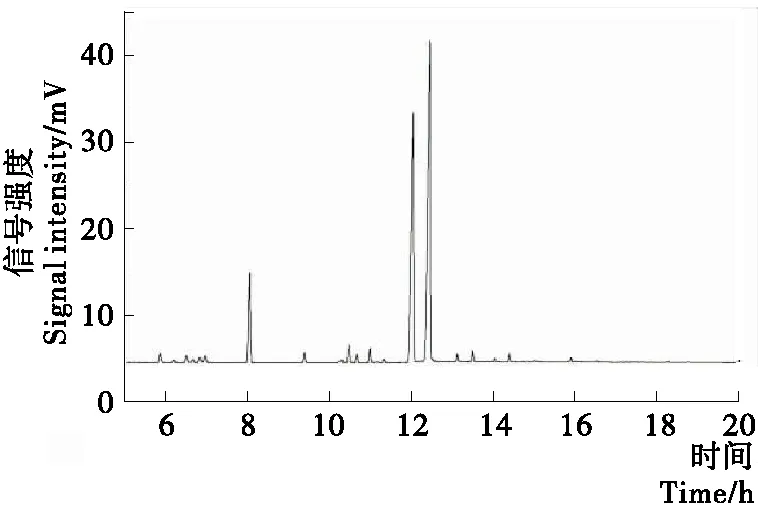
图2 山苍子油的气相色谱图
2.2 相转移催化剂种类对山苍子油中柠檬醛分离的影响
不同相转移催化剂对山苍子油中柠檬醛分离的影响见图3。
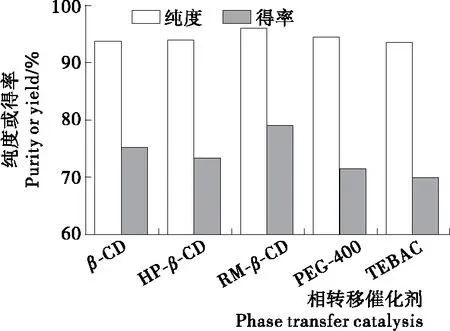
图3 相转移催化剂种类对山苍子油中柠檬醛分离的影响
Figure 3 The effect of phase transfer catalysis types on separation of citral fromLitseacubebaoil
由图3可知,RM-β-CD分离山苍子油中柠檬醛的效果最好,柠檬醛的得率和纯度分别为79.09%和96.14%。β-环糊精及其衍生物(β-CD、HP-β-CD和RM-β-CD)是环状冠醚类相转移催化剂,与链状聚醚(PEG400)和季铵盐(TEBAC)相比,对底物分子具有更强的选择性。有研究[16-18]表明,β-CD及其衍生物与一些极性、大小、形状及性质相匹配的客体分子形成超分子包结物,实现复杂体系选择性地分离,RM-β-CD具有外亲水、内疏水的空腔结构,并且空腔尺寸与柠檬醛分子匹配[19-20],能选择性地与油相的柠檬醛分子形成包结物,然后转移到水相与Na2SO3反应生成水溶性化合物,故柠檬醛的纯度和得率较高。
2.3 相转移催化剂用量对山苍子油中柠檬醛分离的影响
RM-β-CD用量对山苍子油中柠檬醛分离的影响见图4。
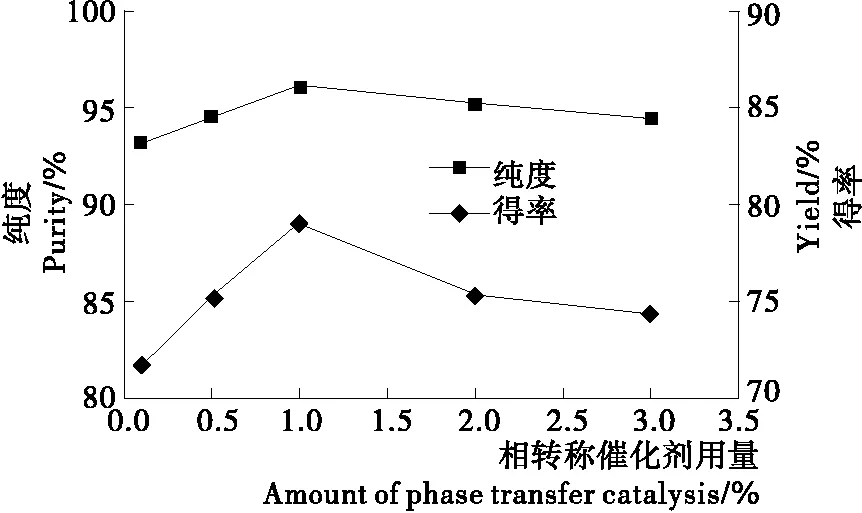
图4 相转移催化剂用量对山苍子油中柠檬醛分离的影响
Figure 4 The effect of phase transfer catalysis amount on separation of citral fromLitseacubebaoil
由图4可知,柠檬醛的得率和纯度随相转移催化剂用量的增加先增加后减少,相转移催化剂用量增加,柠檬醛从油相转移到水相的速率越快,柠檬醛得率增加,但催化剂用量太大,不利于后续的水相和油相的分离,甚至出现乳化现象,因此,RM-β-CD用量为柠檬醛物质的量1.0%左右。
2.4 反应时间对山苍子油中柠檬醛分离的影响
反应时间对分离山苍子油中柠檬醛的影响见图5。
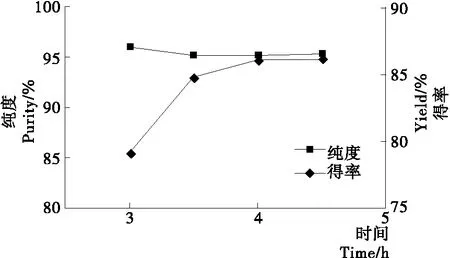
图5 反应时间对山苍子油中柠檬醛分离的影响
由图5可知,随反应时间的延长,柠檬醛纯度略微减少,而得率增大,4.0 h后,得率基本不变,比文献[12]报道的时间大大缩短,因为山苍子油中柠檬醛的分离是一多相反应,相转移催化剂RM-β-CD的存在,加快了油相中柠檬醛向水相中的传质速率,提高了化学反应速率,故在较短的时间内,柠檬醛的得率和纯度均较高。
2.5 反应温度对山苍子油中柠檬醛分离的影响
反应温度对分离山苍子油中柠檬醛的影响见图6。
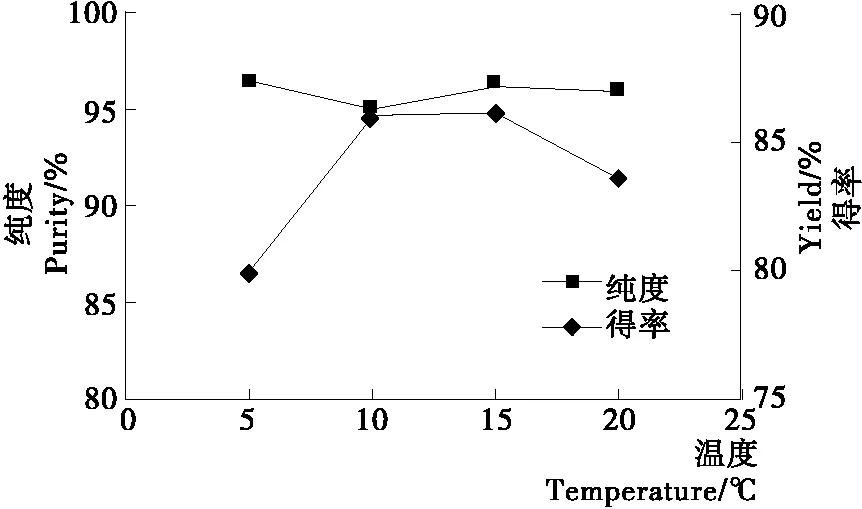
图6 反应温度对山苍子油中柠檬醛分离的影响
Figure 6 The effect of reaction temperature on separation of citral fromLitseacubebaoil
由图6可知,在温度为15 ℃时,柠檬醛纯度和得率均较高,再提高反应温度,柠檬醛得率和纯度下降。因为亚硫酸钠与柠檬醛的加成反应是放热反应,随着反应温度的升高,反应速率加快,得率增加,当温度再升高时,柠檬醛得率下降,因此,反应温度以10~20 ℃为宜。
2.6 响应面优化分析
在单因素试验基础上,采用Box-Behnken试验设计进一步优化相转移催化剂用量、反应时间和反应温度对山苍子油中柠檬醛分离的影响,从分离的经济性和效率角度考虑,因素和水平见表1,响应面试验结果见表2。
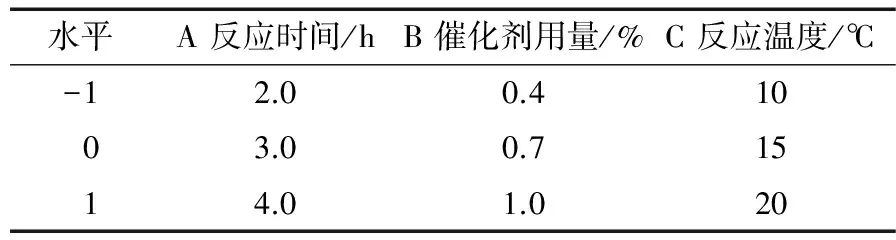
表1 响应面试验因素与水平
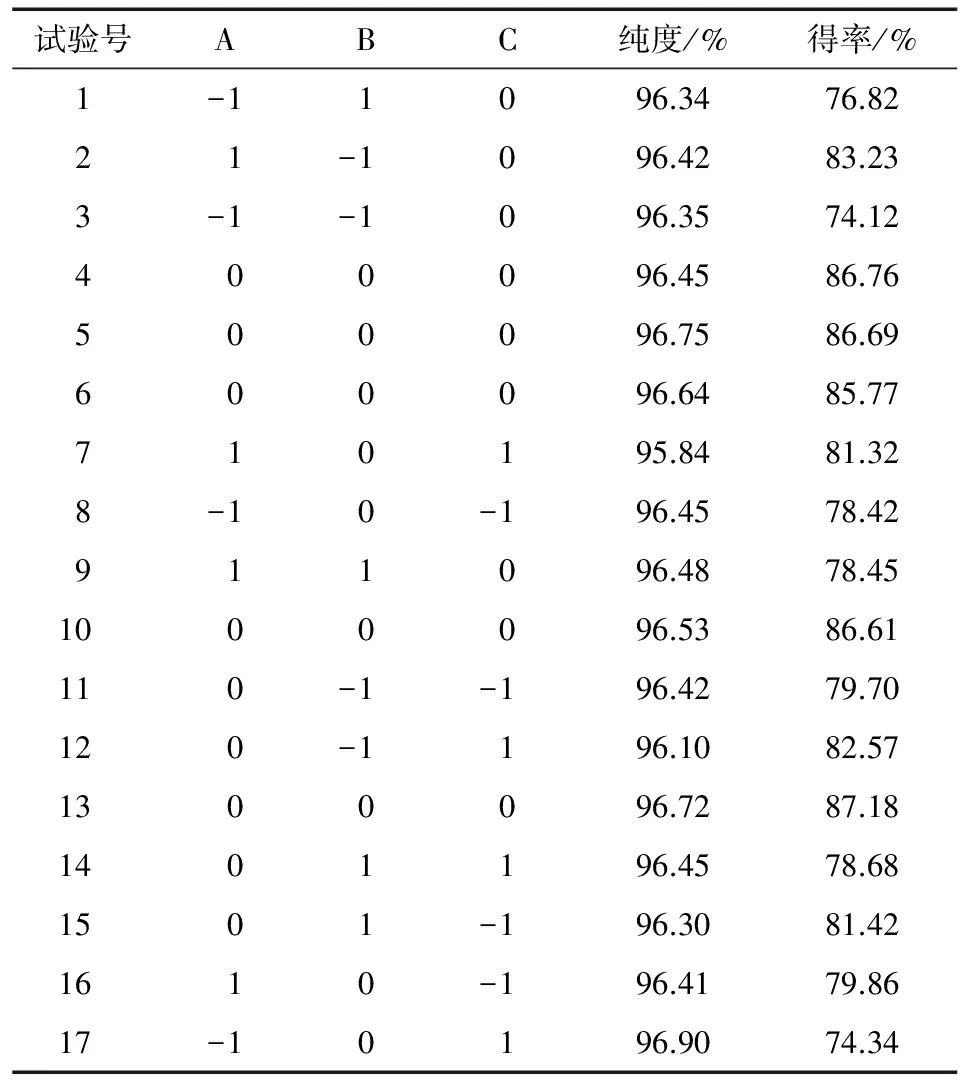
表2 响应面试验结果
以柠檬醛纯度和得率为响应值,运用Design-Expert 7.1.3软件对表2的试验数据进行多元回归分析,结果表明,在试验水平范围内,反应条件变化对柠檬醛纯度影响不显著,但对柠檬醛得率影响显著,其二次多项回归方程为:
Y得率=86.60+2.40A-0.53B-0.31C-5.28A2-3.17B2-2.84C2-1.87AB+1.38AC-1.40BC。
(2)
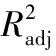
二次多项回归方程的响应曲面图和等高线图见图7~9。等高线的形状可反映交互作用的强弱,椭圆形表示交互作用显著,圆形表示交互作用不显著[21-23]。由图7可知,反应温度一定时,柠檬醛得率随反应时间和催化剂用量的增加呈先增加后减少趋势,柠檬醛得率随反应时间变化的坡度在催化剂用量少时较陡,而催化剂用量大时较平缓,反应时间和催化剂用量交互作用极显著。催化剂用量增加,相际间的传质速率增加,柠檬醛得率增加,但催化剂用量过大,不利于后续水相和油相的分离,甚至产生乳化现象。反应时间增加有利于催化剂将油相的柠檬醛转移到水相,柠檬醛得率增加,再增加时间,水相和油相达到了相平衡,且柠檬醛具有一定的挥发性,导致柠檬醛得率有所减少。
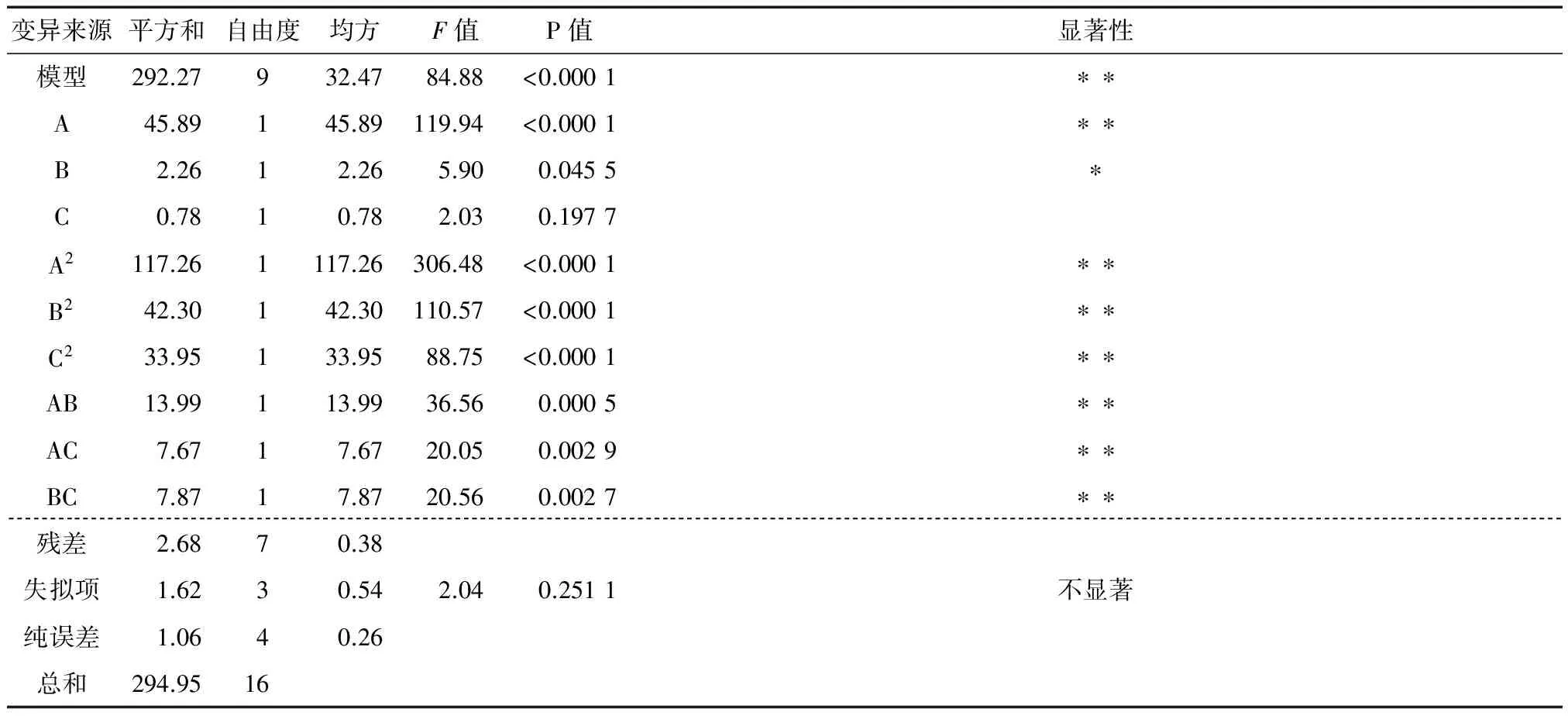
表3 得率回归模型的方差分析†
† **表示极显著(P <0.01),*表示显著(P<0.05)。
由图8可知,催化剂用量一定时,柠檬醛得率随反应时间和温度的增加呈先增加后减少,反应时间和反应温度交互作用极显著。温度升高使柠檬醛分子运动速度加快,提高催化剂对柠檬醛分子的转移速率,从而柠檬醛得率提高。由图9可知,反应时间为3 h时,柠檬醛得率随反应温度和催化剂用量的增加呈先增加后减少趋势,反应温度和催化剂用量交互作用极显著。
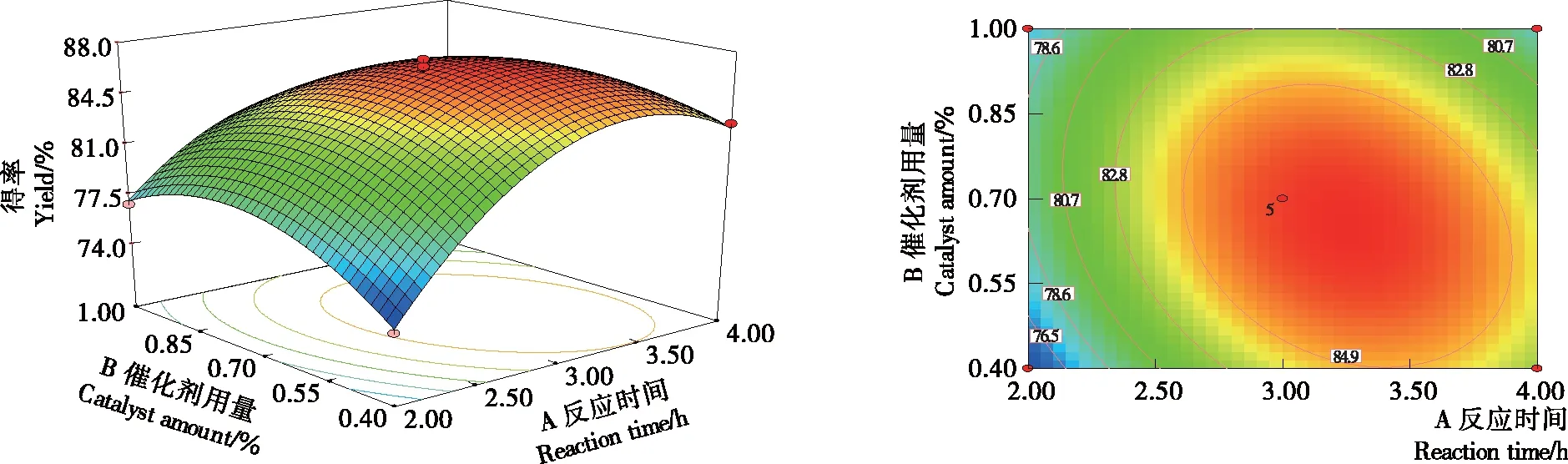
图7 反应时间和催化剂用量影响柠檬醛得率的响应面图和等高线图
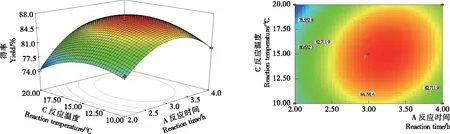
图8 反应温度和反应时间影响柠檬醛得率的响应面图和等高线图
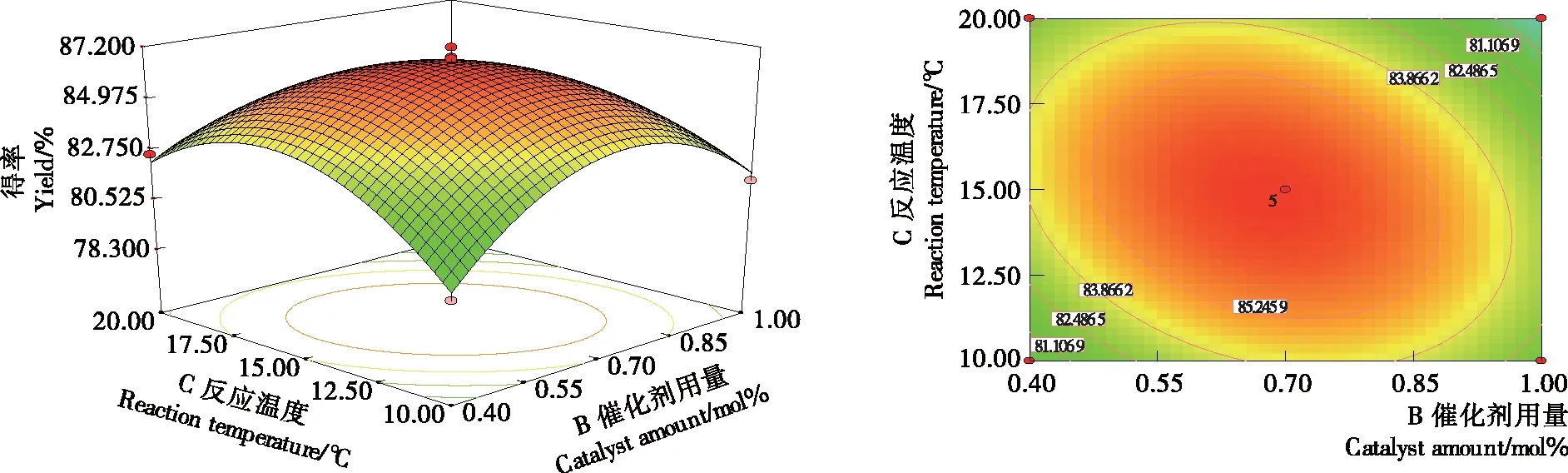
图9 反应温度和催化剂用量影响柠檬醛得率的响应面图和等高线图
应用Design-Expert 7.1.3软件对回归方程求解,得到从山苍子油中分离柠檬醛的优化工艺条件为反应时间3.26 h,催化剂用量为柠檬醛物质的量0.65%,反应温度15.27 ℃,预测得率为86.96%;为便于后续操作,试验条件调整为:反应时间3.3 h,催化剂用量为柠檬醛物质的量0.65%,反应温度为15.0 ℃,在该工艺条件下进行重复实验,柠檬醛的平均得率为86.60%,平均纯度为96.50%,预测值与实际值吻合度高,表明通过该模型得到的工艺参数准确、可靠。以RM-β-CD为催化剂,纯化后柠檬醛的GC图见图10。由图10可知,山苍子油中其他化学成分得到了有效分离,分离后的产品主要为柠檬醛的两种异构体——橙花醛和香叶醛。
3 结论
本研究以RM-β-CD为相转移催化剂,经加成、水解反应从山苍子油中制备高纯柠檬醛,并采用单因素试验和Box-Behnken试验设计优化其分离工艺,优化工艺条件为:反应时间3.30 h,催化剂用量为柠檬醛物质的量的0.65%,反应温度15.0 ℃,该条件下所得产品的柠檬醛得率为86.60%,纯度为96.50%。采用转移催化从山苍子油中分离柠檬醛,分离效率高,方法简单,可行性强。
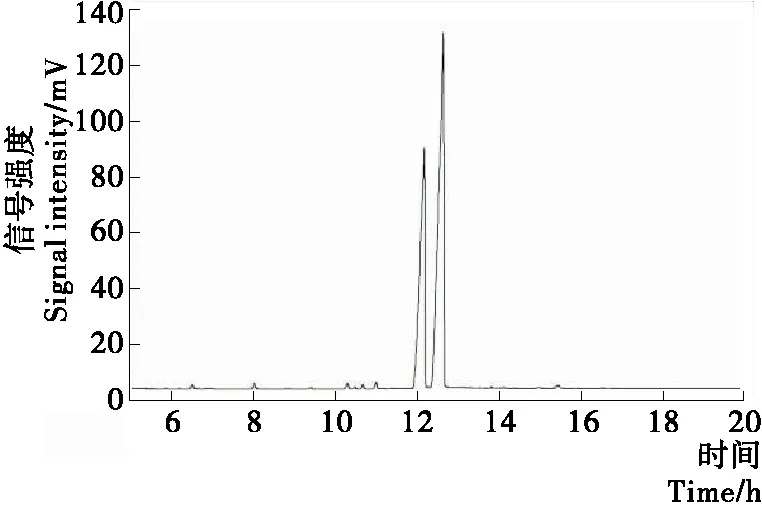
图10 纯化后柠檬醛的气相色谱图
山苍子油中柠檬醛分离后的其他化学成分分离和综合利用有待进一步研究,比如含量较高的柠檬烯、桉树脑、芳樟醇和α-蒎烯等是重要的香料或医药中间体,进一步分离和利用这些成分可提高山苍子加工利用的综合经济效益。
[1] TIWARI B K, VALDRAMIDIS V P, DONNELL C P O, et al. Application of natural antimicrobials for food preservation[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 5 987-6 000.[2] SADDIQ A A, KHAYYAT S A. Chemical and antimicrobial studies of monoterpene: Citral[J]. Pesticide Biochemistry and Physiology, 2010, 98(1): 89-93.
[3] HWANG J K, CHIO E M, LEE J H. Antioxidant activity of Litsea cubeba[J]. Fitoterapia, 2005, 76(7/8): 684-686.
[4] OYEDELE A O, GBOLADE A A, SOSAN M B, et al. Formulation of an effective mosquito-repellent topical product from lemongrass oil [J]. Phytomedicine, 2002, 9(3): 259-262.
[5] 戴舒柳, 罗曼, 李化, 等. 柠檬醛胁迫下K562细胞生长增殖抑制和凋亡诱导研究[J]. 中国中药杂志, 2011, 36(10): 1 370-1 373.[6] 皮少锋, 胡铁, 王烨, 等. 香料中间体9,10-环亚甲基假紫罗兰酮的制备[J]. 食品与机械, 2014, 30(3): 190-193.
[7] 胡铁, 王烨, 皮少锋, 等. 柠檬醛合成紫罗兰酮的工艺优化[J]. 食品与机械, 2014, 30(1): 224-227, 247.
[8] 沈润溥, 胡四平, 宋小华, 等. 由α-环柠檬醛直接缩合制备β-紫罗兰酮的研究[J]. 高校化学工程学报, 2011, 25(3): 538-542.
[9] 晏日安, 苏镜娱, 曾陇梅. (±)-二氢猕猴桃内酯合成方法的改进[J]. 有机化学, 2006, 26(5): 730-732.
[10] 贾绍义, 吴松海, 曾林久, 等. 磁化处理对山苍子油物理性质及精馏过程的影响[J]. 香料香精化妆品, 2008, 36(4): 9-12.
[11] 沙勇, 肖宗源, 吐松. 短程蒸馏山苍子油提纯柠檬醛的应用研究[J]. 现代化工, 2008, 28(S2): 298-300.
[12] 尹显洪, 梁政, 肖机生, 等. 从山苍子油中提取柠檬烯和柠檬醛的研究[J]. 广西师范大学学报: 自然科学版, 1994, 12(3): 66-70.
[13] 韩艳利. 山苍子精油的提取、精制及物理改性研究[D]. 长沙: 中南林业科技大学, 2013: 33-43.
[14] 周海旭, 李忠海, 张慧, 等. 微波辅助提取樟树叶木脂素工艺优化[J]. 食品与机械, 2016, 32(6): 193-197.
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 11424—2008 山苍子(精)油[S]. 北京: 中国标准出版社, 2008.
[16] 纪红兵, 黄丽泉, 石东坡, 等.β-环糊精超分子催化剂用于液相有机合成[J]. 有机化学, 2008, 28(12): 2 072-2 080.
[17] 郭放, 徐赫男, 王秀梅, 等. 利用螯形主体分子的识别功能选择包结分离蒿本挥发油中的肉豆蔻醚[J]. 天然产物研究与开发, 2003, 15(3): 192-195.
[18] 常怀春, 杨常春, 王秀梅, 等. 包结物晶析法分离小茴香挥发油中茴香醚[J]. 应用化学, 2001, 18(6): 440-443.
[19] WANG Ying, JIANG Zi-tao, LI Rong. Complexation and molecular microcapsules ofLitseacubebaessential oil withβ-cyclodextrin and its derivatives[J]. European Food Research and Technology, 2009, 228(6): 865-873.
[20] 旷春桃, 李湘洲, 韩艳利, 等. 山苍子精油与β-环糊精衍生物的包合作用研究[J]. 中国食品学报, 2014, 14(11): 214-221.
[21] 程丹, 傅玉颖, 梅子, 等. 响应曲面法优化酵母微胶囊化核桃油工艺[J]. 中国食品学报, 2013, 13(11): 28-34.
[22] 杨锡洪, 高学丽, 解万翠, 等. 微波辅助碱—酶法提取酵母β-1, 3-葡聚糖工艺优化[J]. 食品与机械, 2016, 32(2): 145-148.
[23] 陈义勇, 张德谨. 乌饭树叶黄酮超声—微波辅助提取工艺的优化[J]. 食品与机械, 2016, 32(1): 148-153.
Separation of citral from Litsea Cubeba oil by phase transfer catalysis
FU Hong-jun1,2PENGXiang-lian1,2KUANGChun-tao3ZHONGHai-yan1,2
(1.CollegeofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China; 2.NationalEngineeringLaboratoryforRiceandByproductsProcessing,Changsha,Hunan410004,China; 3.CollegeofMaterialScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan41004,China)
Randomly methylated-β-cyclodextrin (RM-β-CD) was used as phase transfer catalysis to separate citral fromLitseacubebaoil by addition reaction and hydrolysis reaction. The optimum separation conditions were obtained by single factor experiment design and Box-Behnken experiment design. The purity and yield of citral were 96.50% and 86.60%, respectively, which was gotten under the optimum conditions of reaction time 3.3 h, RM-β-CD amount 0.65% (molar fraction) and reaction temperature 15.0 ℃. Predicted value was in accordance with actual value. This proposed method was used to separate citral fromLitseacubebaoil with convenient and had high efficient advantages.
Litseacubebaoil; citral; phase transfer catalysis; randomly methylated-β-cyclodextrin
湖南省重点研发计划项目(编号:2015SK20723,2015SK2072);湖南省科技计划项目(编号:2012NK3103);湖南省教育厅优秀青年项目(编号:16B282)
付红军(1975-),男,中南林业科技大学讲师,博士生。
E-mail: hj0730@126.com
2016-04-23
