淀粉接枝聚醋酸乙烯酯纳米粒的制备及其对虾青素稳定性影响
2016-11-14刘占军李晓春耿旭芳赵琳琳
刘占军李晓春 耿旭芳 赵 占 赵琳琳
(1.华北理工大学药学院,河北 唐山 063009;2. 陕西省食品药品检验所,陕西 西安 710061)
淀粉接枝聚醋酸乙烯酯纳米粒的制备及其对虾青素稳定性影响
刘占军1李晓春2耿旭芳1赵 占1赵琳琳1
(1.华北理工大学药学院,河北 唐山 063009;2. 陕西省食品药品检验所,陕西 西安 710061)
以二羟基二过碘酸合镍(IV)钾作为引发剂,引发醋酸乙烯酯在淀粉上接枝,生成淀粉接枝共聚物。再用三聚磷酸钠作交联剂制备成具有疏水核心、亲水表面的纳米粒。然后采用透析法,将虾青素与纳米粒混合制成虾青素纳米粒。测定淀粉及接枝共聚物的红外光谱、纳米粒的平均粒径、粒径分布、纳米粒形态,并以虾青素的丙酮溶液作为比较,对虾青素纳米粒的稳定性进行测定。结果表明,在不同条件下,虾青素纳米粒比原料的稳定性均有提高。
虾青素;纳米粒;接枝;稳定性;聚醋酸乙烯酯
虾青素(3,3-二羟基-4,4二酮基-β,β-胡萝卜素)具有很强的抗氧化性能,比β-胡萝卜素和叶黄素防止紫外光光氧化更有效。其在营养食品、化妆品、食品和饲料工业广泛应用[1]。然而,虾青素不能在动物体内合成,必须从饮食获得。虾青素分子高度不饱和,很容易被光和氧分解,导致其抗氧化性能的损失,使其应用受到了一定的限制[2]。
纳米粒可以提高药品、保健品和食品添加剂等产品的水溶性、生物利用度和稳定性,通过将这些物质包载于纳米粒子内部,能够提高其稳定性,最大地发挥其活性。微/纳米包封技术,如微胶囊包埋技术、凝聚技术、纳米沉淀、主客体包结络合技术、超临界流体技术、乳化溶剂挥发技术已逐渐应用于功能性虾青素制剂的制备[3]。淀粉因其来源丰富、价格低廉、可再生、可完全生物降解,被广泛用于食品及食品添加剂中[4],但制备成淀粉纳米粒用于食品添加剂的方法如乳液沉淀法[5]和溶液混合法[6]等,制备出的纳米粒内为非化学键力,稳定性能差,负载的效率也较低。聚醋酸乙烯酯是一种安全、无毒、无刺激性,长期以来用作眼用膜剂、皮肤控释剂和植入给药控释系统等的药用高分子材料[7],将淀粉与聚醋酸乙烯酯接枝得到纳米粒,负载虾青素,可以发挥纳米材料的特点,提高其稳定性,延长保存时间,扩大其应用范围。
本研究拟采用二羟基二过碘酸合镍(IV)钾为引发剂[8-9],在淀粉上接枝聚醋酸乙烯酯,采用透析法,将虾青素与纳米粒混合制成虾青素纳米粒,测定接枝物的红外光谱、纳米粒的平均粒径、粒径分布、纳米粒形态,并以虾青素的丙酮溶液作为比较,对虾青素纳米粒的稳定性进行评价。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
虾青素:含量≥95%,美国Sigma-Aldrich公司;
可溶性淀粉:分析纯,天津市凯通化学试剂有限公司;
引发剂二羟基二过碘酸合镍(IV)钾:本课题组实验室自制;
醋酸乙烯酯:含量≥99%,分析纯,天津致远化学试剂有限公司,经重蒸后使用;
其它试剂:含量≥99%,分析纯,国药集团化学试剂有限公司;
MD10透析袋(截留相对分子量14 000):北京瑞达恒辉科技发展有限公司。
1.1.2 主要仪器设备
透射电镜:H600型,日本Hitachi公司;
激光粒度分析仪:Brookhaven 90Plus型,美国Brookhaven公司;
低温高速离心机:BK30型,德国Sigma公司;
高效液相色谱仪:1100型,美国Angilent公司;
红外光谱仪:FTIR-8400型,日本Shimadzu公司;
电子天平:AE240型,瑞士Mettler公司;
光照实验仪:LS-3000型,北京天星科仪科技公司;
超声波清洗机:KQ - 100型,昆山超声仪器厂。
1.2 试验方法
1.2.1 淀粉接枝共聚物的制备 制备方法按参考文献[10]略改进,一个2 000 mL的三颈烧瓶,配备温度计、磁力搅拌器通和氮气装置,在水浴中进行温度控制。先加入淀粉30 g,蒸馏水870 mL,在搅拌下加热到90 ℃保持30 min,然后冷却到35 ℃,并用N2吹泡30 min,以去除体系中的氧气。加入醋酸乙烯酯30 g后滴加5 mL引发剂,反应在35 ℃条件下持续5 h,确保反应完全。得到的产物反复用去离子水洗3次除去未反应的淀粉,将干燥后的接枝物在索氏提取器中用丙酮提取72 h,除去其中的聚醋酸乙烯酯均聚物。真空冷冻干燥后的产物备用。
1.2.2 空白纳米粒的制备 用透析法制备淀粉纳米粒[11]。精密称取接枝聚合物23 mg溶解在16.5 mL DMSO中,持续搅拌,使之溶解,加入透析膜,用去离子水进行透析。透析介质在开始后3 h,每1 h换一次,之后每5 h更换一次,共透析24 h。得到的纳米粒溶液,滴加0.1%三聚磷酸钠溶液2.5 mL,保持15 min,以使纳米粒稳定,真空冷冻干燥,备用。
1.2.3 虾青素纳米粒的制备 精密称淀粉纳米粒23 mg溶解在16.5 mL DMSO中,持续搅拌,使之溶解。取0.17 mg虾青素溶于4 mL丙酮中,混合后加入透析膜,用去离子水进行透析。透析介质前3 h,每1 h换一次,之后每5 h更换一次,共透析24 h,得到的虾青素纳米粒溶液。
1.2.4 纳米粒的红外测定 溴化钾压片法制备样品,扫描范围400~4 000 cm-1,室温条件下扫描测定。
1.2.5 纳米粒的粒径分布 将空白纳米粒和虾青素纳米粒的混悬液,分别用去离子水稀释10倍,室温散射角为90°条件下,在激光粒度分析仪中测定纳米粒的粒径。
1.2.6 透射电子显微镜(Transmission electron micrographs,TEM)检测 在铺有碳膜的铜网上滴加少量纳米粒混悬液,静置5 min,然后滴加2%磷钨酸染色,晾干后,在透射电子显微镜下观察纳米粒形态。
1.2.7 虾青素的测定 虾青素的含量测定改进参考文献[12]方法进行:0.5 mL的样品加入到2 mL二氯甲烷—甲醇(体积比1∶1)的混合液。密闭条件下搅拌15 min,之后在室温下离心5 min(800×g)。此提取程序重复2次,混合提取液,之后用滤膜过滤(4 mm,0.45 μm),取上清液进样测定。
色谱条件:色谱柱 Extend-C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇∶二氯甲烷∶乙腈∶水(85∶5∶5∶5);检测波长 480 nm;流速 1.0 mL/min;柱温:室温;进样量 20 μL,以虾青素浓度c为横坐标,峰面积A为纵坐标进行线性回归。
1.2.8 光照条件下虾青素纳米粒的稳定性 取10 mL虾青素纳米粒溶液及虾青素丙酮溶液,浓度均为20 μg/mL,分别置于具塞比色管中,置于LS-3000光照实验仪,在室温条件下测定,调节照度为4 000 LX,分别在20,40,60,80,100,120,140,160,180,200,240 min,进行取样,按1.2.7方法测定,每个样品平行3次。
1.2.9 温度对虾青素纳米粒稳定性的影响 将虾青素的丙酮溶液及虾青素纳米粒溶液10 mL,浓度均为20 μg/mL,分装于具塞比色管中,分别置于30 ℃和50 ℃温度下避光水浴,分别在1,2,3,4,5,6,7,8 d取样,按1.2.7方法测吸光值。每个样品平行3次。
1.2.10 数据处理 用Orogin 9.0及SPSS 20数据分析软件进行数据处理,用Duncan检验进行显著性分析(P<0.05)。
2 结果与分析
2.1 红外光谱
由图1可知,在两个谱图上都有淀粉的特征吸收峰575,765,861 cm-1,淀粉接枝共聚物的谱图上,在1 250和1 740 cm-1具有醋酸乙烯酯的特征吸收峰,在淀粉的谱图上没有。1 740 cm-1为酯基的C═O伸缩振动吸收峰,1 250 cm-1为O—C伸缩振动吸收峰。利用二羟基二过碘酸合镍(IV)钾作为引发剂,醋酸乙烯酯接枝到淀粉上,使醋酸乙烯酯的C═C双键打开,接枝到淀粉分子中大量存在的活泼反应基团—OH上,生成接枝共聚物[8]。生成接枝共聚物的同时,在淀粉大分子的骨架上并没有引起更大的结构变化。在淀粉接枝共聚物的谱图上出现的吸收峰说明聚醋酸乙烯已经接枝到淀粉链上。
2.2 纳米粒形态
由图2可知,制得的空白纳米粒,呈现球形或类球形,大小基本均一,粒径比较均匀规整,平均粒径为(80.6±2.1) nm;虾青素纳米粒(图3)的形态基本规整,呈球形或类球形,表面的规整程度比空白纳米粒要差,粒度不均匀,形体大小差别较大,平均粒径为(163.5±3.4) nm,主要因为在负载虾青素的过程中,每个空白纳米粒与虾青素的接触机会不同,导致负载量不同,出现粒径上的差异[13]。
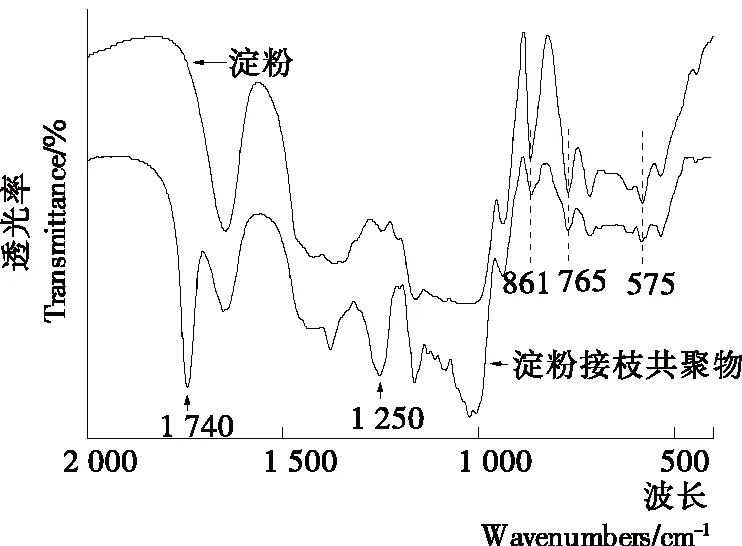
图1 红外光谱

图2 空白纳米粒的透射电镜照片
2.3 纳米粒的粒径分布
激光粒度分析仪测得纳米粒的粒径分布图,空白纳米粒(图4),平均粒径为(116.8±2.1) nm,分散系数为0.118±0.013,可见大多集中分布在平均粒径附近,极少部分粒径比较小的纳米粒使分散程度变大;虾青素纳米粒的平均粒径为(201.8±3.3) nm,分散系数为0.284±0.035,图5微分分布图上236 nm附近出现的侧峰,可能是纳米粒低程度聚集或不均匀形成的,导致分散程度加大,这和透射电镜照片看到的情况相符合。另外,粒径分布图比电镜照片得到的尺寸更大,是由于在不同的测定条件下导致的[14]。
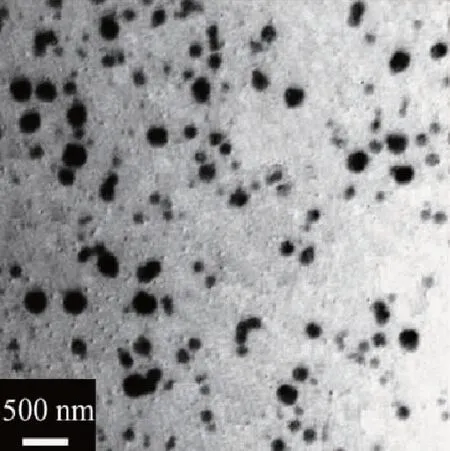
图3 虾青素纳米粒的透射电镜照片
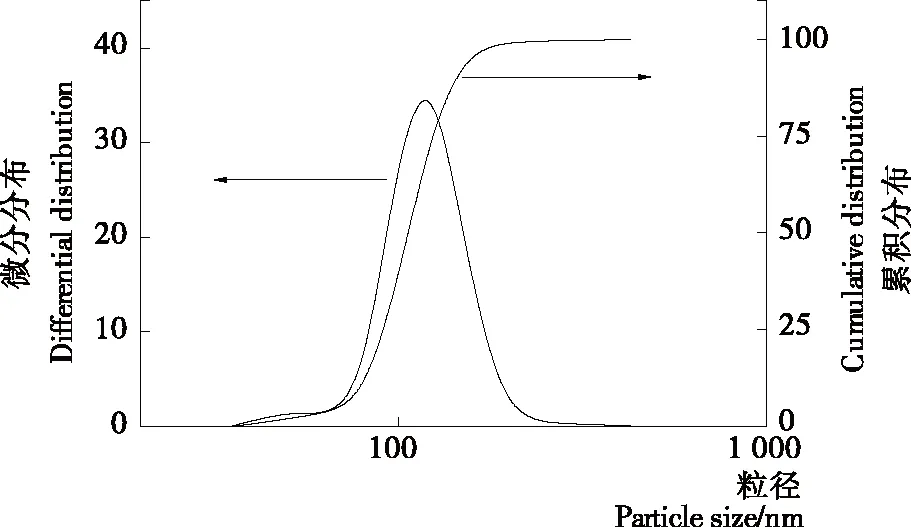
图4 空白纳米粒的粒径分布图

图5 虾青素纳米粒的粒径分布图
2.4 光照条件下虾青素纳米粒的稳定性
由图6可知,在光射条件下,无论哪种形式虾青素都随着时间的延长,浓度逐渐下降。其中,虾青素丙酮溶液很快发生质变,在4 h后样品中的成分低至16.66%,主要原因是虾青素在光直射条件下,分子很容易被激发,发生脱氢反应,生成类胡萝卜自由基阳离子,而自由基生成后很容易诱发其他的虾青素分子发生质变[15]。虾青素纳米粒随时间的延长,所含虾青素浓度也逐渐降低,但降低的速度小,4 h后成分为39.46%,这主要由于纳米粒具有表面与界面效应,具有吸收光子能量及吸收部分自由基的特性,减弱了光化学反应[16]。可见,虾青素负载于纳米粒中,纳米粒所具有的吸收光子,减少自由基作用可有效保持虾青素的稳定。
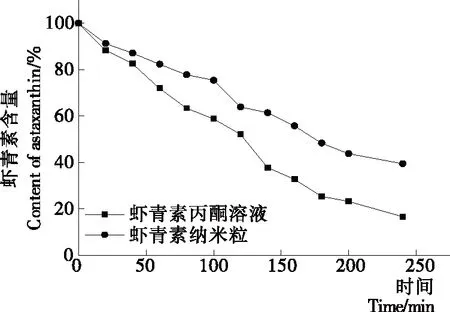
图6 光照对稳定性的影响
2.5 温度对虾青素稳定性的影响
由图7可知,随着贮藏时间的延长,各种形式的虾青素在一定的温度条件下,都随时间的延长,含量逐渐降低。虾青素丙酮溶液中含量下降较快,30 ℃和50 ℃恒温避光下,贮存8 d时含量分别为87.55%和75.35%;温度越高,含量越低,表明温度对虾青素的稳定性影响较大,增加的温度促进虾青素的分解[17]。在相同的条件下纳米粒中的虾青素贮存8 d时含量分别为92.06%和83.94%,其稳定程度得到显著改善(P<0.05),主要是纳米粒所具有的纳米效应,使纳米粒得到了有效的保护[17]。虾青素受热分解是一个复杂的过程,但有两个主要的反应:异构化和氧化[18],温度升高使其异构化和氧化加剧。纳米粒具有较大的比表面积,具有量子尺寸效应,吸收相应的热能易于释放给溶剂或介质,减小了负载其中的虾青素的热效应。另外,纳米粒的包埋作用,使虾青素减少与氧气的相互作用,阻碍了氧化反应,这也是提高其稳定性的原因[19]。
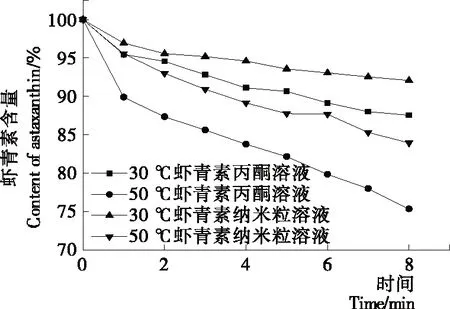
图7 温度对稳定性的影响
3 结论
本试验采用二羟基二过碘酸合镍(IV)钾作为引发剂,在淀粉上接枝聚醋酸乙烯酯,制备纳米粒,反应条件温和,可以得到形态均匀的纳米粒,负载虾青素后,纳米粒形态基本规则,平均粒径为(163.5±3.4) nm,分散系数为0.284±0.035。制备的虾青素纳米粒,因纳米效应和包埋因素影响,在光照和升高温度条件下,都比虾青素丙酮溶液稳定。在光照条件下,4 h后成分仍能达到39.46%;30 ℃和50 ℃恒温避光下,贮存8 d时含量分别为92.06%和83.94%,其稳定性程度比原料得到显著改善。因淀粉资源丰富,成本低,有利于开发制备虾青素相关产品,延长其存贮时间及提高产品的质量。采用本试验制备方法,纳米粒内为化学键力,比乳液沉淀法和溶液混合法方法制备的纳米粒稳定。将该虾青素纳米粒应用于食品或食品添加剂,提高产品稳定性能的研究还在进一步探讨中。另外,将淀粉接枝聚酸酸乙烯酯纳米粒应用于其他食品和食品添加剂,也是继续研究的一个内容。
[1] 张晓燕, 刘楠, 周德庆. 天然虾青素来源及分离的研究进展[J]. 食品与机械, 2012, 28(1): 264-267.
[2] BUSTAMANTE A, MASSON L, VELASCO J, et al. Microencapsulation of H. pluvialis oleoresins with different fatty acid composition: Kinetic stability of astaxanthin and alpha-tocopherol [J]. Food Chemistry, 2016, 190: 1 013-1 021.
[3] 万百惠, 李敬, 赵英源, 等. 微/纳米包封技术在改善虾青素水溶性和稳定性中的应用[J]. 食品工业科技, 2014, 35(23): 382-386.
[4] 李少华, 龙娇妍, 司俊娜, 等. 变性淀粉对玉米饮料稳定性的影响[J]. 食品与机械, 2015, 31(1): 208-211.
[5] DE PAZ E, MARTIN A, BARTOLOME A, et al. Development of water-soluble beta-carotene formulations by high-tempera-ture, high-pressure emulsification and antisolvent precipitation [J]. Food Hydrocolloids, 2014, 37: 14-24.
[6] LI Jing-lei, SHIN G H, LEE I W, et al. Soluble starch formulated nanocomposite increases water solubility and stability of curcumin [J]. Food Hydrocolloids, 2016, 56: 41-49.
[7] MOHAMED W S, MOSTAFA A B, NASR H E. Characterization and application of intercalated montmorillonite with verapamil and its polymethyl methacrylate nanocomposite in drug delivery [J]. Polymer-Plastics Technology and Engin-eering, 2014, 53(14): 1 425-1 433.
[8] LIU Ying-hai, LIU Xiao-hui, DENG Kui-lin, et al. Graft copolymerization of methyl acrylate onto poly(vinyl alcohol) initiated by potassium diperiodatonickelate(IV) [J]. Journal of Applied Polymer Science, 2003, 87(3): 529-534.
[9] LIU Ying-hao, ZHANG Ai-qi, LI Jun-bo, et al. Graft copolymerization of methyl acrylate onto cellulose by potassium diperiodatonickelate(IV) initiating system [J]. Journal of Polymer Materials, 2004, 21(2): 189-195.
[10] LAI S M, DON T M, LIU Y H, et al. Graft polymerization of vinyl acetate onto granular starch: Comparison on the potassium persulfate and ceric ammonium nitrate initiated system [J]. Journal of Applied Polymer Science, 2006, 102(3): 3 017-3 027.
[11] SIMI C K, EMILIA T. Hydrophobic grafted and cross-linked starch nanoparticles for drug delivery [J]. Bioprocess Biosyst Eng, 2007, 30(3): 173-180.
[12] 杜云建, 陈卿. 稀碱法提取虾壳中虾青素的工艺条件研究[J]. 食品与机械, 2010, 26(4): 112-114.
[13] STEICHEN S D, CALDORERA-MOORE M, PEPPAS N A. A review of current nanoparticle and targeting moieties for the delivery of cancer therapeutics [J]. European Journal of Pharmaceutical Sciences, 2013, 48(3): 416-427.
[14] JIANG Xin-yi, XIN Hong-liang, GU Ji-jin, et al. Enhanced antitumor efficacy by D-glucosamine-functionalized and Paclitaxel-loaded poly(ethylene glycol)-Co-poly(trimethylene carbonate) polymer nanoparticles[J]. Journal of Pharmaceutical Sciences, 2014, 103(5): 1 487-1 496.
[15] ANARJAN N, TAN Chin-ping. Effects of storage temperature, atmosphere and light on chemical stability of astaxanthin nanodispersions[J]. Journal of the American Oil Chemists Society, 2013, 90(8): 1 223-1 227.
[16] ZHANG Went-tao, YU Shao-xuan, LIU Wei, et al. “Pulling” pi-conjugated polyene biomolecules into water: enhancement of light-thermal stability and bioactivity by a facile graphene oxide-based phase-transfer approach [J]. Rsc Advances, 2014, 4(90): 48 765-48 769.
[17] AMBATI R R, PHANGS M, RAVI S, et al. Astaxanthin: sources, extraction, stability, biological activities and its commercial applications-a review[J]. Marine Drugs, 2014, 12(1): 128-152.
[18] BUSTOS-GARZA C, YANEZ-FERNANDEZ J, BARRAGAN-HUERTA B E. Thermal and pH stability of spray-dried encapsulated astaxanthin oleoresin from Haematococcus pluvialis using several encapsulation wall materials [J]. Food Research International, 2013, 54(1): 641-649.
[19] 时臻彬, 田怀香, 易封萍, 等. 柠檬醛纳米胶囊的制备及其稳定性研究[J]. 食品与机械, 2012, 28(4): 38-41.
Preparation of starch-graft-poly (vinyl acetate) nanoparticles and effect on the stability of astaxanthin
LIU Zhan-jun1LIXiao-chun2GENGXu-fang1ZHAOZan1ZHAOLin-lin1
(1.CollegeofPharmaceuticalSciences,NorthChinaUniversityofScienceandTechnology,Tangshan,Hebei063000,China; 2.ShaanxiInstituteforFoodandDrugControl,Xi’an,Shaanxi710061,China)
The starch-graft-poly (vinyl acetate) was prepared using potassium diperiodatonickelate (IV) as an initiator. Afterwards, it was produced into nanoparticles containing hydrophobic core and hydrophilic surface in water, using sodium tripolyphosphate as crosslinking agent. Then the nanoparticles loaded with astaxanthin were made by the dialysis method. IR spectra of the starch and the graft copolymer, the average particle size, particle size distribution, and morphology of the nanoparticles loaded with astaxanthin were measured. The stability of nanoparticles loaded with astaxanthin was determined with an acetone solution of astaxanthin as control. The results showed that the stability of the nanoparticles loaded with astaxanthin was improved under several different conditions.
astaxanthin; nanoparticle; graft; stability; poly(vinyl acetate)
河北省自然科学基金——石药集团医药联合研究基金优先资助项目(编号:H2013209192)
刘占军(1967—),男,华北理工大学副教授,博士,硕士生导师。E-mail:liuzhanjun815@163.com
2016—04—04
