补肾益髓方及其拆方对实验性自身免疫性脑脊髓炎小鼠脑和脊髓中p-Tau和Beta-tubulin表达的影响
2016-11-14师一民王永强张秋霞陈振振樊永平
师一民 王永强 安 辰 赵 晖 齐 放 张秋霞 陈振振 樊永平 李 明 王 蕾
(1 首都医科大学中医药学院中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属北京天坛医院,北京,100050)
实验研究
补肾益髓方及其拆方对实验性自身免疫性脑脊髓炎小鼠脑和脊髓中p-Tau和Beta-tubulin表达的影响
师一民1王永强1安辰1赵晖1齐放1张秋霞1陈振振1樊永平2李明1王蕾1
(1 首都医科大学中医药学院中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属北京天坛医院,北京,100050)
目的:观察补肾益髓(Bu Shen Yi Sui,BSYS)方及其拆方补肾(Bu Shen,BS)和化痰活血(Hua Tan Huo Xue,HTHX)方对实验性自身免疫性脑脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)小鼠脑和脊髓中p-Tau和Beta-tubulin的作用。方法:C57BL/6小鼠雌性随机分为正常对照(NC)、模型(MO)、醋酸泼尼松(PA)、梓醇(CA)、BSYS、BS和HTHX组。造模当天与造模后第7天于小鼠背部两侧皮下注射抗原,即50 μg髓鞘少突胶质细胞糖蛋白(MOG)35-55、完全弗氏佐剂(CFA)与结核分支杆菌(TB)混合,并在免疫当天和2 d后腹腔注射500 ng的百日咳毒素(PTX)。每天对小鼠进行灌胃,观察其体重及神经功能评分,并于造模第20 d和第40 d分别取脑和脊髓进行病理检测。采用免疫组化法检测p-Tau和beta-tubulin的表达。结果:与MO组比较,BSYS、BS和HTHX组体重与神经功能评分均出现明显上升,HE染色可观察到炎细胞显著减少,核固缩减轻,同时,BSYS、BS和HTHX方均可明显下调p-Tau表达(P<0.05,P<0.01),上调beta-tubulin蛋白表达(P<0.05,P<0.01)。结论:BSYS方及其拆方BS和HTHX均对EAE小鼠有神经保护作用,表现在减少体重丢失,降低神经功能评分,减轻炎炎性细胞浸润,减轻轴突损伤及促进其修复,尤以BSYS全方更为显著。
补肾益髓方及其拆方;多发性硬化;实验性自身免疫性脑脊髓炎;P-Tau;Beta-tubulin
多发性硬化(Multiple Sclerosis,MS)是一种中枢神经系统(Central Nervous System,CNS)自身免疫反应介导的炎性神经退行性病变[1],病理学改变是以CNS内存在多处炎性反应、髓鞘脱失、轴突损伤、胶质增生和程度不一的髓鞘再生为特征[2]。其中轴突损伤与患者神经功能障碍密切相关[3],患者还伴有认知功能障碍、感觉障碍、视力障碍、疲劳、共济失调等相关症状[4-6]。因此,如何促进轴突损伤的修复对于临床治疗具有重要意义。但现代医学对于MS患者的治疗多为调节免疫反应,对于神经修复面临诸多困难[7]。
中医药在促进轴突再生修复方面有潜在优势,研究发现,中药在改善MS症状、调节免疫功能、促进神经功能恢复、减缓疾病进程等都方面具有较好的疗效[8]。中医认为MS以正虚为本,邪实为标。本虚涉及脾、肝、肾三脏不足,标实有瘀血、痰浊、热毒、水湿、腑实、痰蒙窍闭等差异[9]。经过大样本临床病例的统计分析,MS患者的基本病机概括为肝肾阴虚和痰瘀阻络[10]。补肾益髓方(原称二黄方)是天坛医院樊永平教授在长期治疗MS的临床实践中创立的有效方,具有补肾化痰活血的功效,对肾虚兼痰瘀互阻的MS患者效果明显[11]。前期实验研究也发现,BSYS方对MS动物模型EAE有明显的防治作用。能够有效减轻髓鞘脱失与轴突损伤,促进神经再生与修复[12-13]。
Tau蛋白是一种微管相关细胞骨架蛋白,可在神经元与轴突中高度表达,其异常磷酸化导致细胞内神经纤维缠结,造成相关神经递质的运输、储存和释放障碍,故可作为反映轴突损伤的指标蛋白[14]。Beta-tubulin是组成神经元微管的重要蛋白之一,能够促进细胞的生长、分裂及维持细胞骨架的稳定,在促进突触可塑性调节、突起形成、结构稳定和神经元发育中发挥重要作用[15]。故其可以作为轴突修复的指标蛋白。
为了深入探讨BSYS方的作用机制,我们依其治法将其拆分为BS和HTHX方进行研究。主要采用免疫组化法(Immunohistochemistry,IHC)观察BSYS方及其拆方BS和HTHX方对EAE小鼠的作用及对其脑与脊髓中p-Tau和beta-tubulin表达的影响。
1 材料与方法
1.1实验材料
1.1.1实验动物70只SPF级C57BL/6雌性小鼠,体质量控制在15~17 g。购于北京维通利华实验动物技术有限公司[许可证号为SCXK(京)2012-0001]。动物饲养于首都医科大学实验动物中心(许可证号SYXK(京)2010-0020),具备独立通气笼(Individual Ventilated Cages,IVC)系统,单笼饲养,温度18~22 ℃,相对湿度40%~60%,自由接触饲料和饮水。每日上午添加饲料、更换水和垫料。所有实验均经首都医科大学伦理委员会批准。
1.1.2实验药物BSYS方由生地黄、熟地黄、浙贝母、水蛭、全蝎、益母草等组成;BS方由生地黄、熟地黄等组成;HTHX方由浙贝母、水蛭、全蝎、益母草等组成,均由北京亚东生物制药有限公司制备。醋酸泼尼松片(Prednisone Acetate,PA)由天津力生制药有限公司生产,梓醇(Catapol,CA)由杭州康木科技有限公司提供。
1.1.3主要试剂髓鞘少突胶质细胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)35-55由北京旭和源生物科技有限公司合成;完全弗氏佐剂(Complete Freund′s Adjuvant,CFA,货号F5881)、百日咳毒素(Pertussis Toxin,PTX,货号P7208)均由美国Sigma公司提供;灭活结核分支杆菌(Mycobacterium Tuberculosis,TB,货号231141)由美国BD公司提供。p-Tau抗体(货号ab131354)和Beta-tubulin(货号ab6046)均由美国Abcam公司提供;Alexa Fluor594标记山羊抗兔IgG(H+L)(货号ZF0516)购于北京中杉金桥生物技术有限公司等。
1.2方法
1.2.1分组与模型制备将小鼠随机分为7组:正常(NC)、模型(MO)、PA、CA、BS、HTHX及BSYS组。每组10只。造模当天与造模后第7天于小鼠背部两侧皮下注射0.2 mL的免疫抗原,由50 μg MOG35-55、100 μLCFA、0.3 mg TB和100 μL生理盐水混合而成。每只动物在免疫当天和两天后腹腔注射500 ng的PTX。正常组注射同体积的生理盐水[16]。
1.2.2给药方法PA组小鼠给予PA 5 mg/kg体重灌胃;CA组给予CA 40 mg/kg体重灌胃;BS方组给予BS混悬液1.44生药/kg体重;HTHX方组给予HTHX混悬液1.57 g生药/kg体重灌胃;BSYS方组给予相应BSYS混悬液3.02生药/kg体重灌胃。NC和MO组均灌服相同剂量的蒸馏水。1次/d,共计40 d。
1.2.3体重和神经功能评分每天测量记录小鼠体重,并对其进行神经功能评分。神经功能评分标准按照Weaver′s的15分评分方法[17]对EAE小鼠的神经症状进行观察评分。将小鼠尾巴活动分为3个等级,肢体活动分为4个等级,通过累积分数得出评分。若出现死亡则总分记为15分。
1.2.4标本采集造模第20 d(急性期)和第40 d(缓解期)取小鼠脑和脊髓,每组10只。常规灌流,4%多聚甲醛内、外固定。梯度乙醇脱水,二甲苯透明,石蜡包埋,以2 μm厚度连续切片。
1.2.5HE染色取材组织块固定后,常规石蜡包埋,2 μm切片。组织石蜡切片经二甲苯脱蜡,梯度乙醇洗脱至水,后用苏木素染色5 min,自来水冲洗,盐酸乙醇分化30 s,再用自来水浸泡15 min。置于伊红液2 min,最后常规脱水,透明,封片。
1.2.6IHC染色IHC法测定小鼠脑和脊髓中p-Tau、Beta-tubulin表达。组织石蜡切片经二甲苯脱蜡,梯度乙醇洗脱至水,PBS冲洗,放入柠檬酸缓冲液(pH6.0~6.1),入微波炉进行抗原修复,室温下自然冷却至35 ℃以下,用3%H2O2室温孵育10 min,滴加一抗稀释液p-Tau(1∶200)/Beta-tubulin(脑1∶450,脊髓1∶500)等,放入4 ℃冰箱中孵育过夜(12 h)。取出后在室温下复温1 h,滴加生物素标记的二抗,并进行37 ℃孵育。DAB显色1~5 min,脱水,透明,中性树胶封片,光学显微镜下观察,每个切片选择5个不重叠视野照相,并用NIS-Elements BR 3.2软件测定积分光密度值(Integrated Optical Density,IOD)。
2 结果
2.1BSYS方及其拆方BS和HTHX方对EAE小鼠体重的影响造模前各组小鼠体重差异无统计学意义(P>0.05)。造模后各小鼠体重缓慢上升,于第11天开始,与NC组比较,其他各造模组小鼠体重开始出现明显下降(P<0.05)。于第19天降至最低,后缓慢回升。但第19天到第40天各造模组动物体重均较NC组显著降低(P<0.01)。在第23天到40天,BSYS和BS组小鼠体重与PA组比较,回升明显(P<0.05或P<0.01)。见图1。
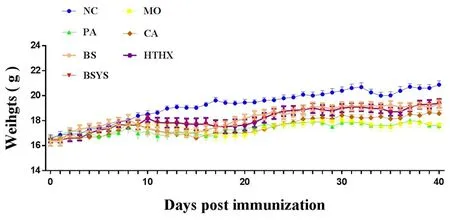
图1 各组小鼠体重变化

图2 各组小鼠神经功能评分变化

图3 各组小鼠脑组织病理学变化(HE×400)
2.2BSYS方及其拆方BS和HTHX方对EAE小鼠神经功能评分的影响各造模组小鼠至第12天陆续发病,其神经功能评分呈现不同程度升高,此前各治疗组之间比较差异无统计学意义。第17天,各治疗组评分明显低于MO组(P均<0.05)。MO组小鼠评分于第22天达最高峰,峰值为6.5分,第22天PA与BSYS组评分明显低于MO组(P<0.01),HTHX组、BS组和CA组评分也低于MO组,但效果不如BSYS组明显,尤其HTHX组与BSYS组组间比较差异有统计学意义(P<0.05)。随后评分逐渐下降,第25天、32天,各治疗组与MO组比较,评分显著降低,其中CA组和HTHX组评分高于其他治疗组,与PA、BSYS组比较差异有统计学意义(P<0.05)。第35天各组小鼠病情趋于平稳,但未恢复正常,各治疗组病情较MO组均明显减轻,PA和BSYS组评分明显低于MO组(P<0.01),各治疗组之间比较无统计学意义,第34天到40天,各治疗组与MO组比较,评分显著降低,其中BSYS组较PA组评分下降明显(P<0.05)。见图2。
2.3BSYS方及其拆方BS和HTHX方对EAE小鼠脑与脊髓不同时间点病理学的影响NC组小鼠脑组织,着色均匀,结构有序完整。MO组脑白质血管周围有炎细胞浸润,核固缩明显。PA、CA、BS、HTHX和BSYS组脑白质血管周围有炎细胞浸润,部分核固缩。病理程度较MO组低。脊髓病理变化与脑相似。见图3、图4。

图4 各组小鼠脊髓组织病理学变化(HE×400)

分组N脑第25天第40天脊髓第25天第40天NC44323±3844227±3964412±4884368±378MO46559±514∗∗∗6200±360∗∗∗6616±927∗∗∗6323±602∗∗∗PA44633±434##4323±793##4712±595##4392±324##CA45679±574#5202±922#5715±264#5497±361#BS44928±390#4547±407#4935±591#4657±277#HTHX45657±635#5324±397#5665±928#5498±597#BSYS44780±420##4437±385##4815±291##4576±290##
注:与NC组比较,***P<0.001;与MO组比较,#P<0.05,##P<0.01。
2.4BSYS方及其拆方BS和HTHX方对EAE小鼠脑和脊髓中p-Tau的影响各组小鼠发病第25天和第40天,MO组小鼠脑p-Tau表达较NC组显著上调(P<0.001),各治疗组小鼠脑p-Tau表达与MO组相比不同程度下降(P<0.05,P<0.01,P<0.001)。各组小鼠脊髓内p-Tau表达变化趋势与脑相似。见表1,图5-6。

图5 各组小鼠脑中p-Tau蛋白的表达变化(IHC×400)

图6 各组小鼠脊髓中P-Tau蛋白的表达变化(IHC×400)

组别N脑第25天第40天脊髓第25天第40天NC41157±1031184±0561164±0541209±054MO4853±070∗∗∗887±032∗∗∗866±049∗∗∗906±053∗∗∗PA41047±058##1089±048##1068±069##1104±060##CA4920±048#949±058#939±044#969±047#BS4973±048#990±040#983±054#1021±071#HTHX4940±049#956±056#947±057#962±052#BSYS41011±053##1033±049##1031±062##1070±052##
注:与NC组比较,**P<0.01,***P<0.001;与MO组比较,#P<0.05,##P<0.01。
2.5BSYS方及其拆方BS和HTHX方对EAE小鼠脑和脊髓中beta-tubulin的影响造模第25天和第40天,MO组小鼠脑beta-tubulin表达较NC组明显下调(P<0.01,P<0.001),各治疗组小鼠脑beta-tubulin表达与MO组相比不同程度上升(P<0.05,P<0.01)。各组小鼠脊髓内beta-tubulin表达变化趋势与脑相似。见表2、图7、图8。

图7 各组小鼠脑中beta-tubulin表达变化(IHC×400)

图8 各组小鼠脊髓中beta-tubulin表达变化(IHC×400)
3 讨论
MS在神经系统疾病中属于疑难性疾病,对于MS的治疗进展关注一直持续上升,西医治疗虽有进展尝试以新的药物及治疗方法替代,但仍以糖皮质激素、β干扰素为常规治疗药物[18-21],但存在反复发作、不良反应发生率较高、费用高等问题。中医药治疗本病从理论文献到临床有自己的独特的治疗体系,并在近年的治疗中取得较好的效果[8,22-27]。中医无MS病名,可根据其临床表现与病因病机归为“骨痿”[28],以肝肾阴虚与痰瘀阻络为主要病机,樊永平教授以滋补肝肾培其本、化痰活血缓其标[29],二法并用标本兼治,在长期的临床中取得良好的治疗效果,在近期的实验研究中亦取得成果[30-31]。通过本次实验的结果发现,BSYS方在升高EAE小鼠的体重与降低神经功能评分的同时,显著降低炎细胞浸润与减轻细胞核固缩,说明本方对EAE小鼠有较好的防治作用,这些结果和以前的实验结果是一致的[12,32],关于本方剂量的选择,是参考以往实验结果,BSYS方以3.02 g/kg为优,并根据此将剂量计算拆方BS和HTHX方的剂量。本实验中以PA作为代表药物,CA为本方君药地黄的主要成分。在本次实验中,PA、CA、BS和HTHX治疗组对EAE小鼠也有一定的防治作用,但以BSYS方的效果最优。
我们又进一步研究了本方对EAE轴突损伤及其修复作用。Tau过度磷酸化积累是多种神经退行性病变的重要特征之一。研究报道p-Tau蛋白在MS患者中大量增加,尤其是疾病早期[33-34]。已有从MS患者脑脊液中提取Tau蛋白作为MS患者的生物标记物,用于疾病的诊断[35]。在本次实验中我们发现,急性期和缓解期EAE小鼠脑和脊髓中p-Tau有显著的升高,各治疗组均有明显降低p-Tau的作用,说明可以减少EAE小鼠的轴突损伤。各治疗组之间无明显差异。
Beta-tubulin在支持神经元细胞骨架和沿神经突起和突触释放神经递质转运中发挥着重要的作用。研究发现,MS患者脑脊液中tubulin的含量远低于其他神经系统疾病患者与正常对照组脑脊液中tubulin的含量,认为脑脊液中tubulin的含量可以作为轴突修复的指标之一[36]。我们的实验发现,EAE小鼠脑和脊髓中beta-tubulin的表达在急性期和缓解期均有显著下降,各治疗药物显著上升beta-tubulin的表达,可以促进EAE小鼠轴突的修复。其中以BSYS方效果最为明显。说明补肾配伍化痰活血法对于MS治疗的有效性。
综上所述,BSYS方及其拆方BS和HTHX均能EAE小鼠有防治作用,并能减轻轴突损伤及促进其修复,尤以BSYS全方更为显著,为临床应用补肾化痰活血法治疗MS提供科学内涵。
[1]Herz J,Zipp F,Siffrin V.Neurodegeneration in autoimmune CNS inflammation[J].Exp Neurol,2010,225(1):9-17.
[2]Enzinger C,Barkhof F,Ciccarelli O,et al.Nonconventional MRI and microstructural cerebral changes in multiple sclerosis[J].Nat Rev Neurol,2015,11(12):676-686.
[3]Lee JY,Taghian K,Petratos S.Axonal degeneration in multiple sclerosis:can we predict and prevent permanent disability?[J].Acta Neuropathol Commun,2014(2):97.
[4]Münzel EJ,Jolanda ME,Williams A.Promoting remyelination in multiple sclerosis-recent advances[J].Drugs,2013,73(18):2017-2029.
[5]Chalah MA,Riachi N,Ahdab R,et al.Fatigue in Multiple Sclerosis:Neural Correlates and the Role of Non-Invasive Brain Stimulation[J].Front Cell Neurosci,2015(9):460.
[6]Guenter W,Jabońska,Bieliński,et al.Neuroimaging and genetic correlates of cognitive dysfunction in multiple sclerosis[J].Psychiatr Pol,2015,49(5):897-910.
[7]Rottlaender A,Kuerten S.Stepchild or Prodigy? Neuroprotection in Multiple Sclerosis(MS)Research[J].Int J Mol Sci,2015,16(7):14850-14865.
[8]贾刘云,王森,王倩,等.中医药治疗多发性硬化的研究进展[J].中医研究,2015,28(10):75-78.
[9]樊永平,吴畏.500例多发性硬化患者中医证候研究[J].北京中医药大学学报,2014,37(1):68-72.
[10]樊永平,尤昱中,陈克龙,等.261例多发性硬化患者临床特点和中医证候分布[J].首都医科大学学报,2012,33(3):301-305.
[11]房玲,樊永平,赵晖,等.补肾益髓方防治多发性硬化的研究进展[J].中医药导报,2013,19(12):108-110.
[12]Fang L,Zheng Q,Yang T,et al.Bushen Yisui Capsule ameliorates axonal injury in experimental autoimmune encephalomyelitis[J].Neural Regen Res,2013,8(35):3306-3315.
[13]郑琦,杨涛,房玲,等.补肾益髓胶囊对实验性自身免疫性脑脊髓炎小鼠大脑内BDNF和Nogo A的影响[J].南京中医药大学学报,2013,29(5):439-444.
[14]姚中凯,吴作培,孙贵新.微管相关蛋白2:调节神经元发育、结构稳定及突起形成和突触可塑性[J].中国组织工程研究,2015,19(37):6010-6016.
[15]王群,胡志红,王建枝,等.反复饥饿对大鼠空间学习及海马神经元骨架蛋白磷酸化的影响[J].中国生物化学与分子生物学报,2010,26(11):1023-1027.
[16]Polak PE,Kalinin S,Feinstein DL.Locus coeruleus damage and noradrenaline reductions in multiple sclerosis and experimental autoimmune encephalomyelitis[J].Brain,2011,134(Pt 3):665-677.
[17]Weaver A,Goncalves dSA,Nuttall RK,et al.An elevated matrix metalloproteinase(MMP)in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization[J].FASEB J,2005,19(12):1668-1670.
[18]申丽萍.多发性硬化的临床治疗进展[J].临床医药文献电子杂志,2015,2(18):3690-3670.
[19]侯世芳,刘银红,许贤豪.多发性硬化诊断与治疗进展[J].中国现代神经疾病杂志,2014,14(10):849-853.
[20]贺电,李娅,徐竹,等.干扰素-β治疗复发-缓解型多发性硬化系统评价[J].中国现代神经疾病杂志,2014,14(9):775-788.
[21]张菲菲,李静.多发性硬化症治疗药物研究进展[J].国际药学研究杂志,2014,41(3):296-300.
[22]刘涛.中西医治疗多发性硬化进展[J].中国处方药,2016,14(2):19-20.
[23]陈克龙,樊永平.中医治疗多发性硬化临床试验疗效评价[J].辽宁中医药大学学报,2011,13(4):79-82.
[24]樊永平.多发性硬化中医病因病机和治疗[J].环球中医药,2013,6(9):668-670.
[25]于兰,赵建军.中医益髓填精,通络解毒法治疗多发性硬化的优势分析[J].中国医药指南,2014,12(36):263-265.
[26]郑子安,钟相根,贾旭,等.多发性硬化中医辨治与研究思路探讨[J].吉林中医药,2012,32(11):1092-1094.
[27]张法英.多发性硬化的中医理论文献研究[D].北京:中国中医科学院,2015.
[28]樊永平.痿证理论的源流梳理[J].北京中医药大学学报,2011,34(1):12-17.
[29]樊永平,王平,张星虎,等.二黄方治疗多发性硬化急性发作的机制研究[J].中华中医药杂志,2007,22(1):25-29.
[30]樊永平,刘秀贞,王蕾,等.二黄方对EAE大鼠外周血NK细胞和细胞因子的影响[J].北京中医药大学学报,2007,30(3):165-168.
[31]樊永平,宋丽君,叶明,等.二黄胶囊对实验性自身免疫性脑脊髓炎大鼠中枢神经系统细胞因子和淋巴细胞亚群免疫组化表达的影响[J].中国实验方剂学杂志,2010,16(5):142-146.
[32]Zheng Q,Yang T,Fang L,et al.Effects of Bu Shen Yi Sui Capsule on Th17/Treg cytokines in C57BL/6 mice with experimental autoimmune encephalomyelitis[J].BMC Complement Altern Med,2015(15):60.
[33]Brettschneider J,Maier M,Arda S,et al.Tau protein level in cerebrospinal fluid is increased in patients with early multiple sclerosis[J].Mult Scler,2005,11(3):261-265.
[35]Abdelhak A,Junker A,Brettschneider J,et al.Brain-Specific Cytoskeletal Damage Markers in Cerebrospinal Fluid:Is There a Common Pattern between Amyotrophic Lateral Sclerosis and Primary Progressive Multiple Sclerosis?[J].Int J Mol Sci,2015,16(8):17565-17588.
[36]Svarcová J,Fialová L,Bartos A,et al.Cerebrospinal fluid antibodies to tubulin are elevated in the patients with multiple sclerosis[J].Eur J Neurol,2008,15(11):1173-1179.
(2016-03-09收稿责任编辑:张文婷)
Effects of Bushen Yisui Decoction and Its Decomposed Decoctions on Expressions of p-Tau and Beta-tubulin in Brain and Spinal Cord of Mice with Experimental Autoimmune Encephalomyelitis
Shi Yimin1, Wang Yongqiang1, An Chen1, Zhao Hui1, Qi Fang1, Zhang Qiuxia1, Chen Zhenzhen1,Fan Yongping2, Li Ming1, Wang Lei1
(1 Beijing Key Lab of TCM Collateral Disease Theory Research, School of Chinese Medicine, Capital Medical University,Beijing100069,China; 2BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective: To observe effect of the Bushen Yisui Dection (BYD) and its decomposed Bushen Decoctions (BD) and Huatan Huoxue Decoction (HHD) on the expressions of p-Tau and beta-tubulin in the brain and spinal cord of mice with experimental autoimmune encephalomyelitis (EAE). Methods: C57BL/6 female mice were randomly divided into normal control (NC), model (MO) and prednisone acetate (PA), catalpol (CA), BYD, BD and HHD groups. The mice were injected subcutaneously with the antigens mixture, including 50 μg OG35-55, CFA and TB at two sites on the back on the 1st day and 7 days later, and then were injected intraperitoneally with 500 ng PTX on days 1st and 2 day later. The mice in each group were administered intragastrically once a day. Meanwhile, the body weight and neurological function of mice were observed. The brain and spinal cord of mice were removed for pathological examination on 20th and 40th day. The expressions of p-Tau and beta-tubulin were detected by immunohistochemistry analysis. Results: Compared with the MO group, the body weight and scores of mice were significantly increased in BYD, BD and HHD groups. HE staining showed a significant reduction in inflammatory cells and nuclear condensation. The expression of p-Tau was significantly reduced, while beta-tubulin was markedly increased in BYD, BD and HHD groups as well (P<0.05,P<0.01). Conclusion: BYD and its decomposed decoctions BD and HHD have neuroprotective effects on reducing weight loss and scores, inflammatory cell infiltration, axonal injury and enhancing the repair of axon in EAE mice. The effect of Bushen Yisui Decoction is more significant particularly.
Bushen Yisui Decoction and its decomposed decoctions; Multiple sclerosis; Experimental autoimmune encephalomyelitis; p-Tau; Beta-tubulin
国家自然科学基金项目(编号:81273742、81573898);北京市教委重点项目(编号:KZ201310025023);北京市属高等学校高层次人才引进与培养计划-长城学者项目(编号:CIT&TCD20140329)
师一民(1990—),男,在读硕士,首都医科大学中医药学院,研究方向:主要从事中医药防治脑病的基础研究
李明,博士,教授,首都医科大学中医药学院,Tel:(010)83911630,E-mail:13611386113@163.com;王蕾,博士,教授,首都医科大学中医药学院,Tel:(010)83911626,E-mail:tmwangl@ccmu.edu.cn
R285.5
A doi:10.3969/j.issn.1673-7202.2016.09.047
