颗石球缓解紫外辐射对颗石藻光合作用的胁迫
2016-11-12阮祚禧邹定辉许振平王婷晔黄凤英罗丽娜
阮祚禧 邹定辉 许振平 邓 誉 王婷晔 黄凤英 罗丽娜
( 1. 汕头大学科技中心海洋生物研究所,汕头 515063; 2. 厦门大学海洋环境科学国家重点实验室,厦门 361102; 3. 华南理工大学环境科学与能源学院,广州 510006;4. 暨南大学生物科学技术学院生态系,广州 510632)
颗石球缓解紫外辐射对颗石藻光合作用的胁迫
阮祚禧1,2邹定辉3许振平1邓誉1王婷晔1黄凤英1罗丽娜4
( 1. 汕头大学科技中心海洋生物研究所,汕头 515063; 2. 厦门大学海洋环境科学国家重点实验室,厦门 361102; 3. 华南理工大学环境科学与能源学院,广州 510006;4. 暨南大学生物科学技术学院生态系,广州 510632)
颗石藻(Coccolithophore)是一类胞外具有数层钙质颗石粒(Coccolith)的海洋钙化金藻,在绝大部分海域均有分布。 颗石藻通过光合固碳向深海沉降有机碳颗粒,同时其钙化作用形成的颗石粒是海底的重要沉积物。它们与钙化浮游动物翼足类(Petropod)钙化量可占海洋生物钙化量的80%,对于海洋碳、钙循环有重要意义[1,2]。
颗石藻在条件合适时,可形成大面积藻华(全球每年可达上百万平方公里)[3]。促进藻华形成的环境因素很多[4—7],其中较强的日照显得尤为重要,因此,藻华时往往伴随着较强的紫外辐射(UVR)。UVR可以透过水层数十米,到达藻华分布的位置(10-20m)[8],这意味着藻细胞往往经受较高的UVR,并需要克服其对光合作用乃至生长产生的负面影响[9—12]。那么,颗石藻又是如何应对这一胁迫的?
颗石藻表面往往覆盖一层又一层的颗石粒,形成壳状结构的颗石球(Coccosphere)。这一特殊的结构具有何种生物学功能,一直吸引很多学者关注[13,14]。早在1952年,有学者提出其可能起到反射UVR的作用的猜想[15]。最近,我们的研究显示:颗石球能够消减阳光辐射中的部分UVR,并在酸化条件下,对于细胞钙化以及颗石粒形成具有重要的影响[16]。然而,当前对于颗石粒的光学特性所知甚少,尤其是它如何影响光合作用电子传递,进而影响光合固碳。为此,本文以颗石藻的代表性种Emiliania huxleyi为材料,就颗石球光生物学功能展开研究。
1 材料与方法
1.1材料
赫氏颗石藻(Emiliania huxleyi CS369)购自澳大利亚联邦科学与工业研究组织(CSIRO)微藻中心。颗石藻以K母液加富的过滤消毒海水为培养液[17],在(18±1) ℃、光强为450 μmol/(m2·s)、光周期为14 :10(光∶ 暗)的培养箱(GXZ型,中国)中进行适应培养8d。然后接入500 mL的三角瓶中(约2.0×105cell/mL),每天更换部分培养液,大约培养8d后进行相关参数的测量。
1.2细胞粒径和颗石球厚度
细胞颗粒通过研究级显微镜(Zeiss Axioplan 2 Imaging,德国)观察,并拍取10—15张图像,用显微图像分析系统随机测量100—150个细胞的直径。其中,为获取裸细胞的直径,需用99.9%的CO2冲藻液去除颗石球。然后,颗石球的厚度可通过CO2酸化处理的裸细胞和带颗石球的完整细胞之间的粒径的差值获得。
1.3细胞扫描光谱
首先用CO2去除胞外的颗石粒,再将这些裸细胞与带颗石球的完整细胞按一定的比例混合,获得不同平均厚度的颗石球。藻液直接过滤到Whatman GF/F玻璃纤维滤膜上,并以浸泡了新鲜培养液的GF/F滤膜为空白对照,利用双通道分光光度计(Shimadzu UV2501PC,日本)获取细胞的扫描光谱[16]。由裸细胞和完整细胞的透射光谱的差值获得颗石球的吸收光谱,并计算紫外区和可见光区的平均吸光值。
由于数据是否能正确恢复是建立在收发两端达到码组同步、初始通道同步、帧/多帧同步的基础上,故通过与第三方IP核的对接可以充分验证本文设计接收同步系统的正确性。
1.4辐射处理
以太阳辐射模拟器(Realtime,德国)为光源,并利用不同的滤膜去除辐射中的多余波段:可见光(Photosynthetically Active Radiation,PAR),用Ultraphan UV Opak 395膜滤(Digefra,德国)除波长小于395 nm的辐射; 模拟全阳光辐射(PAR+UVR),用Ultraphan 295膜滤(Digefra,德国)除波长小于295 nm的辐射。其中PAR强度为91.3 W/m2[420 μmol/(m2·s)]、UVR强度为20.2 W/m2。
1.5快速光响应曲线
用脉冲调制荧光仪(Walz-WATER ED,德国)测定快速光响应曲线。快速光响应曲线的相对电子传递速率rETR计算公式[18]:
rETR=0.5×PAR×(F′m-F′s)/Fm
式中0.5表示吸收的光能在光系统Ⅰ和Ⅱ之间平均分配; F′m表示在光适应状态下,当光系统Ⅱ的所有反应中心都处于关闭态且所有非光化学过程都处于最优状态时的荧光产量; Fs表示稳态荧光产量,当外界条件保持恒定时,照射光化光后达到稳定值时的荧光产量。
1.6数据处理
2 结果
2.1颗石球的光学特性
颗石球对不同波段辐射的吸收与其平均厚度相关。就UVR的吸收率而言,颗石球厚度从0.1 μm(3.4%)增加到0.7 μm(10.5%),增加了2.1倍,但对PAR的吸收率增加更为明显(从1.3%到5.5%),提高了3.1倍(图1)。
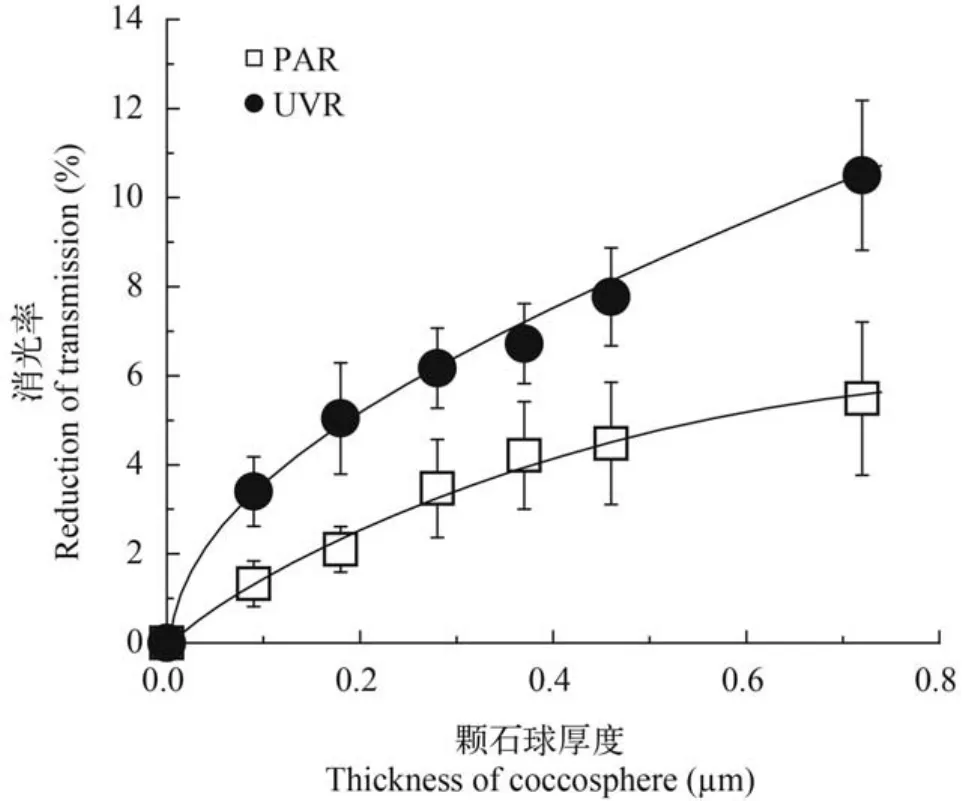
图1 颗石球对可见光(PAR)和紫外辐射(UVR)的消减Fig. 1 Reduction of transmission in photosynthetic active radiation(PAR) and ultraviolet radiation(UVR) by coccosphere of E. huxleyi
2.2颗石球的生长及其对光系统Ⅱ电子传递的影响
用CO2去除了颗石藻表面的颗石粒后,藻细胞经过4h生长直径为5.1 μm时,颗石球平均厚度约为0.1 μm(图2),细胞表面仅有少量的颗石粒出现,在显微镜中很难观察到; 再过1.5h,颗石球厚度迅速增加到0.4 μm; 7h和9h,细胞的直径为7.6和8.0 μm,基本或已形成完整的颗石球,厚度达到1.0和1.2 μm(图2)。11h,颗石球厚度为1.0 μm,略有下降,但与前2h的厚度并没有显著差别(t-test,P=0.19)。在颗石球生长的过程中,裸细胞直径并没有显著变化。
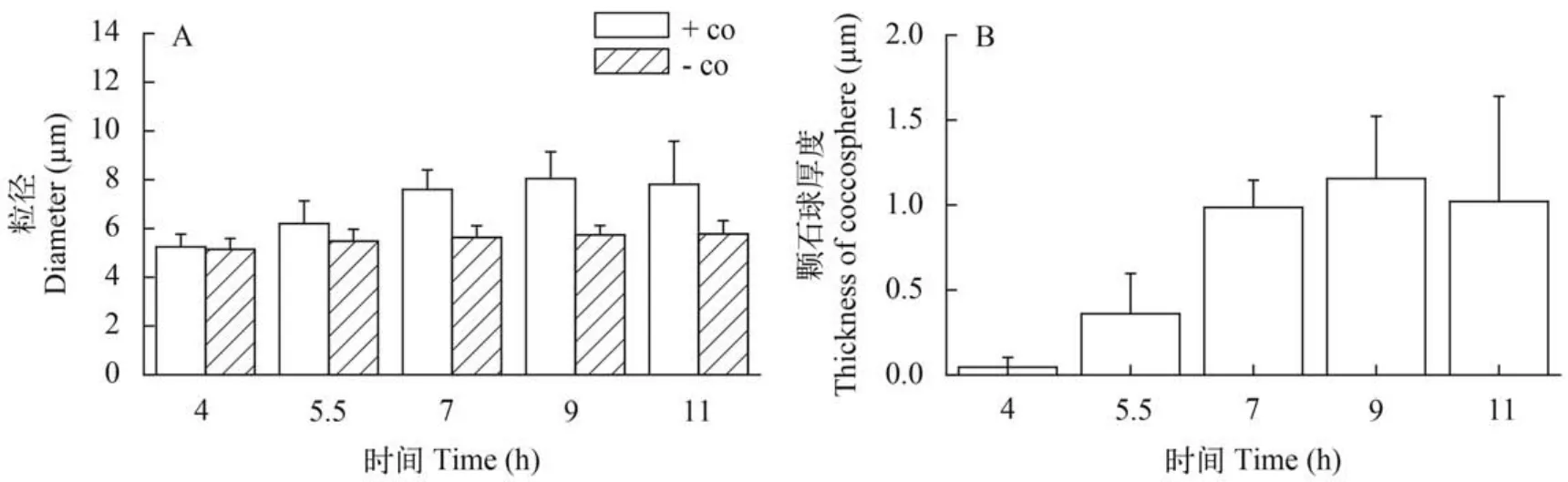
图2 E. huxley去除颗石粒后,粒径(A)和颗石球厚度(B)随时间的变化Fig. 2 After coccoliths being removed,cell size(A) and thickness of coccosphere(B) varied with time -co,用CO2去除了颗石球的裸细胞;+co,带有颗石球的完整细胞-co:cells treated with CO2; +co:untreated cells
颗石球厚度为0、1.0和1.2 μm的藻细胞(颗石粒被CO2去除后的1h、7h和9h)经过1h的辐射处理(PAR或PAR+UVR),它们的响应各不相同。仅接受PAR时,这些细胞的快速光响应曲线基本相互重合(图3),rETRmax、Ek以及a之间没有显著差异(表1),显示颗石球对光系统Ⅱ电子传递基本没影响。接受PAR+UVR处理时,裸细胞的电子传递速率受UVR的抑制最为明显,rETRmax仅为66±7,相对于PAR(156±3),电子传递速率下降了57.7%,大致是颗石球厚度为1.0和1.2 μm的颗石藻的下降幅度的3倍和6倍; 而最大量子产率a也有类似的情况,颗石球厚度为0、1.0和1.2 μm的藻细胞,分别被UVR抑制了60.5%、12.7%和8.8%,裸细胞的UVR抑制率是带颗石球细胞的1.5—7倍,但饱和光强Ek似乎并不受UVR的影响。
3 讨论
颗石粒具有特殊的光学特性[19],使得颗石球能够滤除部分PAR和有害UVR,尤其对于后者,其滤除的比率甚至是前者的5倍左右(图1); 并且随着胞外颗石粒层数的增加,其消减的阳光辐射能力也增强。颗石球所消减的PAR似乎还不足以影响光系统Ⅱ的电子传递(图3)和最终的光合固碳[16],但其所消减的UVR,则能有效减少UVR对藻细胞光合作用所产生的胁迫。因此,颗石粒及其形成的颗石球除了具有调节浮力等功能外[13],还具有透过可用于光合固碳的PAR而消减有害UVR的作用,改变微辐射环境的功能。
3.1颗石球的光学特性
Quintero-Torres等[19]的模拟研究表明,Calcidiscus leptoporus和Helicosphaera carteri的颗石粒可显著地反向散射UVR,而对可见光(400—700 nm)的反向散射率则低得多,从而有利于这部分光进入细胞。虽然这两种颗石粒的晶体类型与E. huxleyi的并不相同[20],但特有的晶体构造方式,可能导致它们具有相似的光学特性。此外,颗石粒的大小也能直接影响其对光的散射。E. huxleyi的颗石粒的大小约为(1—2 μm),相对于>2 μm的颗粒,该尺寸的方解石能更有效地散射海水中的光[21],尤其是对波长<500 nm的辐射更为明显[22]。由此,细胞表面的颗石球较薄的时候,吸光区主要集中在波长小于500 nm的辐射,尤其是紫外区[16]。
随着颗石粒层数增加,颗石球变厚,所消减的光谱也产生变化。厚度为0.7 μm的颗石球可消减11%UVR和5%PAR(图1); 当颗石球增加到1.2 μm,可消减大约20%—25%UVR和10%—15%PAR[16]。研究显示,颗石球可显著增强侧向(90度)散射光[23],可能是不同的颗石粒之间的相互叠加增强了颗石球的反射和散射。
3.2颗石球对颗石藻光合作用的影响
本文颗石藻的饱和光强在500 μmol/(m2·s)左右,与之前的相关报道大致相当[8,24]。颗石球被除去后,颗石藻的饱和光强虽然略微有点减少,但并不显著,此外量子产率和最大相对电子传递速率也没有受到影响(表1),显示颗石球所消减PAR对E. huxleyi影响不大,可能与颗石藻本身耐受高光的生理特性有关[8,25]。
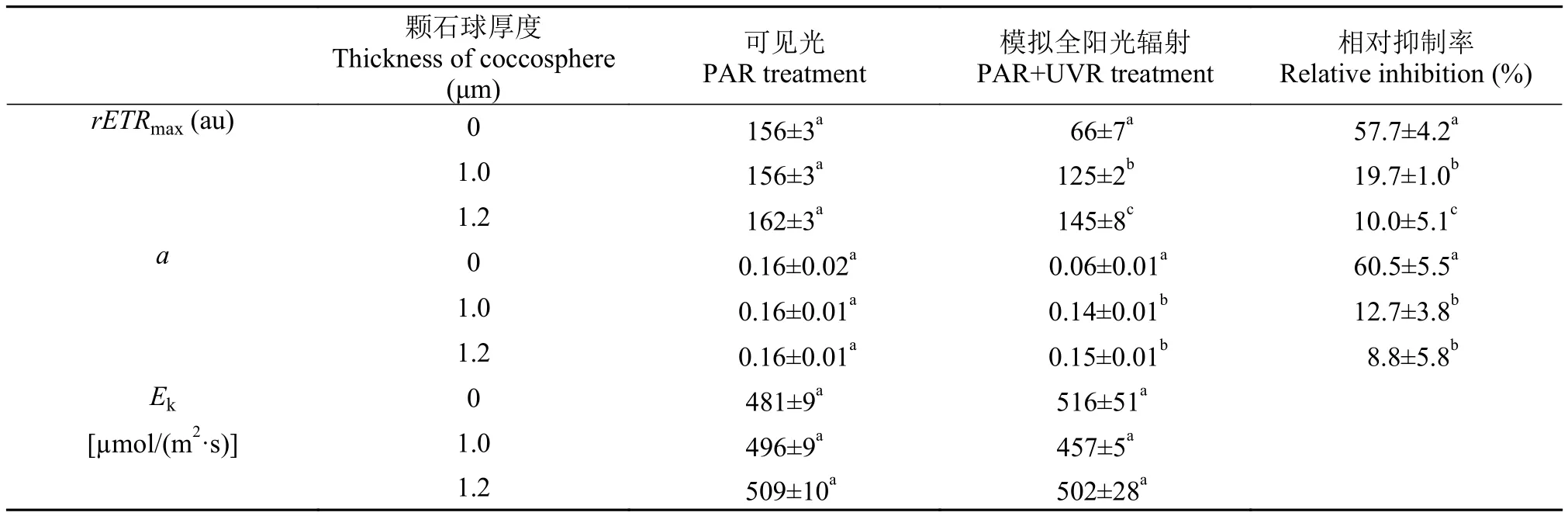
表1 相对电子传递速率参数Tab. 1 Relative electron transport parameters calculated from rapid light curve shown as Fig. 3
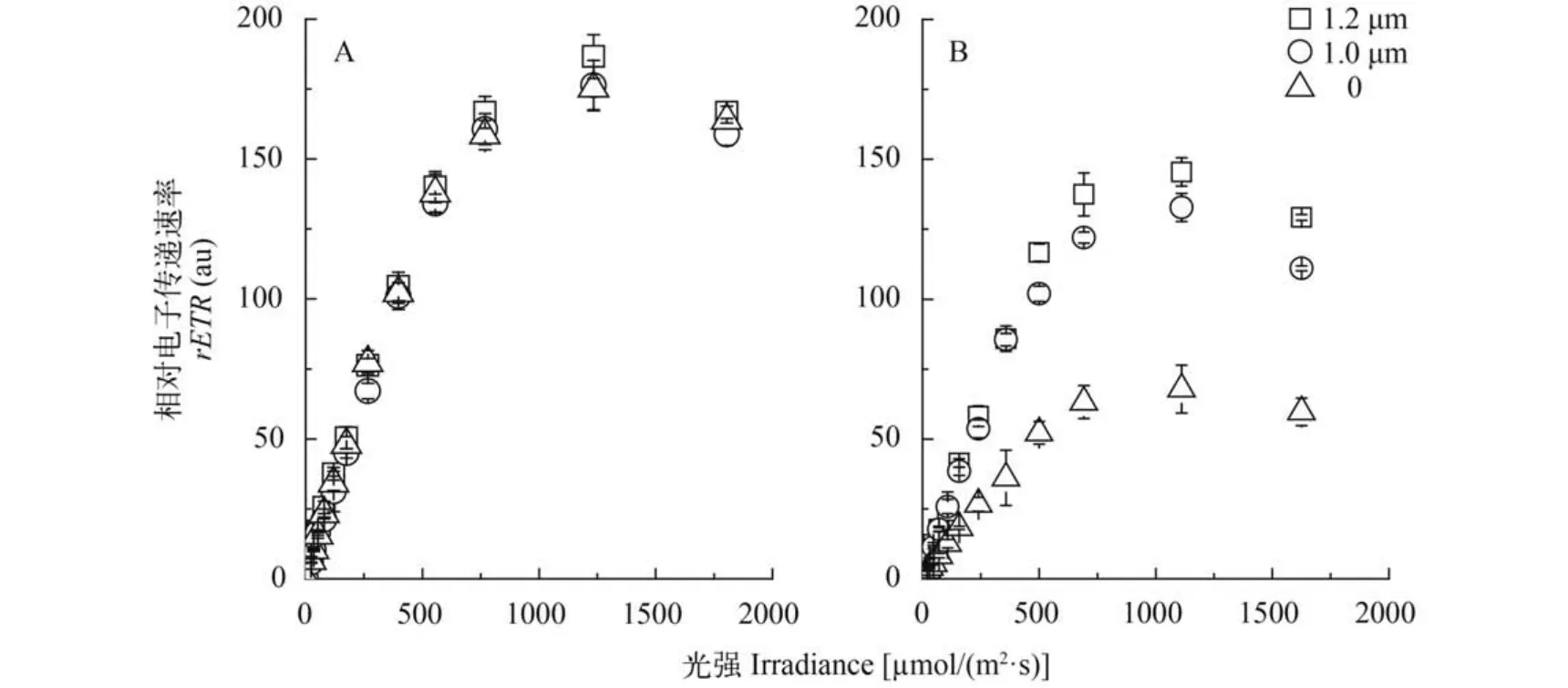
图3 在可见光(PAR,A)和模拟全阳光辐射(PAR+UVR,B)条件下颗石球对E. huxleyi快速光响应曲线的影响Fig. 3 Effects of coccosphere on rapid light curve of E. huxleyi after one hour of exposure to photosynthetically active radiation(PAR,A)or photosynthetically active radiation plus ultraviolet radiation(PAR+UVR,B)
与PAR不同,颗石藻对UVR显得非常敏感。E. huxleyi生长下降一半时,所接受UVR的剂量仅为其他浮游植物下降一半时的1/4,甚至更少[26],少量增加UVR的剂量就能导致藻细胞的电子传递抑制显著增强(表1)。如果按照1.2 μm颗石球消减约1/4的UVR计算[16],去除颗石粒的裸细胞仅多接受约1.25 W/m2的UVR,但其最大电子传递速率抑制率就增加了接近5倍(表1)。原位实验的结果显示,浮游植物的光合固碳能力受UVB抑制的部分,往往与UVB强度而不是剂量有关[27],因此颗石球通过反射或散射的方式降低细胞接收UVR的强度和剂量,对于颗石藻细胞抵御UVR,保护光系统起着重要的作用[11]。此外,UVR不仅能使光系统Ⅱ的反应中心蛋白降解失活[28],还会间接抑制和减缓这一损伤的修复[29,30],降低光系统Ⅱ反应中心的修复能力。因此,在UVR胁迫下,往往协同产生高光胁迫[25]。在这种情况下,颗石球所滤除的部分PAR(图1),也可能在一定程度上有助于缓解光抑制。
3.3颗石球生长与昼夜光周期相适应
通常夜间,颗石藻进行细胞分裂,胞外颗石粒脱落,钙化速率仅为光照条件下的十分之一,甚至更低[14]。当太阳刚刚升起的时候,新形成的颗石粒层较薄,有利于适应日出的早期阶段:阳光辐射较弱,加上阳光进入海水的角度较小,水中的光强低于其光合作用的光补偿点。颗石球的这一特性,有利于颗石藻能最大限度的利用光驱动电子传递和光合固碳。随着日照增加,尤其到了8点前后,阳光辐射往往达到甚至超过了颗石藻的饱和光强[约400—500 μmol/(m2·s)左右],钙化作用也达到最大[24]。再经过2—4h的生长,在正午前后可形成完整的颗石球(图2)。此时,海面的阳光辐射可达到1000—1500 μmol/(m2·s)(UVR 37—55 W/m2),甚至更高[8],而颗石球的厚度也达到最大值(图2),从而有助于消除部分的UVR和PAR,减少由此带来的胁迫。可见,颗石球厚度变化的节律与阳光辐射的变化相适应,可消减高光和UVR对光合作用所带来的负面影响,起到保护的作用。
[1]Milliman J D. Production and accumulation of calcium carbonate in the ocean:Budget of a nonsteady state [J]. Global Biogeochemical Cycles,1993,7(4):927—957
[2]Westbroek P,Young J,Linschooten K. Coccolith production(biomineralization) in the marine alga Emiliania huxleyi [J]. The Journal of Protozoology,1989,36(4):368—373
[3]Brown C W,Yoder J A. Coccolithophorid blooms in the global ocean [J]. Journal of Geophysical Research:Oceans(1978-2012),1994,99(C4):7467—7482
[4]Tyrrell T,Merico A. Emiliania huxleyi:bloom observations and the conditions that induce them [A]. In:Thierstein H R,Young J R(Eds.),Coccolithophores:From Molecular Processes to Global Impact [C]. Berlin:Springer. 2004,75—97
[5]Oguz T,Merico A. Factors controlling the summer Emiliania huxleyi bloom in the Black Sea:A modeling study [J]. Journal of Marine Systems,2006,59(3):173—188
[6]Highfield A,Evans C,Walne A,et al. How many Coccolithovirus genotypes does it take to terminate an Emiliania huxleyi bloom [J]? Virology,2014,466:138—145
[7]Hovland E K,Hancke K,Alver M O,et al. Optical impact of an Emiliania huxleyi bloom in the frontal region of the Barents Sea [J]. Journal of Marine Systems,2014,130:228—240
[8]Nanninga H,Tyrrell T. Importance of light for the formation of algal blooms by Emiliania huxleyi [J]. Marine Ecology Progress Series,1996,136(1):195—203
[9]Gieskes W,Buma A. UV damage to plant life in a photobiologically dynamic environment:the case of marine phytoplankton [J]. Plant Ecology,1997,128(1):16—25
[10]Garde K,Cailliau C. The impact of UV-B radiation and different PAR intensities on growth,uptake of14C,excretion of DOC,cell volume,and pigmentation in the marine prymnesiophyte,Emiliania huxleyi [J]. Journal of Experimental Marine Biology and Ecology,2000,247(1):99—112
[11]Buma A G,Van Oijen T,Van De Poll W,et al. The sensitivity of Emiliania huxleyi(Prymnesiophyceae) to ultraviolet-B radiation [J]. Journal of Phycology,2000,36(2):296—303
[12]Xing T,Gao K,Beardall J. Response of growth and photosynthesis of Emiliania huxleyi to visible and UV irradiances under different light regimes [J]. Photochemistry and Photobiology,2015,91(2):343—349
[13]Young J R. Functions of coccoliths [A]. In:Winter A,Siesser W G(Eds.),Coccolithophores [C]. Cambridge:Cambridge University Press. 1994,63—82
[14]Paasche E. A review of the coccolithophorid Emiliania huxleyi(Prymnesiophyceae),with particular reference to growth,coccolith formation,and calcification-photosynthesis interactions [J]. Phycologia,2002,40(6):503—529
[15]Braarud T,Gaarder K R,Markali J,et al. Coccolithophorids studied in the electron microscope. Observations on Coccolithus huxleyi and Syracosphaera carterae [J]. Nytt Magasin for Botanik,1952,1:129—134
[16]Gao K,Ruan Z,Villafane V E,et al. Ocean acidification exacerbates the effect of UV radiation on the calcifying phytoplankter Emiliania huxleyi [J]. Limnology and Oceanography,2009,54(6):1855—1862
[17]Keller M D,Selvin R C,Claus W,et al. Media for the culture of oceanic ultraphytoplankton [J]. Journal of Phycology,1987,23(4):633—638
[18]Ralph P J,Gademann R. Rapid light curves:a powerful tool to assess photosynthetic activity [J]. Aquatic Botany,2005,82(3):222—237
[19]Quintero-Torres R,Aragón J,Torres M,et al. Strong farfield coherent scattering of ultraviolet radiation by holococcolithophores [J]. Physical Review E,2006,74(3):32901
[20]Pienaar R N. Ultrastructure and calcification of coccolithophores [A]. In:Winter A,Siesser G W(Eds.),Coccolithophores [C]. Cambridge:Cambridge University Press. 1994,13—37
[21]Balch W M,Kilpatrick K A,Holligan P,et al. The 1991 coccolithophore bloom in the central North Atlantic. 2. Relating optics to coccolith concentration [J]. Limnology and Oceanography,1996,41(8):1684—1696
[22]Tyrrell T,Holligan P,Mobley C. Optical impacts of oceanic coccolithophore blooms [J]. Journal of Geophysical Research:Oceans(1978-2012),1999,104(C2):3223—3241
[23]Balch W M,Kilpatrick K,Holligan P M,et al. Coccolith production and detachment by Emiliania huxleyi(Prymnesiophyceae) [J]. Journal of Phycology,1993,29(5):566—575
[24]Nimer N,Merrett M. Calcification rate in Emiliania huxleyi Lohmann in response to light,nitrate and availability of inorganic carbon [J]. New Phytologist,1993,123(4):673—677
[25]Heraud P,Beardall J. Changes in chlorophyll fluorescence during exposure of Dunaliella tertiolecta to UV radiation indicate a dynamic interaction between damage and repair processes [J]. Photosynthesis Research,2000,63(2):123—134
[26]Peletier H,Gieskes W,Buma A. Ultraviolet-B radiation resistance of benthic diatoms isolated from tidal flats in the Dutch Wadden Sea [J]. Marine Ecology Progress Series,1996,135(1):163—168
[27]Buma A G,Helbling E W,De Boer M K,et al. Patterns of DNA damage and photoinhibition in temperate South-Atlantic picophytoplankton exposed to solar ultraviolet radiation [J]. Journal of Photochemistry and Photobiology B:Biology,2001,62(1):9—18
[28]Melis A,Nemson J A,Harrison M A. Damage to functional components and partial degradation of photosystem Ⅱ reaction center proteins upon chloroplast exposure to ultraviolet-B radiation [J]. Biochimica et Biophysica Acta(BBA)-Bioenergetics,1992,1100(3):312—320
[29]Murata N,Takahashi S,Nishiyama Y,et al. Photoinhibition of photosystem Ⅱ under environmental stress [J]. Biochimica et Biophysica Acta(BBA)-Bioenergetics,2007,1767(6):414—421
[30]Bouchard N,Campbell D A,Roy S. Effects of UV-B radiation on the D1 protein repair cycle of natural phytoplankton communities from three latitudes(Canada,Brazil,and Argentina) [J]. Journal of Phycology,2005,41(2):273—286
COCCOSPHERE RELIEVES THE STRESS OF ULTRAVIOLET RADIATION ON PHOTOSYNTHESIS IN THE COCCOLITHOPHORID EMILIANIA HUXLEYI
RUAN Zuo-Xi1,2,ZOU Ding-Hui3,XU Zheng-Ping1,DENG Yu1,WANG Ting-Ye1,HUANG Feng-Ying1and LUO Li-Na4
(1. Marine Biology Institute & Guangdong Provincial Key Laboratory of Marine Biotechnology,Science Center,Shantou University,Shantou 515063,China; 2. State Key Laboratory of Marine Environmental Science,Xiamen University,Xiamen 361102,China;3. College of Environment and Energy,South China University of Technology,Guangzhou 510006,China;4. Institute of Hydrobiology,Jinan University,Guangzhou 510632,China)
Emiliania hulxeyi;颗石球;紫外辐射;相对电子传递速率
Emiliania hulxeyi; Coccosphere; Ultraviolet radiation(UVR); Relative electron transport rates(rETR)
Q142.6
A
1000-3207(2016)05-1078-05
10.7541/2016.139
2015-10-12;
2016-01-25
汕头大学青年基金(YR13002); 近海海洋环境科学国家重点实验室(厦门大学)访问学者与开放课题(MELRS1305); 广东省大学生创新创业训练计划项目(201510560079); 国家自然科学基金(31370476); 广东省海洋渔业科技与产业发展专项(A201401D03); 广东省科技计划项目(2014A020217005); 广东省产学研项目(2012B091100341)资助 [Supported by Foundation of Shantou University(YR13002); Visiting Scholar Program of State Key Lab of Marine Environmental Science(Xiamen University)(MELRS1305); University Student Innovation Improvement Project of Guangdong(201510560079),National Natural Science Foundation of China(31370476); Fishery Science and Technology and Industry Development Project of Guangdong(A201401D03); Science and Technology Program of Guangdong(2014A020217005); Special Project on the Integration of Industry;Education and Research of Guangdong Province(2012B091100341)]
阮祚禧(1976—),男,福建省尤溪县人;博士;主要从事藻类生理生态学研究。E-mail:run@stu.edu.cn
