红光下培养方式对雨生红球藻细胞增殖及其活力的影响
2016-11-12王建沅周成旭严小军徐继林骆其君吴小凯
罗 杰 王建沅 周成旭 严小军 徐继林 骆其君 马 斌 吴小凯
(宁波大学海洋学院,宁波 315211)
红光下培养方式对雨生红球藻细胞增殖及其活力的影响
罗杰王建沅周成旭严小军徐继林骆其君马斌吴小凯
(宁波大学海洋学院,宁波 315211)
雨生红球藻;绿色细胞;红光;培养方式
研究重点针对雨生红球藻绿色游动细胞的增殖培养阶段,分析了在利于细胞增殖的红光条件下,几种培养方式的调整对增殖过程和细胞活力的影响。结果显示:(1)在红光下,增殖平台期维持时间长,细胞活力稳定,细胞中性脂无累积,但进入平台期前,细胞中性脂有规律波动,进入平台期后相对稳定; 通过更新率为20%的半连续培养,细胞数产出较批次培养提高57%; 半连续培养中细胞呈现胁迫调节的时间较批次培养晚。随着培养时间增加,半连续培养下细胞营养盐吸收能力降低。(2)初始接种密度与细胞增殖速率及细胞光合活力呈负相关:初始密度低的细胞增殖速率较高,细胞光合作用活力高。(3)在培养过程中添加CO2时,最大密度均有提高,达6.0×105cells/mL,较无添加组提高54%; 细胞分裂速率均有提高,但红光下较白光下增殖速率高(分别为0.223/d和0.198/d); 添加CO2降低培养液pH,利于维持适宜增殖的pH环境。叶绿素荧光参数以及细胞粒径在红光和白光下有显著差异:红光下,Fv/Fm显著高于白光下; 红光下补充CO2显著减小细胞粒径,而白光下粒径无显著变化。研究结果显示,在红光下,采用间断式半连续培养补充CO2培养绿色游动细胞,有利于提升细胞活力与产出。
虾青素是一种次生类胡萝卜素,具有艳丽的色泽以及强的抗氧化能力,被应用于水产养殖、食品添加剂、化妆品和医药等众多领域[1]。能合成虾青素的生物有甲壳类生物、酵母以及一些微型藻类。虾青素也可人工合成[2]。雨生红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻。其休眠孢囊内虾青素含量可占到细胞干重的4%[3]。不仅如此,红球藻来源的天然虾青素生物活性及其安全性均高于人工合成虾青素或其他生物来源的虾青素[4,5],因此,红球藻是生产优质虾青素的理想材料。
培养雨生红球藻生产虾青素的工业实践依赖于红球藻的生物学特征。红球藻生活史周期有典型的绿色游动细胞期和红色休眠孢囊期。绿色游动细胞具有高的光合效率及细胞活性,以及活跃的细胞分裂能力,是红球藻生产中实现高生物量的关键阶段; 受环境条件胁迫时,细胞逐渐转入红色休眠孢囊阶段,此期细胞分裂速率下降并大量累积虾青素[6],是虾青素生产的关键阶段。因此,工业生产上常采用两步法培养[7,8]:第一步,绿色细胞增殖培养,以获得最大生物量为阶段目标; 第二步,通过光、盐、营养盐胁迫或添加胡萝卜素合成的前体底物等手段[9,10],达到虾青素最大最优化累积。另外,细胞在两步骤转换过程中可能因胁迫造成死亡而造成生产损失,转换界面阶段细胞状态也是整个工艺流程中的关键环节[11]。并且,对高活力的营养细胞进行胁迫,所能合成的虾青素比细胞活力低的细胞合成的虾青素含量更高[12—14]。因此,以高产优质虾青素为目标进行红球藻培养时,获得最大密度且高活力的绿色细胞是产量与质量的基础保障[15]。但是,生产实践中一个关键的瓶颈即是绿色游动细胞生物量低[16,17],细胞密度一般都低于5.0×105cells/ mL[18]。其原因与红球藻细胞对环境条件变化异常敏感有关,常造成培养过程中的细胞分裂速度慢、活力低。因此,如何优化绿色细胞增殖条件获得最大最优化细胞产出是第一步生产的关键。
光强和光质都对细胞分裂、细胞状态及其周期间转化产生影响[19]。红色光质能促进雨生红球藻绿色细胞生长已被大多数研究者所接受并不断进行其条件优化的研究[14,20,21]。吴霞等将红色转光膜应用于红球藻养殖,发现生物量明显得到了改善,比普通聚乙烯塑料薄膜提高了8.8%以上[22]。在绿色细胞培养阶段,增加红色光质比例可以明显利于绿色细胞增殖[23]。王建沅等[24]研究了红光下红球藻增殖过程受营养盐调节特征发现,由于起始营养盐浓度对初期增殖、细胞最大产量以及增殖时间都有影响,认为半连续培养是适宜红球藻绿色细胞生长的一种培养方式。虽然不少研究已经证明,光质在红球藻生产虾青素全程具有重要的作用,尤其是两步培养法工艺中分别提供红、蓝单色光质可有效提高阶段目标培养物产量,并且LED光照技术也为优化工艺提供了条件。但是,分段分光质方法尚未广泛应用到实际生产中、红球藻不同株系特征及其各种养殖条件常各不相同,要保障成功且可持续优质高产,尚需大量综合研究与分析。
本研究针对雨生红球藻绿色细胞培养阶段的优化调节进行研究,分析红光条件下几种培养方式对细胞增殖及其过程的影响。主要比较了批次培养和半连续培养的过程差异; 批次培养方式下,不同初始接种密度对细胞增殖过程的影响; 以及批次培养中补充CO2对细胞增殖过程及细胞粒径的影响,以期为红球藻生产工艺优化提供理论参考。
1 材料与方法
1.1藻种与培养基
雨生红球藻购于中科院水生所,品系为797。于宁波大学微藻种质室保种,保种及实验所用培养基为BG11或NMB3#培养基[24]。
1.2实验方法与条件设置
红光条件下,红球藻的半连续培养与批次培养过程比较取预培养至指数期藻液,接种至6个装有新鲜配制NMB3#培养基的锥形瓶中,初始接种密度为3.2×104cells/mL,体积为400 mL。各取3瓶设置批次培养和半连续培养目标。半连续培养方式下,待各组增殖至平台期时,进行更新处理,每次更新20%,共进行3次间隔时间为6d的更新(F1、F2、F3)。各组均置于温度为23℃、红色LED光照为36 μmol/(m2·s)(L∶D=12∶12)的培养室中。在培养过程中,隔天分别取样,检测叶绿素荧光参数、细胞密度、氮磷营养盐浓度变化以及细胞中性脂变化。用Water-PAM叶绿素荧光仪检测叶绿素荧光参数。细胞密度以浮游植物计数框计数(北京普利特仪器公司)。氮磷浓度以Smartchem 全自动化学分析仪200分析,实验中取水样冻存,待全部实验结束后低温避光解冻后检测。细胞中性脂检测参考王金娜等[25]的方法,以尼罗红试剂进行细胞染色后,检测吸光值进行分析。
在红光条件下不同初始接种密度对红球藻批次培养细胞增殖及其过程的影响取预培养至平台初期红球藻液,密度约为5.0×104cells/mL,以新鲜配制NMB3#培养液进行稀释,形成不同稀释度的4组初始接种密度,稀释比例分别为:密度Ⅰ(藻液/培养液=1∶5)、密度Ⅱ(藻液/培养液=1∶10)、密度Ⅲ(藻液/培养液=1∶15)、密度Ⅳ(藻液/培养液= 1∶20)。实验水体200 mL,设置3个平行实验。置于温度为25℃、红色LED光照为65 μmol/(m2·s)(L∶D=12∶12)的培养室中。每日上下午各摇瓶一次。隔天分别取样检测细胞密度和叶绿素荧光参数变化。
添加CO2对批次培养细胞增殖过程及其细胞大小的影响取预培养至指数期的藻液(1.5×105cells/ mL) 500 mL,接种至1000 mL BG11培养液中(3000 mL锥形瓶,培养水体体积1500 mL),初始密度为5.0×104cells/mL。为了比较复合白色光源和红色LED光源下微藻受CO2影响的差异,本研究于相同光强的白光与红光条件下,分别设置CO2添加组与不加CO2的对照组,形成红光实验组(加CO2)RLED+ CO2和对照组RLED以及白光实验组(加CO2)CWh+ CO2及其对照组CWh。各3平行,置于温度为25℃,光照强度为30 μmol/(m2·s)(L :D=12 :12)的培养室中培养,每日定期摇瓶三次。采用4L CO2钢瓶,通过磁力阀以及CO2细化器,通入微量细化CO2,根据预实验结果,CO2添加组的添加量设为0.3 mL/min,昼通夜关。每12h 取样检测培养液pH,隔天检测叶绿素荧光参数Fv/Fm。为了分析细胞大小在培养过程中的相应变化,本实验隔天取样,以CASY颗粒计数仪(Innovatis,Germany)检测细胞数和细胞粒径。
1.3数据分析
其中:N为T天时的细胞浓度,N0为初始细胞浓度。
细胞生产力[cells/(mL·d)]按以下公式计算[26]:细胞生产力=,
其中:Ct1与Ct2分别为t1、t2所对应的细胞密度。
氮磷营养盐消耗速率的计算方法:r(%/d)=
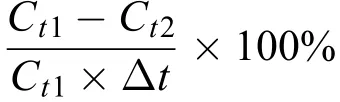
数据采用Excel 2003软件进行制图,采用SPSS 13.0单因素方差分析(one way ANOVA)执行Duncan检测分析条件的显著性(P<0.05说明条件影响显著)。采用Bivariate过程pearson相关系数双边检验进行数据分析(P<0.05说明相关性显著,P<0.01说明变量之间相关性极显著)。
2 结果
2.1在红光条件下红球藻的半连续培养与批次培养过程比较
细胞密度变化红球藻在实验设置的光照条件下能维持稳定的细胞增殖,并且在进入平台期后,批次培养及半连续方式下,藻细胞均能较长时间维持于绿色游动细胞状态而不下沉。细胞增殖情况如图1A所示。对半连续方式实验组,分别在培养的第18、第24、第30天进行20%更新。由图中结果可以看出,在细胞增殖至平台初期后,进行第1次更新时(18d),细胞密度回落至2.2×105cells/mL,但能在2d内增殖至更新前相同水平(3.3×105cells/mL),而从相似密度的指数增长期细胞(10d)批次培养增殖至该密度时需要8d时间。从细胞生产力角度的分析结果(图1B)可以看出,半连续培养方式可以显著提高细胞生产力:其细胞生产力显著大于批次培养平台期的细胞生产力(P<0.05)。由批次培养最后收获(36d,3平行总计)的细胞数为2.1×108cells,半连续培养下总计收获的细胞数为3.3×108cells,提高57%。从图1B还可以看出,进行半连续培养时,3次不同更新时间下细胞增殖能力有所不同,平台初期更新细胞的增殖恢复最快,细胞生产力最高,平台后期更新时,细胞生产力显著降低(P<0.05)。
叶绿素荧光参数变化由图2可以看出,在半连续培养方式下,更新培养液能显著提高细胞的光合能力。批次培养至平台后期时,Fv/Fm和qP均下降,说明此时细胞光合能力相对下降,电子传递速率也趋于下降。而在半连续培养方式下,更新培养液后的Fv/Fm、qP和ETR均恢复至高于批次培养组,说明其细胞光合能力提高。从NPQ的变化特征来看,指数增殖及平台前期和中期细胞的NPQ值相对稳定且数值较低,批次培养至平台后期时NPQ值显著增加,半连续培养在第3次更新后期NPQ值也相对增加,说明细胞提高光保护响应。半连续培养方式下NPQ提高的时间较批次培养时间推迟,显示细胞响应变化延后。
培养液氮磷营养盐消耗特征在实验设置的营养盐条件下,营养盐消耗迅速,8—10d 后,氮磷营养盐均消耗至低水平(图3A,B),细胞增殖进入平台前期。批次培养时,进入平台期后,氮磷营养盐维持低值,细胞数量稳定。在半连续培养方式下,更新培养液后,对氮的消耗迅速,3次更新的每日消耗率依次为42%、40%和33%,前面的两次更新后,氮浓度迅速均回复低水平。第3次更新时,氮的消耗速率降低,后续消耗率维持在16%—22%,显示随着更新次数增加,对营养盐消耗速率降低。指数增殖期对磷的消耗率与氮消耗有相似的特点,指数期最高(图3C,D),批次培养进入平台期后,仍然有磷元素的吸收消长。在半连续更新培养中,磷的消耗速率较氮消耗速率低(P<0.05)。
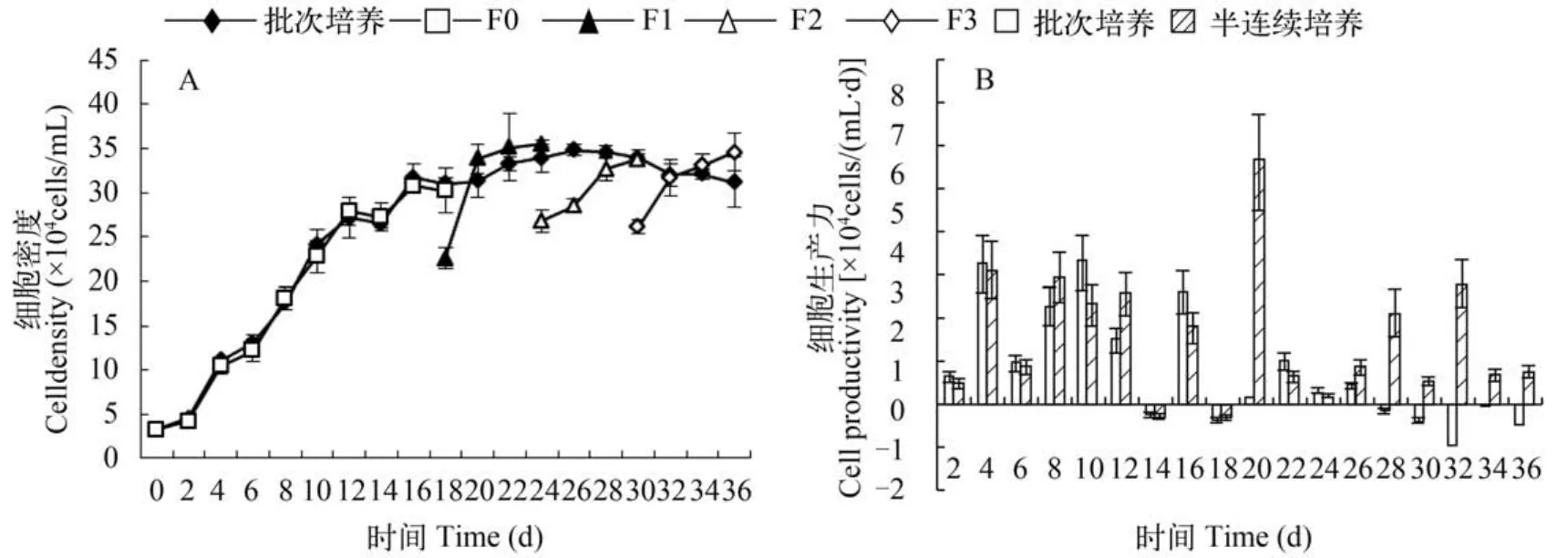
图1 半连续培养与批次培养中雨生红球藻细胞密度及细胞生产力变化Fig. 1 The cell growth and productivity in batch culture and fed-batch culture
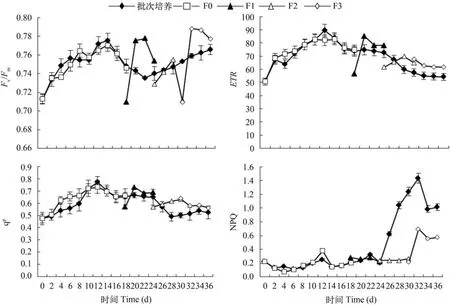
图2 半连续培养与批次培养过程中细胞叶绿素荧光参数变化Fig. 2 The change of chlorophyll fluorescence parameters in batch culture and fed-batch culture
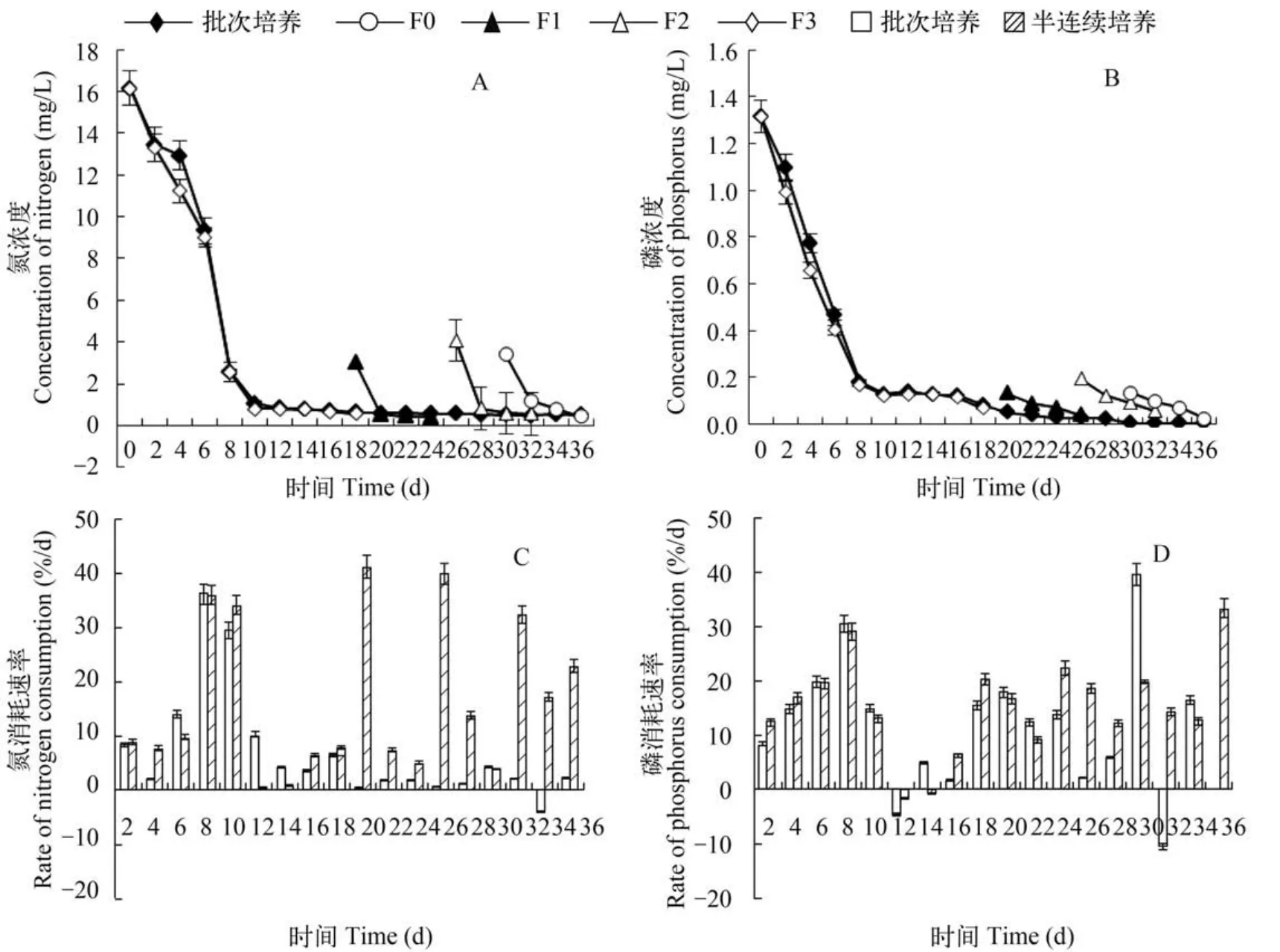
图3 半连续培养与批次培养方式下氮磷营养盐消耗特征Fig. 3 Nitrogen and phosphorus consumptions in batch culture and fed-batch culture
细胞中性脂变化以尼罗红荧光染料对红球藻细胞中性脂进行染色,通过检测细胞荧光强度变化,分析细胞增殖过程中中性脂的相对变化特征,结果如图4所示。从图中可以看出,在整个培养过程中,单位细胞中性脂的荧光值变化处于最低4最高10的相对区间中,全程平均为6.0 FI/cell,且培养始末的中性脂水平相当(7.0 FI/cell); 从接种初始到细胞指数增殖时期至平台前期(0—16d),细胞中性脂含量呈规律升降波动状态,进入平台期后,升降变化消失,单位细胞中性脂含量相对稳定。虽然图4显示平台后期批次培养的单位细胞中性脂低于半连续培养组,但因指数期时即显示该特征,可能与两种培养方式无关。在3次更新中,细胞中性脂没有显著的变化(P>0.05)。
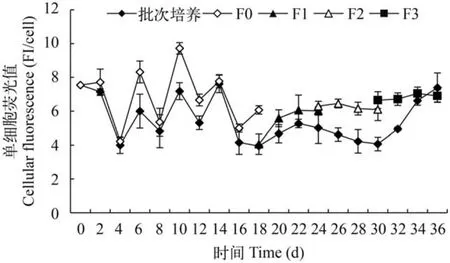
图4 半连续培养与批次培养方式下红球藻细胞中性脂的相对变化Fig. 4 The variation of cellular neutral fatty acid in batch culture and fed-batch culture
2.2在红光条件下,不同初始接种密度对红球藻批次培养细胞增殖过程影响
细胞密度的变化不同初始密度下藻细胞增殖情况如图5所示。从图中可以看出,在本研究的接种密度下,细胞迅速增殖没有停滞期。初始密度高的藻细胞其增殖速率越低,呈反相关关系(图6)。在增殖结束后,较低密度的Ⅰ、Ⅲ、Ⅳ组最终生物量无显著差异(P>0.05)。
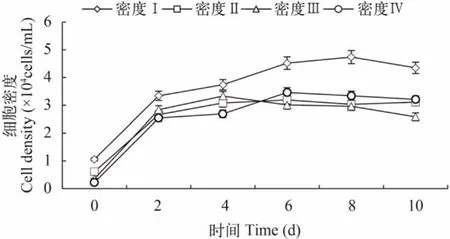
图5 不同初始接种密度下雨生红球藻的细胞增殖Fig. 5 The cell proliferation from different initial cell densities
叶绿素荧光参数的变化不同初始密度接种时,初始密度高的藻细胞光合活性明显低于初始密度低的光合活性,表现为初始密度高的密度Ⅰ组Fv/Fm和ETR在培养全程处于相对低水平,Fv/Fm仅在其初始状态以下波动; 而初始密度相对较低的密度Ⅲ和密度Ⅳ组,Fv/Fm和ETR较初始水平有一定的提升。这说明初始密度差异可影响细胞光合能力,初始接种密度低有利于提高细胞光合能力。但是NPQ和qP各组之间全程没有显著性差异(P>0.05)。
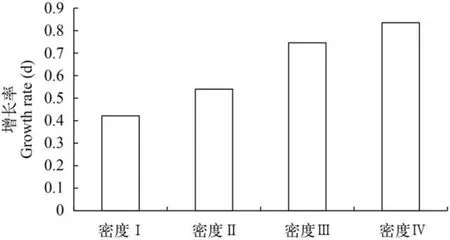
图6 不同初始接种密度下的红球藻细胞增殖速率Fig. 6 The cell growth rate of different initial cell densities
2.3添加CO2对批次培养细胞增殖过程及细胞大小的影响
细胞密度及细胞粒径变化本实验采用对静置培养的雨生红球藻液以细化散气的方式添加纯CO2,研究白色日光灯光源和红色LED光源条件下,添加CO2对绿色细胞增殖过程的影响。结果显示:添加CO2有助于红球藻绿色细胞的增殖,具体表现为延滞期显著缩短、细胞分裂速率提高(图8a,b)。其中,红光和白光下通气组细胞增殖速率分别为:0.223/d、0.198/d,无添加的对照组分别为:0.168/d、0.190/d,添加CO2对红光下的增殖速率促进作用明显。从细胞大小变化来看,红光下添加CO2实验组细胞粒径显著小于对照组(P<0.05)(图8c)。其中,实验组平均粒径为(14.6±2.4) μm,对照组为(17.6±2.6) μm。在 白光下添加CO2比对照组细胞粒径虽有降低但无显著性差异(P>0.05)(图8d)。对细胞生产力分析结果也显示(图9),在红光下添加CO2对细胞生产力有显著促进作用(P<0.05),在白光下则无稳定的促进作用,其后期的对照组细胞生产力大于实验组。
藻液pH及藻细胞光合能力(Fv/Fm)变化两种光照条件无添加C O2情况下,p H维持在10.0±0.5的较高水平,并呈现出“昼升夜降”的稳定波动(图10A,B)。在添加CO2的实验组中,培养液pH均显著下降,在本实验中添加细化后的纯CO2,pH可维持在7—8,使红球藻处于最适pH环境。
在不同光照条件下,以细化散气方式添加纯CO2对光系统Ⅱ的最大光合效率Fv/Fm的影响主要体现在细胞增殖后期,此期红光下与白光下实验组的Fv/Fm均显著大于无CO2对照组(P<0.05)(图10C,D)。说明添加CO2可有助于提升红球藻绿色细胞的光合作用活力。
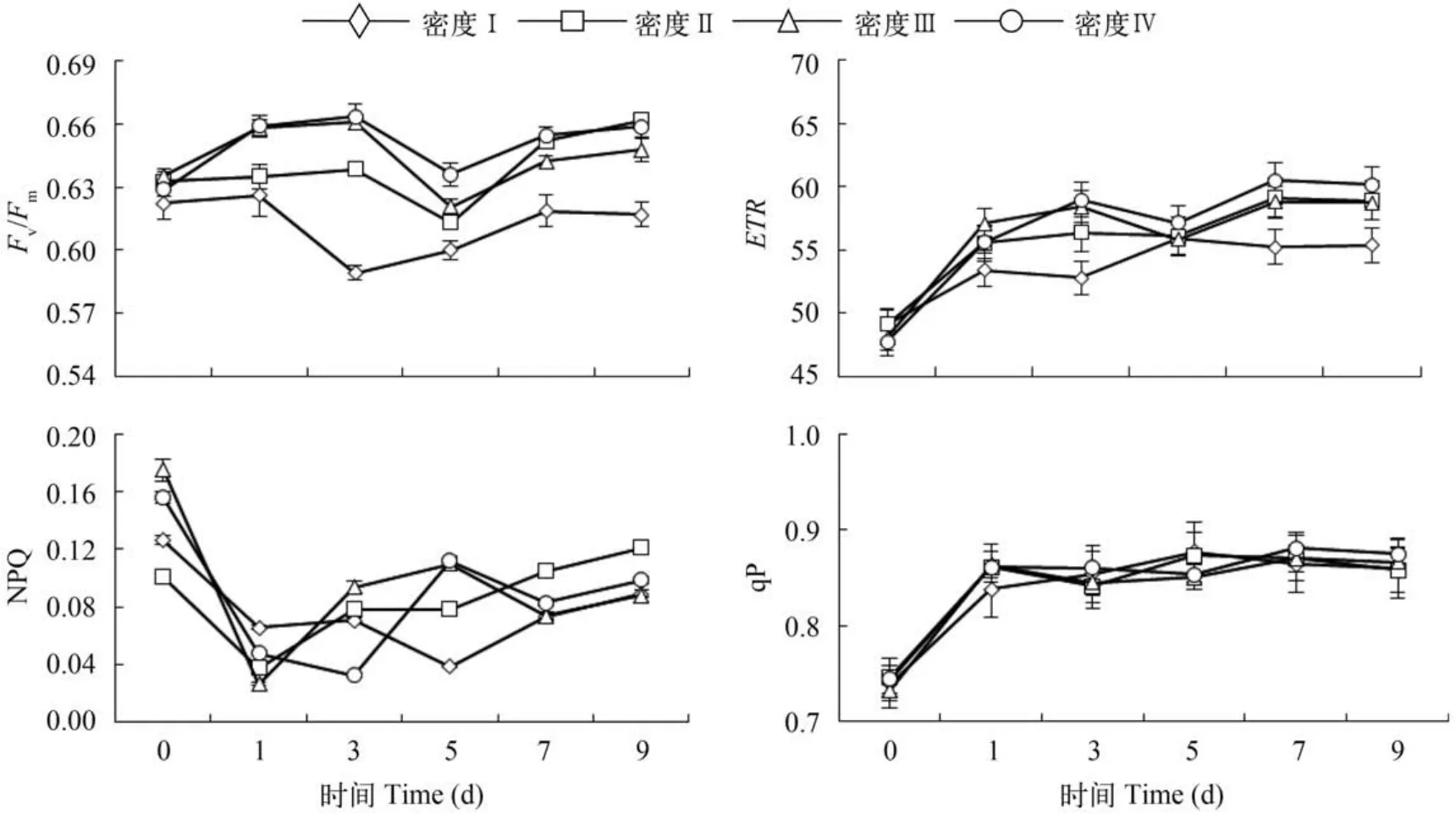
图7 不同初始接种密度下的红球藻细胞增殖过程中的叶绿素荧光参数变化Fig. 7 The variation of chlorophyll fluorescence parameters during cell proliferation from different initial cell densities
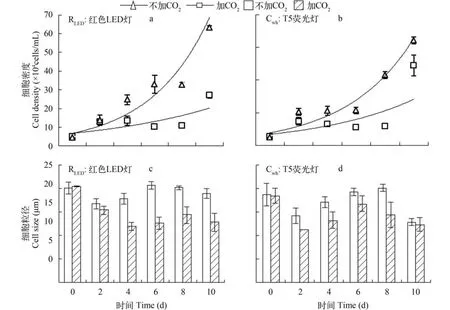
图8 红光与白光条件下通入CO2对细胞增殖与细胞粒径变化的影响Fig. 8 The cell growth and cell size under red and white light conditions with CO2bubbling in or not
3 讨论
获得最大生物量是雨生红球藻生产中的第一要务。提升生物量的前提需提升红球藻绿色细胞活力[27]。因为,虽然虾青素的含量及合成速率在红球藻各个生活周期中显著不同,但虾青素的积累速率在游动细胞和不动细胞中是相同的,游动细胞中虾青素含量低是因为它的合成速率远低于细胞的分裂速率[6]。所以,任何可限制细胞分裂的因素都会导致细胞分裂速率下降,从而导致个体细胞内虾青素的快速累积。因此在红球藻的培养中可着眼于游动细胞活力的提升。
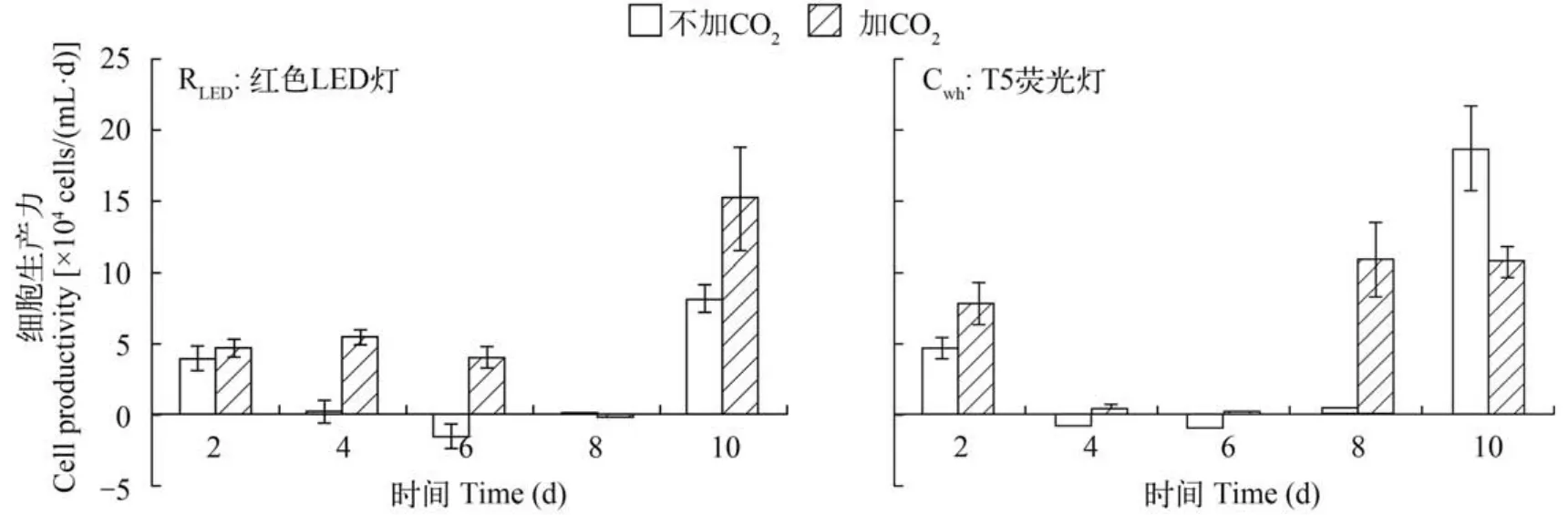
图9 红光与白光条件下添加CO2对细胞生产力的影响Fig. 9 The cell productivity under red and white light conditions with CO2bubbling in or not
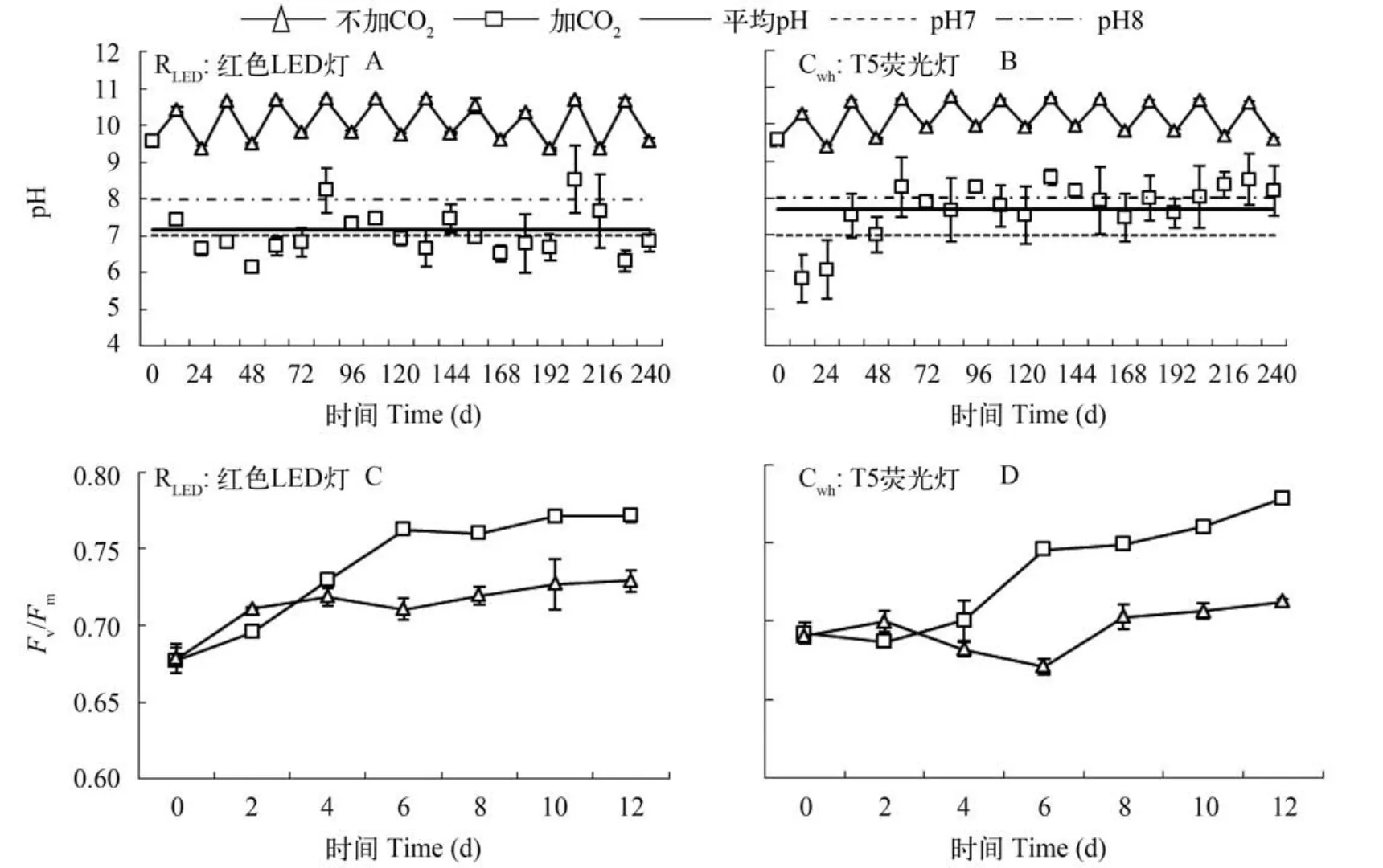
图10 添加CO2差异条件下培养液pH与藻细胞Fv/Fm变化Fig. 10 The variation of pH and Fv/Fmin different CO2condition
3.1红光下半连续培养利于提升细胞数量及细胞活力
光照影响雨生红球藻营养生长和转红,也是光生物反应器设计和开发过程中需要考虑的关键因素之一。红球藻细胞对光的变化异常敏感,不同波长的光质在生产两个阶段可能产生互逆的影响。绿色游动细胞阶段提供适宜光强的红光,消除了白光环境下因短波长光照对绿色游动细胞造成的胁迫,有利于其细胞维持长时间的绿色游动状态,维持高光合潜能以及增殖活力,从而有利于实施半连续培养方式。本研究结果显示,批次培养下平台期维持较长时间,光合荧光参数显示其细胞光合能力稳定,中性脂没有显著累积。中性脂通常是细胞受到胁迫时大量累积[28],说明细胞没有受到相关胁迫。但中性脂含量在增殖过程中的波动与细胞色素组成变化是否有相关性值得深入研究。半连续培养的细胞产出较批次培养大。光合荧光参数在每次更新时能恢复至批次培养时的水平,同期中性脂相对高于批次培养组,但未超出初始状态。在培养后期,细胞密度仍然稳定时,批次培养的NPQ值显著增加,显示细胞出现自我保护的代谢。半连续培养NPQ后期也显著提高,说明此方式下细胞相应的光保护代谢只是推迟但是仍然出现。Wang等[11]研究认为,以已经开始胁迫保护的营养细胞进行胁迫转红,有利于保护更多的细胞不受损失并且能累积更大量的虾青素。红球藻增殖后的培养液中会累积抑制细胞进一步增殖或抑制细胞活力的物质。因此,生产工艺上,是长期批次培养的绿色细胞还是半连续培养获得的更多细胞更利于转红培养,尚待研究证明。
3.2补充CO2促进雨生红球藻生长以及降低细胞粒径
红球藻培养过程中pH会不断上升,常常达10.0以上。但大多数的研究显示,红球藻生长的最适pH在中性偏碱的环境[29]。本研究无CO2添加组最高pH可达10.7,但细胞仍能增殖,光合荧光参数亦无显著下降,说明红球藻对高pH环境有一定的耐受性,这与崔宝霞等[30]的研究结果相似。但是,单纯调节pH变化对红球藻增殖的影响不明显,增殖过程中,通过酸碱调节pH在6.8—10.0,其增殖能力没有显著差异[13,14]。韦韬等[31]研究发现,较高浓度的CO2(600 cm3/m3)有利于绿色细胞光合作用的进行,同时维持培养液的pH在合适的范围,从而促进红球藻的快速生长。本研究发现,红光下补充CO2不仅能使pH处于适宜范围,还可以显著影响细胞增殖和光合能力,并能降低细胞粒径。
红球藻细胞粒径变化在生产工艺的改进上可能有重要意义。在绿色细胞培养中,因细胞年龄、不同遮光等原因,造成一次培养物中不同的细胞所含细胞色素各异,形成细胞均质性差异大,是红球藻绿色细胞高密度增殖局限的重要原因。不同于其他微型藻类,红球藻群体中单细胞可获得条件的优化是一个重要环节。红球藻细胞具有特征性的透明质套状的细胞壁,该细胞壁与原生质体之间的距离随条件变化有明显的差异。即使不考虑该特征与处于培养水体中细胞与细胞间的空间竞争是否相关,其变化必然影响细胞的大小。相对而言,小粒径细胞比大粒径细胞更利于形成高密度且高活力细胞群体,从而为高质高产的虾青素提供细胞基础。红光下细胞粒径与最大光合潜能(Fv/Fm)呈极其显著的负相关。这说明细胞粒径越小细胞的光合潜能越大、细胞生产力越高。Hata等[32]在小体积培养(500 mL)过程中能达到6.8 cells/(mL·d)的生产力。Kaewpintong等[33]在气升式光生物反应器(3000 mL)中的生产力为5.52 cells/(mL·d)。本研究在红光下添加CO2时,细胞生产力可达5—15 cells/(mL·d)。
在实际生产中,充气是一个关键环节,但是充气的强度控制很重要,以防止气泡剪切力的影响。红球藻对剪切力敏感,因此有研究者认为气升式光生物反应器比机械搅动的反应器更利于细胞存活和增殖[34]。气升式供气的同时补充一定比例的CO2
[26]。本研究提供CO2的方式为昼开夜关的细化的CO2,且为间歇式摇动的静置培养。在红光下细胞能维持相对稳定的绿色游动细胞状态,细胞的均质性好,在白天增殖pH显著上升的情况下补充CO2,使细胞没有被过分干扰的情况下均匀增殖,细胞的均质性好。CO2的通入可使得培养液中的无机碳源更多的以藻类光合作用易于吸收的自由CO2形式存在[35],这一点在实验结果中的最大光合潜能Fv/Fm得以体现,通气组较不通气组有显著提升(P<0.05)。同时,最大光合潜能Fv/Fm与细胞粒径呈极其显著的负相关(P<0.01),即细胞粒径越小细胞的光合作用效率越高。
虾青素累积阶段是营养盐胁迫有利还是营养盐足够有利,不同研究结果尚各执一词[13,14]。一方面是不同株造成的结果差异,另一方面也可能是还没有抓住根本性的问题:保持细胞的完整性与活力。氮营养盐缺乏比高光强对虾青素合成影响更大,因为缺氮使细胞停止分裂[36]。初始接种或规模生产上的细胞更新过程,都涉及到最适细胞密度与最适营养盐浓度的关系问题。虽然有高的细胞产出,但是过高的营养盐抑制初始增长[25]。本研究发现,相对低的初始密度组有高的细胞增殖能力以及高的光合能力,可能与单个细胞受光能力有关、细胞间相互遮光影响小。
综合本研究结果显示,在以培养绿色游动细胞为目标的培养阶段提供红色光照,可获得延长的平台期,以有利于进行半连续方式的更新培养,从而获得更高活力的细胞与更高生物量。但是,部分更新培养数次后,细胞呈现变化,采用间断式半连续培养方式可能更有利于提升细胞活力与产出。更新比例和更新次数尚有待于根据不同条件不同品系进行针对性研究。
[1]Lorenz R T,Cysewskt G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin [J]. Trends in Biotechnology,2000,18(4):160—167
[2]Olaizola M. Commercial development of microalgal biotechnology:from the test tube to the marketplace [J]. Biomolecular Engineering,2003,20(4—6):459—466
[3]Kaczor A,Baranska M. Structural changes of carote-noid astaxanthin in a single algal cell monitored in situ by raman spectroscopy [J]. Analytical Chemistry,2011,83(20):7763—7770
[4]Gong X D,Chen F. Influence of medium components onastaxanthin content and production of Haematococcus pluvialis [J]. Process Biochemistry,1998,33(4):385—391
[5]Johnson E A,An G H. Astaxanthin from microbial source[J]. Critical Reviews in Biotechnology,1991,11(4):297—326
[6]Chen F,Jiang Y. Microalgae Biotechnology [M]. Beijing:China Light Industry Press. 1999,195—196 [陈峰,姜悦.微藻生物技术. 北京:中国轻工业出版社. 1999,195—196]
[7]Fábregas J,Otero A,Maseda A,et al. Two stage cultures for the production of astaxanthin from Haematococcus pluvialis [J]. Journal of Biotechnology,2001,89(1):65—71
[8]Harker M,Tsavalos A J,Young A J. Factors responsible for astaxanthin formation in the chlorophyte Haematococcus pluvialis [J]. Bioresource Technology,1996,55(3):207—214
[9]Kobayashi M,Kakizono T,Nagai S. Enhanced carotenoids biosynthesis by oxidative stress in acetate induced cyst cells of a green unicellular alga,Haematococcus pluvialis [J]. Applied and Environmental Microbiology,1993,59(3):867—873
[10]Fábregas J,Domínguez A,Maseda A,et al. Interactions between irradiance and nutrient availability during astaxanthin accumulation and degradation in Haematococcus pluvialis [J]. Applied Microbiology and Biotechnology,2003,61(5—6):545—551
[11]Wang B B,Zhang Z,Hu Q,et al. Cellular capacities for high-light acclimation and changing lipid profiles across life cycle stages of the green alga Haematococcus pluvialis [J]. PLoS One,2014,9(9):1—12
[12]Lababpour A,Shimahara K,Hada K,et al. Fed-Batch culture under illumination with blue light emitting diodes(LEDs) for astaxanthin production by Haematococcus pluvialis [J]. Journal of Bioscience and Bioengineering,2005,100(3):339—342
[13]Lababpour A,Hada K,Shimahara K,et al. Effects of nutrient supply methods and illumination with blue light emitting diodes(LEDs) on astaxanthin production by Haematococcus pluvialis [J]. Journal of Bioscience and Bioengineering,2004,98(6):452—456
[14]Katsuda T,Lababpour A,Shimahara K,et al. Astaxanthin production by Haematococcus pluvialis under illumination with LEDs [J]. Enzyme and Microbial Technology,2004,35(1):81—86
[15]Kang C D,Han S J,Choi S P,et al. Fed-batch culture of astaxanthin-rich Haematococcus pluvialis by exponential nutrient feeding and stepwise light supplementation [J]. Bioprocess and Biosystems Engineering,2010,33(1):133—139
[16]Lorenz R T,Cysewski G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin [J]. Trends in Biotechnology,2000,18(4):160—167
[17]Olaizola M. Commercial production of astaxanthin from Haematococcus pluvialis using 25,000-liter outdoor photobioreactors [J]. Journal of Applied Phycology,2000,12(3):499—506
[18]Zhang Z. Biological characteristics of Haematococcus pluvialis in high cell density system [D]. Thesis for Master of Science. Institute of Oceanology,Chinese Academy of Sciences,Qingdao. 2003 [张展. 雨生红球藻生物学特性的高密度效应. 硕士学位论文,中科院海洋研究所,青岛. 2003]
[19]Zheng J,Hu M J,Guo Y P. Regulation of photosynthesis by light quality and its mechanism in plants [J]. Chinese Journal of Applied Ecology,2008,19(7):1619—1624 [郑洁,胡美君,郭延平. 光质对植物光合作用的调控及其机理. 应用生态学报,2008,19(7):1619—1624]
[20]Hou D M. Study on the photoinduction of Haematococcus pluvialis for highly-efficient astaxanthin production[D]. Thesis for Master of Sicence. East China University of Science and Technology,Shanghai. 2014 [侯冬梅. 雨生红球藻高产虾青素的光诱导工艺研究. 华东理工大学,上海. 2014]
[21]Qi A X. Studies of cultures medium and cultures modes of Haematococcus pluvialis for enhanced production of astaxanthin [D]. Thesis for Master of Sicence. Xiamen University,Xiamen. 2006 [齐安翔. 高产虾青素的雨生红球藻培养基及培养模式的若干研究. 硕士学位论文,厦门大学,厦门. 2006]
[22]Wu X,Kang R J,Cong W,et al. Application of sun-light conversion film on the growth of Haematococcus pluvialis [J]. The Chinese Journal of Process Engineering,2006,6(6):969—972 [吴霞,康瑞娟,丛威,等. 转光膜在雨生红球藻养殖上的应用过程. 过程工程学报,2006,6(6):969—972]
[23]Zhang R Q. Study on Haematococcus pluvialis transformational conditions and astaxanthin extraction [D]. Thesis for Master of Sicence. Ocean University of China,Qingdao. 2012 [张睿钦. 雨生红球藻细胞转化及虾青素的提取,中国海洋大学,山东. 2012]
[24]Wang J Y,Zhou C X,Yan X J,et al. The characteristics of growth and nutrient consumption of Haematococcus pluvialis under red light [J]. Acta Hydrobiologica Sinica,2014,38(6):1135—1142 [王建沅,周成旭,严小军,等.雨生红球藻在红光下的生长及营养盐消耗特征. 水生生物学报,2014,38(6):1135—1142]
[25]Wang J N,Yan X J,Zhou C X,et al. Screening of oilproducing microalgae and detecting dynamics of neutral lipid accumulation [J]. Acta Biophysica Sinica,2010,26(6):472—480 [王金娜,严小军,周成旭,等. 产油微藻的筛选及中性脂动态积累过程的检测. 生物物理学报,2010,26(6):472—480]
[26]Kamonpan K,Artiwan S,Sorawit P,et al. Photoautotrophic high-density cultivation of vegetative cells of Haematococcus pluvialis in airlift bioreactor [J]. Bioresource Technology,2007,98(2):288—295
[27]Sun H,Kong Q,Geng Z Y,et al. Enhancement of cellbiomass and cell activity of astaxanthin-rich Haematococcus pluvialis [J]. Bioresource Technology,2015,186(6):67—73
[28]Yang J. Isolation of high-lipid microalgae and study on the properties of lipid production in reclaimed water [D]. Thesis for Master of Sicence,Tsinghua University,Beijing. 2009 [杨佳. 高油脂微藻的筛选及其在升水中的产油特性研究. 清华大学,北京. 2009]
[29]Zhang B Y ,Li Y G,Li Z K,et al. Effects of temperature,light intensity and pH on photosynthesis and growth rate of Haematococcus pluvialis [J]. Oceanologia ET Limnologia Sinica,2003,34(5):558—565 [张宝玉,李夜光,李中奎,等. 温度、光照强度和pH对雨生红球藻光合作用和生长速率的影响. 海洋与湖沼,2003,34(5):558—565]
[30]Cui B X,Zhong F X. Comparative studies on the growth of Heamatacoccus Pluvialis 797 in different culture media [J]. Journal of Wuhan Polytechnic University,2007,26(4):14—16 [崔宝霞,钟方旭. 雨生红球藻797在不同培养基上生长的研究. 武汉工业学院学报,2007,26(4):14—16]
[31]Wei T,Gu W H,Li J,et al. Effects of carbon and nitrogen on the growth and astaxanthin accumulation of Haematococcus pluvialis [J]. Marine Science,2012,34(11):55—61 [韦韬,顾文辉,李健,等.不同碳氮浓度对雨生红球藻生长及虾青素累积的影响. 海洋科学,2012,34(11):55—61]
[32]Hata N,Ogbonna J C,Hasegawa Y,et al. Production of astaxanthin by Haematococcus pluvialis in a sequential heterotrophic-photoautotrophic culture [J]. Journal of Applied Phycology,2001,13(5):395—402
[33]Kamonpan K,Artiwan S,Sorawit P ,et al. Photoautotrophic high-density cultivation of vegetative cells of Haematococcus pluvialis in airlift bioreactor [J]. Bioresource Technology,2007,98(2):288—295
[34]Choi S L,Suh I S,Lee C G,et al. Lumostatic operation of bubble column photobioreactors for Haematococcus pluvialis cultures using a specific light uptake rate as a control parameter [J]. Enzyme and Microbial Technology,2003,33(4):403—409
[35]Xu H,Liu Z P,Yuan L,et al. Effect of pH on growth of several freshwater algae [J]. Environmental Science & Technology,2009,32(1):27—30 [许海,刘兆普,袁兰,等. pH对几种淡水藻类生长的影响. 环境科学与技术,2009,32(1):27—30]
[36]Fábregas J,Domínguez A,Álvarez D G,et al. Induction of astaxanthin accumulation by nitrogen and magnesium deficiencies in Haematococcus pluvialis [J]. Biotechnology Letters,1998,20(6):623—626
EFFECTS OF CULTURE METHOD ON CELL PROLIFERATION AND CELL ACTIVITY OF HAEMATOCOCCUS PLUVIALIS GROWING UNDER RED LIGHT
LUO Jie,WANG Jian-Yuan,ZHOU Cheng-Xu,YAN Xiao-Jun,XU Ji-Lin,LUO Qi-Jun,MA Bin and WU Xiao-Kai
(School of Marine Sciences,Ningbo University,Ningbo 315211,China)
The current study investigated methods culturing green motile cells of Haematococcus pluvialis under red light on cell density,cell growth rate and cell activity. In red light,the stationary growth phase in batch culture maintained for long time,and the cell photosynthetic activity maintained stable high. There was no neutral lipid accumulation in the cell growth in red light. Biomass yields from a semi-continuous culture of 20% medium renew rate was 57% higher than those from the batch culture. The variation of nutrient absorption rate and chlorophyll fluorescence parameter showed that cellular stress regulation started earlier in batch culture than those in semi-continuous cultures. The cell growth rate and photosynthetic activity were negatively related to the initial cell density in a batch culture. Culture of lower initial density had higher growth rate and higher photosynthetic activity. The effects of CO2on the cultures under red light or under white light were conditionally dependent. Adding CO2increased maximum biomass by 54%. The growth rates increased as while,however,that in the red light was higher(0.223/d) than that in white light(0.198/d). The pH values were not related with the light quality under both red light and white light,and pH decreased to the suitable level of pH 78. Chlorophyll parameter Fv/Fmsignificantly increased by red light with CO2addition while it is not mediated by white light. Cell size significantly decreased by red light with CO2addition while it was no regulated by white light. These results revealed that the method of intermittent semi-continuous culture for green motile cells of H. pluvialis had higher cell yield with high activity,which is a plausible strategy in astanxanthin industry.
Haematococcus pluvialis; green motile cell; red light; culture method
Q178.1+1
A
1000-3207(2016)05-1041-10
10.7541/2016.135
2016-03-14;
2016-06-24
国家星火计划项目(2015GA701001); 海洋药源生物种质库建设项目; 国家公益性行业(海洋)科研专项经费项目(201105009); 国家“万人计划”(财教[2014]412号)资助 [Supported by the National Spark Program of National Ministry of Science and Technology(No. 2015GA701001); National Collection of Marine Organisms for Medicine Resources; National Marine Research Special Funds for Public Welfare Projects(No. 201105009); National High-Level Personnel of Special Support Program(No. 2014-412)]
罗杰(1992—),男,安徽寿县人; 硕士; 主要从事微藻生理生态研究。E-mail:luojie315@outlook.com
周成旭,副研究员; 主要从事微型藻类的生物学、生理生态学、有害赤潮及生物质应用等研究。E-mail:zhouchengxu@nbu.edu.cn
