泥鳅精子和卵子结构及受精过程的细胞学观察
2016-11-12高胜涛刘亚秋余仕祥王志坚
胡 雨 高胜涛 刘亚秋 余仕祥 王志坚
(1. 西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,水产科学重庆市重点实验室,重庆 400715; 2. 重庆市垫江县农业委员会,重庆 408300)
泥鳅精子和卵子结构及受精过程的细胞学观察
胡雨1高胜涛1刘亚秋1余仕祥2王志坚1
(1. 西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,水产科学重庆市重点实验室,重庆 400715; 2. 重庆市垫江县农业委员会,重庆 408300)
研究旨在探讨泥鳅精子受精时限及为其人工繁殖提供基础资料。采用光镜、电镜技术对泥鳅(Misgurnus anguillicaudatus)精子、卵子和不同时间段的受精卵进行了观察。结果显示:泥鳅精子头部无顶体,主要为核占据,核凹窝较浅,中段具不对称的袖套,尾部轴丝为“9+2”结构,无侧鳍。卵子动物极卵膜仅有一受精孔,受精孔为深凹陷、短孔道型。在20—21℃水温条件下,授精后3s,精子开始穿过精孔管或已经进入卵子; 授精后5—8s,形成精子星光; 授精后70s,卵子处于第二次减数分裂后期; 授精后6—8min,第二极体形成,等待排出; 授精后20—25min,雌雄原核融合; 授精后25—30min,受精卵进入第一次有丝分裂中期; 授精后40—45min,第一次有丝分裂结束,二细胞形成。研究表明:成熟卵子精孔管内口径(2.286±0.364) μm,而精子头部直径与其接近,单精受精; 入水后150s内可受精。
泥鳅;精子;受精孔;受精过程
泥鳅(Misgurnus anguillicaudatus)隶属于鲤形目、鳅科、泥鳅属,在我国除西部高原地区外,各河流干、支流以及水库、湖泊、沟渠、稻田等水体均有分布[1]。其肉质细嫩,味道鲜美,营养丰富,具较好的药用价值,被誉为“水中人参”[2,3]。目前,泥鳅已成为我国淡水养殖的重要种类,更是我国外贸出口的优质水产品[4],经济效益可观。有关泥鳅的研究主要集中在生物学特性、人工繁殖、苗种培育、对环境适应性及种质资源现状等方面[3,5—8],而有关泥鳅受精生物学研究未见报道。本研究采用组织学、电镜技术等方法研究了泥鳅精子的超微结构和受精的细胞学特点,探讨泥鳅精子受精时限,以期丰富我国鱼类受精生物学内容,并为人工繁殖提供基础资料。
1 材料与方法
1.1试验材料
2014年4月由重庆市垫江水产站收集成熟雌雄泥鳅群体,运回室内暂养。光周期12 L :12 D,记录水温。每天投饵3次。
1.2试验方法
精子形态结构的观察成熟精子涂片的制备需取新鲜精液用2.5%戊二醛固定2h,充分摇匀,涂片,甲醇固定,HE染色,Nikon DXM1200显微镜观察、拍照。
精子超微结构观察活体解剖取发育成熟的雄性泥鳅精巢,剪切成1 mm3左右小块,用冷的2.5% 戊二醛固定,置4℃冰箱中保存。固定样品经0.2 mol/L(pH7.4)磷酸缓冲液漂洗,1%锇酸后固定,梯度乙醇脱水,丙酮置换,环氧树脂650聚合包埋,LKB-5型超薄切片机切片,醋酸双氧铀和柠檬酸铅双染,H-7500型透射电镜下观察并拍照,观察成熟精子的超微结构。
人工授精及受精过程的观察选择发育良好的雌雄亲鱼人工催产,进行人工干法授精。受精卵的激活和胚胎孵化的水温均为21—22℃,取成熟卵及人工授精后不同时间段的受精卵样品分别用Smith氏液和2.5%戊二醛固定。保留部分受精卵于培养皿内进一步孵化,统计其受精率和孵化率分别为82.72%和76.24%。
经Smith氏液固定的受精卵,24 h后换至70%的乙醇中保存。脱水甲剂(无水乙醇∶氯仿∶冰醋酸= 6∶3∶1)、脱水乙剂(正丁醇∶氯仿∶冰醋酸= 6∶3∶1)依次脱水,松油醇透明,石蜡包埋,连续切片7—8 μm,HE染色,Nikon DXM1200显微镜观察、拍照。
经冷的2.5%戊二醛固定的受精卵,置4℃冰箱中保存。固定样品经0.2 mol/L(pH 7.4)磷酸缓冲液冲洗3次,置-80℃超低温冰箱冷冻2h,冷冻干燥24h,标本定位,Jeoljec-3000FC喷镀、JSM.6510LV扫描电子显微镜观察并拍照。
1.3数据分析
采用Image-Pro Plus 6.0图像软件测量各项指标,SPSS软件对试验数据进行分析,统计值以平均值±标准误(mean±SE)表示。
2 结果
2.1精子的超微结构
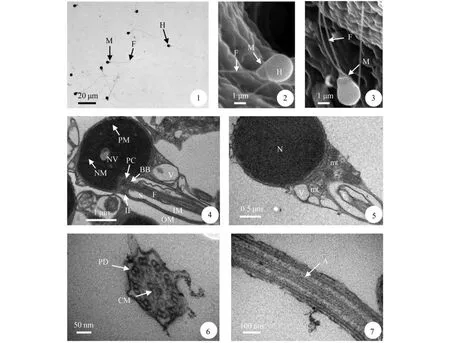
泥鳅精子属于鞭毛型,由头部、中段和尾部三部分组成,全长(30.579±2.033) μm,尾长(26.936± 1.854) μm(图版 Ⅰ-1)。
精子头部多呈圆球形,少数呈梨形,直径(1.877± 0.071) μm(图版 Ⅰ-2、3),无顶体,被有质膜,质膜表面不平整,呈波浪形,细胞质相对较少。头部主要结构是细胞核,细胞核圆形,核膜与质膜紧密相贴,核后端有一较浅的植入窝,植入窝偏向一侧,其凹陷深度约为细胞核长径的1/4,有的核内具有零星分散的核空泡,空泡中可见电子致密状物质分布(图版 Ⅰ-4),有的核内无核空泡(图版 Ⅰ-5)。
中段较短,与细胞核后端相连,由中心粒复合体和袖套组成。中心粒复合体位于植入窝中,包括基体和近端中心粒。基体位于植入窝的下段,其后连着轴丝。近端中心粒的长轴与基体的长轴相互垂直,呈“T”字型排列。袖套接于细胞核的后端。在泥鳅精子的纵切面上,能见到不对称的袖套,一侧肥厚,另一侧较薄,肥厚的一侧含的线粒体和囊泡较多(图版 Ⅰ-4)。
精子尾部即鞭毛。其起始于植入窝并由袖套腔向后延伸,主要结构为轴丝,轴丝属典型的“9+2”型双联微管结构(图版 Ⅰ-6),轴丝外由细胞质膜包裹,轴丝前段波浪形起伏的质膜内具少量细胞质,无侧鳍(图版 Ⅰ-7)。
2.2成熟卵的结构
刚产出的泥鳅成熟卵金黄色半透明,圆球形,平均直径约0.90 mm。受精卵具弱黏性,在水温21—22℃时,授精后40—45min多数卵分裂为二细胞。成熟的未受精卵遇水也会膨胀,并能够进行卵裂至囊胚期,但不能完成后续的胚胎发育。
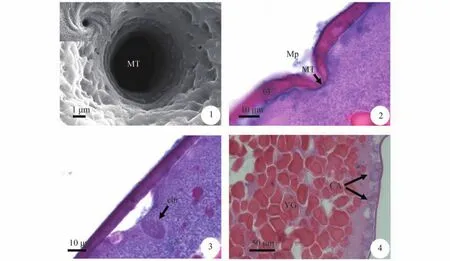
卵子外层为卵膜,属初级卵膜。卵膜内侧为卵子质膜,质膜表面具微绒毛。卵膜厚约(5.994± 0.511) μm,光镜下呈竖条纹状,HE染色可观察到两层亚结构,靠近卵黄层厚(4.817±0.617) μm,染色淡蓝紫色为其内层; 外侧厚(1.430±0.206) μm,染色深红色为外层。
扫描电镜下可观察到卵子动物极具一个凹陷区,即漩涡状的受精孔,呈顺时针方向。受精孔由前庭和精孔管组成,前庭底部为精孔管外口,精孔管外口周边呈平滑的圆环状结构,外口径(3.639±0.587) μm(图版 Ⅱ-1)。卵膜在受精孔前庭形成部位逐渐加厚,最厚处为(8.240±0.803) μm,随后逐渐变薄,由拐点处开始至受精孔底部为受精孔的凹陷区。泥鳅的受精孔为深凹陷,短孔道型。前庭是受精孔的主体,呈漏斗状,最大直径(39.245±3.845) μm,深(15.038±1.347) μm。精孔管贯穿前庭底部和胞质,长(2.694±0.573) μm,内口径(2.286±0.364) μm(图版 Ⅱ-2)。
成熟卵子处于第二次减数分裂中期,其分裂相在细胞质浅层,位于精孔管侧下方凹陷质膜处,凹陷的质膜无微绒毛。纺锤体长轴(10.518± 0.939) μm,短轴(8.532±0.66) 8 μm(图版 Ⅱ-3)。此时质膜下有许多皮层小泡,离精孔管越近,皮层小泡越少,在精孔管凹陷的正下方皮层小泡完全消失。卵黄位于卵子中央,多呈圆形或不规则形,由膜包被,颗粒大小不等(图版 Ⅱ-4)。
2.3受精过程的观察
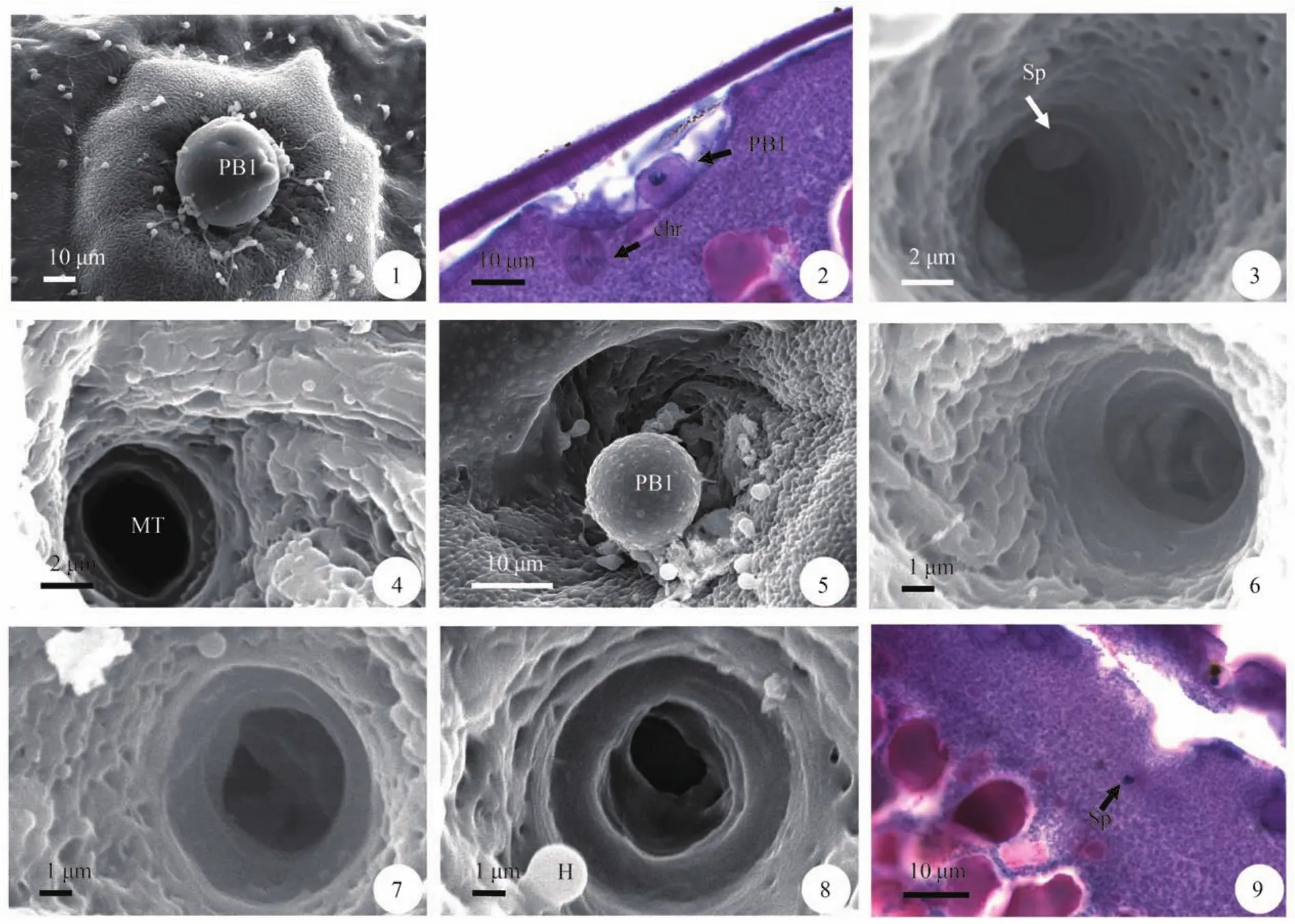
授精0s,卵子周围黏附大量精子,可观察到部分卵子前庭区出现第一极体,呈球状,直径约7.433—31.972 μm(图版 Ⅲ-1),有的第一极体表面具小突起。有受精孔附近出现一大一小两个球体。精孔管打开,部分成熟卵子精孔管侧下方凹陷的质膜外侧连有第一极体,多数为椭圆形[(11.437± 1.128)×(7.916±1.190) μm](图版 Ⅲ-2),少数为球形。核近圆形,HE染色呈蓝色。
授精后3s,大量精子聚集到受精孔,精孔管呈现不同状态,有的精子刚进入其中(图版 Ⅲ-3),有的精孔管敞开着(图版 Ⅲ-4),有的精孔管口出现第一极体(图版 Ⅲ-5),也有的精子已入卵且精孔管口被无定形絮状物堵塞(图版 Ⅲ-6)。
授精后5—8s,多数精孔管口被絮状物堵塞或者精孔管外口缩小(图版 Ⅲ-7、8),少数仍敞开着。观察到有精子穿过精孔管进入皮层约7.664 μm。进入卵子皮层的精子,头部开始膨大,释放中心粒,产生微弱精子星光(图版 Ⅲ-9)。动物极最外层部分皮层小泡破裂,释放内含物。
授精后10—20s,由于絮状物逐渐堵住精孔管口,迟到的精子不能进入其中被堵在外(图版 Ⅲ-10),有的精孔管仍敞开着。进入皮层的精子星光开始延长。卵膜开始膨胀且部分卵膜和质膜之间形成卵周隙(图版 Ⅲ-11),前庭处出现受精锥(图版Ⅲ-12)。
授精后25—30s,扫描电镜下,精孔管几乎完全堵塞(图版 Ⅲ-13)。皮层中的精子发出放射状的精子星光(图版 Ⅲ-14)。受精锥变大。
授精后35—50s,精孔管完全堵塞,有的受精孔被许多解体的精子堵住(图版 Ⅲ-15)。精子星光扩张,头部继续膨胀,逐渐位于精子星光的中央(图版Ⅲ-16)。皮层反应明显,卵膜与质膜之间形成较明显的卵周隙。深层的皮层小泡移到皮层浅层。皮层小泡内含的球状内含物以完整的形式释放出来(图版 Ⅲ-17)。此时仍可观察到第一极体,位于卵膜与精孔管侧下方凹陷质膜之间,但未与质膜相连(图版 Ⅲ-18)。
授精后55—70s,扫描电镜下,受精锥向外突出,有的甚至突出前庭外,其表面具许多小孔(图版 Ⅲ-19)。授精70s,卵子的染色体已经准备向两极移动。
授精后80—110s,受精锥逐渐解体,前庭内凝在一起的精子形态模糊,受精孔附近卵周隙逐渐扩大。可观察到第一极体出现在前庭区的卵膜外,呈球状,直径(7.206±0.859) μm(图版 Ⅲ-20)。
授精后120s,少数卵子未受精,精孔管口仍敞开着。少量皮层小泡在释放内含物,卵周隙内充满解体的皮层小泡内含物,受精孔附近的质膜平整。
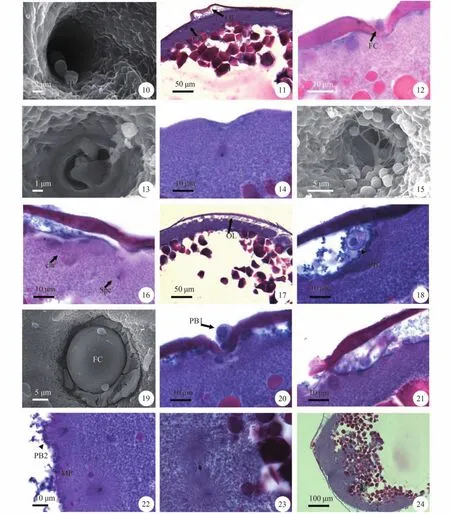
授精后150s,扫描电镜下,所有卵子精孔管关闭。卵子处于第二次减数分裂后期。
授精后4min,卵子染色体继续向两极移动(图版 Ⅲ-21)。细胞质向动物极流动,胚盘区开始加厚。
授精后6min,进入第二次减数分裂末期,第二极体略突出于质膜表面。观察到还有极少数第一极体未排出卵膜外。
授精后8min,卵子进入第二次减数分裂后期,此时纺锤体长径(14.230±0.575) μm,一端突出于卵子质膜表面,染色质已经被拉向两极,即将形成第二极体排出(图版 Ⅲ-22)。动物极皮层区明显厚于其他区域。
授精后10min,精子星光四射,精核解除浓缩状态、膨大形成雄原核,雄原核先于雌原核到达胚盘中央,等待与雌原核结合。
授精后20—25min,雌雄原核已经靠近,开始融合,核膜解体,成为合子。
授精后25—30min,受精卵处于第一次有丝分裂中期(图版 Ⅲ-23),染色体排列在纺锤体中间,动物极顶部开始凹陷。
授精后40—45min,受精卵完成第一次有丝分裂,分裂沟形成,胚盘分裂成两个细胞,细胞基部与卵黄物质相连(图版 Ⅲ-24)。
3 讨论
3.1泥鳅与其他硬骨鱼类精子超微结构的异同点
泥鳅属于体外受精的鱼类,精子头部主要结构是细胞核,无顶体,尾部轴丝为“9+2”双联微管结构,这些特征与大多数硬骨鱼类是相同的。
大多数鱼类精子头部为圆球形,而泥鳅还具有梨形的头部。精子细胞核内的核泡可能在受精过程中起到缓冲保护的作用[9],可分为两种,一种为透明状,内无电子致密物质,另一种为周边空白,中间含有少量电子致密物质[10]。泥鳅精子纵切面上,观察到有的核内含1至多个大小不等的核泡。核泡分布无规律性、周边空白,中间还有少量电子致密物质,属于上述核泡的第二种类型。而有的核内无核泡,可能是成熟精子染色质浓缩过程中细胞核的体积和表面积大大缩小,导致核泡消失[11]。
不同物种精子植入窝深度不同,鲤科鱼精子的植入窝一般较浅[12,13]。泥鳅精子细胞核后端的植入窝凹入深度约为细胞核的1/4,袖套呈不对称形式,这与同为隶属于花鳅亚科的大鳞副泥鳅相同[14]。而鲇形目中的鲿科如长吻鮠[15]、黄颡鱼[16]和鲈形目中的鲷科如真鲷、平鲷[17]等的核凹陷较深。也有些鱼类如褐篮子鱼无植入窝[18]。目前,植入窝的深度已被作为鱼类分类依据的佐证之一[19]。
3.2受精方式及单精受精
受精孔是硬骨鱼类精子入卵的唯一通道,其形态结构因物种不同而有所差异。硬骨鱼类的受精孔通常只有一个,鲟类除外,如白鲟[20]、中华鲟[21]等具多个受精孔。鲟类的受精方式为多精入卵、单精受精,入卵的精子最终只有一个雄原核与雌原核结合形成合子,其余雄原核作为营养物质被卵子吸收。而泥鳅与大多数鱼类一样,只有一个受精孔,受精孔属于深凹陷、短孔道型。受精前精孔管敞开,精孔管内口径(2.286±0.364) μm,而泥鳅的精子头部直径(1.877±0.071) μm。精孔管内口径与精子头宽相近,只能允许一个精子进入细胞质,这与赤眼鳟、欧洲鲶相同[22,23]。泥鳅的受精方式为单精入卵、单精受精,且主要通过三种方式阻止多精入卵:(1)精孔管的内口径只允许一个精子进入;(2)当第一个精子进入卵子细胞质后,精孔管立即被絮状物堵塞或者精孔管外口缩小;(3)皮层反应释放皮层小泡内含物于卵周隙中使得卵膜外举硬化形成受精膜,阻止多余精子入卵。
泥鳅的受精程序也与其他硬骨鱼类基本相同,即精子入卵、卵子激动、产生星光、形成雌雄原核到形成合子核,最终完成第一次卵裂。
3.3关于第一极体
傅朝君等[24]报道草鱼V期成熟的卵子处于第二次减数分裂中期,等待与精子结合受精,纺锤体附近的卵膜下可看到被排出的第一极体。在泥鳅成熟卵子授精后0—6min内可观察到位于卵膜下,与凹陷质膜外侧相连的第一极体,有的第一极体未与凹陷质膜相连,位于卵膜与质膜之间,还可观察到有的第一极体在前庭外,位于受精孔附近,与卵膜相连,表面具小突起,其直径是未排出第一极体的1—4倍。由于在受精孔附近观察到了一大一小两个球体的现象,因此推测第一极体排出后,仍可以分裂为两个极体。但泥鳅卵子授精6min也可观察到极少数未排出卵膜的第一极体,由于第二极体是在授精8min时等待排出,因此推测第一极体的存在可能不会影响到第二极体的排出。
3.4精子入卵时间与精子活力
鱼类种类不同,精子入卵时间不同。尼罗罗非鱼授精后50s,精子开始入卵[25]。鲂授精后2s开始进入精孔管[26],胭脂鱼授精后3s开始有精子入卵[27]。泥鳅人工授精后3s,大量精子聚集到卵子的精孔器,甚至已有精子进入精孔管。这与沈其璋等[28]在6—7月对泥鳅进行人工授精,发现授精2s有精子的尾部留在精孔管外相符。推测极短时间内泥鳅精子入卵的原因可能有两个:(1)与胭脂鱼、唇、稀有鮈鲫相比[27,29,30],泥鳅卵子前庭深度较浅,精子需移动的距离较短。(2)泥鳅精孔器呈漩涡状,有利于精子的云集卷入精孔管[28]。
泥鳅精子入卵后立刻有絮状物堵住精孔管,这与大鳞副泥鳅不同,后者授精后5s精子入卵,2—3min后绝大部分卵子的受精孔才完全封闭[31]。然而,泥鳅授精后120s,仍有少数卵子未受精,精孔管口仍敞开着,这可能是人工授精后,最先到达受精孔的精子遇到部分成熟卵子前庭处正排出第一极体,则在受精孔附近不停摆动鞭毛,等待第一极体排出后进入精孔管。这需要其精子的运动时间较长。水温19℃时,泥鳅精子强烈运动时间为58—130s,寿命时间为245—303s[32],而本研究人工授精的水温为21—22℃,该温度可能延长了精子强烈运动的时间,因此授精120s后,泥鳅精子仍具有强烈运动的能力,可以继续完成进入精孔管的过程。张涛等[33]认为日本鳗鲡授精后90s所有的复合体孔均封闭,其卵在入海水90s前都能受精,说明鱼类卵子在所有复合体孔封闭前都能受精。本研究中观察到泥鳅授精150s时,所有卵子精孔管关闭,推测其卵在入水后150s内都能受精,其精子的活力可能至少可以维持到150s。
[1]Ding R H. The Fishes of Sichuan,China [M]. Sichuan:Sichuan Science and Technology Press. 1994,117—120[丁瑞华. 四川鱼类志. 四川:四川科学技术出版社. 1994,117—120]
[2]Huang J,Yang S,Qin Z B,et al. Comparative study about flesh contents and nutrient values in brown bullhead,loach and darkbarbel catfish [J]. Acta Hydrobiologica Sinica,2010,34(5):990—997 [黄钧,杨淞,覃志彪,等.云斑鮰、泥鳅和瓦氏黄颡鱼的含肉率及营养价值比较研究. 水生生物学报,2010,34(5):990—997]
[3]Du Z C. Artificial breeding and seedling culture technique for Misgurnus anguillicaudatus [J]. Freshwater Fisheries,2003,33(6):57—58 [杜忠臣. 泥鳅人工繁殖及苗种培育技术. 淡水渔业,2003,33(6):57—58]
[4]Wu P,He Z Z,Wei Y H,et al. Analysis of nutrition in young triploid loach Misgurnus anguillicaudatus [J]. Journal of Fisheries of China,2007,31(B9):100—103[吴萍,何珠子,魏育红,等. 三倍体泥鳅幼鱼的营养分析. 水产学报,2007,31(B9):100—103]
[5]Mcmahon B R,Burggren W W. Respiratory physiology of intestinal air breathing in the teleost fish Misgurnus anguillicaudatus [J]. Journal of Experimental Biology,1987,133(1):371—393
[6]Tang J X,Tang Y Y,Sun H X,et al. Effects of Cu2+and Pb2+(single factor and joint toxicity) on DNA damage in Misgurnus anguillicaudatus oocytes [J]. Acta Hydrobiologica Sinica,2013,37(3):501—506 [唐建勋,唐奕扬,孙红祥,等. 重金属Cu2+、Pb2+单因子及联合毒性对泥鳅卵细胞DNA的损伤效应. 水生生物学报,2013,37(3):501—506]
[7]Gao J,Koshio S,Wang W,et al. Effects of dietary phospholipid levels on growth performance,fatty acid composition and antioxidant responses of Dojo loach Misgurnus anguillicaudatus Larvae [J]. Aquaculture,2014,426:304—309
[8]Zhou X,Yu Y,Li Y,et al. Comparative analysis of mitochondrial genomes in distinct nuclear ploidy loach Misgurnus anguillicaudatus and its implications for poly-ploidy evolution [J]. Plos One,2014,9(3):e92033
[9]Chen D Y. Fertilization Biology:Fertilization Mechanism and Reproductive Engineering [M]. Beijing:Science Press. 2000,2—12 [陈大元. 受精生物学:受精机制与生殖工程. 北京:科学出版社,2000,2—12]
[10]Du C L,Zhao N,Wang Y M,et al. Studies on the ultra/microscopic structures of spermatozoon in Megalobrama pellegrini [J]. Journal of Southwest China Normal University(Natural Science Edition),2012,37(2):72—76[杜长雷,赵娜,王永明,等. 厚颌鲂精子的显微及超微结构观察. 西南师范大学学报(自然科学版),2012,37(2):72—76]
[11]Kang X J,Liang C G,Guo M S,et al. Ultrastructure of spermatogenesis and spermiogenesis in the half-smooth tongue sole Cynoglossus semilaevis [J]. Acta Zoologica Sinica,2008,54(2):356—365 [康现江,梁春光,郭明申,等. 半滑舌鳎精子发生和精子形成的超微结构. 动物学报,2008,54(2):356—365]
[12]You Y L,Lin D J. A study on the fine structure of the spermatozoon of teleost Cyprinus carpio(Linnaeus) [J]. Zoological Research,1996,17(4):377—383 [尤永隆,林丹军. 鲤鱼精子超微结构的研究. 动物学研究,1996,17(4):377—383]
[13]Hu J,Zhang Y,Fu C,et al. Ultrastructure of rosy barb Puntius conchonius spermatozoon [J]. Acta Zoologica Sinica,2005,51(5):892—897
[14]Li F,Wan Q,Huang X M. Study on the structure of Paramisgurnus dabryanus spermatozoa [J]. Journal of Biology,2011,28(4):26—30 [李飞,万全,黄鲜明. 大鳞副泥鳅精子结构研究. 生物学杂志,2011,28(4):26—30]
[15]Zhang Y G,Luo Q S,Zhong M C. Studies on the structure of testis and spermatozoon in Leiocassis longirostris[J]. Acta Hydrobiologica Sinica,1993,17(3):246—251[张耀光,罗泉笙,钟明超. 长吻鮠精巢及精子结构的研究. 水生生物学报,1993,17(3):246—251]
[16]You Y L,Lin D J. The ultrastructure of spermatozoon of the teleost Pseudobagrus fulvidraco [J]. Acta Biologiae Experimentalis Sinica,1996,29(3):235—245 [尤永隆,林丹军. 黄颡鱼(Pseudobagrus fulvidraco)精子的超微结构. 实验生物学报,1996,29(3):235—245]
[17]Gwo J C,Kuo M C,Chiu J Y,et al. Ultrastructure of Pagrus major and Rhabdosargus sarba spermatozoa(Perciformes:Sparidae:Sparinae) [J]. Tissue and Cell,2004,36(2):141—147
[18]Gwo J C,Yang W T,Kuo M C,et al. Spermatozoal ultrastructures of two marine perciform teleost fishes,the goatfish,Paraupeneus spilurus(Mullidae) and the rabbitfish,Siganus fuscescens(Siganidae) from Taiwan [J]. Tissue and Cell,2004,36(1):63—69
[19]Gwo J C,Chiu J Y,Lin C Y,et al. Spermatozoal ultrastructure of four Sparidae fishes:Acanthopagrus berda,Acanthopagrus australis,Lagodon rhomboids and Archosargus probatocephus [J]. Tissue and Cell,2005,37(2):109—115
[20]Linhart O,Kudo S. Surface ultrastructure of paddlefish eggs before and after fertilization [J]. Journal of Fish Biology,1997,51(3):573—582
[21]Xu Y,Xiong Q M. Cytological study of the fertilization of Acipenser sinensis Gray [J]. Acta Zoologica Sinica,1990,36(3):275—278 [许雁,熊全沬. 中华鲟受精细胞学研究. 动物学报,1990,36(3):275—279]
[22]Sun J J,Guo Y G,Li G F,et al. An observation on the early fertilization of Squaliobarbus curriculus by scanning electron microscope [J]. Journal of Fishery Sciences of China,2006,13(5):740—744 [孙际佳,郭云贵,李桂峰,等. 赤眼鳟精子入卵的扫描电镜观察. 中国水产科学,2006,13(5):740—744]
[23]Kudo S,Linhart O,Billard R. Ultrastructural studies of sperm penetration in the egg of the European catfish,Silurus glanis [J]. Aquatic Living Resources,1994,7(2):93—98
[24]Fu C J,Liu X T,Shan J,et al. Cytological study on maturity of egg in Ctenopharyngodon idllus [J]. Freshwater Fisheries,1981,(5):5—8 [傅朝君,刘宪亭,单健,等. 草鱼卵球成熟细胞学的研究. 淡水渔业,1981,(5):5—8]
[25]Huang Y S. Cytological study on fertilization of egg in Tilapia nilotica [J]. Acta Zoologica Sinica,1993,39(1):19—22 [黄永松. 尼罗罗非鱼卵母细胞受精细胞学研究.动物学报,1993,39(1):19—22]
[26]Wang R X,Zhang Y R,Fu C S,et al. The observation on the initial fertilization of freshwater bream by electronic scanning microscope [J]. Journal of Fisheries of China,1982,6(4):313—320 [王瑞霞,张毓人,傅仓生,等. 鲂鱼受精早期精子入卵的扫描电子显微镜观察. 水产学报,1982,6(4):313—320]
[27]Li P,Liu X L,Li Y,et al. Cytological study on fertilization process of Myxocyprinus asiaticus [J]. Journal of Fishery Sciences of China,2013,20(2):250—259 [李萍,刘晓蕾,李勇,等. 胭脂鱼受精过程的细胞学观察. 中国水产科学,2013,20(2):250—259]
[28]Shen Q Z,Wu K Z,Cai Z Y. Dynamical action of sperm penetration into the egg of Misgurnus anguillicaudatus [J]. Zoological Research,1990,11(3):179—184 [沈其璋,吴坤璋,蔡振岩. 泥鳅精子入卵的动力作用. 动物学研究,1990,11(3):179—184]
[29]Gan G M. Studies on Fertilization Biology of Hemibarbus labeo [D]. Southwest University,2003 [甘光明. 唇䱻受精生物学研究. 西南大学,2003]
[30]Wang Y M. Studies on the Fertilization Biology of Gobiocypris rarus [D]. Southwest University,2011 [王永明.稀有鮈鲫受精生物学研究. 西南大学,2011]
[31]Yao J H,Zhou P F. Scanning electron microscopic observation on the ultrastructure of the chorion and the process of insemination of Paramisgurnus dabryanus [J]. Journal of Shanghai Fisheries University,1998,7(1):65—68[姚纪花,周平凡. 大鳞副泥鳅卵子壳膜结构与授精过程的扫描电镜观察. 上海水产大学学报,1998,7(1):65—68]
[32]Xu R W. An observation on the lifetime of loach M. anguillicaudatus spermatozoa [J]. Journal of Zhejiang Col-lege of Fisheries(Natural Science Edition),1992,11(1):17 [徐如卫. 泥鳅Misgurnus anguillicaudatus Cantor精子寿命的初步观察. 浙江海洋学院学报(自然科学版),1992,11(1):17]Zhang T,Liu L,Zhang J M,et al. Ultrastructure of sper-
[33] matozoa and fertilized eggs of Anguilla japonica and observation on the fertilization process [J]. Acta Hydrobiologica Sinica,2010,34(4):769—778 [张涛,柳凌,张洁明,等. 日本鳗鲡精卵的超微结构以及受精过程观察.水生生物学报,2010,34(4):769—778]
CYTOLOGICAL STUDIES ON STRUCTURE OF SPERMS AND EGGS OF MISGURNUS ANGUILLICAUDATUS AND THE FERTILIZATION PROCESS
HU Yu1,GAO Sheng-Tao1,LIU Ya-Qiu1,YU Shi-Xiang2and WANG Zhi-Jian1
(1. Key Laboratory of Freshwater Fish Reproduction and Development,Ministry of Education,Chongqing Key Laboratory of Aquatic Science,School of Life Science,Southwest University,Chongqing 400715,China; 2. Agriculture Committee of Dianjiang,Chongqing 408300,China)
This study investigated fertilization of spermatozoa of Misgurnus. anguillicaudatus at different time periods using optical microscope and electron microscope technology methods. The results showed that no acrosome was observed in the head of the sperm,which was mainly occupied by the nuclear. The implantation fossa of the sperms was low,and the mid-piece contained asymmetric sleeve. The flagella without lateral fins were organized as a “9+2” microtubular structure by axonemes. There was only one micropyle in shell of egg's animal pole,and the micropyle belongs to the type of concave and short channel. Under the water temperature of 20—21,sperm passed micropylar tube and entered ovum at 3s after insemination; sperm star light was observed at 5—8s; the second meiosis of the ovum occurred at 70s after insemination; the second polocyte appeared at 6—8min after insemination. Male and female prnucleus were fused at 20—25min after insemination. Zygote was in metaphase of first mitosis at 25—30min after insemination. The first mitosis finished at 40—45min after insemination,and two cells then formed. The inner diameter of micropylar tube of mature egg was(2.286±0.364) μm,similar like the diameter of sperm head,and the monospermy of M. anguillicaudatus. Eggs of M. anguillicaudatus were fertilizable in 150s after entering to water.
Misgurnus anguillicaudatus; Sperm; Micropyle; Fertilization process
图版 Ⅰ 精子结构Plate Ⅰ Sperm structure
图版 Ⅱ 成熟卵子结构Plate Ⅱ Mature egg structure
图版 Ⅲ 受精过程Plate Ⅲ fertilization process
Q952.4
A
1000-3207(2016)05-0942-09
10.7541/2016.122
2015-06-05;
2015-12-04
公益性行业(农业)科研专项(201203086)资助 [Supported by the Special Fund for Agro-scientific Research in the Public Interest of China(201203086)]
胡雨(1990—),女,四川宜宾人; 硕士研究生; 主要研究方向为渔业生态与环境。E-mail:huyu9005@foxmail.com
王志坚(1969—),Tel:023-68253005; E-mail:wangzj1969@126.com
