三疣梭子蟹Na+/H+-exchanger基因克隆鉴定及在盐度胁迫下的表达分析
2016-11-12马金武吕建建高保全
马金武 吕建建 刘 萍 高保全 李 健
(1. 中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,青岛 266071; 2. 上海海洋大学水产与生命学院,上海 201306; 3. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,青岛 266071)
三疣梭子蟹Na+/H+-exchanger基因克隆鉴定及在盐度胁迫下的表达分析
马金武1,2吕建建1,3刘萍1,3高保全1,3李健1,3
(1. 中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,青岛 266071; 2. 上海海洋大学水产与生命学院,上海 201306; 3. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,青岛 266071)
为研究Na+/H+-exchanger基因在三疣梭子蟹(Portunus trituberculatus)盐度胁迫过程中的功能作用,克隆了三疣梭子蟹Na+/H+-exchanger基因并进行表达分析。结果显示,Na+/H+-exchanger基因(GenBank:KU519329)全长4233 bp,5′和3′非编码区(UTR)长分别为519和753 bp,开放阅读框(ORF)长2961 bp。编码986个氨基酸,预测蛋白质分子量和等电点分别为110.8 kD和7.42,具有信号肽和典型的Na+/H+-exchanger蛋白结构域,含12个跨膜α螺旋; 三疣梭子蟹Na+/H+-exchanger基因与普通滨蟹(Carcinus maenas)同源性最高,达到87.2%,系统进化分析也显示该序列与普通滨蟹聚为一支; 表达分析显示,三疣梭子蟹Na+/H+-exchanger基因在鳃中表达量最高; 在低盐(盐度5、10和20)胁迫过程中,Na+/H+-exchanger基因在0—12h上调表达明显,在24—168h间表达量呈下降趋势; 在高盐(盐度50)胁迫初期(0—12h),该基因表达量相对稳定,之后(24—168h)显著下调表达。研究表明低盐显著诱导Na+/H+-exchanger基因的高表达,推测三疣梭子蟹Na+/H+-exchanger基因在低盐环境下发挥重要的渗透调节功能。
三疣梭子蟹;Na+/H+-exchanger;基因克隆;盐度胁迫;表达分析
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus),广泛分布于我国南北沿海[1],在日本和朝鲜半岛等海域亦有广泛分布[2,3],可存活于盐度为13.7—47.7的水环境中[4],属广盐性水生甲壳动物[1],其生长快、食用价值高和养殖利润丰厚等特点使其成为我国重要的海水捕捞和养殖品种[5]。
盐度对水生甲壳动物的生长发育和新陈代谢等具有极其重要的影响[6],其主要通过血淋巴渗透压调控以适应环境盐度的变化,且血淋巴渗透压水平主要取决于对无机离子通透性的调控,其中以Na+和Cl-的调控最为重要[7—9]。水生甲壳动物进行渗透压和离子调节的主要器官是鳃[10],且主要在鳃离子转运型上皮进行[11,12]。其离子转运过程主要由离子泵、离子交换器和通道蛋白等共同作用调控完成[10,13],其中离子交换器Na+/H+-exchanger在Na+的跨膜转运过程中具有重要作用。Na+/H+-exchanger通过CA提供的胞质内高H+梯度,将质膜外Na+交换进入胞质内,再由基底侧质膜上的Na+/K+-ATPase转运进入基底侧质膜外,从而完成鳃上皮细胞的Na+跨膜转运过程,水生甲壳动物Na+/H+-exchanger向膜内和膜外分别转运2 Na+和1 H+[14—17],对广盐性蟹类在低盐环境下的Na+摄入具有重要影响。水生甲壳动物的渗透压调节方式呈现多样性,主要包括高渗调节型、渗透调节随变型和高渗-低渗调节型[10]。Na+/H+-exchanger主要在渗透调节随变型和高渗-低渗调节型蟹类中起重要作用,且在高渗调节型蟹类中,Na+/H+-exchanger主要在“弱”高渗调节型蟹类中调节Na+的转运,“强”高渗调节型蟹类中不起作用[10]。本实验室对5—50不同盐度下三疣梭子蟹血清渗透压和离子含量的变化进行了系统研究,结果表明三疣梭子蟹属于高渗调节型蟹类[18],由于“强”和“弱”高渗调节型蟹类的区分规则仍不明确,有关三疣梭子蟹中Na+/H+-exchanger的功能作用需进一步分析研究。
目前,对于十足目甲壳动物Na+/H+-exchanger已进行诸多研究,但主要侧重于电生理学方面,分子生物学方面的研究仅初步开始。1989年第一个人体细胞中Na+/H+-exchanger克隆测序完成,截至目前,Na+/H+-exchanger基因在水生甲壳动物中的分子克隆研究进展缓慢,仅有4个物种完成克隆测序,且仅有普通滨蟹(Carcinus maenas)对序列特性和表达情况进行了分析报道,有关三疣梭子蟹Na+/H+-exchanger对渗透调节作用的研究至今未见报道。本研究通过实验室构建的三疣梭子蟹转录组文库[19]筛选出Na+/H+-exchanger基因的EST序列,采用RACE技术克隆获得该基因全长cDNA序列并对该基因及其编码的氨基酸序列进行生物信息学分析,通过Blast比对分析该基因氨基酸序列与其他甲壳动物的同源性,采用反转录实时定量PCR(RT-qPCR)技术分析该基因在不同组织及不同盐度胁迫下的表达变化。对广盐性甲壳动物Na+/H+-exchanger基因的渗透调节机理的研究以及三疣梭子蟹耐低盐新品系的选育都具有重要意义。
1 材料与方法
1.1实验材料与取样
实验所用三疣梭子蟹为三疣梭子蟹“黄选1号”品种,个体为80日龄蟹[体重为(30±2.25) g]。于山东省昌邑市海丰水产养殖有限责任公司进行实验,实验前于养殖车间自然海水盐度下(盐度30)暂养7d,期间连续充气,淘汰活力较差的个体,每天定时投喂蓝蛤,换水清污。实验设置盐度5、10、20和50实验组和自然海水对照组(盐度30),每个盐度设3个平行组,每组90只蟹子,实验于400 cm×400 cm× 150 cm的水泥池、水深40 cm的水体中进行,盐度50实验组水体由自然海水与地下卤水混匀调制,盐度5、10和20实验组水体由自然海水与自来水混匀调制,实验前水体充分曝气,实验期间的投喂和饲养管理与暂养期相同。各盐度组分别在实验第0、3h、6h、9h、12h、24h、48h和72h时取鳃组织,放于无RNA酶离心管中,标记编号后置于液氮中冷冻保存。
1.2Na+/H+-exchanger基因cDNA全长克隆
采用Trizol法分别提取鳃组织中的总RNA,采用琼脂糖凝胶电泳和微量紫外分光光度计检测RNA的完整度和质量,使用SMARTTMRACE cDNA Amplification Kit按照说明书要求操作,分别合成3′和5′ RACE的cDNA第一链。利用三疣梭子蟹转录组文库中检索到的Na+/H+-exchanger基因EST序列和Primer Premier 5.0软件设计3′和5′ RACE特异性引物(表1),于生工生物工程(上海)股份有限公司合成。使用TaKaRa LA Taq DNA聚合酶与RACE通用引物UPM、NUP和四条3′和5′ RACE特异性引物进行巢式PCR,对目的基因的3′和5′末端序列进行快速扩增。利用琼脂糖凝胶分别检测3′ RACE和5′ RACE的扩增产物,使用胶回收试剂盒回收目的片段,使用pMD18-T载体和DH5α大肠杆菌感受态细胞进行连接转化,取阳性单克隆进行菌落PCR鉴定,目的单克隆菌液送上海桑尼生物技术有限公司进行测序。
1.3序列分析
使用DNAStar软件的SeqMan程序进行序列拼接得到Na+/H+-exchanger基因cDNA全长,采用ORF Finder进行基因开放阅读框(ORF)预测,采用Blast程序分析目的基因与其他物种的同源性和一致性,使用DNAMAN软件进行基因编码氨基酸序列的多重序列比对。使用ProtParam tool、SMART、TMHMM Server v. 2.0和ProtScale等在线生物信息分析工具对基因编码蛋白的基本物理性质、结构域、信号肽、跨膜结构和亲、疏水性进行预测分析,利用MEGA 4.0软件采用邻接法构建NJ系统进化树。
1.4反转录实时荧光定量PCR(RT-qPCR)
采用Trizol法提取各盐度组三疣梭子蟹鳃组织的总RNA,使用TaKaRa PrimeScript RT reagent Kit进行反转录合成cDNA。根据已获得的三疣梭子蟹Na+/H+-exchanger基因cDNA全长序列,利用Primer Premier 5.0软件设计荧光定量引物,内参选择RPL8[20](表1),于生工生物工程(上海)股份有限公司合成。使用ABI 7500 Real Time PCR仪和TaKaRa SYBR Premix Ex Taq Ⅱ试剂对三疣梭子蟹各组织及盐度胁迫下基因的表达情况进行分析。反应体系采用TaKaRa SYBR Premix Ex Taq Ⅱ说明书中20 μL体系标准,PCR反应程序为:95℃ 30s;95℃ 5s,60℃ 34s,40 个循环; 95℃ 15s,60℃ 1min,95℃ 15s。Na+/H+-exchanger基因的相对表达分析采用2-ΔΔCt法,数据处理使用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA)和Duncan检验,利用Origin Pro 9.0对统计结果进行作图,P<0.05表示具有显著差异性。

表1 实验用PCR引物序列Tab. 1 Primer used in the study
2 结果
2.1Na+/H+-exchanger基因cDNA全长克隆及序列分析
三疣梭子蟹Na+/H+-exchanger基因cDNA全长4233 bp,GenBank登录号为KU519329,其5′和3′端非编码区分别为:519和753 bp,开放阅读框(ORF)长2961 bp。ORF编码氨基酸986个,预测蛋白的分子式和分子量分别为C4987H7829N1349O1432S40和110.8 kD,理论等电点为7.42。Blast对比分析表明,Na+/H+-exchanger基因编码氨基酸序列与普通滨蟹、麦龙螯虾(Cherax cainii)、天空蓝魔虾(Cherax destructor)和红螯螯虾(Cherax quadricarinatus)的同源性分别为87.2%、58.5%、58.2%和57.8%。通过氨基酸序列多重比对分析表明,Na+/H+-exchanger氨基酸序列在60—650氨基酸区段内保守性较高。SMART分析预测表明该基因编码蛋白结构域包括:Na+/H+-exchanger蛋白结构域(84—486aa)、信号肽(0—19aa)和3个低复杂结构(26—37aa、890—903aa和926—937aa)。TMHMM和ProtScale在线工具分析表明,Na+/H+-exchanger基因编码蛋白质结构中含有12个跨膜结构域,主要分布于0—500氨基酸区段,该区段内亲、疏水性氨基酸均有分布,500—986氨基酸编码蛋白无跨膜区段,位于膜内,呈亲水性。
利用MEGA 4.0软件构建系统发育进化树分析表明,脊椎动物和无脊椎动物Na+/H+-exchanger遗传进化距离较远,埃及伊蚊等昆虫类聚为一支,三疣梭子蟹同普通滨蟹亲缘关系最近并同麦龙螯虾等聚为一支(图1)。
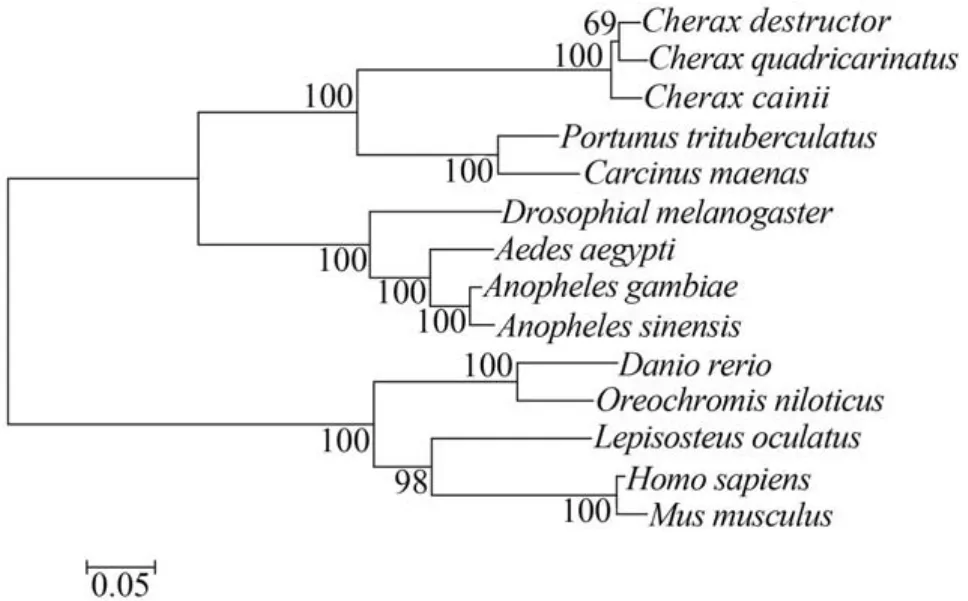
图1 Na+/H+-exchanger氨基酸序列NJ系统进化树Fig. 1 The Neighbor-Joining Phylogenetic tree for amino acid sequences of Na+/H+-exchanger
2.2Na+/H+-exchanger基因的组织表达分布和不同盐度胁迫下的表达分析
利用RT-qPCR分析了三疣梭子蟹Na+/H+-exchanger基因在不同组织中的表达分布情况,结果显示,三疣梭子蟹Na+/H+-exchanger基因在鳃中表达量最高并显著高于其他组织(P<0.05),肠表达量次之,其他组织表达量极低且肌肉组织中几乎不表达(图2)。

图2 三疣梭子蟹不同组织中Na+/H+-exchanger基因的表达Fig. 2 Expression of Na+/H+-exchanger gene in different tissues of P. trituberculatus
经过盐度胁迫后,对三疣梭子蟹鳃组织中Na+/H+-exchanger基因表达情况进行分析表明,对照组在0—168h内表达量无显著变化。低盐(盐度5、10和20)组中Na+/H+-exchanger基因在0—12h上调表达明显,其中盐度5实验组表达量显著高于其他组(P<0.05),在24—168h表达量整体呈下降趋势,盐度5实验组在120h表达量出现小幅上调,盐度10实验组在72h表达量有较大增长,其他时间表达量与对照组持平或低于对照组,盐度20实验组除48h表达量与对照组持平外,其他时间表达量均低于对照组。高盐(盐度50)组Na+/H+-exchanger基因表达量在0—12h同对照组相对持平,在24—168h内表达量降低并显著低于对照组(P<0.05)(图3)。

图3 盐度胁迫下三疣梭子蟹Na+/H+-exchanger基因在鳃中的表达情况Fig. 3 Expression of Na+/H+-exchanger gene in P. trituberculatus gill tissue under salinity stress
3 讨论
Na+/H+-exchanger在脊椎动物中的研究起步较早,主要侧重于体内离子平衡、酸碱平衡和细胞体积调节等方面[21]。Towle等[17]克隆了第一个甲壳动物Na+/H+-exchanger基因,其研究表明普通滨蟹Na+/H+-exchanger基因编码673个氨基酸,序列多重比对分析表明普通滨蟹Na+/H+-exchanger基因同脊椎动物的几个亚型均不相关。麦龙螯虾、天空蓝魔虾和红螯螯虾的Na+/H+-exchanger基因cDNA全长已获得,且研究发现其Na+/H+-exchanger基因与盐度调节相关,但并未对序列特性等进行相关报道[22,23]。
本研究通过RACE技术首次克隆得到三疣梭子蟹Na+/H+-exchanger基因cDNA全长,预测编码蛋白986个,氨基酸序列多重比对和Blast分析表明三疣梭子蟹同普通滨蟹同源性最高,达到87.2%,这一结论印证了三疣梭子蟹同普通滨蟹同属梭子蟹科且具有相似生存环境和生活习性的特点,与Péqueux[7]提出的地域分布对生物渗透调节能力具有重要影响的结论一致。与NCBI数据库中氨基酸序列的比对分析表明甲壳动物Na+/H+-exchanger基因还未进行基因分型,因此三疣梭子蟹Na+/H+-exchanger基因的分型工作有待进一步研究。SMART在线结构域预测分析发现该基因具有典型的Na+/H+-exchanger蛋白结构域(84—486aa),充分证明该基因为三疣梭子蟹Na+/H+-exchanger基因。TMHMM和ProtScale在线工具预测表明0—500氨基酸区段具有12个跨膜α螺旋,与三疣梭子蟹Na+/H+-exchanger蛋白结构域重叠,且该区段内亲疏水性氨基酸均有分布,推测该区段可能与离子的跨膜转运功能相关[17,21]。系统进化分析表明,三疣梭子蟹Na+/H+-exchanger符合遗传进化规律。
利用RT-qPCR分析表明三疣梭子蟹Na+/H+-exchanger基因的表达具有组织特异性,与普通滨蟹Na+/H+-exchanger基因的研究结果一致[17],推测梭子蟹科甲壳动物Na+/H+-exchanger基因在盐度适应过程中主要在鳃组织中特异性表达。根据盐度胁迫过程中各实验组和对照组三疣梭子蟹鳃组织中Na+/H+-exchanger基因的表达规律及特点,推测三疣梭子蟹Na+/H+-exchanger基因在盐度适应过程中主要在低盐环境下起作用,在高盐环境中作用不明显。盐度5实验组在0—24h内表达量显著高于盐度10和20实验组,推测低盐环境对Na+/H+-exchanger基因的表达具有促进作用,Na+/H+-exchanger基因在极低盐度环境下的作用更加明显。盐度5、10和20实验组在24—168h表达量出现再次上调,推测是由于渗透压调控后期需要Na+/H+-exchanger基因的再表达以补充前期损失Na+/H+-exchanger,与渗透压水平的维持有关,盐度5、10和20实验组在24—168h的部分时间表达量低于对照组,推测是因为前期Na+/H+-exchanger基因的高表达已满足渗透调节作用,高表达的Na+/H+-exchanger可能对Na+/ H+-exchanger基因的转录水平具有负反馈作用。盐度50实验组基因表达量在24—168h内表达量显著低于对照组,推测是因为高盐度对基因表达产生抑制。
通过对三疣梭子蟹Na+/H+-exchanger基因的克隆、鉴定以及表达分析,初步明确了该基因的序列特征及其在盐度适应过程中的生理作用,为水生甲壳动物Na+/H+-exchanger基因分子方面的研究和三疣梭子蟹耐低盐新品系的选育提供了一定理论参考。
[1]Sun Y M,Song Z L,Yan R S,et al. Preliminary study on the growth of Portunus trituberculatus [J]. Acta Ecologica Sinica,1984,4(1):57—64 [孙颖民,宋志乐,严瑞深,等. 三疣梭子蟹生长的初步研究. 生态学报,1984,4(1):57—64]
[2]Li J,Liu P,Gao B Q,et al. The new variety of Portunus trituberculatus “Huangxuan No.1” [J]. Progress in Fishery Sciences,2013,34(5):51—57 [李健,刘萍,高保全,等. 三疣梭子蟹新品种“黄选1号”的选育. 渔业科学进展,2013,34(5):51—57]
[3]Yu J H,Pan L Q. Prokaryotic expression of C-type lectin like-domain protein gene of Portunus tritubrculatus and activity analysis of recombinant protein [J]. Progress in Fishery Sciences,2013,34(5):58—63 [于金红,潘鲁青.三疣梭子蟹C-型凝集素的原核表达和活性检测. 渔业科学进展,2013,34(5):58—63]
[4]Sui Y N,Gao B Q,Liu P,et al. The tolerance to and optimal salinity for growth in swimming crab Portunus trituberculatus “Huangxuan No. 1” [J]. Journal of Dalian Ocean University,2012,27(5):398—401 [隋延鸣,高保全,刘萍,等. 三疣梭子蟹“黄选1号”盐度耐受性及适宜生长盐度分析. 大连海洋大学学报,2012,27(5):398—401]
[5]Wang C,Jiang L X,Wang R J,et al. Effect of abrupt and gradual changes in salinity on development and feeding in juvenile swimming crab(Portunus trituberculatus) [J]. Fisheries Science,2010,29(9):510—514 [王冲,姜令绪,王仁杰,等. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响. 水产科学,2010,29(9):510—514]
[6]Zhou S L,Jiang N C,Lu J P,et al. Progress of the study on osmotic regulation in crustacean Ⅰ. The gill's structure and function and its' concerned factors [J]. Donghai Marine Science,2001,19(1):44—51 [周双林,姜乃澄,卢建平,等. 甲壳动物渗透压调节的研究进展Ⅰ. 鳃的结构与功能及其影响因子. 东海海洋,2001,19(1):44—51]
[7]Péqueux A. Osmotic regulation in crustaceans [J]. Journal of Crustacean Biology,1995,15(1):51—60
[8]Zhao L,Long X W,Wu X G,et al. Effects of water salinity on osmoregulation and physiological metabolism of adult male Chinese mitten crab Eriocheir sinensis [J]. Acta Hydrobiologica Sinica,2016,40(1):27—34 [赵磊,龙晓文,吴旭干,等. 水体盐度对中华绒螯蟹成体雄蟹渗透压调节和生理代谢的影响. 水生生物学报,2016,40(1):27—34]
[9]Morris S. Neuroendocrine regulation of osmoregulation and the evolution of air-breathing in decapod crustaceans[J]. The Journal of Experimental Biology,2001,204(Pt5):979—989
[10]Mcnamara J C,Faria S C. Evolution of osmoregulatory patterns and gill ion transport mechanisms in the decapod Crustacea:A review [J]. Journal of Comparative Physiology B,2012,182(8):997—1014
[11]Freire C A,Onken H,McNamara J C. A structure-function analysis of ion transport in crustacean gills and excretory organs [J]. Comparative Biochemistry and Physiology,A:Comparative Physiology,2008,151(3):272—304
[12]Onken H,Riestenpatt S. NaCl absorption across split gill lamellae of hyperregulating crabs:Transport mechanisms and their regulation [J]. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology,1998,119(119):883—893
[13]Kirschner L B. The mechanism of sodium chloride uptake in hyperregulating aquatic animals [J]. Journal of Experimental Biology,2004,207(9):1439—1452
[14]Shetlar R E,Towle D W. Electrogenic sodium-proton exchange in membrane vesicles from crab(Carcinus maenas) gill [J]. American Journal of Physiology,1989,257(4Pt2):R924—R931
[15]Burnett L E,Towle D W. Sodium ion uptake by perfusedgills of the blue crab Callinectes sapidus:effects of ouabain and amiloride [J]. Journal of Experimental Biology,1990,149(1):293—305
[16]Lucu Čedomil. Ion transport in gill epithelium of aquatic Crustacea [J]. Journal of Experimental Zoology,1993,265(4):378—386
[17]Towle D W,Rushton M E,Heidysch D,et al. Sodium/proton antiporter in the euryhaline crab Carcinus maenas:molecular cloning,expression and tissue distribution [J]. Journal of Experimental Biology,1997,200(Pt6):1003—1014
[18]Ma J W,Lü J J,Liu P,et al. Effects of abrupt salinity stress on serum osmolarity and ion concentration of“Huangxuan No.1” Portunus trituberculatus [J]. Progress in Fishery Sciences,2016,37(1):58—62 [马金武,吕建建,刘萍,等. 急性盐度胁迫对三疣梭子蟹(Portunus trituberculatus)“黄选1号”血清渗透压及离子含量的影响. 渔业科学进展,2016,37(1):58—62]
[19]Lü J J,Liu P,Wang Y,et al. Transcriptome analysis of Portunus trituberculatus in response to salinity stress provides insights into the molecular basis of osmoregulation [J]. PloS One,2013,8(12):1—15
[20]Xu Q H,Liu Y. Gene expression profiles of the swimming crab Portunus trituberculatus exposed to salinity stress [J]. Marine Biology,2011,158(10):2161—2172
[21]Bianchini L Pousségur J. Molecular structure and regulation of vertebrate Na+/H+exchangers [J]. Journal of Experimental Biology,1994,196(6):337—345
[22]Ali M Y,Pavasovic A,Amin S,et al. Comparative analysis of gill transcriptomes of two freshwater crayfish,Cherax cainii and C. destructor [J]. Marine Genomics,2015,22:11—13
[23]Ali M Y,Pavasovic A,Mather P B,et al. Analysis,characterisation and expression of gill-expressed carbonic anhydrase genes in the freshwater crayfish Cherax quadricarinatus [J]. Gene,2015,564(2):176—187
NA+/H+-EXCHANGER IN SWIMMING CRAB(PORTUNUS TRITUBERCULATUS):CLONING,CHARACTERIZATION AND MRNA EXPRESSION UNDER SALINITY STRESS
MA Jin-Wu1,2,LÜ Jian-Jian1,3,LIU Ping1,3,GAO Bao-Quan1,3and LI Jian1,3
(1. Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China; 2. College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China; 3. Laboratory for Marine Fisheries and Aquaculture,Qingdao National Laboratory for Marine Science and Technology,Qingdao 266071,China)
Na+/H+-exchanger is a membrane-associated enzyme responsible for the active transport of Na+and H+ions across cell membranes and generating chemical and electrical gradients. It plays an important role in salinity adaptation process of aquatic crustacean. The swimming crab(Portunus trituberculatus) distributes widely in the coastal waters of Japan,Korean and China,which is a commercially important marine crab in China. Growth,development and immunity of the crab are significantly affected by salinity variation. In order to investigate the function of Na+/H+-exchanger in P. trituberculatus under salinity stress,Na+/H+-exchanger cDNA(GenBank:KU519329) was cloned from gill tissue of P. trituberculatus by RACE(rapid-amplification of cDNA ends). The full-length of Na+/H+-exchanger cDNA was 4 233 bp(base pairs) including a 519 bp 5′-untranslated region(UTR),a 2961 bp ORF(open reading frame)and a 753 bp 3′-UTR. The ORF encoded 986 amino acids with calculated molecular weight 110.8 kD and theoretical isoelectric point 7.42. Comparison with homologous proteins showed that the deduced Na+/H+-exchanger sequence has the highest sequence identity to Carcinus maenas(87.2%),and the two sequences were clustered into one group by phylogenetic analysis. Typical domains including one signal peptide,one Na+/H+-exchanger domain and twelve transmembrane alpha helixes were found in amino acid sequence of Na+/H+-exchanger. Results of RT-qPCR showed that P. trituberculatus Na+/H+-exchanger was the highest expressed in gill. During salinity stress,the expression of Na+/H+-exchanger of gill in low salinity groups(5,10 and 20) increased significantly during 0—12h. Subsequently,the expression was down-regulated during 24—168h. The expression of Na+/H+-exchanger in gill in high salinity group(50) was almost no change compared to control group during 0—12h,and the expression level significantly decreased compared with the control group during 24—168h. Low salinity significantly induced the expression of Na+/H+-exchanger gene,suggesting that Na+/H+-exchanger of P. trituberculatus plays a vital role mainly in low salt conditions in the process of salinity adaptation.
Portunus trituberculatus; Na+/H+-exchanger; Gene cloning; Salinity stress; Expression analysis
S965.1
A
1000-3207(2016)05-0902-06
10.7541/2016.116
2016-01-29;
2016-04-21
国家自然科学基金面上项目(41576147,41306177); 2015年泰山领军人才工程高效生态农业创新类计划(LJNY2015002); 青岛海洋科学与技术国家实验室鳌山科技创新计划项目(2015ASKJ02)资助 [Supported by the National Natural Science Foundation of China(Grant No. 41576147 and 41306177); the Project of Taishan Scholars Leading Talent(LJNY2015002); The Scientific and Technological Innovation Project Financially Supported by Qingdao National Laboratory for Marine Science and Technology(No. 2015ASKJ02)]
马金武(1990—),男,山东临沂人; 硕士研究生; 主要从事三疣梭子蟹遗传育种工作。E-mail:1007431629@qq.com
刘萍,研究员; E-mail:liuping@ysfri.ac.cn
