额尔齐斯河白斑狗鱼假尾复口吸虫的分子鉴定
2016-11-12番林古丽热哈提
番林古丽·热哈提 焦 丽 岳 城
(新疆农业大学动物医学学院,乌鲁木齐 830052)
额尔齐斯河白斑狗鱼假尾复口吸虫的分子鉴定
番林古丽·热哈提焦丽岳城
(新疆农业大学动物医学学院,乌鲁木齐 830052)
利用分子生物学方法对采自额尔齐斯河(中国段)的白斑狗鱼(Esox lucius Linnaeus)晶状体内寄生的复口吸虫(Diplostomum)进行了种类鉴定,结果显示其种类为假尾复口吸虫(D. paracaudum),为中国新记录种。通过PCR扩增待鉴定种的部分18S-ITS1-5.8S序列,测序后与GenBank中假尾复口吸虫的序列进行比对,发现其相似度达到99.6%。将该序列与7种复口吸虫的ITS1序列进行比对后构建系统进化树,进化树以单殖吸虫Gyrodactylus parvae为外类群,结果显示:待鉴定种与假尾复口吸虫(D. paracaudum)聚为一支,其支持率达到了50%以上,支持它们为同一虫种。
额尔齐斯河;白斑狗鱼;假尾复口吸虫;分子鉴定
额尔齐斯河(Irtysh River)发源于中蒙边境,地处欧亚大陆腹地,上游在我国境内,位于新疆阿尔泰地区东北部,该河以东西走向流出国境,进入斋桑泊(布赫塔尔马水库),汇入鄂毕河,最终流入北冰洋,是新疆重要的生态屏障和社会经济发展支撑之一[1,2]。额尔齐斯河水资源丰富,水系繁杂极具特殊性,使该河有了较多独特的鱼类,主要有白斑狗鱼(Esox lucius)、哲罗鲑(Hucho taimen)、细鳞鱼(Brachymystax lenok)、高体雅罗鱼(Leuciscus idus)等名贵独特的鱼类。白斑狗鱼隶属于鲑形目(Salmoniformes)、狗鱼科(Esocidae),狗鱼属(Esox),具有肉质鲜美、生长快、营养丰富等特点,自然分布见于亚洲、欧洲及北美洲北部的冷水水域,在我国仅分布于新疆额尔齐斯河水系,是一种较大型的名贵经济型鱼类[3,4]。郝翠兰等[5]对额尔齐斯河(中国段)白斑狗鱼的寄生虫种类及感染情况进行了研究,结果显示白斑狗鱼被5种寄生虫感染,分别为复口吸虫后囊蚴、单肠四钩虫、绦虫幼虫、新疆鳋、白鲑鲺,其中复口吸虫是白斑狗鱼寄生虫群落的优势种。
复口吸虫(Diplostomum)的囊蚴阶段寄生在鱼类的眼球中,导致晶体混浊成乳白色,故又称“白内障病”,严重感染时可致宿主失明,由于运动和索饵障碍,易被终末宿主鸟类捕捉,也可直接引起鱼类大量死亡,特别是池塘养殖的鱼类[6]。复口吸虫病在世界上有着广泛的分布。最早的研究是在19世纪初叶,Nordmann(1832)在几种淡水鱼的眼球和皮肤内发现了复口吸虫的囊蚴,并定名为Diplostomum volen。Braun(1894)用Nordmann发现的后囊蚴,进行人工感染红嘴鸥(Larusridibundus)获得了成虫,并定名为匙形复口吸虫(Diplostomum spathaceum)。Diesing(1850)从鸟类中获得的此类型的成虫,定名为Diplostomum grande。此后,有不少国家的学者陆续在一些鸥鸟和鱼类中,发现了超过41种复口吸虫的成虫和幼虫,并对它们的形态、生活史和分类学等诸方面做了大量的研究[7—9]。目前,我国仅描述了3种即倪氏复口吸虫(D. niedashui)、湖北复口吸虫(D. hupehensis) 和山西复口吸虫(D. shanxinensis)[10,11]。2009年4月至2014年7月我们对额尔齐斯河白斑狗鱼(Esox lucius)进行采样,发现其晶状体内寄生1种复口吸虫囊蚴,通过提取不同虫体基因组,针对18S-ITS1-5.8S rDNA 序列进行PCR扩增后测序然后构建系统进化树。研究结果显示:该复口吸虫隶属于吸虫纲(Trematoda)复殖吸虫亚纲(Digenea)鹗形目(Strigeiformes)双穴科(Diplostomidae)复口吸虫属(Diplostomum) 的假尾复口吸虫(Diplostomum paracaudum)。
1 材料与方法
1.1材料来源
2009年4月至2014年7月,从额尔齐斯河流域的北屯、福海、布尔津、哈巴河、185 团等采样点捕获或采购白斑狗鱼样本,在实验室进行编号记录后,测量体长并进行解剖检查,采集晶状体内的复口吸虫,分别固定于95%的乙醇溶液中。
1.2目的基因的提取及PCR扩增
取酒精固定的虫体样本置于TE缓冲液(pH 8.0)中浸泡过夜,吸去TE缓冲液,用Omega软体动物DNA小量提取试剂盒提取虫体DNA,并在-20℃保存。
由上海生工合成的,以18S-ITS1-5.8S序列为扩增引物。上游引物:18S-ITS1(5′-CCGTCGCTACT ACCGATTGAA-3′),下游引物:ITS1-5.8S(5′-CGCAATGTGCGTTCAAGATGTC-3′)[12]。PCR反映体系为50 μL,各物质及其体积如下:10×Taq MasterMix 25 μL,上游引物(10 mmol/L) 1 μL,下游引物(10 mmol/L) 1 μL,DNA模板2 μL,双蒸水21 μL。反应条件经优化后为94℃预变性10min; 94℃变性30s,60℃退火30s,72℃延伸50s,30个循环; 72℃延伸10min,4℃∞。
1.3目的DNA序列的测定
将扩增产物经1%琼脂糖电泳分析,得到目的条带切胶后用OMEGA公司的胶回收试剂盒进行纯化,纯化产物连接到 pEASY-T1载体进行TA克隆,经DH5α感受态细胞转化后,用Transgen公司的EasyPure Plasmid MiniPrep Kit提取质粒DNA,选取阳性质粒送上海生工测序。
1.4分子系统发育学分析
从GenBank下载具有18S-ITS1-5.8S核酸序列的复口吸虫属(Diplostomum)7种,总计13个样本及一外类群Gyrodactylus parvae,其核酸序列见表1。利用计算机MEGA5.1软件构建邻接法(Neighborjoining)、最大简约法(Maximum parsimony)系统进化树。
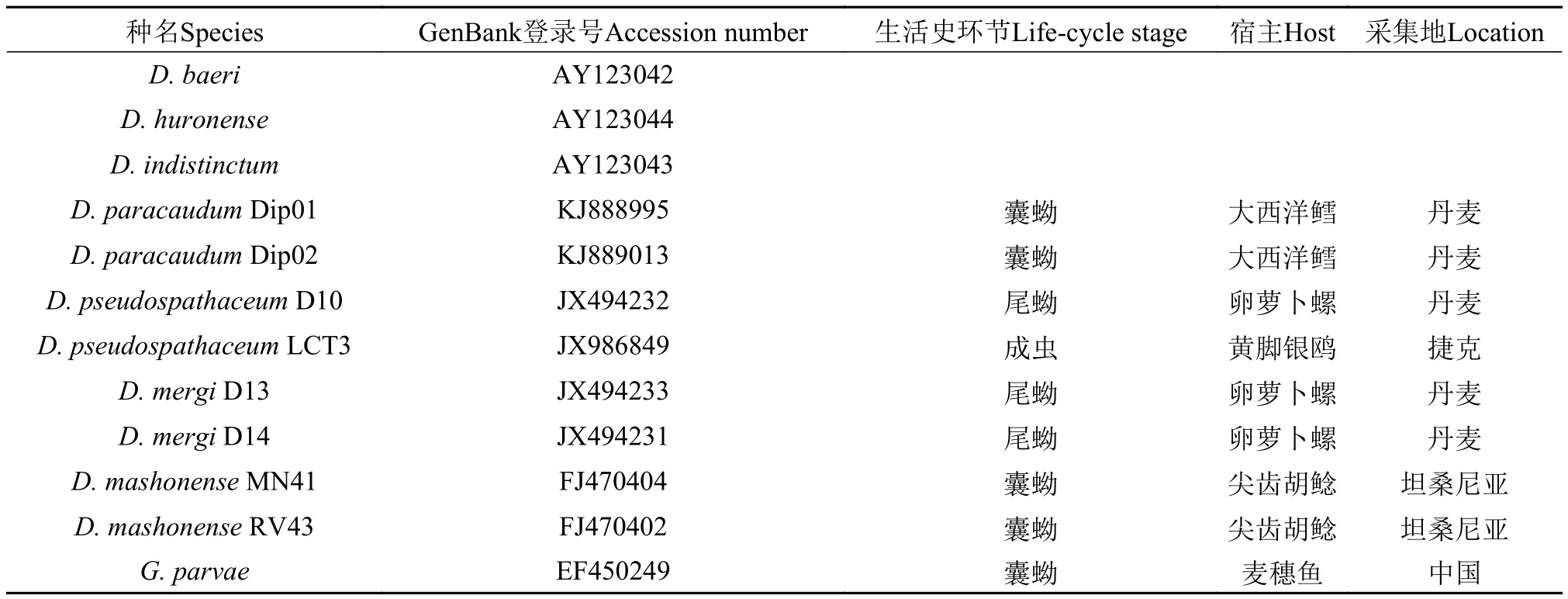
表1 来自GenBank的复口吸虫18S-ITS1-5.8S基因序列Tab. 1 18S-ITS1-5.8S sequences of Diplostomum from GenBank
2 结果
2.1基于18S-ITS1-5.8S rDNA基因的遗传距离分析
利用计算机MEGA5.1软件建立基于18S-ITS1-5.8S基因序列的7种复口吸虫(13个样本)与本实验待测种B1的遗传矩阵见表2。矩阵显示B1与D. paracaudum Dip01的遗传距离较短,为0.003。
2.2基于18S-ITS1-5.8S rDNA基因的系统发育分析
基于所得到的数据,以G. parvae为外类群进行分子系统发育分析。利用计算机MEGA5.1软件构建邻接法(Neighbor-joining)(图1)分子系统发育关系树,树上各分支上的数字用1000次Bootstrap来检测分子系统发育树各分支的置信度。待鉴定种B1与D. paracaudum Dip01聚为一支,其Bootstrap支持率为58%。
应用最大简约法(Maximum parsimony)构建分子系统发育关系树(MP树,图2)。MP树与NJ系统进化树显示结果一致:待鉴定虫种B1与D. paracaudum Dip01在进化树中均聚为一支。
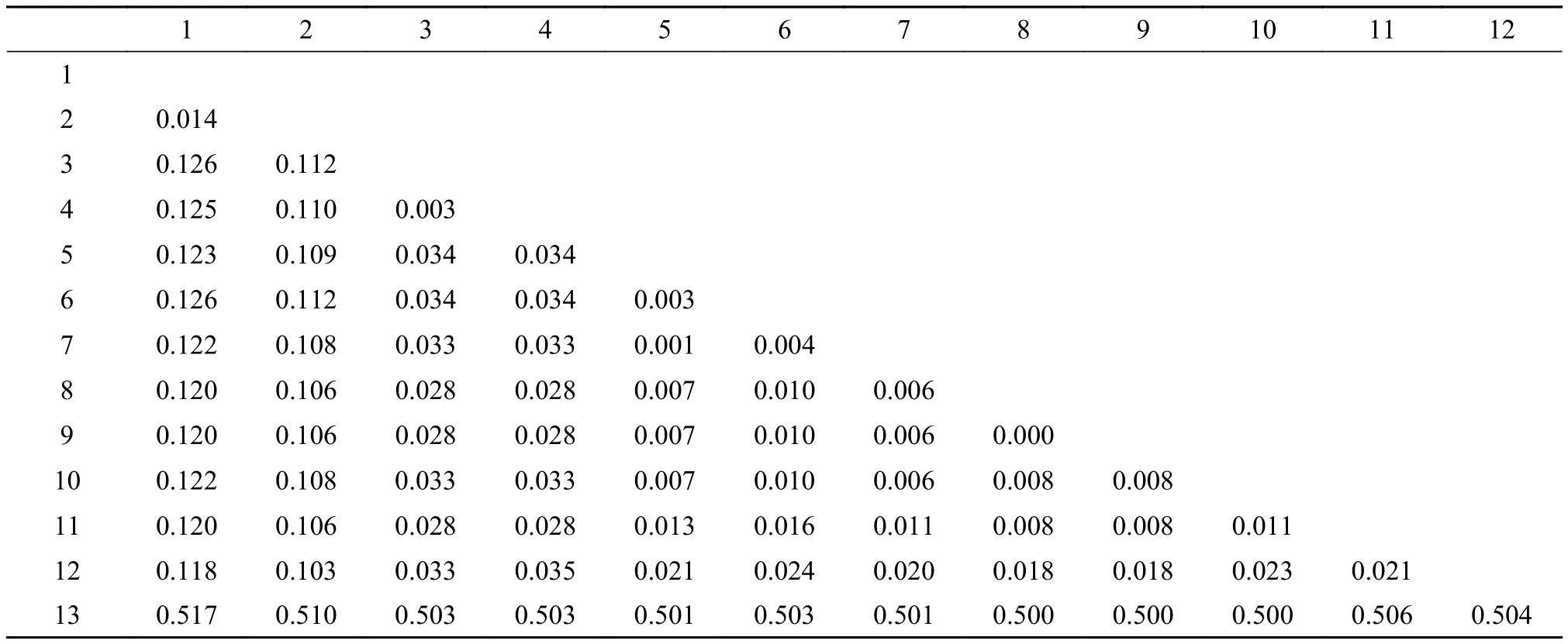
表2 18S-ITS1-5.8S rDNA序列区域的遗传距离Tab. 2 The distance of 18S-ITS1-5.8S rDNA genetic region
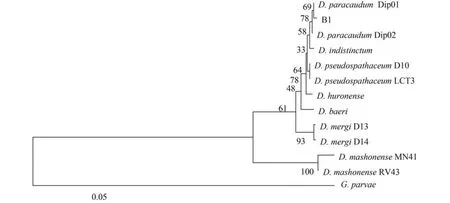
图1 基于18S-ITS1-5.8S基因系统进化树(NJ树)Fig. 1 Phylogenetic analysis of 18S-ITS1-5.8S gene(NJ tree)
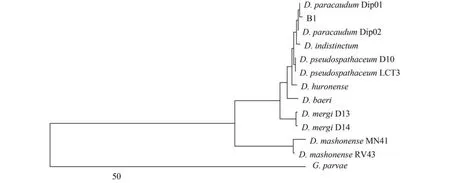
图2 基于18S-ITS1-5.8S基因系统进化树(MP树)Fig. 2 Phylogenetic analysis of18S-ITS1-5.8S gene(MP tree)
3 讨论
复口吸虫的种类在世界各地都有,主要原因是其宿主范围广,可随着终末宿主鸟类的迁移,使虫卵得到广泛散布。此外,第二中间宿主鱼类的洄游也可带来复口吸虫在地理区域上的扩散和流行[13,14]。早期对复口吸虫的种类鉴定主要是通过囊蚴的焰细胞形态、数量和排列方式进行的,但不同种类的复口吸虫囊蚴阶段的形态特征非常相似,所以观察十分困难,而且受采样时间及不同研究者的认知水平等限制,极易导致人为的差异。因此,仅靠其形态特点鉴定是不足的。随着分子生物学技术的进步,为我们提供了除利用形态学以外的另一种寄生虫鉴定方法。DNA序列分析可用于鉴定所有发育阶段的虫体,这是研究对具有复杂生活史寄生虫的优势手段[15]。特别是对像复口吸虫这样难以获得成虫的物种,这样的技术更有意义。选取容易采集,而且具有不同形态的复口吸虫囊蚴,通过分析比较其rDNA内转录间隔区(ITS)序列的差异,可以用来检测未定种。
本研究选取ITS基因为分子标记,对额尔齐斯河鱼类复口吸虫进行测序比对,经鉴定分析发现该吸虫为D. paracaudum。D. paracaudum的尾蚴和囊蚴在波兰、德国、芬兰和英国,成虫在芬兰的小黑背鸥(Larvsfuscus)体内发现的,并获得了尾蚴、囊蚴、成虫的部分ITS1序列及尾蚴的部分COⅠ序列,完成了整个生活史的分子鉴定工作[16,17]。在中国大陆,尚未发现D. paracaudum方面的研究报道,本实验是对中国境内D. paracaudum的首次报道。目前D. paracaudum已确定的分布地有波兰、德国、芬兰和英国,从地理分布上可以看出此种复口吸虫多分布于欧洲。在额尔齐斯河发现该种复口吸虫,证实了额尔齐斯河这一横跨欧亚大陆的河流特性,即其寄生虫区系与欧洲相近,而不同于国内其他地区的寄生虫区系。
目前,国内外关于复口吸虫的研究主要还是集中在第二中间宿主鱼类感染的囊蚴方面,包括感染率、感染强度、感染丰度、鱼类宿主的种类等流行病学层面上,但对这些虫体的分类学方面的研究较少。本次发现的复口吸虫为中国新记录-D. paracaudum,鉴于额尔齐斯河独特的地理位置,对该地区的寄生虫分类鉴定方面的研究对我国寄生虫区系研究意义重大,本文发现的新记录种为我国不同地域鱼类寄生虫的区系组成、病原分布、种群生态等方面提供科学资料。
[1]Ren M L,Guo Y,Zhang R M,et al. Fishes and fish fauna composition in Ergis River,China [J]. Arid Zone Research,2002,1(2):62—66 [任慕莲,郭焱,张人铭,等.我国额尔齐斯河流鱼类及名类区系组成. 干旱区研究,2002,1(2):62—66]
[2]Ren M L,Guo Y,Zhang R M,et al. The Fish Resources and Fishery in Ergis River,China [M]. Urumqi:Technology Hygiene Press. 2002,80—87 [任慕莲,郭焱,张人铭,等. 中国额尔齐斯河鱼类资源及渔业. 乌鲁木齐:新疆科技卫生出版社. 2002,80—87]
[3]Huo T B,Ma B,Adakbek·Karjan,et al. The study on feeding behavior and ecological niche of Esoxlucius in Lake Ulungur [J]. Chinese Journal Fisheries,2009,22(3):6—9 [霍堂斌,马波,阿达可白克·可尔江,等. 乌伦古湖白斑狗鱼摄食生态的初步研究. 水产学杂志,2009,22(3):6—9]
[4]Su D X,Adakbek·Karjan. Research of Esox lucius Linnaeus biology in the Ulungur Lake [J]. Xinjiang Agricultural Sciences,2002,39(5):259—263 [苏德学,阿达可白克·可尔江. 乌伦古湖白斑狗鱼的生物学研究. 新疆农业科学,2002,39(5):259—263]
[5]Hao C L,Zhao J S,Jiao L,et al. Investigation on parasite species and infected condition of Esox lucius Linnaeus in Ergis River [J]. Xinjiang Agricultural Sciences,2011,48(1):135—138 [郝翠兰,赵江山,焦丽,等. 额尔齐斯河白斑狗鱼寄生虫种类及感染情况的调查研究. 新疆农业科学,2011,48(1):135—138]
[6]Sun J. Diplostomum and its progress in advance on ecology [J]. Ecologic Science,2005,24(2):168—172 [孙军.复口吸虫的研究进展. 生态科学,2005,24(2):168—172]
[7]Yang F X. Studies on strigeid trematodes from birds. I. on a new genus and three new species in Diplostomatidae[J]. Acta Zoologica Sinica,1959,11(4):482—498 [杨复曦. 广东鸟类鹗形类吸虫的研究. I. 双穴科(吸虫纲)的吸虫,包括一新属三新种的描述. 动物学报,1959,11(4):482—498]
[8]Locke S A,McLaughlin J D,Marcogliese D J. DNA barcodes show cryptic diversity and a potential physiological basis for host specificity among Diplostomoidea(Platyhelminthes:Digenea) parasitizing freshwater fishes in the St. Lawrence River. Canada [J]. Molecular Ecology,2000,19,2813—2827
[9]Niewiadomska K. The genus Diplostomum-taxonomy,morphology and biology [J]. Acta Parasitologica,1996,41:55—66
[10]Pan J P,Wang W J. Diplostomiasis research and control methods,including descriptions of two new species [J]. Acta Hydrobiologica Sinica,1963,1:1—45 [潘金培,王伟俊. 复口吸虫病的研究及其防治方法,包括二新种的描述. 水生生物学集刊,1963,1:1—45]
[11]Zheng X Y. Studies on Diplostomiasis and pathogenic biology of rainbow trout [D]. Wuhan:Institute of Hydrobiology,Chinese Academy of Sciences,1987 [郑小英. 虹鳟复口吸虫病及其病原生物学的研究. 武汉:中国科学院水生生物研究所硕士论文. 1987]
[12]Francisca I,Fernanda R P,Nuno E. Morphology,ultrastructure,genetics,andmorphometrics of Diplostomum sp.(Digenea:Diplostomidae) metacercariae infecting the European flounder,Platichthysflesus L.(Teleo-stei:Pleuronectidae),off the northwest coast of Portugal [J]. Parasitology Research,2012,110:81—93
[13]Wootten R. Observations on strigeidmetacercariae in the eyes of fish from Hanning field reservoir,Essex,England[J]. Journal of Helminthology,1974,48:73—83
[14]Kennedy C R. A checklist of British and Irish freshwater fish parasites with notes on their distribution [J]. Journal of Fish Biology,1974,6:613—644
[15]Mikheev V N,Pasternak A F,Taskinen J,et al. Parasiteinduced aggression and impaired contest ability in a fish host [J]. Parasites & Vectors,2010,3:17
[16]Niewiadomska K,Szymafiski S. Host-induced variability of Diplostomum paracaudum(Iles,1959) metacercariae(Digenea) [J]. Acta Parasitologica Polonica,1991,36,11—17
[17]Niewiadomska K,Niewiadomska-Bugaj M. Optimal identification procedure for Diplostomum paracaudum(Iles,1959) and D. pseudospathaceum Niewiadomska,1984 metacercariae(Digenea) based on morphological characters [J]. Systematic Parasitology,1995,130:165—171
MOLECULAR IDENTIFICATION OF DIPLOSTOMUM PARACAUDUM ON ESOX LUCIUS IN IRTYSH RIVER
Parengul · Rahat,JIAO Li and YUE Cheng
(College of Veterinary Medicine,Xinjiang Agricultural University,Urumqi 830052,China)
The current study identified a species of Diplostomum from the lens of Esox lucius in Irtysh River(China section) using molecular biology techniques. These results showed that this species was Diplostomum paracaudum,a new record of this kind of species in China. The similarity of partial 18S-ITS1-5.8S sequence between this sample and another D. paracaudum from GenBank was 99.6%. A phylogenetic tree analysis based on the partial 18S-ITS1-5.8S of 7 species in the genus of Diplostomum identified an out group species Gyrodactylus parvae,and supported our sample was closely related to D. paracaudum with a more than 50% bootstrap.
Irtysh River; Esox lucius Linnaeus; Diplostomum paracaudum; Molecular identification
Q959.15
A
1000-3207(2016)05-0992-05
10.7541/2016.128
2016-02-19;
2016-04-15
国家自然科学基金项目(31360644)资助 [Supported by the National Natural Science Foundation of China(No. 31360644)]作者简介:番林古丽·热哈提(1989—),女,哈萨克族,新疆阿勒泰人; 硕士研究生; 研究方向为预防兽医学。E-mail:1002497734@qq.com通信作者:岳城(1958—),男,陕西城固人; 教授,博士研究生导师; 研究方向为水生动物保护学。E-mail:yuechengxnd@aliyun.com
