长江上游中华沙鳅食性特征的C、N同位素分析
2016-11-12徐丹丹倪露芸王永明谢碧文
李 斌 陶 敏 徐丹丹 倪露芸 王永明 王 芳 谢碧文
(内江师范学院生命科学学院,长江上游鱼类资源保护与利用四川省重点实验室,内江 641100)
长江上游中华沙鳅食性特征的C、N同位素分析
李斌陶敏徐丹丹倪露芸王永明王芳谢碧文
(内江师范学院生命科学学院,长江上游鱼类资源保护与利用四川省重点实验室,内江 641100)
应用C、N稳定同位素技术并结合肠含物分析对我国长江上游特有鱼类中华沙鳅(Sinibotia superciliaris)不同发育阶段食性进行了探究。结果显示:中华沙鳅δ13C、δ15N 平均值分别为(-22.48±0.85)‰、(10.09±0.69)‰;不同体长段δ13C(P<0.05,F=2.44)、δ15N(P<0.01,F=6.06)值差异显著,暗示了中华沙鳅在生长发育过程中存在食性转变现象;体长<80 mm 的个体主要摄食水生昆虫和藻类,属杂食偏肉食性鱼类;体长>80 mm的个体,其食物以虾类、淡水壳菜和水生昆虫为主,属肉食性鱼类。中华沙鳅营养级位于2.02—2.47,与长江上游多种底栖型鱼类生态位相似;食物竞争可能是导致其摄食强度弱和资源量下降的原因之一。研究结果可为长江上游中华沙鳅野生资源保护提供理论参考。
中华沙鳅;稳定同位素;肠含物分析;食性
在水生生态系统中,食物资源对于鱼类的生长、发育和繁衍至关重要[1]。鱼类食物信息对于描述其在水生生态系统中不同种间的营养关系[2]、分析水域环境中资源分配模式和了解群落结构与功能有重要的意义[3]; 同时也是开展水域资源保护和增殖、建立实施多种类资源管理模式的基础[4]。
研究鱼类食物组成的传统方法主要是肠含物分析,该方法虽能够获得鱼类 “瞬时” 食物信息,但易忽视已经被鱼类消化和吸收的食物,故该方法并不能全面的反映鱼类食物来源[5]。近年来碳(δ13C)、氮(δ15N)稳定同位素技术已经广泛用于研究不同环境条件下鱼类食性特征。稳定同位素比值反映的是消费者一定时间内摄取和吸收食物同位素特征[6]。δ13C值可以反映消费者食物来源,而δ15N值可用来确定其营养级水平[7]。目前稳定同位素技术已成功用于鱼类食性类型[8—10]和摄食策略[11,12]等方面的研究。
中华沙鳅(Sinibotia superciliaris)隶属鲤形目(Cypriniformes)鳅科(Cobitidae),俗称钢鳅,是我国长江上游特有鱼类,栖息于流水环境中,为底栖型的小型经济鱼类[13]。近年来由于长江上游向家坝、白鹤滩等大型水利枢纽工程建设、人为过度捕捞和非法渔具使用等因素导致中华沙鳅野生资源量急剧下降[14]。因此,亟需开展对中华沙鳅野生资源的保护研究工作。目前,有关中华沙鳅的研究主要集中在年龄生长与繁殖[14,15]和系统发育方面[16,17],对其食性方面的关注较少,仅见零星报道[18]。本研究应用稳定同位素技术并结合肠含物分析对长江上游中华沙鳅生活史不同发育阶段食物组成进行研究,以探讨长江上游中华沙鳅食物保障情况,为中华沙鳅的资源保护和增殖放流提供参考依据,同时也为长江上游鱼类食物网的研究提供基础资料。
1 材料与方法
1.1样品采集与处理
于2009—2010年的5月、8月和10月,在长江上游干流宜宾、南溪和支流沱江资中河段3个样点采集中华沙鳅样品(图1)。该批样品为沿江渔民用定置刺网、地笼等网具所捕获,有较强的随机性和代表性。
样品采集后在鲜活状态下对其体长(mm)、体重(g)等常规生物学指标进行测量。现场解剖并测量肠长(mm),参照殷名称确定其肠充塞指数[19](Stomach fullness index),然后将其整个肠道保存在5%—8%甲醛溶液中备用。在解剖镜下分析鉴定肠道食物组成,参照殷名称统计食物出现频率(Frequency of Occurrence)[19]。鱼体用75%的酒精溶液保存,并随机挑出大小不同的个体共计60尾用于同位素分析。具体方法为取其背部肌肉,保存在5 mL离心管中以60℃烘干至恒重,再用研钵研磨成均一粉末,放入干燥器保存待测。60尾中华沙鳅体长分为7个阶段,分别是60—69 mm(n=6)、70—79 mm(n=7)、80—89 mm(n=9)、90—99 mm(n=17)、100—109 mm(n=6)、110—119 mm(n=15)、120—129 mm(n=9)。水生昆虫、有机碎屑、藻类、虾和淡水壳菜等潜在食源碳、氮稳定同位素数据引自李雷[12]。
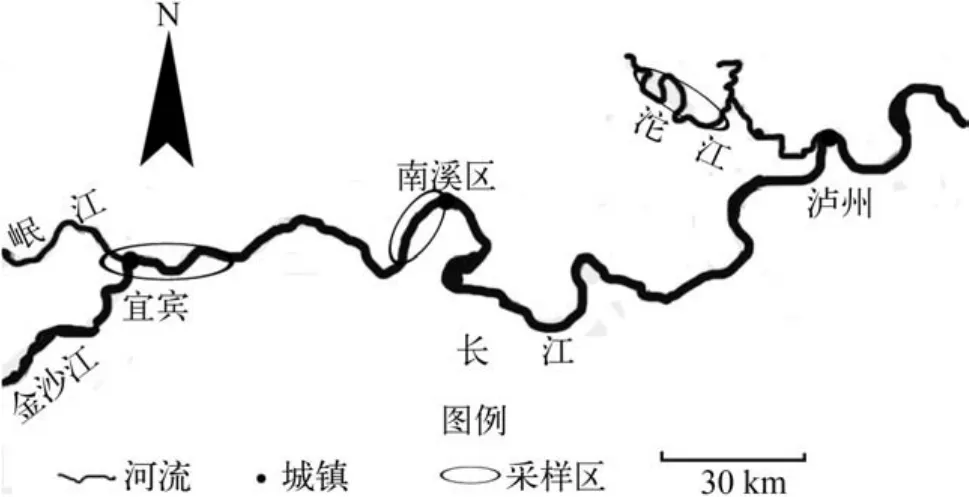
图1 江上游中华沙鳅采样区域Fig. 1 Sampling areas of S.superciliaris in the Upper Yangtze River
1.2稳定同位素测定
稳定C、N同位素比值测定在北京林业科学院同位素实验室完成,所用稳定同位素质谱仪为菲尼根Flash EA112 HT元素分析仪与菲尼根DELTA V Advantage同位素比率质谱仪相连而成。稳定C、N同位素的自然丰度表示为:
δX=[(R样品/R标准)-1]×1000‰
式中X代表13C或15N,R代表所测同位素的比值(13C/12C或15N/14N)。δ13C值是相对于国际PDB标准,δ15N值是相对于空气中氮气的丰度。分析精度δ13C<0.10‰,δ15N<0.20‰。酒精会对样品的δ13C、δ15N值产生影响,因此本研究参考Bosley和Wainright[20]方法对中华沙鳅δ13C、δ15N值进行了校正。
1.3统计与分析
营养级计算公式[21]:
TP(trophic position)=[(δ15Nconsumer-δ15Nbaseline)/ Δδ15N‰]+λ
式中,Δδ15N=3.4‰; 当baseline是生产者时,λ=1; 当baseline初级消费者时,λ=2。
所有实验数据用SPSS 16.0和Excel 2003软件作常规统计。中华沙鳅不同体长段C、N同位素数据应用Statistic 6.0软件进行方差分析(Analysis of variance),若发现不同体长段之间存在显著差异则以LSD(最小显著差数法)进行多重比较。所有统计值均采用平均值±标准差表示,显著水平定位P<0.05。
2 结果
2.1基础生物学特征
体长与体质量关系本次调查共采集中华沙鳅样本304尾,体长为57.12—128.84 mm,体质量为7.67—60.13 g,体长与体质量之间呈现明显的幂函数关系(图2),表达式为W=0.0002 L2.56,(R2=0.824,b=2.56,P<0.001; 其中b=2.56,表明野生状态下的中华沙鳅基本上处于等速生长)。中华沙鳅肠道长与体长之间的比值平均为0.74±0.16(t检验,P>0.05,n=304)。
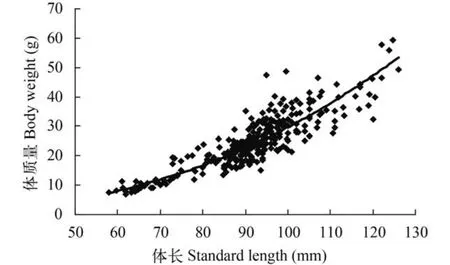
图2 中华沙鳅体长与体质量关系(n=304)Fig. 2 Correlation between the standard length and body weight of S. superciliaris(n=304)
摄食强度与空肠率304尾中华沙鳅样本被分为7个不同体长段(图3)。分析显示不同体长段的中华沙鳅摄食强度差异显著(P=0.029<0.05,SS=10.57,MS=1.761,F=2.38)。LSD检验可知,100—109 mm体长段中华沙鳅的摄食强度最大,明显大于其他体长段的个体; 体长<109 mm的个体随着体长的增加其摄食强度也逐渐增强; 体长>110 mm的个体伴随体长的增大其摄食强度呈现递减趋势;但总体而言不同体长段中华沙鳅摄食强度均不高(图3),其中体长<70 mm和体长>110 mm个体的空肠率明显高于其他体长段。
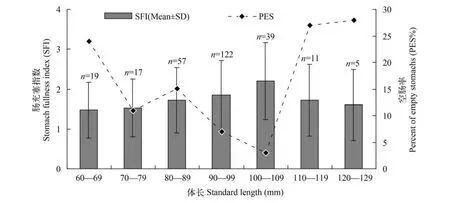
图3 体长段中华沙鳅肠充塞指数和空肠率Fig. 3 Mean(±SD) size classes of stomach fullness and percent of empty stomachs of S. superciliaris
2.2肠含物组成
在304尾中华沙鳅样本中,肠道中有食物样本量达到270尾,占总样本的88.89%。其肠含物食物组成主要可分为虾、摇蚊幼虫、扁蜉、纹石蚕、淡水壳菜、有机碎屑、藻类和其他等类群(表1)。在食物出现频率方面水生昆虫(摇蚊幼虫、扁蜉和纹石蚕)最高为67.86%,其中以纹石蚕比例最大,占水生昆虫总数81.89%,摇蚊幼虫最低为4.16%; 其次为藻类,达到42.07%,最低为有机碎屑(5.06%)。
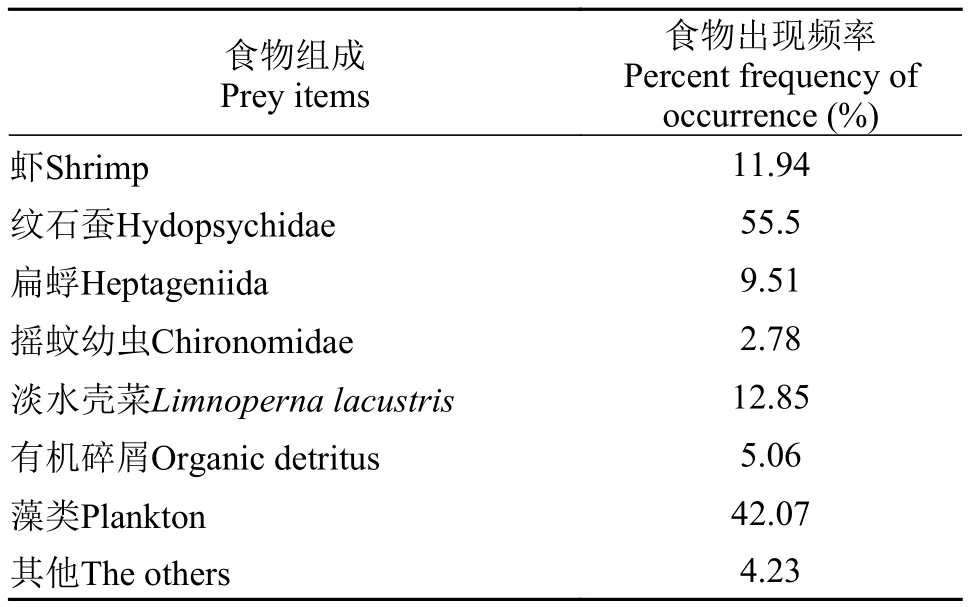
表1 中华沙鳅肠含物主要类群及其出现频率Tab. 1 Composition and frequency of occurrence in intestinal contents of S. superciliaris
2.3同位素组成
在304尾中华沙鳅样本中有60尾用于δ13C、δ15N值分析(表2),其体长和体质量范围分别为60.31—128.84 mm和8.21—59.83 g,肠含物组成主要可分为有机碎屑、浮游生物(藻类)、水生昆虫(摇蚊幼虫、扁蜉和纹石蚕)、双壳类(淡水壳菜)和虾五大类。
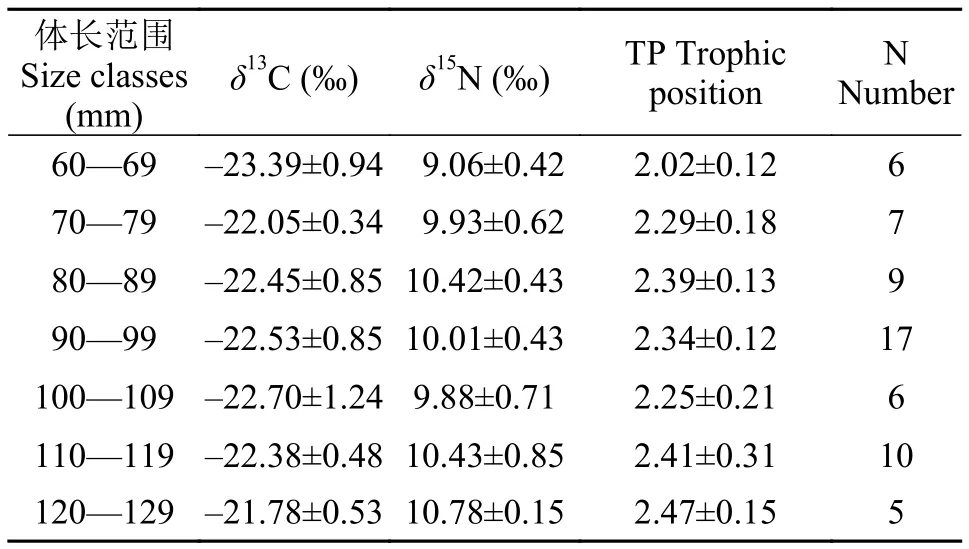
表2 各体长段中华沙鳅稳定同位素比率(n=60,平均值±标准差)Tab. 2 Mean(±SD) size classes of stable isotope ratios of S. superciliaris(n=60)
60尾中华沙鳅样品δ13C、δ15N平均值分别为-22.48±0.85‰和10.09±0.69‰,δ15N值随着δ13C值增加呈递增趋势(图4,R2<0.5,P=0.37)。由图5可知潜在食源中有机碎屑δ13C、δ15N最低(δ13C,-27.28± 0.64‰; δ15N,0.75±0.58‰)。除了有机碎屑外,其他潜在食源的δ13C值与中华沙鳅δ13C值较为接近。在δ15N组成方面,绝大多数中华沙鳅个体的δ15N值都明显高于潜在食源,仅少数几尾个体的δ15N与淡水壳菜较为相似(图5)。
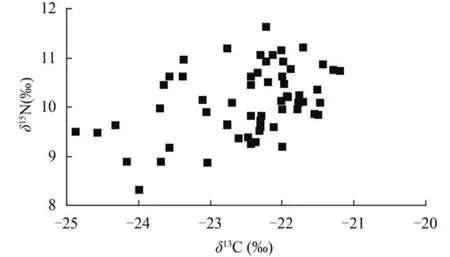
图4 碳、氮同位素比值的相关系图Fig. 4 The relationship of the Variations in δ13C and δ15N signatures
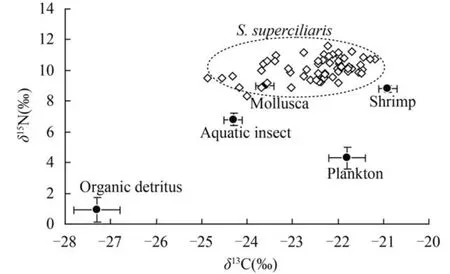
图5 中华沙鳅和潜在优势食源同位素比值Fig. 5 Stable isotope ratios(δ13C and δ15N) of the dominant potential food items and S. superciliaris
分析显示不同体长段中华沙鳅δ13C差异显著(P<0.05,SS=9.25,MS=1.54,F=2.44),LSD检验体长在60—69 mm的个体δ13C显著低于其他体长段的个体(P<0.05)。中华沙鳅(不同体长段)δ15N值变化规律与δ13C值一致(P<0.01,SS=11.50,MS=1.92,F=6.06),LSD检验体长在60—69 mm个体δ15N值显著低于其他体长段的个体; 体长在120—129 mm的个体δ15N值显著高于体长段70—79 mm(P=0.013)、90—99 mm(P=0.010)、100—109 mm(P=0.011)的个体。总体而言中华沙鳅δ13C、δ15N值随其体长的增长呈递增趋势(图6)。这暗示了中华沙鳅在不同发育阶段可能存在食物转换现象[9]。
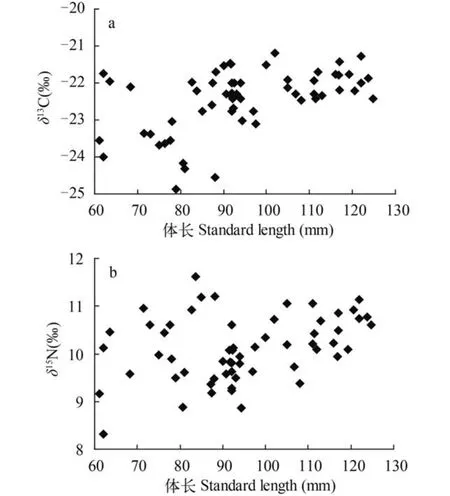
图6 中华沙鳅体长与δ13C、δ15N值之间关系图(a,δ13C和b,δ15N)Fig. 6 δ13C and δ15N signatures in S. superciliaris according to standard length in upper reaches of the Yangtze River
2.4营养水平
食物关系是了解生态系统能量流动的核心,也是群落赖以生存的基础[22]。通常在水域生态系统中不同营养级间的δ15N富集度的平均值为3.4‰[21]。依据David和Post[23]的建议,本研究中选择淡水壳菜的δ15N值作为基线值计算了不同体长段中华沙鳅的营养级(表2)。图7显示了中华沙鳅随着体长段的增加其营养级水平呈现递增趋势; 其中体长在120—129 mm的个体其营养级水平最高,平均值为2.47±0.15; 体长<69 mm的个体营养水平最低,平均值为2.02±0.12。
3 讨 论
3.1中华沙鳅食性
本文应用稳定同位素技术并结合肠含物分析对长江上游(宜宾、南溪和沱江资中河段)野生中华沙鳅食性进行了研究。中华沙鳅的食物主要由水生昆虫、虾、双壳类、有机碎屑和藻类等组成(表2和图4)。这一结果与普炯[18]报道的合江水域中华沙鳅食性研究结果有部分是相似的,但本次研究发现淡水壳菜和藻类也是长江上游中华沙鳅食物的重要组成部分。碳、氮稳定同位素分析显示中华沙鳅不同生长发育阶段可能存在食物转变现象,这一现象在其他鱼类也有发现[24—26]。本研究显示小个体中华沙鳅(<80 mm)食性为杂食偏肉食性,食物来源以藻类、有机碎屑、水生昆虫等为主; 大个体中华沙鳅(>80 mm)为肉食性,主要摄食水生昆虫、虾和淡水壳菜等。
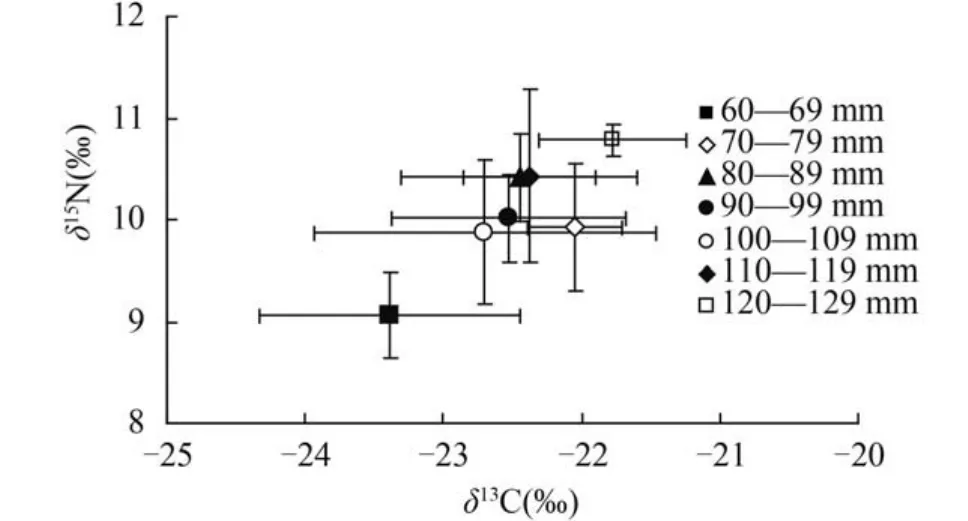
图7 中华沙鳅不同体长段碳、氮同位素比值组成Fig. 7 Mean(±SD) size classes of δ13C and δ15N of S. superciliaris
3.2形态、繁殖、栖息类型与食性之间的关联
形态与食性之间的关联本次调查的304尾中华沙鳅的肠道长:体长=0.74<1,符合其肉食性鱼类生物学特征[19]。已有报道显示鱼类的代谢速度会影响其自身的摄食量,通常在同一个种群中大个体鱼类生长速度开始变缓,其对食物需求量也逐渐减少[27]。因此,本次调查中大个体中华沙鳅(>120 mm)空肠率明显高于小个体。Santiago等[26]发现鱼类的形态特征与其在不同发育阶段的食性转变现象有密切关联; 类似的研究报道较多,例如伴随鱼类口裂的增大其食性也将由杂食性或肉食偏植物食性向肉食性转变[24,28,29]; 游泳能力对鱼类的摄食强度有明显影响,胸鳍发达的个体能够迅速准确的获取食物,从而保证了其摄食率的稳定性[30]; 同一种群中大个体鱼类具有相对发达的胸鳍,在食物获取方面的优势也就更加明显[31]。因此,中华沙鳅不同生长发育阶段食性的差异可能与形态结构和游泳能力有关。
繁殖与食性之间的关联鱼类在不同生长发育阶段对能量需求不同,鱼类摄取食物种类主要取决于食物能量的高低[32]。已有报道显示,食物中虾类、双壳类的能量值明显高于藻类、有机碎屑和水生昆虫等。当繁殖季节来临时,进入繁殖阶段的中华沙鳅[13](体长≥90 mm个体已经达到性成熟),倾向于选择高能量食物的比例明显增加[26]。因此,繁殖耗能可能是引起中华沙鳅食性转变的诱因之一。
栖息类型与食性之间的关联鱼类觅食特征与栖息类型相关[33]。在野外调查采样期间,发现大个体的中华沙鳅更喜好敞水区,而小个体常生活在近水区。这种现象发生的可能原因:① 生活在敞水区的大个体中华沙鳅更易获取丰富优质的食物资源[34]; ② 生活在近水区的小个体可有效降低其被捕食的风险[35],从而提高成活率; ③ 有利于合理分配资源,避免生态位重叠降低种内食物竞争关系,提高了饵料资源利用率。因此,不同的栖息环境可能是引起中华沙鳅食性差异的因素之一。
3.3相对营养级位置
研究区域中华沙鳅营养级位于2.02—2.47,与长江上游同水域长薄鳅[12]、瓦氏黄颡鱼、光泽黄颡鱼[36]等多种喜底栖鱼类生态位相似,有很强的种间食物竞争。与上述几种鱼类相比,中华沙鳅个体偏小竞争能力弱可能是导致其摄食强度弱和资源量下降的因素之一。
4 结论
通过对长江上游中华沙鳅肠含物组成和稳定C、N同位素数据分析显示,生活在该水域的野生中华沙鳅群体在生活史不同发育阶段存在食物转变现象。通常体长<80 mm 的个体主要摄食水生昆虫和藻类,属杂食偏肉食性鱼类; 体长>80 mm的个体,其食物以虾类、淡水壳菜和水生昆虫为主,属肉食性鱼类。中华沙鳅营养级位于2.02—2.47,与长江上游多种底栖型鱼类生态位相似; 种间食物竞争可能是导致其摄食强度弱和资源量下降的原因之一。
[1]Ross S T. Resource partitioning in fish assemblages:a review of field studies [J]. Copeia,1986,247(2):352—388
[2]Hutchinson G E. Concluding remarks [J]. Cold Spring Harbor Symposia,1957,22:415—427
[3]Fogarty M J,Murawski S A. Large scale disturbance and the structure of marine systems:fishery impacts on Georges Bank [J]. Ecological Applications,1998,8(1):6—22
[4]Deng J Y,Jiang W M,Yang J M. Species interaction and food web of major predatory species in the Bohai Sea [J]. Journal of Fishery Sciences of China,1997,4(4):1—7
[5]Deb D. Trophic uncertainty vs. Parsimony in food web research [J]. Oikos,1997,78(1):191—194
[6]Deniro M J,Epstein S. Influence of the diet on the distribution of nitrogen isotopes in animals [J]. Geochimica et Cosmochimica Acta,1981,45(3):341—351
[7]Bootsma H AM,Hecky R E,Hesslein R H. Food partitioning among lake Malawi nearshore fishes as revealed by stable isotope analysis [J]. Ecology,1996,77(4):1286—1290
[8]Logan J M,Golet W J,Lutcavage M E. Diet and condition of Atlantic bluefin tuna(Thunnus thynnus) in the Gulf of Maine,2004-2008 [J]. Environmental Biology of Fishes,2015,98(5):1411—1430
[9]Svanbäck R,Quevedo M,Olsson J,et al. Individuals in food webs:the relationship between trophic position,omnivory and among-individual diet variation [J]. Oecologia,2015,178(1):103—114
[10]Artero C,Koenig C C,Richard P,et al. Ontogenetic dietary and habitat shifts in goliath grouper Epinephelus itajara from French Guiana [J]. Endangered Species Research,2015,(27):155—168
[11]Yonezaki S,Kiyota M,Okamura H,et al. Long-term ecosystem change in the western North Pacific inferred from commercial fisheries and top predator diet [J]. Deep Sea Research Part II Topical Studies in Oceanography,2015,113:91—101
[12]Li L,Wei Q W,Wu J M,et al. Diet of Leptobotia elongata revealed by stomach content analysis and inferred from stable isotope signatures [J]. Environmental Biology of Fishes,2015,98(8):1965—1978
[13]Li Q,Yao M Y,Zhou B,et al. Technique of artificial reproduction of Botia superciliaris Günther [J]. Journal of Freshwater Fisheries of China,2011,41(5):92—95 [李强,姚明予,周波,等. 中华沙鳅人工繁殖技术初探. 淡水渔业,2011,41(5):92—95]
[14]Yang M S,Ding X. Study on the reproductive biology of Botia superciliaris [J]. Journal of Hydroecology,2010,3(2):38—41 [杨明生,丁夏. 中华沙鳅的繁殖生物学研究. 水生态杂志,2010,3(2):38—41]
[15]Zhao T,Liu J H. The initial study of the otolith age and growth of Botia superciliaris Günther in the Jiangjin Segment of Yangtze River [J]. Journal of Freshwater Fisheries of China,2008,38(5):46—50 [赵天,刘建虎. 长江江津江段中华沙鳅耳石及年龄生长的初步研究. 淡水渔业,2008,38(5):46—50]
[16]Tang Q Y,Liu H Z,Yang X P,et al. Studies on the structure of the mitochondrial DNA control region and phylogenetic relationships of the subfamily Botiinae [J]. Acta Hydrobiologica Sinica,2005,29(6):645—653 [唐琼英,刘焕章,杨秀平,等. 沙鳅亚科鱼类线粒体DNA控制区结构分析及系统发育关系研究. 水生生物学报,2005,29(6):645—653]
[17]Liu H Y,Chen D Q,Liu S P,et al. Genetic diversity of Botia superciliaris in the upper Yangtze River [J]. Journal of Freshwater Fisheries of China,2009,39(3):8—13[刘红艳,陈大庆,刘绍平,等. 长江上游中华沙鳅遗传多样性研究. 淡水渔业,2009,39(3):8—13]
[18]Pu J,Jia L,Su S Q,et al. A preliminary study on feeding habits of Botia superciliaris [J]. Journal of Southwest University(Natural Science Edition),2014,36(1):41—46[普炯,贾砾,苏胜齐,等. 中华沙鳅食性研究. 西南大学学报(自然科学版),2014,36(1):41—46]
[19]Yin M C. Fishery Ecology [M]. Beijing:Chinese Agricultural Press. 1993,67—79 [殷名称. 鱼类生态学. 北京:中国农业出版社. 1993,67—79]
[20]Bosley K L,Wainright S C. Effects of preservatives and acidification on the stable isotope ratios(N15:N14,C13:C12)of two species of marine animals [J]. Pédagogie Médicale,2013,14(1):27—38
[21]Post D M. Using stable isotopes to estimate trophic position:models,methods,and assumptions [J]. Ecology,2002,83(3):703—718
[22]Li B,Chen F J,Tao M,et al. The characteristic of the food web structure at aquatic organisms community in sumer voer Zoige Aipine wetland [J]. Acta Hydrobiologica Sinica,2016,30(2):313—320 [李斌,陈发军,陶敏,等. 夏季若尔盖高寒湿地水生生物群落食物网结构特征. 水生生物学报,2016,30(2):313—320]
[23]David M,Post D M. Using stable isotopes to estimate trophic position:models,methods,and assumptions [J]. Ecology,2002,83(3):703—718
[24]Li B,Wang Z J,Jin L,et al. Study on diet shift of Erythroulter mongolicus mongolicus with stable isotope technology [J]. Journal of Fisheries of China,2011,35(9):1419—1426 [李斌,王志坚,金丽,等. 蒙古鲌食性转变的稳定性同位素研究. 2011,35(9):1419—1426]
[25]Eloranta A P,Kahilainen K K,Jones R I. Seasonal and onto-genetic shifts in the diet of Arctic charr Salvelinus alpinusin asubarctic lake [J]. Journal of Fish Biology,2010,77(1):80—97
[26]Santiago A B,Lorena B S,Daniel E F,et al. Feeding habits of the Magellan skate:effects of sex,maturity stage,and body size on diet [J]. Hydrobiologia,2010,64(1):275—286
[27]Sims D W. The effect of body size on standard metabolicrate of the lesser spotted dogfish [J]. Journal of Fish Biology,1996,48(3):542—544
[28]Yasuno N,Chiba Y,Shindo K,et al. Size-dependent ontogenetic diet shifts to piscivory documented from stable isotope analyses in an introduced population of largemouth bass [J]. Environmental Biology of Fishes,2012,93(2):255—266
[29]Lucifora L O,Valero J L,Bremec C S,et al. Feedinghabits and prey selection by the skate Dipturus chilensis(Elasmobranchii:Rajidae) from the south-western Atlantic [J]. Journal of the Marine Biological Association of the UK,2010,80(8):953—954
[30]Higham T E. The integration of locomotion and prey capture invertebrates:morphology,behavior,and performance [J]. Integrative & Comparative Biology,2007,47(1):82—95
[31]Scharf F S,Juanes F,Rountree R A. Predator size prey size relationships of marine fish predators:interspecific variation and effects of ontogeny and body size trophicniche breadth [J]. Marine Ecology Progress,2000,208(1):229—248
[32]Wanink J H,Joordens J C A. Dietary shifts in Brycinu ssadleri(Pisces:Characidae) from southern Lake Victoria [J]. Aquatic Ecosystem Health & Management,2007,10(4):392—397
[33]Kikolsky G V. The Ecology of Fishes [M]. Academic,London,1963,321—322
[34]Schoener T W. Resource partitioning in ecological communities [J]. Science,1974,185(4145):27—39
[35]Grey J. Ontogeny and dietary specialization in brown trout(Salmo trutta L.) from Loch Ness,Scotland,examined using stable isotopes of carbon and nitrogen [J]. Ecology of Freshwater Fish,2001,10(3):168—176
[36]Bacha M,Amara R. Spatial,temporal and ontogenetic variation in diet of anchovy(Engraulis encrasicolus) on the Algerian coast(SW Mediterranean) [J]. Estuarine Coastal & Shelf Science,2009,85(2):257—264
[37]Li B,Wang Z J,Yue X J,et al. Influence of 175-m-impoundment in Three Gorge Reservoir area on the food web energy sources of main commercial fishes in backwater area of Xiaojiang River [J]. Chinese Journal of Applied Ecology,2013,24(6):1715—1721 [李斌,王志坚,岳兴建,等. 三峡库区175m蓄水对小江回水区主要经济鱼类能量来源的影响. 2013,24(6):1715—1721]
DIET OF SINIBOTIA SUPERCILIARIS BY STABLE ISOTOPE SIGNATURE FROM THE UPPER REACHES OF THE YANGTZE RIVER
LI Bin,TAO Min,XU Dan-Dan,NI Lu-Yun,WANG Yong-Ming,WANG Fang and XIE Bi-Wen
(Key Laboratory of Sichuan Province for Fishes Conservation and Utilization in the Upper Reaches of the Yangtze River,School of Life Sciences,Neijiang Normal University,Neijiang 641100,China)
Sinibotia superciliaris belongs to endemic economic fish in upper reaches of the Yangtze River,and its population decreased sharply in recent years because of overfishing and habitat destroy. In this study,intestinal contents and stable isotope analysis from muscle were examined based on specimens collected in May,August and October of 2009 in upper reaches of the Yangtze River,China. The results showed that the mean values of δ13C and δ15N of the S. superciliaris were(-22.48±0.85)‰ and(10.09±0.69)‰,respectively. The significant differences in δ13C(P<0.05,F=2.44) and δ15N(P<0.01,F=6.06) values were associated with body lengths,suggesting the changes of feeding habit during the growth and development of the S. superciliaris. We observed that small individuals(body length <80 mm) fed mainly on algae,aquatic insects and organic detritus based on the most important food item in the intestine contents and that big individuals(body length >80 mm) ate mainly,Shrimp,Limnoperna lacustris and aquatic insects. The trophic level of S. superciliaris ranged from 2.02 to 2.47,which was similar to the variety of benthic fishes of the upper reaches of the Yangtze River,suggesting that food competition might cause the population decline. The present results may provide useful information in conservation and sustainable utilization of fish resource as well as aquaculture.
Sinibotia superciliaris; Stable isotopes; Intestinal content analysis; Feeding habits
Q958.8
A
1000-3207(2016)05-0978-07
10.7541/2016.126
2016-04-18;
2016-06-23
四川省科技支撑项目(2011NZ0075)资助 [Supported by Science and Technology Support Project of Sichuan Province(2011NZ0075)]作者简介:李斌(1981—),男,河南信阳人; 博士,副教授; 研究方向为水域生态学。E-mail:libin2004xinyang@126.com
谢碧文,E-mail:xiebw6873@163.com
