卵巢显微制片及观察计数的规范化方法
2016-11-12毕文杰
郑 翔,毕文杰
(1.四川大学华西基础医学与法医学院基础医学专业实验室,成都610041;2.成都医学院人体解剖学与组织胚胎学教研室,成都610500)
卵巢显微制片及观察计数的规范化方法
郑 翔1,毕文杰2
(1.四川大学华西基础医学与法医学院基础医学专业实验室,成都610041;2.成都医学院人体解剖学与组织胚胎学教研室,成都610500)
常规显微制片技术在生物医学领域具有重要作用。制片和观察计数的方法亟待规范。该文以卵巢不同发育阶段卵泡的计数研究为例,展示了常规显微制片和观察计数的原理与规范化方法,并融入了近年的技术改进。该文以具体实验为基础,探讨了该技术的一般性操作原理和方法,旨在稳定和提高显微形态学研究的质量。
常规显微制片;计数;卵巢;卵泡;大鼠
标本显微制片和观察计数是生物学与医学领域必要的实验技能。其中,动物组织常规显微制片一般采用甲醛固定、石蜡包埋、切片、苏木素-伊红染色(HE staining)的方法[1]。该法结果精美,易批量和连续制片,标本蜡块耐保存[1-2]。然而,实验耗时较长,操作环节多,技术经验对结果影响较大。目前国内高校实验室和临床病理科室的专职制片人员,普遍存在老龄化和人数锐减的问题。此外,商品化数字切片的教学应用[3],进一步削弱了教学单位对制片技术的需求。因此,常规显微制片这一基础性重要技术,很多单位已不重视;相关专业研究生往往未掌握合格的制片操作,甚至将显微制片任务外包。本文认为,要提高生物、医学研究团队的水平和高校形态学科的教学质量,提升常规显微制片的质量、规范技术操作势在必行。本文以医学研究中常用的一个具有代表性的实验——卵巢中不同发育阶段的卵泡计数为例,介绍常规显微制片和计数的规范化方法。
1 技术原理与设备条件
常规显微制片的基本原理是:新鲜标本经甲醛等化学试剂的作用,发生蛋白交联[1],即“化学固定”(chemical fixation)。固定后微观结构和化学成分得以稳定,防止自溶与腐败。固定后标本仍富含水分,须经有机试剂浸透脱水,最后用融化的石蜡进行置换,实现石蜡包埋(paraffin embedding)。标本的包埋蜡块硬度和韧性适中,可借助切片机用锋利刀片切成几微米厚的薄切片。切片裱贴在防脱载玻片上进行HE染色。其中,苏木素(hematoxylin)成分将细胞核、胞质的嗜碱性颗粒、细胞外基质的糖胺多糖等染成蓝紫色,伊红(eosin)则将其余结构染成深浅不等的粉红色。染色切片经透明和盖玻片封固,可在显微镜下成像。
常规显微制片及观察计数的必要设备有:60℃恒温箱、轮转式切片机、生物组织摊烤片仪、生物显微镜和显微照相系统。需批量储备试剂和标本应配备4℃冰箱;制片工作量很大的科室可配备包埋工作台、脱水机、染色机等自动化设备。
2 标本化学固定
新鲜的人体或实验动物标本,应尽快进行化学固定,防止组织缺氧后发生变化。卵巢常规制片,从组织离体或血供停止到浸透固定液,要求不超过1 h。由于固定液渗透时间与标本厚度的平方正相关[1],故根据实践,标本内部任一点距表面的最短距离不应超过2.5 mm。大鼠卵巢一般不超过该尺寸,可不切开。浸泡固定的时间不小于3 h,时间上限根据实验目的确定。实验暂停较久(如超过1月),应将标本保存在70乙醇中,勿长期存留于固定液。如需同步固定全身组织,可经心脏或升主动脉灌注固定[4]。取材动作应轻柔,用锋利眼科剪从输卵管或子宫末端离断,必要时夹持、牺牲卵巢周围的脂肪组织,避免手术器械挤压卵巢实质。
最常用的固定液为中性缓冲甲醛(neutral buffered formalin,NBF)[1,5]。NBF稳定耐保存,作用温和,适于绝大多数研究。甲醛溶液应从多聚甲醛加热溶解获得。市售37~40甲醛含有不少于8的稳定剂甲醇,渗透速度快于甲醛,易损伤卵母细胞的膜性结构。标准配方中NBF渗透压约940 mOsm/L,可通过增减磷酸盐缓冲对的量来调整。一般采用600~940 mOsm/L固定,液量不小于标本体积20倍,都能得到良好固定。不能按生理渗透压配液,否则溶液渗透压易受卵泡液和其他体液影响,导致结构变形。NBF的pH介于6.8~7.2;太低交联过快,后续步骤易致标本收缩硬化;太高造成某些分子改变,染色对比不佳。不论浸泡还是灌注固定,固定液温度应保持15℃~25℃。过度预冷可能造成结构失真[6]。
3 石蜡包埋
目前国内外普遍采用乙醇脱水、二甲苯透明和石蜡3步浸透的包埋流程[1,5]。该法中试剂可重复利用,但步骤多、标本收缩显著。四氢呋喃脱水、石蜡2步浸透的流程更快捷,标本不收缩,切片难度小,制片质量高于乙醇、二甲苯流程[7]。按表1所示的流程,通常半日即可完成操作。石蜡包埋、冷却和蜡块修切的方法与传统流程相同。大鼠卵巢肉眼观类似微缩的“多囊肾”。为提高效率,卵巢切片应沿短轴前进,取最大切面面积,故包埋时应使卵巢自然平放。

表1 标本脱水及石蜡包埋操作改进流程
4 石蜡切片
卵巢包埋蜡块安装在轮转式切片机上,按4~6 μm切片。大鼠卵巢尺寸小,卵泡分布密集,进行连续取片计数更准确。目前一般采用一次性切片刀片,刀刃同一位置可切普通组织至少200断面;平移位置4次,可确保切出800余断面。单个卵巢连续切片一般共500~700断面,不需更换刀片。切片操作参考轮转式切片机的说明书,技巧和处置可参考相关文献[5]。
生物组织摊烤片仪的水槽加注蒸馏水,对于熔点54℃~56℃的纯蜡,展片水温恒定为42℃~45℃。蜡片展平即捞起,在水面漂展不超过1 min,防止结构松散。卵巢连续切片时,将10个断面的蜡带裱贴成行,每张载玻片裱贴3行,共30断面。
载玻片捞片前先经防脱剂处理。常规制片的防脱剂常用明矾明胶[8],采用涂布或浸没处理。如切片还需长时间碱性环境浸泡、加热,则应换用APES或L-多聚赖氨酸处理[1,4-5]。卵巢切片需在40℃恒温过夜或60℃烘烤2~4 h方可紧密贴合。
5 HE染色
苏木素为天然染料混合物,有多种配方[9]。仅做常规观察,以Ehrlich配方为首选。其优势是可将细胞质和细胞外基质的嗜碱性成分一并清晰显示。Ehrlich苏木素稳定,耐存放,染色效能下降缓慢。伊红通常采用1水溶性伊红-黄(eosin-Y)的蒸馏水溶液,加2~3滴浓甲醛防止微生物滋生。
HE染色流程如表2所示。最受经验影响的为苏木素的染色和分色。先过染,再用盐酸乙醇液分色,这样显示结构更精细。卵巢4~6 μm切片一般分色15~30 s(较多数标本更久),结构区分最佳。由于染液和分色液反复使用,不同批次和使用次数对染色、分色效能有影响,故每批次操作应预试。根据预试结果按统一时间操作,避免质量不一。

表2 HE染色操作流程
HE染色的手工操作有标本缸——提篮染色、试剂瓶——卧式缸染色和立式缸染色3种方式,单次装片量分别为30~60张、10~19张和5~9张。3种方式分别适用于批量制片、科研和教学。卵巢连续切片一套16~24张,用提篮染色1次完成或卧式缸染色分两次完成均可。染色机的装片量与提篮染色方式相同。
6 显微观察和计数
本文以原始、初级和次级卵泡的计数为例,如图1所示。
技术条件:NBF(600 mOsm/L)固定,乙醇-四氢呋喃脱水、石蜡包埋,4 μm切片,HE染色。Olympus C5060WZ数码相机接Olympus BHS生物显微镜照相。
放大倍数:图1(a)~图1(c)为10×40(高倍);图1(d)为10×10(低倍)。
目前国内外大多数文献采用等距取片法,计数切到卵母细胞的卵泡数量。由于各阶段卵泡中卵母细胞尺寸差别显著,如表3所示,取片间距过小会高估次级卵泡数量,而间距过大又会低估原始卵泡和早期初级卵泡数量,如表4所示。因此,分次按不同间距等距取片计数,方可获得准确结果。其中,初级卵泡还应区分单层和多层卵泡细胞两阶段,即图1(b)和图1(c)分次计数。为确保卵母细胞既不重复出现也不遗漏,取片间距应不小于该阶段卵母细胞的平均直径2RO,且不大于RF+2RO(RF为该型卵泡平均直径;原理如图2所示)。表3最右列显示了一只健康16周龄雌性未孕大鼠左侧卵巢卵泡计数的准确结果。
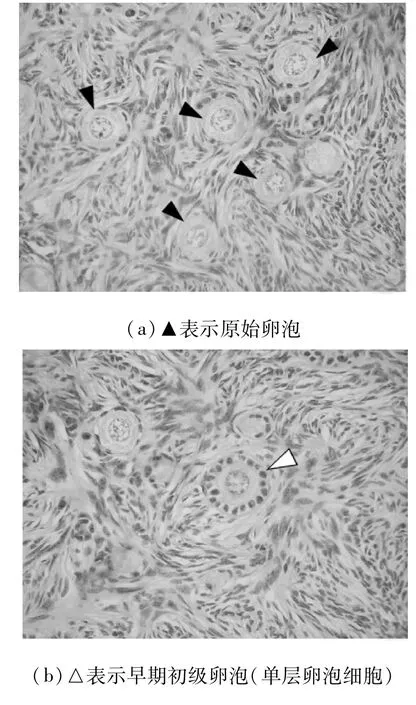

图1 大鼠原始卵泡和生长卵泡的形态

表3 不同阶段卵泡卵母细胞的直径比较(各阶段n=10)

表4 不同取片间距和取片方式下卵泡计数结果的比较
图2中,假设各卵泡和卵母细胞均为规则球形,半径相同,卵母细胞居卵泡正中;卵泡之间按最紧密方式堆积。沿图中自下而上方向取片,S1为刚切到卵母细胞O1的平面,S2为卵母细胞O2最后出现的切面。S1与S2之间的距离为RF+2RO,即为最大取片间距。超过该间距取片,可能遗漏一层(O2所在层次)卵泡。
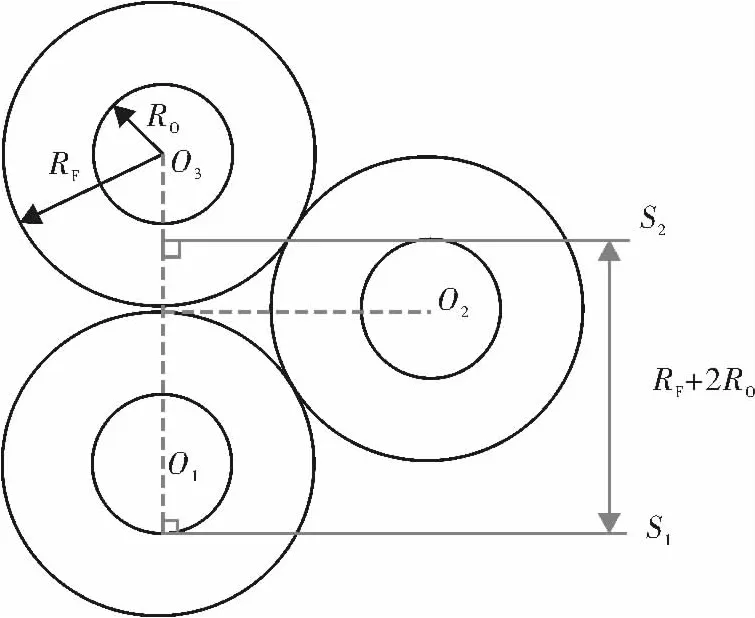
图2 卵泡计数取片间距的理论模型
7 讨论
大鼠卵巢标本的制片和观察计数有以下5个质量控制环节。1)NBF渗透压为600~940 mOsm/L,不含Cl-离子,液量体积不小于标本的20倍,否则结构易变形。2)保证脱水和石蜡浸透各步的基本时间,每步如能摇匀液体1次更稳妥。3)切片厚度4~6 μm,展片水温与石蜡熔点配合,漂展良好即尽快裱贴,避免切片变形或破坏。4)通过预试确定合理的苏木素染色、分色条件,染色全程切片不能干燥。5)计数尺寸差别较大的结构(如卵泡),应根据该结构不同类型的尺寸分次进行,且取片间距也应参考待检结构的尺寸确定。
本文方法对其他标本的显微制片也有普遍适用性,但有的方面需调整。比如组织块的尺寸,大鼠卵巢较小,不必切开固定。而肝、肾等实质器官则必须切割。因肝具有丰富血管通道,厚度可适当增大。肺则常用经气管灌注固定液的方式固定,经70%乙醇脱水后再切开。睾丸尺寸较大本应切开,但因内部张力大易膨出,故有必要采用灌注固定法或换用其他快速固定液[10]。又如NBF的渗透压,在处理不熟悉的标本时应预试,以标本宏观不收缩、显微结构真实为标准。多数腺体、睾丸等渗透压要求偏低,在450~600 mOsm/L为宜;肾、卵巢、附睾、精子涂片等,则适合采用600~940 mOsm/L的高渗液。NBF各成分的配比要根据不同标本进行调整才能获得上佳的显微图像。
四氢呋喃脱水流程为我室近年的改进。该流程具有速度快、质量高的显著优势[7]。该法处理的标本,可照常进行免疫组织化学、原位杂交等检测,灵敏度与传统乙醇、二甲苯流程无差别,我们常规制片可首选Ehrlich苏木素。在组织化学实验中如需复染细胞核,应采用Mayer配方,避免胞核以外的结构着染。
本文未区分成熟卵泡和次级卵泡。大鼠成熟卵泡阶段时间短,典型形态标志不显著,易误判。故表3中次级卵泡和成熟卵泡合并计数。本文未显示闭锁卵泡数量。闭锁卵泡数量通过HE染色观察会被低估,因为原始卵泡闭锁后不留痕迹,而其他阶段的闭锁卵泡,仅在卵母细胞凋亡时可辨[11],此后演化成间质腺,计数困难。
大鼠卵巢取片间距,根据切片实测平均值(如表3所示),代入图2关系式估算。这一关系式虽基于理想化的球体模型,并假设卵母细胞居卵泡正中,但也适于球形细胞(RF和RO视为胞质和胞核的半径)、梭形结构(横断面呈圆形紧密堆积)和胞核偏心位的标本。由于卵母细胞的核与卵泡相比太小,故一般不以胞核为标志来计数,否则工作量过大。分类计数法获得的是卵泡的绝对数量;大量文献中按同一间距取片计数得到的数据并非全部无用,在比较同类型卵泡数量的组间差别时仍具有参考价值。
8 结束语
常规石蜡切片-HE染色技术对操作经验依赖性较高,已有报道关注该技术的规范性和质量[2,12-14]。卵巢常规显微制片和卵泡观察计数是生物显微技术中一个具有代表性的实验。通过该实验,展示了最新的常规制片流程和技术要点,旨在通过阐明原理,进一步提高技术的规范性、稳定性和实验结果的准确性。采用规范化方法有利于科研合作、回顾研究和教学培训,尤其是当前方兴未艾的数字化切片的发展[3],对制片技术提出了更高乘描绘[J].大学物理实验,2013,26(2):82-84.
[1]BANCROFT J D,GAMBLE M.组织学技术[M].北京:北京大学医学出版社,2008:53-134.
[2]凌启波,梁英杰.HE制片质控要求[J].临床与实验病理学杂志,2000,16(4):333-334.
[3]范嘉盈,张岚,陈荪红.虚拟切片技术在实验教学中的应用[J].实验室研究与探索,2014,33(5):72-76.
[4]王晓冬,汤乐民.生物光镜标本技术[M].北京:科学出版社,2007:27-28.
[5]梁英杰,凌启波,张威.临床病理学技术[M].北京:人民卫生出版社,2011:40-86.
[6]ZHANG S X,HOLMBERG E G,GEDDES J W.Artifactual dendritic beading in rat spinal cord induced byperfusion with cold saline and paraformaldehyde[J].Journal of Neuroscience Methods,2007,163(1):38-43.
[7]郑翔,毕文杰.以四氢呋喃为脱水剂的石蜡显微制片经验及优势分析[J].解剖学杂志,2014,37(4):560-562.
[8]倪灿荣,马大烈,戴益民.免疫组织化学实验技术及应用[M].北京:化学工业出版社,2006:11-12.
[9]AVWIORO G.Histochemical uses of haematoxylin-a review[J].J Pharm Clin Sci,2011(1):24-34.
[10]LATENDRESSE J R,WARBRITTION AR,JONASSEN H,et al.Fixation of testes and eyes using a modified Davidson's fluid:comparison with Bouin's fluid and conventional Davidson's fluid[J].Toxicologic Pathology,2002,30(4):524-533.
[11]成令忠,钟翠萍,蔡文琴.现代组织学[M].上海:上海科学技术文献出版社,2003:1002-1019.
[12]王华,周孝琼.病理组织切片中常见问题及解决方法[J].实验科学与技术,2010,8(5):38-40.
[13]唐从国,郭周庆.如何做好一张HE染色切片[J].中国组织化学与细胞化学杂志,2012,21(4):428-429.
[14]宋蜀伶,潘鑫艳,王力.HE制片技术的标准化初步探讨[J].西南国防医药,2014,24(9):1035-1036.
Standardized Method of Conventional Microscopic Section Making,Observation and Counting of Ovary
ZHENG Xiang1,BI Wenjie2
(1.Laboratory of Basic Medical Sciences,West China College of Preclinical Medicine and Forensic Medicine,Sichuan University,Chengdu 610041,China;2.Department of Anatomy,Chengdu Medical College,Chengdu 610500,China)
The conventional microscopic section making technique plays an important role in biomedical sciences.The method and procedures for section making,observation and counting should be standardized.The authors show the principles and the standardized method based on the case of counting follicles of different developmental stages in the rat ovary,and introduce the recent technical improvement.Taking a particular experiment as an example,this paper discusses the general principles of operation and methods in order to stabilize and improve the quality of microscopic morphological studies.
conventional microscopic section making;counting;ovary;ovarian follicle;rat
R329-33
A
10.3969/j.issn.1672-4550.2016.05.011
2015-07-19
四川大学实验技术项目(2015-165);四川省卫生厅科研项目(130294)。
郑 翔(1981-),男,硕士,实验师,主要从事组织胚胎学与病理学实验技术及实验教学。
