菠萝蜜过氧化物酶活性部位的研究
2016-11-12陶毅明金荣仲马义丽刘青波桂林医学院生物技术学院广西桂林541004
陶毅明,金荣仲,朱 华,马义丽,刘青波(桂林医学院生物技术学院,广西 桂林 541004)
菠萝蜜过氧化物酶活性部位的研究
陶毅明,金荣仲,朱 华,马义丽,刘青波
(桂林医学院生物技术学院,广西 桂林 541004)
以菠萝蜜果肉过氧化物酶(peroxidase,POD)为研究对象,用丁二酮、碳化二亚胺(N-ethyl-N’-3-dimethylaminopropyl carbodiimide,EDC)、N-乙酰咪唑(N-acetylimidazole,NAI)、β-巯基乙醇(β-mercaptoethanol,MT)、对-氯汞苯甲酸(parachloro-mercuri-benzoate,pCMB)和焦碳酸二乙酯(diethylpyrocarbonate,DEPC)对POD进行化学修饰,研究酶活性必需基团。结果表明,丁二酮、EDC和NAI对酶活力无显著影响,说明精氨酸、羧基和酪氨酸与酶活力无关;pCMB、DEPC和β-巯基乙醇强烈抑制酶活性,说明半胱氨酸和组氨酸是酶活性的必需基团,二硫键对酶活性有重要贡献。动力学分析和底物保护实验表明,DEPC为POD的竞争性抑制剂,组氨酸位于酶活中心。
过氧化物酶;菠萝蜜;酶活中心;必需基团;化学修饰
菠萝蜜(Artocarpus heterophyllus)为桑科木菠萝属植物,又称木菠萝,其果肉含丰富的糖类、蛋白质、柠檬酸和多种维生素[1]。成熟的菠萝蜜采后一星期会发生褐变现象,影响果肉的品质和销售[2]。
过氧化物酶(peroxidase,POD)是一种以H2O2作为电子受体的催化底物氧化的酶。POD广泛分布于植物体不同的组织、器官及生长发育的不同时期[3],参与活性氧清除[4]、吲哚乙酸降解[5]、木质素合成[6]等生理功能,也是除多酚氧化酶(polyphenol oxidase,PPO)和苯丙氨酸解氨酶(phenylalaninammonialyase,PAL)之外,参与褐变的重要酶类[7]。在H2O2存在下,POD能催化酚类等物质氧化,与PPO和PAL共同作用,使果蔬发生褐变,导致果皮变色、营养散失、品质与口味不佳[8]。
有关POD催化机理和酶活中心的报道以辣根过氧化物酶(horseradish peroxidase,HRP)为主,研究表明HRP酶活中心的组氨酸通过酸碱催化等机制参加反应[9]。一些其他来源的POD结构也得到解析,如拟南芥、大麦、花生和大豆POD以及酶-底物中间产物已通过X射线晶体衍射或定点突变等方法得到大量关于酶空间结构和酶活必需基团的信息[9-10]。
化学修饰法是研究酶活中心的一种常用方法,因其简便,不需要制备酶晶体,被广泛使用。这些氨基酸化学修饰剂在特定的pH值条件下与酶分子中特定氨基酸发生反应,导致酶活力的改变,为相关研究提供酶活中心的信息[11-12]。研究POD酶活中心必需氨基酸,能为控制果蔬酶促褐变提供理论依据,也为菠萝蜜采后保鲜和贮藏运输提供参考。因此,本实验用化学修饰剂研究菠萝蜜POD酶活中心必需基团,并用紫外光谱法和动力学法初步探讨了组氨酸在POD酶活中的贡献。
1 材料与方法
1.1 材料
成熟菠萝蜜果肉 市售。
1.2 试剂与仪器
OctylSepharose 4 Fast Flow、Sephacryl S-200 美国GE公司;碳化二亚胺(N-ethyl-N’-3-dimethylaminopropyl carbodiimide,EDC)、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 美国Sigma公司;对-氯汞苯甲酸(diethyl pyrocarbonate,pCMB) 德国Karl Roth公司;愈创木酚 德国科密欧公司;其余试剂为国产分析纯。
1510酶标仪 美国Thermo Fisher公司;3K15冷冻离心机 德国Sigma公司。
1.3 酶的提取纯化
称量5 g菠萝蜜果肉,于25 mL预冷的pH7.2 50 mmol/L磷酸盐缓冲液中(含0.5%聚乙烯吡咯烷酮和少量二氧化硅),在研钵中充分研磨,研钵周围放置冰块。之后,4 ℃静置过夜。次日研磨液4 ℃、10 000 r/min离心15 min,弃沉淀,留上清,缓慢添加硫酸铵粉末至饱和度为80%,沉淀蛋白质。4 ℃静置2 h后,10 000 r/min、4 ℃离心15 min,收集沉淀。蛋白质沉淀用4 mL上述磷酸缓冲液重新溶解后,经OctylSepharose 4 Fast Flow疏水柱和Sephacryl S-200分子筛层析,最后得到纯化的POD。
1.4 POD酶活力测定
取50 μL酶液加入150 μL用50 mmol/L磷酸盐缓冲液配制的底物溶液中(pH6.0,含愈创木酚21.7 mmol/L,过氧化氢52.2 mmol/L),室温下反应15 min后在酶标仪上测定吸光度(A470nm)[13]。
1.5 POD的化学修饰
配制浓度为200 mmol/L丁二酮、EDC、N-乙酰咪唑(N-acetylimidazole,NAI)、β-巯基乙醇(β-mercaptoethanol,MT)、pCMB和DEPC母液。pCMB和DEPC母液用无水乙醇配制,在实验浓度范围内,乙醇(终体积分数为0.5%~3%)对酶活力无显著影响。其余母液用蒸馏水配制。取50 μL酶液、50 μL不同pH值缓冲液和一定体积修饰剂母液,并用蒸馏水补足至200 μL,得到不同浓度的修饰剂体系。酶与修饰剂在25 ℃水浴反应20 min后,取50 μL修饰后的酶液,与150 μL底物溶液室温下反应,测定POD剩余酶活力。未经修饰剂的酶活力定为100%。各修饰剂体系中使用的缓冲液如下:丁二酮为pH 8.0硼酸-硼砂缓冲液,EDC为pH 4.5醋酸-醋酸钠缓冲液,β-巯基乙醇为pH 8.0 Tris-HCl缓冲液,pCMB为pH 5.8醋酸-醋酸钠缓冲液,DEPC为pH 6.5磷酸盐缓冲液。各缓冲液浓度均为0.2 mol/L[14-16]。每组3个重复。
1.6 底物保护实验
取50 μL 43.4 mmol/L愈创木酚(pH6.0)与50 μL酶液混合,在25 ℃恒温水浴作用10 min后,取出50 μL混合液,与100 μL修饰剂作用15 min后,测定剩余酶活力。
1.7 DEPC与POD作用的紫外光谱扫描
取1 mL未经修饰或经修饰过的酶液,于石英比色皿中,用酶标仪扫描220~300 nm波长范围内的吸光度。
1.8 DEPC对POD的抑制机制
在不同浓度DEPC溶液中,改变底物愈创木酚的浓度,测定A470nm。以吸光度的倒数1/A470nm对底物浓度的倒数1/[S]作图,即Lineweaver-Burk双倒数作图。每组3个重复。
1.9 数据处理
每组实验重复3次,数据以±s表示。
2 结果与分析
2.1 精氨酸、酪氨酸残基与羧基的化学修饰
丁二酮在避光条件下,在pH 8.0硼酸-硼砂缓冲液中,能特异性地与精氨酸胍基反应[14]。NAI能与酪氨酸的酚羟基反应[12]。水溶性的EDC在偏酸条件下,可与蛋白质中的酸性氨基酸(谷氨酸和天冬氨酸)的羧基或蛋白质C端羧基发生反应[15]。这3 种化学修饰剂与POD作用后,酶活性变化不显著(表1),说明精氨酸、酪氨酸残基和羧基与酶活力无关,不是酶活性的必需基团。

表1 POD经丁二酮、NAI和EDC修饰后的剩余酶活力Table 1 Residual activity of POD after modifi cation by diacetyl, NAI and EDC
2.2 半胱氨酸残基的化学修饰
有机汞是常用的巯基修饰剂。pCMB在pH 5.8条件下可与半胱氨酸巯基反应[16],结果如图1所示:随着pCMB浓度的增加,POD活性迅速下降,酶经6 mmol/L pCMB修饰后,酶活力仅为原来的15.6%,说明半胱氨酸与酶活力密切相关。底物保护实验表明,愈创木酚与酶的结合不能解除pCMB对酶的抑制作用,说明pCMB与酶的作用位点和愈创木酚与酶的结合位点不是同一个位点,即pCMB结合在酶活中心以外的地方。因此,推测半胱氨酸是菠萝蜜POD的酶活性必需基团,但是位于酶活中心之外。

图1 1 pCMB对POD的修饰作用Fig. 1 Modifi cation of POD by pCMB
2.3 二硫键对酶活力的影响
二硫键在维系蛋白质结构稳定方面起着重要作用。β-巯基乙醇是常用的还原剂,它可打开二硫键,将其还原成游离的巯基。在pH 8.0 Tris-HCl缓冲液中,与巯基乙醇保温后,检测剩余酶活力,结果如图2所示。POD经β-巯基乙醇处理后,酶活性迅速降低,这与pCMB的修饰结果类似。6 mmol/L β-巯基乙醇导致80%酶活力丧失,且底物没有保护作用。因此,认为二硫键对于维持POD酶活力极为重要,菠萝蜜POD可能由两条或以上的肽链组成,可能存在链内或链间二硫键,当二硫键被还原后,亚基解开,酶分子也就丧失了催化活性。

图2 2 β-巯基乙醇对POD的修饰作用Fig. 2 Modifi cation of POD by β-mercaptoethanol
2.4 组氨酸残基的化学修饰
DEPC是一种广泛使用的组氨酸修饰剂。在pH 6.5条件下,DEPC主要和组氨酸咪唑基反应,同时可能与酪氨酸发生副反应[17]。紫外光谱分析结果(图3)表明,未经修饰作用POD在278 nm波长处有一特征吸收峰,这也是蛋白质的特征吸收峰,主要是蛋白质分子中组氨酸和酪氨酸的贡献。POD与DEPC作用后,在242 nm波长处有一新特征峰生成,这是因为DEPC与组氨酸咪唑基发生乙酯基化作用[18]。在278 nm波长处吸收峰没有变化,表明在本实验条件下,DEPC主要和组氨酸反应,DEPC与酪氨酸的副反应很少。

图3 POD经DEPC修饰后的紫外光谱Fig. 3 UV spectrum of POD after modifi cation by DEPC
POD与DEPC保温后,检测剩余酶活力的结果如图4所示。随着DEPC浓度的升高,酶活力迅速下降,6 mmol/L DEPC处理后,POD酶活力为原来的30.3%,说明组氨酸是POD酶活的必需基团。底物保护实验表明,愈创木酚能有效保护酶活。POD与愈创木酚结合之后,再经修饰剂处理,剩余酶活要远高于无底物保护的酶。底物结合后,再经6 mmol/L DEPC处理,仍有75.7%酶活力,酶活力约为无底物保护的2.5倍。因此,推测组氨酸是POD酶活的必需基团,且位于酶活中心。
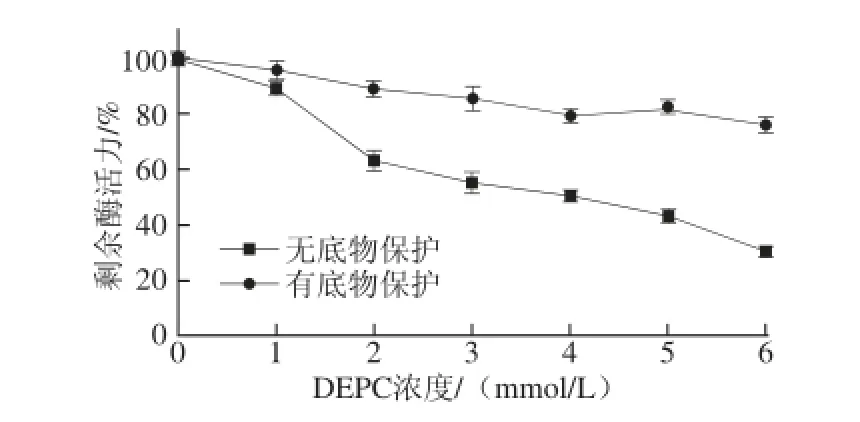
图4 DEPC对POD的修饰作用Fig. 4 Modifi cation of POD by DEPC
为进一步验证组氨酸是否在酶活中心,采用双倒数作图,对DEPC抑制POD的机制做了进一步分析,结果如图5所示。在不同浓度DEPC溶液中,改变底物愈创木酚[S],以1/A470nm对1/[S]双倒数作图,得到一组纵截距相同,横截距不同的直线。随着DEPC浓度增加,酶表观Km增大,无DEPC时,Km为23.8 mmol/L,1 mmol/L DEPC时,Km为38.5 mmol/L,2 mmol/L DEPC时,Km为76.9 mmol/L,说明DEPC是POD的竞争性抑制剂,即DEPC与酶活中心结合。结合图4,可进一步推测,DEPC是与酶活中心的组氨酸结合,也证明了组氨酸是POD酶活中心的必需基团。

图5 双倒数法判断DEPC对POD的抑制机制Fig. 5 Determination of inhibition type of DEPC on POD by Lineweaver-Burk plot
3 讨论与结论
过氧化物酶EC 1.11.1.7属于氧化还原酶,含血红素辅基,它以H2O2作为电子受体,多种底物作为电子供体,催化底物发生氧化作用,其作用的底物非常广泛,包括抗坏血酸、谷胱甘肽、胺类和酚类等[19]。POD广泛分布在果蔬中,参与果实成熟、色泽和风味的形成,并能与多酚氧化酶、苯丙氨酸解氨酶一起参与植物的酶促褐变[20-21]。
POD的酶活中心和作用机制研究较为透彻的是HRP。晶体结构分析和定点突变都证明精氨酸、组氨酸和赖氨酸是HRP酶活必需基团。HRP分子中,位于血红素辅基附近的第38位精氨酸和第42位组氨酸,这2 个氨基酸都位于酶的疏水口袋内,在催化反应时,通过疏水作用和氢键与芳香类底物结合,同时还参与过氧化氢的异裂。HRP催化芳香类化合物氧化时,通过两次单电子传递,形成中间复合物Ⅰ和Ⅱ[22-23]。基因序列分析表明许多植物POD催化中心都含有精氨酸和组氨酸。花生POD的X射线衍射结果显示,第169位组氨酸位于酶活中心,其侧链咪唑基上的一个氮原子与血红素辅基的铁离子形成配位键,另一个氮原子与第238位谷氨酸羧基形成氢键[24]。
晶体结构解析能提供直观准确的关于酶的结构与酶活中心的信息,但是实验要求高,需要制备蛋白晶体,而化学修饰法通过修饰剂与氨基酸的特异性反应来推断酶活中心,虽然有一些局限,例如可能发生副反应,但也能提供参考。通过化学修饰法,本实验探讨了菠萝蜜POD酶活性必需基团。丁二酮、NAI和EDC作用POD之后,酶活力没有显著变化,认为精氨酸残基、酪氨酸残基和羧基与酶活无关。pCMB和巯基乙醇使酶活迅速下降,认为半胱氨酸残基即游离巯基和二硫键对酶活力有重要贡献。当二硫键被巯基乙醇破坏后,酶的空间结构遭到破坏或者亚基解聚,失去了催化能力。POD经DEPC修饰后,酶活力迅速下降,底物愈创木酚对DEPC导致的失活有缓解作用,说明组氨酸是POD酶活中心的必需基团。对小麦草POD的化学修饰表明,组氨酸和酪氨酸是酶活必需基团[25]。
为了排除DEPC与酪氨酸残基的副反应的干扰,本实验分析了紫外光谱,结果表明,当DEPC与POD结合后,240 nm波长处吸收峰增加,说明DEPC与组氨酸形成了新的化学键,而278 nm波长处吸收峰不变,说明DEPC与酪氨酸发生的副反应很少,POD酶活力减少,是由于组氨酸的修饰引起的。动力学分析进一步表明,DEPC是POD的竞争性抑制剂,与底物竞争和酶结合,DEPC与酶作用的位点就是底物与酶的结合位点——组氨酸,即组氨酸位于酶活中心。
[1] 毛琪, 叶春海, 李映志, 等. 菠萝蜜研究进展[J]. 中国农学通报, 2007, 23(3): 439-443. DOI:10.3969/j.issn.1000-6850.2007.03.097.
[2] 田春美, 钟秋平. 木薯淀粉/壳聚糖可食性复合膜对鲜切菠萝蜜的保鲜研究[J]. 食品研究与开发, 2007, 28(5): 130-133. DOI:10.3969/ j.issn.1005-6521.2007.05.043.
[3] MINIBAYEVA F, BECKETT P R, KRANNER I. Roles of apoplastic peroxidases in plant response to wounding[J]. Phytochemistry, 2015, 112: 122-129. DOI:10.1016/j.phytochem.2014.06.008.
[4] 侯媛媛, 朱璇, 王英, 等. 水杨酸处理对杏果实冷害及活性氧代谢的影响[J]. 食品科学, 2014, 35(4): 195-199. DOI:10.7506/spkx1002-6630-201404040.
[5] 梁艳荣, 胡晓红, 张颖力. 植物过氧化物酶生理功能研究进展[J].内蒙古农业大学学报, 2003, 24(2): 110-113. DOI:10.3969/ j.issn.1009-3575.2003.02.026.
[6] 刘海进, 李吕木. 木质素过氧化物酶的研究进展[J]. 中国饲料, 2010(2): 20-22. DOI:10.15906/j.cnki.cn11-2975/s.2010.02.001.
[7] 周丹, 李颖佳, 王建中, 等. 板栗酶促褐变过程中多酚氧化酶和过氧化物酶活性的变化[J]. 食品科技, 2014, 39(6): 47-50. DOI:10.13684/ j.cnki.spkj.2014.06.011.
[8] 丁薪源, 曹建康. 果蔬过氧化物酶酶学特性研究进展[J]. 食品科技, 2012, 37(10): 62-66. DOI:10.13684/j.cnki.spkj.2012.10.042.
[9] NIGEL C V. Structural determinants of plant peroxidase function[J]. Phytochemistry Reviews, 2004, 3: 3-18. DOI:10.1023/ B:PHYT.0000047799.17604.94.
[10] MIRZA O, HENRIKSEN A, ØSTERGAARD L, et al. Arabidopsis thaliana peroxidase N, structure of a novel neutralperoxidase[J]. Acta Crystallographica D, 2000, 56(Pt 3): 372-375. DOI:10.1107/ S0907444999016340.
[11] 李冬霞, 夏文水. 米曲霉外切β-氨基葡萄糖苷酶活性部位研究[J]. 食品工业科技, 2010, 31(10): 200-202. DOI:10.13386/ j.issn1002-0306.2010.10.046.
[12] 梁成钦, 周先丽, 徐庆. 罗汉果蛋白酶的化学修饰[J]. 食品与生物技术学报, 2012, 31(2): 206-210. DOI:10.3969/ j.issn.1673-1689.2012.02.015.
[13] CAI Feng, YANG Chao’ou, DUAN Peipei, et al. Purification and characterization of a novel thermal stable peroxidase from Jatrophacurcas leaves[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 77: 59-66. DOI:10.1016/j.molcatb.2011.12.002.
[14] 彭新湘, 李明启. 乙醇酸氧化酶必需精氨酸残基的化学修饰[J]. 植物生理学报, 1991, 17(4): 321-326.
[15] 孙芳, 王红扬, 王洁, 等. 鸭心苹果酸脱氢酶功能基团的研究[J].食品科学, 2014, 35(15): 212-215. DOI:10.7506/spkx1002-6630-201415043.
[16] 张茜, 闫冰, 王勤, 等. 修饰剂对青霉菌葡萄糖氧化酶的效应研究[J].厦门大学学报(自然科学版), 2010, 49(5): 707-710.
[17] DING Shihua, LI Yingwen, ZHU Liquan. Identication of histidine residues at the active site of Megalobatrachus japonicus alkaline phosphatase by chemical modification[J]. Biochimica et Biophysica Acta, 2002, 1594(1): 100-108. DOI:10.1016/S0167-4838(01)00288-6.
[18] TAVAKOLI H, GHOURCHIAN H, MOOSAVI-MOVAHEDI A A, et al. Histidine and serine roles in catalytic activity of choline oxidase from Alcaligenes species studied by chemical modifications[J]. Process Biochemistry, 2006, 41(2): 477-482. DOI:10.1016/ j.procbio.2005.07.003.
[19] HAMID M, REHMAN K. Potential applications of peroxidases[J]. Food Chemistry, 2009, 115(4): 1177-1186. DOI:10.1016/ j.foodchem.2009.02.035.
[20] TERESA M C, FEDERICO P, JOSÉ M E. Purification and kinetic characterization of two peroxidases of Selaginella martensii Spring involved in lignifi cation[J]. Plant Physiology and Biochemistry, 2012, 52: 130-139. DOI:10.1016/j.plaphy.2011.12.008.
[21] GONG Zhiqing, LI Dajing, LIU Chunquan, et al. Partial purifi cation and characterization of polyphenol oxidase and peroxidase from chestnut kernel[J]. LWT-Food Science and Technology, 2015, 62(2): 1095-1099. DOI:10.1016/j.lwt.2014.10.012.
[22] GAJHEDE M, SCHULLER D J, HENRIKSEN A, et al. Crystal structure of horseradish peroxidase C at 2.15 Å resolution[J]. Nature Structural Biology, 1997, 4(12): 1032-1038. DOI:10.1038/nsb1297-1032.
[23] MOGHARRAB N, GHOURCHIAN H, AMININASAB M. Structural stabilization and functional improvement of horseradish peroxidase upon modification of accessible lysines: experiments and simulation[J]. Biophysical Journal, 2007, 92(4): 1192-1203. DOI:10.1529/biophysj.106.092858.
[24] SCHULLER D J, BAN N, van HUYSTEE R B, et al. The crystal structure of peanut peroxidase[J]. Structure, 1996, 4(3): 311-321. DOI:10.1016/S0969-2126(96)00035-4.
[25] LAI L S, WANG D J, CHANG C T, et al. Catalytic characteristics of peroxidase from wheat grass[J]. Journal of Agricultural and Food Chemistry, 2006, 54(22): 8611-8616. DOI:10.1021/jf060888w.
Active Center of Peroxidase from Jackfruit Flesh
TAO Yiming, JIN Rongzhong, ZHU Hua, MA Yili, LIU Qingbo
(College of Biotechnology, Guilin Medical University, Guilin 541004, China)
In order to investigate the essential groups for peroxidase (POD) activity from jackfruit fl esh, diacetyl, N-ethyl-N’-3-dimethylaminopropylcarbodiimide (EDC), N-acetylimidazole (NAI), β-mercaptoethanol(MT), parachloro-mercuribenzoate (pCMB) and diethyl pyrocarbonate (DEPC) were used to modify the POD enzyme. The results revealed that diacetyl, EDC and NAI showed no significant impact on POD activity, indicating that Arg, carboxyl and Lys had no association with the enzyme activity. However, pCMB, DEPC and MT strongly inhibited POD activity, indicating that Cys and His were the essential groups for its activity, and disulfi de bond played a very important role in the enzyme activity. Enzymatic kinetics and substrate protection indicated that DEPC was a competitive inhibitor for POD, and the His residue was located at the enzyme active center.
peroxidase; jackfruit; enzyme activity center; essential group; chemical modifi cation
10.7506/spkx1002-6630-201611018
Q55
A
1002-6630(2016)11-0103-05
陶毅明, 金荣仲, 朱华, 等. 菠萝蜜过氧化物酶活性部位的研究[J]. 食品科学, 2016, 37(11): 103-107. DOI:10.7506/ spkx1002-6630-201611018. http://www.spkx.net.cn
TAO Yiming, JIN Rongzhong, ZHU Hua, et al. Active center of peroxidase from jackfruit fl esh[J]. Food Science, 2016, 37(11): 103-107. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611018. http://www.spkx.net.cn
2015-07-24
国家自然科学基金地区科学基金项目(31260214)
陶毅明(1981—),男,副教授,博士,主要从事生物化学与酶学研究。E-mail:yiming_tao@yahoo.com
