平菇疏水蛋白Po.hyd基因RNAi载体构建及转化
2016-11-12刘媛媛马爱民华中农业大学食品科学技术学院湖北武汉430070
刘媛媛,马爱民*(华中农业大学食品科学技术学院,湖北 武汉 430070)
平菇疏水蛋白Po.hyd基因RNAi载体构建及转化
刘媛媛,马爱民*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
为研究平菇疏水蛋白基因Po.hyd的功能,首次构建了Po.hyd的RNAi载体,并通过根癌农杆菌介导获得了平菇转化子。通过聚合酶链式反应(polymerase chain reaction,PCR)扩增Po.hyd序列,利用Golden Gate克隆法构建了干扰载体p1302-GG-ihyd,将其导入根癌农杆菌GV3101中,并在乙酰丁香酮的诱导下完成根癌农杆菌对平菇幼嫩菌丝的介导转化。转化子经PCR检测、荧光显微镜观察、实时定量荧光PCR技术(real-time PCR)以及Southern杂交等技术进行验证。结果显示,本研究最终获得1 株可稳定遗传的平菇转化子,该转化子具有潮霉素抗性,且在荧光显微镜下可检测到绿色荧光信号,Po.hyd基因的表达量为野生型的43%,干扰载体T-DNA片段以单拷贝的形式整合在转化子基因组内。
糙皮侧耳;疏水蛋白;RNAi;根癌农杆菌介导
疏水蛋白(hydrophobin)是表面活性最高的蛋白之一,具有可在临界面形成两性亲和蛋白膜的特殊性质,在食品生产及保藏领域具有广阔的应用前景[1-2]。2009年Cox等[3]将里氏木霉(Trichoderma reesei)的Ⅱ型疏水蛋白HFBⅡ加入到巧克力奶昔中,改善了奶昔泡沫的稳定性,该研究认为是疏水蛋白在奶昔气泡的表面形成了稳固的两亲蛋白膜,从而防止了气泡的歧化与合并。2010年Stübner等[4]将黄色镰刀菌(Fusarium culmorum)的Ⅱ型疏水蛋白FcHyd5p基因导入到毕赤酵母(Pichia pastoris)中,结果显示添加疏水蛋白FcHyd5p的碳酸溶液发生了液体迸出现象,而对照组并无此现象产生。2012年Niu Baolong等[5]克隆了T. reesei的疏水蛋白基因HFBI并将其导入至P. pastoris中进行异核表达,啤酒曝气实验的结果证实,疏水蛋白是啤酒迸出现象的强诱导因子,也说明了疏水蛋白作为乳化剂和啤酒爆瓶预测因子的可行性。近年来疏水蛋白在食品领域的应用已成为研究热点,然而对于疏水蛋白基因功能的研究少有报道。
RNAi技术[6],称转录后基因沉默技术(post transcriptional gene silencing,PTGS),已被广泛应用于香菇(Lentinula edodes)[7]、糙皮侧耳[8-9]、灰盖鬼伞(Coprinus cinereus)[10]、双孢蘑菇(Agaricus bisporus)[11]、双色蜡蘑(Laccaria bicolor)[12]等食用菌的基因功能研究中。RNAi技术的核心是RNAi载体的构建,构建方法主要有:酶切连接法[13]、重叠延伸聚合酶链式反应技术(overlap extension- polymerase chain reaction,OE-PCR)[14]、自主连接克隆法(ligation-independent cloning,LIC)[15]、Gateway法[16]以及Golden Gate克隆法[17]。其中,Golden Gate克隆法通过酶切与连接同步进行的方式来形成颈环结构,具有高效、省时和经济等优点[18]。
平菇(Pleurotus ostreatus)是我国最主要的人工栽培食用菌之一[19]。本实验室前期克隆了平菇疏水蛋白基因Po.hyd[20],并构建了根癌农杆菌介导的平菇转化体系[21]。本研究采用Golden Gate技术构建Po.hyd干涉载体并进行转化,为后续Po.hyd基因功能的研究提供基础,并为RNAi技术在其他大型真菌中的应用提供参考。
1 材料与方法
1.1 菌株与质粒
平菇739、根癌农杆菌GV3101为华中农业大学食品科学技术学院微生物实验室保存。
质粒pCAMBIA1302-GUS(具有潮霉素hph基因、绿色荧光蛋白GFP、以及GUS标记)为华中农业大学食品科学技术学院微生物实验室改造并保存;质粒pRNAi-GG为中国热带农业科学院热带生物技术研究所言普研究员赠送。
1.2 试剂与培养基
Taq酶、限制性内切酶HindⅢ、SacⅠ 日本TaKaRa公司;限制性内切酶BsaⅠ New England Biolabs公司;T4 DNA Ligase、M-MLV Reverse Transcriptase美国Promega公司;凝胶回收试剂盒和质粒提取试剂盒 美国Axygen公司;Fast Start Universal SYBR Green Master 罗氏公司;DH5α感受态细胞、pEASY-Blunt载体、Fast-Pfu DNA聚合酶 北京全式金生物技术有限公司;Southern杂交试剂盒 美国GE公司。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂粉15 g, ddH2O 1 000 mL;LB培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,ddH2O 1 000 mL,加琼脂粉15 g即LB固体培养;基本培养基(minimal medium,MM):20×磷酸盐缓冲液10 mL、盐溶液10 mL,HCl调pH值至7.0;诱导培养基(IM):20×MM培养基5 mL、50%甘油1 mL、1 mol/L葡萄糖溶液l mL、1 mol/L MES缓冲液4 mL、20 mmol/L AS溶液1 mL,无菌ddH2O至100 mL。共培养培养基(Co-CM):琼脂粉1.5 g、与IM等量的各成分(葡萄糖减半)、ddH2O 80 mL。
1.3 仪器与设备
尼康80i荧光显微镜 日本尼康公司;ABI ViiA7 Real-time PCR仪 美国Applied Biosystem公司。
1.4 引物设计
根据已发表的Po.hyd(GenBank登录号AF331452)、载体pCAMBIA1302序列(GenBank登录号AF234298)利用软件Primer 5进行引物设计,荧光定量PCR反应的内参基因引物为βtub-S与βtub-AS[22],引物序列见表1。

表1 所用引物序列Table 1 Primers used in this study
1.5 总RNA的提取
参照TaKaRa RNAisoTMplus说明书进行操作。
1.6 cDNA第一链的合成与Po.hyd基因编码区序列扩增
参照M-MLV Reverse Transcriptase反转录酶说明书合成cDNA的第一链。Po.hyd基因PCR扩增体系如下:Fast-pfu DNA聚合酶(10 U/μL)0.2 μL、cDNA模板2 μL、Po.hyd上下游引物(10 μmol/L)各1 μL、dNTP(2.5 mmol/L)2 μL、5×Fast-pfu Buffer 5 μL、ddH2O补至25 μL。扩增条件:95 ℃ 5 min,95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,循环数为32 个,72 ℃ 7 min。PCR产物连接pEASY-Blunt载体并测序,并用BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列分析与比对。
1.7 干扰载体pRNAi-GG-ihyd及p1302-GG-ihyd的构建
干扰载体pRNAi-GG-ihyd的构建参照pRNAi-GG载体说明书进行。选用RNAi-AS与M13F、RNAi-AS与M13R两对引物进行菌落PCR鉴定,延伸时间为别为40 s以及90 s,其他扩增条件同1.5节。
p1302-GG-ihyd载体构建步骤:HindⅢ与SacⅠ双酶切载体pRNAi-GG-ihyd与pCAMBIA1302-GUS,分别回收片段和载体骨架,回收产物进行连接反应并转化DH5α感受态,经Po.hyd基因菌落PCR,与HindⅢ与SacⅠ双酶切进一步确定阳性质粒。p1302-GG-ihyd构建策略如图1所示。
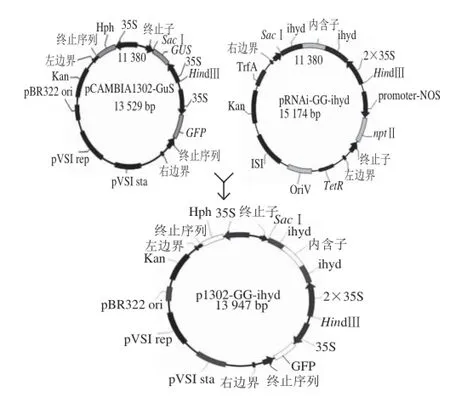
图1 p1302-GG-ihyd载体构建策略Fig. 1 p1302-GG-ihyd vector construction strategy
1.8 根癌农杆菌介导菌丝转化
参照华中农业大学食品科学技术学院微生物实验室构建的农杆菌介导体系进行操作[12]。
1.9 转化子的PCR初步鉴定
十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法提取转化子菌丝DNA并作为模板,分别扩增hph和GFP基因片段,反应体系如1.6节所述,57 ℃退火30 s,72 ℃分别延伸70 s与30 s,其他扩增条件见1.6节。
1.10 转化子的荧光显微镜鉴定
将1.9节步骤中认定为阳性的转化子转接至PDA培养基中央,于培养基中插入若干无菌玻璃片,25 ℃避光倒置培养7 d,用于观察菌丝绿色荧光蛋白表达情况。
1.11 平菇转化子real-time PCR检测Po.hyd基因干扰效率
转化子Po.hyd基因荧光定量PCR参照Fast Start Universal SYBR Green Master说明书进行。Po.hyd基因的Ct值以及表达量参照公式ΔΔCt法进行计算。
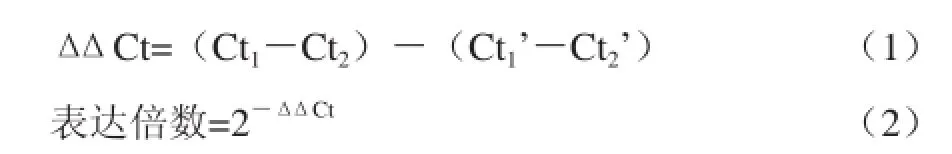
式中:Ct1为待测样本中Po.hyd基因的Ct值;Ct2为待测样本中内标基因的Ct值;Ct1’为对照样本中Po.hyd基因的Ct值;Ct2’为对照样本中内标基因的Ct值。
1.12 Southern杂交鉴定T-DNA插入拷贝数
扩大培养1.10节中能够观测到绿色荧光信号的转化子,提取其基因组DNA经HindⅢ酶切过夜,以潮霉素基因Hyg作为探针进行杂交,具体实验操作按GE公司杂交试剂盒进行。
2 结果与分析
2.1 Po.hyd基因DNA序列克隆与分析

图2 平菇菌丝总RNNAA与Poo..hhyydd基因PCR扩增结果电泳图Fig. 2 Electrophoresis of total RNA and PCR amplifi ed products of the Po.hyd gene from P. ostreatus
平菇RNA的电泳检测结果如图2A所示,28S rRNA条带与18S rRNA条带亮度比例约为2∶1,表明提取的总RNA较完整,质量符合要求。Po.hyd基因编码区cDNA序列扩增结果,如图2B所示,扩增得大小为330 bp左右的单一条带,与预期大小一致,结合测序结果,表明所获得基因片段与GenBank中Po.hyd的序列相同。
2.2 重组质粒pRNAi-GG-ihyd、p1302-GG-ihyd的构建

图3 质粒pRNAi-GG-ihyd引物与酶切位点及菌落PCR扩增结果Fig. 3 Restriction enzyme cleavage sites of pRNAi-GG-ihyd vector and colony PCR products of pRNAi-GG-ihyd
重组质粒pRNAi-GG-ihyd引物结合位点与酶切位点图如3A所示,菌落PCR结果如图3B所示,其中引物RNAi-AS与M13R(泳道1)所扩基因1 400 bp、RNAi-AS与M13F(泳道2)所扩基因600 bp均与预期结果一致,结合测序结果,进一步证明载体pRNAi-GG-ihyd构建成功。

图4 p1302-GG-ihyd载体PCCRR及HHiinnddⅢ与SSaaccⅠ双酶切结果Fig. 4 PCR products and double enzyme digestion of p1302-GG-ihyd vector with Po.hyd gene using HindⅢ and SacⅠ
p1302-GG-ihyd载体的菌落PCR验证结果如图4A所示,扩增结果为单一条带,大小330 bp与预期一致,而HindⅢ与SacⅠ双酶切验证结果(图4B),目的条带约3 200 bp符合预期,证明干扰载体p1302-GG-ihyd构建成功,可用于平菇菌丝转化实验。
2.3 转化子潮霉素选择性培养
图5A为平菇菌丝与农杆菌共培养60 h菌丝的生长情况,菌丝在农杆菌共培养的情况下菌丝生长良好,菌落于滤纸片四周分布均匀,菌丝长度与密度相对均衡。图5B为潮霉素选择性培养的菌落生长情况,可见在潮霉素抗性选择压力下,滤纸片四周的菌落分布不均匀,菌丝长度及密度差异较大,其中未转化成功的菌丝不具备潮霉素抗性,呈现出不生长或者死亡状态,而转化成功的菌丝获得了潮霉素抗性,菌丝在抗性筛选的情况下菌丝萌发伸长,呈现出生长趋势。用接种针将具有潮霉素抗性的菌落转接至新的潮霉素培养平板中,菌丝生长状况如图5C所示,可见菌丝虽较为稀疏但仍可正常生长,同时将野生型菌株置于潮霉素平板中培养作为对照,结果如图5D所示,可见野生型菌株在潮霉素平板中不生长。初步认定在潮霉素抗性培养基中可以正常生长的菌株为拟转化子,经后续实验的筛选确定为转化子。


图5 根癌农杆菌介导转化各阶段菌丝的生长状态Fig. 5 Growth status of the mycelia of transformants via Agrobacterium tumefaciens mediation
2.4 转化子的PCR鉴定
以拟转化子DNA作为模板,利用hph及GFP引物进行PCR鉴定,检测hph基因PCR结果如图6A所示,潮霉素扩增结果为单一的且大小为1 000 bp左右的条带,结合测序结果,证明潮霉素基因已经成功插入至转化子DNA中,如图6B为GFP基因PCR扩增结果,扩增结果为500 bp单一条带,结合测序结果证明7 株拟转化子有5 株能同时扩出潮霉素hph及GFP基因,初步认证获得5 株转化子。
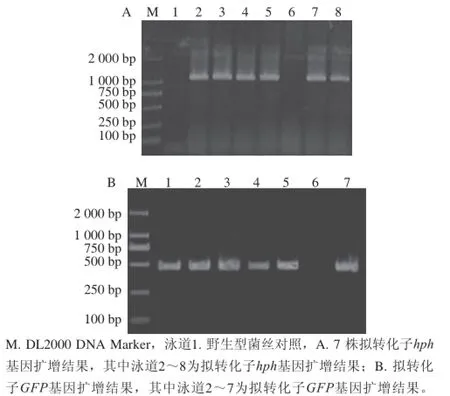
图6 拟转化子hhpphh基因与GGFFPP基因PCRR扩增结果Fig. 6 PCR products of the hph gene and the GFP gene from putative transformants
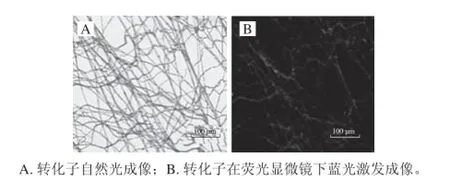
图7 转化子的荧光检测、real-time PCR及Southern杂交分析Fig. 7 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants
2.5 转化子的荧光检测荧光显微镜观察转化子的绿色荧光蛋白表达情况,图7A为5号转化子的自然光与荧光显微成像。图7B为5号菌丝的荧光显微成像图,可见在蓝光激发下可发出清晰的绿色荧光,证明绿色荧光蛋白GFP在转化子中获得表达,说明转化实验获得成功。
2.6 平菇转化子real-time PCR检测Po.hyd基因干扰效率选取3 株能检测出绿色荧光信号的转化子,进行real-time PCR分析。由图8可知,5号和14号菌株Po.hyd基因的表达明显被抑制,9号菌株的Po.hyd基因表达量变化不大。转化子中Po.hyd基因被抑制的效果存在较大差异,是由于干扰载体的T-DNA区随机整合在基因组中的位置不同造成,插入位点附近的基因复杂性导致了启动子的启动效率差异,进而导致基因的干扰效率表现不一致。

图8 野生型及转化子的荧光检测、real-time PCR及Southern杂交分析Fig. 8 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants and the wild-type strain
2.7 转化子Southern杂交结果分析
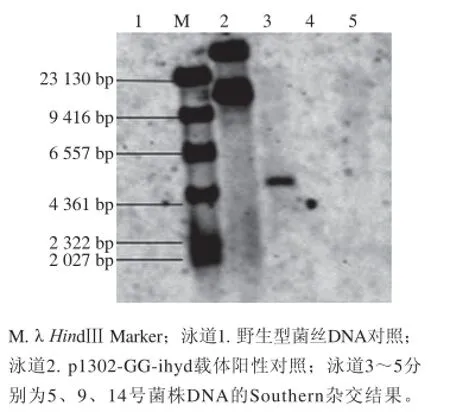
图9 转化子的荧光检测、real-time PCR及Southern杂交分析Fig. 9 Fluorescence detection and real-time PCR and Southern blot analysis of P. ostreatus transformants
对3 个阳性转化子进行Southern杂交,结果如图9所示,只有5号菌株获得了单条杂交信号,9号与14号转化子与野生型菌未获得杂交信号。导致这种现象的原因尚不明确,这种转化子遗传性状不稳定的现象在Peng等[23]研究聚乙二醇介导平菇双核菌丝原生质体的转化实验中也曾出现过,该研究也获得了具有潮霉素抗性的转化子,但转化子的抗性于3~6 周后消失。转化子表型不稳定可能与启动子的选择或外源片段随机插入宿主基因组中的位置有关,也可能是高等真核生物基因自主修复的结果,但造成转化子抗性丢失这种现象的分子机制尚未得到具体解释。
3 结 论
本研究获得1 株可稳定遗传的转化子,其基因组DNA可以检测到外源hph基因与GFP基因,在荧光显微镜下可检测出绿色荧光,Southern杂交为单一条带,转化子表达量结果显示,Po.hyd基因表达量为野生型的43%,说明RNAi载体构建与农杆菌介导平菇的遗传转化获得成功,外源基因以单拷贝形式插入转化子基因组中,与Ding Yi等[21]构建的根癌农杆菌介导平菇菌丝转化体系相符。
对于real-time PCR检测结果出现的Po.hyd基因表达量变化差异较大的现象,这一方面与以及T-DNA的插入位点有关。外源片段随机插入到转化子的染色体中有关,不同插入位点的转化子基因结构复杂性有所不同,致使外源插入基因与宿主基因之间的互作方式各不相同,故而表现出不同的基因干扰效率。Southern杂交结果显示,部分转化子多次传代后出现了抗性基因丢失的现象,这与启动子的选择有关,启动子是负责调控基因转录的相关上游元件,对基因的表达水平具有决定性的影响,有研究指明内源强启动子可以减少基因的甲基化现象,有助于维持转化子遗传性状的稳定以及外源基因的高效表达[24-25]。而本实验选用的35S启动子,虽然是真核生物的组成型启动子,但在平菇内的启动效率可能不如内源启动子稳定,不能够高效并稳定的表达潮霉素基因。另外,值得说明的是转化子遗传性状相对稳定,还与农杆菌种类、载体的结构、抗性基因的选择以及转化方法等因素有关[21,25]。
后续的研究将对Po.hyd RNAi转化子进行基因功能方面的验证,同时结合Po.hyd的超表达载体与反义RNA载体来共同研究该基因的功能。
[1] BURKE J, COX A, PETKOV J, et al. Interfacial rheology and stability of air bubbles stabilized by mixtures of hydrophobin and β-casein[J]. Food Hydrocolloids, 2014, 34: 119-127. DOI:10.1016/ j.foodhyd.2012.11.026.
[2] GREEN A J, LITTLEJOHN K A, HOOLEY P, et al. Formation and stability of food foams and aerated emulsions: hydrophobins as novel functional ingredients[J]. Current Opinion in Colloid & Interface Science, 2013, 18(4): 292-301. DOI:10.1016/j.cocis.2013.04.008.
[3] COX A R, ALDRED D L, ANDREW B R, et al. Exceptional stability of food foams using class II hydrophobin HFBII[J]. Food Hydrocolloids, 2009, 23(2): 366-376. DOI:10.1016/ j.foodhyd.2008.03.001.
[4] STÜBNER M, LUTTERSCHMID G, VOGEL R F, et al. Heterologous expression of the hydrophobin FcHyd5p from Fusarium culmorum in Pichia pastoris and evaluation of its surface activity and contribution to gushing of carbonated beverages[J]. International Journal of Food Microbiology, 2010, 141(1/2): 110-115. DOI:10.1016/ j.ijfoodmicro.2010.03.003.
[5] NIU Baolong, WAN Dandan, YANG Yanyan, et al. Heterologous expression and characterization of the hydrophobin HFBI in Pichia pastoris and evaluation of its contribution to the food industry[J]. Amino Acids, 2012, 43(2): 763-771. DOI:10.1007/s00726-011-1126-5.
[6] FIRE A, XU S Q, MONTGOMERY M K, et al. Potent and specifi c genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391: 806-811. DOI:10.1038/35888.
[7] NAKADE K, WATANABE H, SAKAMOTO Y, et al. Gene silencing of the Lentinula edodes lcc1 gene by expression of a homologous inverted repeat sequence[J]. Microbiological Research, 2011, 166(6): 484-493. DOI:10.1016/j.micres.2010.09.004.
[8] SALAME T M, YARDEN O, HADAR Y, et al. Pleurotus ostreatus manganese-dependent peroxidase silencing impairs decolourization of Orange II[J]. Microbial Biotechnology, 2010, 3(1): 93-106. DOI:10.1111/j.1751-7915.2009.00154.x.
[9] SALAME T M, KNOP D, LEVINSON D, et al. Redundancy amongst manganese-peroxidases in Pleurotus ostreatus[J]. Applied and Environmental Microbiology, 2013, 79(7): 2405-2415. DOI:10.1128/ AEM.03849-12.
[10] HENEGHAN M N, COSTA A M S B, CHALLEN M P, et al. A comparison of methods for successful triggering of gene silencing in Coprinus cinereus[J]. Molecular Biotechnology, 2007, 35(3): 283-296. DOI:10.1007/s12033-007-9008-5.
[11] EASTWOOD D C, CHALLEN M P, ZHANG Cunjin, et al. Hairpinmediated down-regulation of the urea cycle enzyme argininosuccinate lyase in Agaricus bisporus[J]. Mycological Research, 2008, 112(6): 708-716.
[12] KEMPPAINEN M J, PARDO A G. pHg/pSILBAγ vector system for efficient gene silencing in homobasidiomycetes: optimization of ihpRNA-triggering in the mycorrhizal fungus Laccaria bicolor[J]. Microbial Biotechnology, 2010, 3(2): 178-200. DOI:10.1016/ j.mycres.2008.01.009.
[13] MANAMOHAN M, SHARATH CHANDRA G, ASOKAN R, et al. One-step DNA fragment assembly for expressing intron-containing hairpin RNA in plants for gene silencing[J]. Analytical Biochemistry, 2013, 433(2): 189-191. DOI:10.1016/j.ab.2012.09.034.
[14] HECKMAN K L, PEASE L R. Gene splicing and mutagenesis by PCR-driven overlap extension[J]. Nature Protocols, 2007, 2(4): 924-932. DOI:10.1038/nprot.2007.132.
[15] XU G, SUI N, TANG Y, et al. One-step, zero-background ligation independent cloning intron-containing hairpin RNA constructs for RNAi in plants[J]. New Phytologist, 2010, 187(1): 240-250. DOI:10.1111/j.1469-8137.2010.03253.x.
[16] EAMENS A L, WATERHOUSE P M. Vectors and methods for hairpin RNA and artificial microRNA-mediated gene silencing in plants[J]. Methods in Molecular Biology, 2011, 701: 179-197. DOI:10.1007/978-1-61737-957-4_10.
[17] 言普, 沈文涛, 黎小瑛. 植物hpRNA干扰载体构建的研究进展[J]. 生物技术通报, 2013(9): 7-12.
[18] YAN Pu, SHENG Wentao, GAO Xinzheng, et al. High-throughput construction of intron-containing hairpin RNA vectors for RNAi in plants[J]. PLoS ONE, 2012, 7(5): e38186. DOI:10.1371/journal. pone.0038186.
[19] SÁNCHEZ C. Cultivation of Pleurotus ostreatus and other edible mushrooms[J]. Applied Microbiology and Biotechnology, 2010, 85(5): 1321-1337. DOI:10.1007/s00253-009-2343-7.
[20] MA A, SHAN L, WANG N, et al. Characterization of a Pleurotus ostreatus fruiting body-specific hydrophobin gene, Po.hyd[J]. Journal of Basic Microbiology, 2007, 47(4): 317-324. DOI:10.1002/ jobm.200710317.
[21] DING Yi, LIANG Shen, LEI Jinghang, et al. Agrobacterium tumefaciens mediated fused egfp-hph gene expression under the control of gpd promoter in Pleurotus ostreatus[J]. Microbiological Research, 2011, 166(4): 314-322. DOI:10.1016/j.micres.2010.07.001.
[22] SALAME T M, KNOP D, LEVINSON D, et al. Inactivation of a Pleurotus ostreatus versatile peroxidase-encoding gene (mnp2) results in reduced lignin degradation[J]. Environmental Microbiology, 2014, 16(1): 265-277. DOI:10.1111/1462-2920.12279.
[23] PENG M, SINGH N K, LEMKE P A, et al. Recovery of recombinant plasmids from Pleurotus ostreatus transformants[J]. Current Genetics, 1992, 22(1): 53-59. DOI:10.1007/BF00351742.
[24] 董晓雅. 平菇遗传转化体系和转漆酶工程菌株的构建[D]. 郑州: 河南农业大学, 2010.
[25] 师亮. 根癌农杆菌介导的灵芝遗传转化体系的建立及其在灵芝三萜生物合成研究中的应用[D]. 南京: 南京农业大学, 2012.
Construction of RNAi Vector and Transformation of Hydrophobin Gene Po.hyd in Pleurotus ostreatus
LIU Yuanyuan, MA Aimin*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
RNAi vector for Pleurotus ostreatus hydrophobin gene, Po.hyd, was constructed and transformants were obtained by Agrobacterium tumefaciens mediated transformation. Po.hyd was cloned by PCR method using the Golden Gate technology to build the interference vector p1302-GG-ihyd, which had a neck ring structure. Finally, this vector was transferred into A. tumefaciens GV3101 under the induction of acetosyringone (AS), the young mycelia were mediated by A. tumefaciens, and the transformants were detected and identifi ed by PCR amplifi cation, fl uorescence microscopy, real-time PCR and Southern blot technique. One genetically stable P. ostreatus transformant was obtained, which was hygromycin resistant. The green fl uorescence signal could be detected under a fl uorescence microscope, and the expression of Po.hyd was 43% compared with the wild type strain. The exogenous DNA was integrated into the genome in a single copy. This result will lay the preliminary foundation for further studies on the function of Po.hyd.
Pleurotus ostreatus; hydrophobin; RNAi; Agrobacterium tumefaciens mediated transformation
10.7506/spkx1002-6630-201611015
Q78
A
1002-6630(2016)11-0084-06
刘媛媛, 马爱民. 平菇疏水蛋白Po.hyd基因RNAi载体构建及转化[J]. 食品科学, 2016, 37(11): 84-89. DOI:10.7506/ spkx1002-6630-201611015. http://www.spkx.net.cn
LIU Yuanyuan, MA Aimin. Construction of RNAi vector and transformation of hydrophobin gene Po.hyd in Pleurotus ostreatus[J]. Food Science, 2016, 37(11): 84-89. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611015. http://www.spkx.net.cn
2015-08-23
国家自然科学基金面上项目(31172011;30771502)
刘媛媛(1988—),女,硕士研究生,研究方向为食品生物技术。E-mail:lyy0425@foxmail.com
*通信作者:马爱民(1965—),男,教授,博士,研究方向为食品生物技术。E-mail:aiminma@mail.hzau.edu.cn
