肿瘤患者肝移植术中回收自体血细胞形态及病理学研究
2016-11-12袁莉闫伟华饶伟薛欣李如霞朱孔娟臧运金青岛大学附属医院麻醉科山东青岛6600青岛大学附属医院病理科山东青岛6600青岛大学附属医院器官移植科山东青岛6600
袁莉,闫伟华,饶伟,薛欣,李如霞,朱孔娟,臧运金(.青岛大学附属医院麻醉科,山东 青岛 6600;.青岛大学附属医院病理科,山东 青岛 6600;.青岛大学附属医院器官移植科,山东 青岛 6600)
肝移植术患者创伤大、出血多、 凝血功能差,通常需要输注大量异体血液制品[1],以维持循环和内环境稳定,而异体输血可能引起传染性疾病和免疫功能抑制等不良反应。术中自体血液回收、自体输血已成为肝移植手术的重要措施之一,但其在肿瘤患者手术中的应用一直存在争议,主要问题在于血液回输后引起肿瘤细胞播散的危险。本研究对肿瘤患者血液回收、洗涤的自体血细胞形态及病理学方面有无肿瘤细胞进行了研究,结果报告如下。
1 材料与方法
1.1 研究对象:原位肝移植患者124例,包括2014年56例,2015年65例,2016年3例,活体肝移植5例。其中肿瘤患者55例,占所有患者的44%,包括肝脏肿瘤、胃肿瘤、胆管肿瘤等。
1.2 麻醉方法:所有124例患者建立有创动脉血压,监测脉搏氧饱和度,全身麻醉,右颈内静脉穿刺置入三腔管及肺动脉飘浮导管,监测中心静脉压(CVP)、肺动脉压(PAP)及肺毛细血管嵌压(PAWP)。所有患者自切皮起应用自体血回收仪(Cell Saver 5或Cell Saver 5+)进行自体血回收。患者身下铺保温毯,使用暖风机及输液加温仪,室温调节在22~23°C,监测患者鼻咽温度或直肠温度,尽可能保持正常体温,避免低温对患者凝血功能的不利影响。维持尿量>0.5 ml/(kg·h),输注等渗白蛋白林格液。肿瘤患者自体血仅在大量失血时回输。大量失血是指成人出血速度达到150 ml/min,或出血速度达到1.5 ml(/kg·min)超过20分钟,或3小时内丢失50%自身血容量。
1.3 监测指标:术中应用自体血回收仪做血液回收,应用225 ml离心杯进行自体血回收,全自动清洗,每次得到血细胞比容0.50的自体血225 ml。采集每次回收后洗涤红细胞液3 ml,送中心血站血液研究所及病理科进行血液涂片检查及肿瘤细胞学检查。
2 结 果
2.1 一般结果:本研究肝移植手术总数为124例,手术成功率100%,平均总住院天数为29天,围术期病死率4.03%(5/124),患者一年累计存活率93%(8/124),心脏死亡器官捐献(DCD)96例。术中出血600~30 000 ml不等, 输注红细胞0~78 U,新鲜冰冻血浆400~17 090 ml, 输注冷沉淀0~1 600 U。术中ACT超过200秒者给予鱼精蛋白拮抗残余肝素。
2.2 回收血细胞形态学及病理学结果(表1,图1):全自动洗涤一次红细胞容量225 ml,55例术前肿瘤患者中,有36例患者回收血量少未洗涤,另外19例患者进行自体血回收,其中,失血量<1 000 ml的7例患者自体血未回输,失血量>1 000 ml的12例患者最终有10例回输自体血,有2例因为术中切除肝脏肿瘤,怀疑肿瘤破裂最终未输注自体血。回收血液总量225~13 900 ml。有6例患者回收血液量多,洗涤次数超过5次。55例肿瘤患者最终有10例回输自体血。
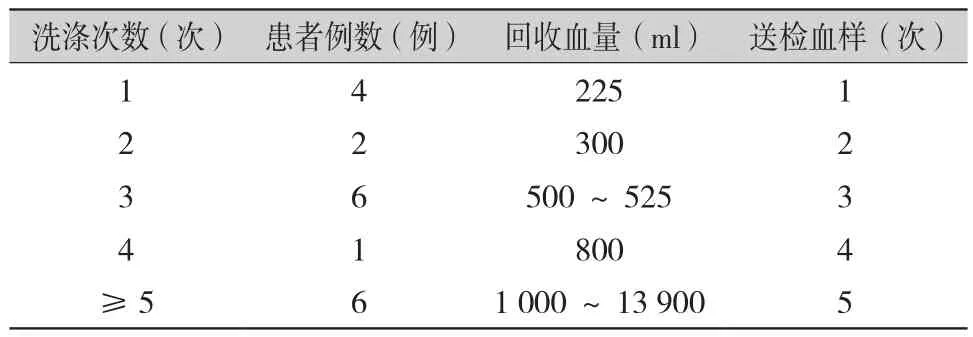
表1 19例患者送检血样次数、回收血量及洗涤次数
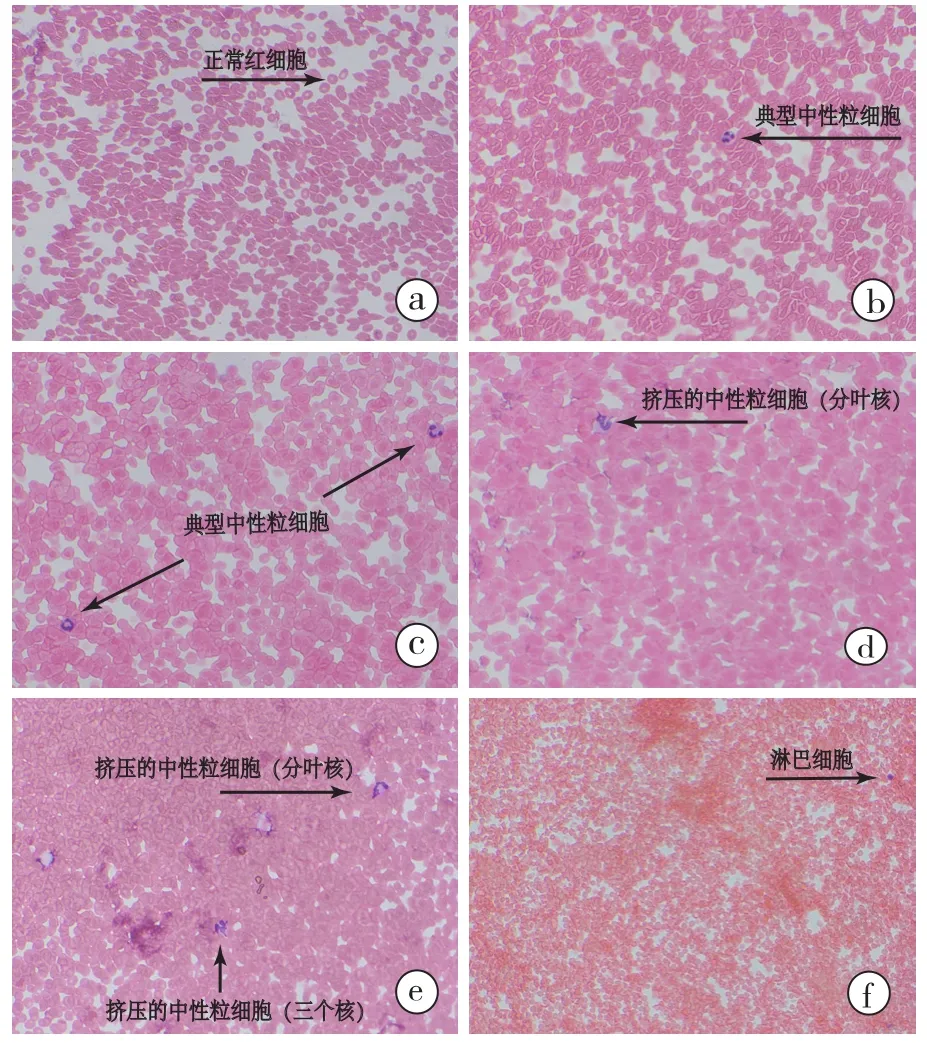
图1 a:患者不同洗涤次数的血细胞涂片,患者第一次回收自体血洗涤红细胞中未发现肿瘤细胞,罕见白细胞,箭头所示为正常红细胞;b:患者第二次回收自体血洗涤红细胞中未发现肿瘤细胞,仅见少量白细胞,箭头所示为典型中性粒细胞;c:患者第三次回收自体血洗涤红细胞中未发现肿瘤细胞,仅见少量白细胞,箭头所示为典型中性粒细胞;d:患者第四次回收自体血洗涤红细胞中未发现肿瘤细胞,见少量白细胞,箭头所示为挤压的中性粒细胞(分叶核);e:6例患者大量回收自体血后,洗涤红细胞中有白细胞及可疑肿瘤细胞,但经过两个医院的病理科医生会诊后,排除肿瘤细胞,确定为白细胞,箭头所示为挤压的中性粒细胞(分叶核和三叶核);f:6例患者大量回收自体血后,洗涤红细胞中未发现肿瘤细胞(苏伊士染色×200)
肝细胞性肝癌在低倍光镜下癌细胞可排列成小梁状、实性巢状、假腺样或腺泡样结构,细胞排列成3~4层厚的小梁或细胞索;高倍镜下,癌细胞浆丰富,嗜酸性,核圆形。核仁清楚,癌细胞核浆比例明显增大,常见明显的异型性,癌细胞大小不一、形态怪异,包括畸形的瘤巨细胞,核深浅差别明显,可单核或多核。偶见破骨细胞样巨细胞。所有血样涂片血细胞形态正常,病理学检查未发现肿瘤细胞。回输血后,由于手术后吸收热量、带管时间不等,手术患者有无寒战、发热等输血并发症无法详细统计,患者无血红蛋白尿,初步确定无溶血发生。
3 讨 论
随着外科和麻醉技术的不断发展,目前,肝移植患者围术期血制品的使用量大大减少,但相对于其他常规手术,肝移植围术期血制品的需求量仍然较大。曹淑梅等[2]研究表明,肝移植术中采用自体血回输,平均每例患者回输自体浓缩红细胞为(2 631±1 637) ml。一项大样本前瞻性研究中发现,660例肝移植患者,平均血液回收量为5 086 ml(500~44 300 ml),平均回输量为1 662 ml( 36~13 630 ml)[3]。原位肝移植手术患者,术中采集术野及回收后血液各15 ml,分别检测红细胞功能,自体血回收后,红细胞形态、结构、生理功能及流变学指标未见明显不良影响[4]。术中应用回收式自体血回输对其病毒载量无明显影响,且病毒定量的改变率与回输血量不相关,但仍需要大样本的随机化前瞻性研究证据支持,同时需要对照实验排除脾脏血的影响。肝移植患者均为终末期肝病,凝血功能差,术中容易大量失血,异体输血可能会增加肿瘤的复发率和病死率[5]。这可能与自然杀伤(NK)细胞和细胞毒T细胞的抑制,以及T抑制细胞的激活相关[6]。
由于肿瘤患者肝移植自体血回输尚无最后定论,对于肿瘤患者,原则上不进行回输。输注异体血,尤其是输血量大时会导致患者围术期感染,降低移植器官的存活率,甚至导致多器官的功能衰竭和死亡。近年来,国内外的一些研究表明,肿瘤患者肝移植术中回输自体血不增加肿瘤的复发率及生存率[6-9],即肝移植后患者肿瘤复发与是否回输自体血无关,肿瘤的复发与术前肿瘤的类型和分级有关,但其合理的术前评估系统有待进一步建立[10]。1项囊括11项研究,2 326例前列腺癌、肝癌、宫颈癌、胃肠道癌患者的Meta分析,认为术中自体血回输预后并不逊色于异体输血[6]。这些实验多为回顾性研究和非随机对照实验[3,7]。应当考虑患者的异质性、肿瘤的类型和分期、术中输血的具体情况,以及较长的随访期等因素。为了更有效地清除肿瘤细胞,推荐回输自体血时应使用白细胞滤器[11]。Catling等[12]在血液回收后加用白细胞滤器,所有肿瘤患者阳性标本均未检测到肿瘤细胞。这些数据表明,白细胞滤器能提高血液自体血回收机清除肿瘤细胞的能力,大的肿瘤细胞簇能够以物理方式被滤网捕获,小的肿瘤细胞簇和单个的肿瘤细胞则通过物理屏障或电荷吸附的方式被阻隔,降低肿瘤细胞回输的风险[3]。Gwak 等[13]研究认为白细胞滤器存在阈值,当肿瘤细胞超过一定负荷时,就不能被完全清除,并认为这一阈值为1×105个/ml。Liang等[11]研究表明,在32例标本中,有肿瘤破裂的1例标本经白细胞滤器处理后仍检测到了肿瘤细胞。这说明白细胞滤器的清除效能与血液中肿瘤细胞的负荷相关。某些可能导致回收血液中肿瘤细胞负荷增加,如术中肿瘤破裂、进展期癌症,使用血液回收需谨慎[8]。
本研究全自动洗涤一次红细胞容量为225 ml,55例术前肿瘤患者中,回收血液总量225~13 900 ml,有36例患者回收血量少未洗涤。有5例患者回收的血液量多,洗涤次数超过5次。随着洗涤次数的增加,虽然有1份涂片中红细胞团有可疑细胞, 但经过病理科医生联合诊断,排除肿瘤细胞的可能,全部送检回收洗涤红细胞血样中均未发现肿瘤细胞。
目前,许多城市“血荒”现象持续存在,对于肿瘤患者肝移植手术,国内外的通行做法是在术中应用血细胞回输仪行自体血回收,并进行离心、洗涤,最终成为血细胞比容(Hct) 0.50~0.65的红细胞悬液[14]。只有在大量失血和异体血供应相对不足时,为挽救患者生命才回输洗涤的自体血液,另外加异体血输注。肝移植患者围术期应用舒莱等免疫抑制剂,围术期大量异体血输注除了可能导致急性排斥反应,还可能导致输血相关性肺损伤、移植物抗宿主反应等不良后果,因此,大量失血患者有回输自体血的适应证,本研究中有10例肿瘤患者回输了自体血。由于青岛大学附属医院肝脏移植科成立仅2年多时间,术后随访时间不长,回输自体血是否增加肿瘤复发率,还需要后续的进一步研究,全自动清洗及白细胞滤器的联合使用对提高患者的安全性很有必要。如果肿瘤手术,特别是恶性肿瘤肝移植手术中输血几乎不可避免,血液回收自体输血是一种重要的选择。
鉴于多个实验研究的支持,包括英国国立健康与临床优化研究所(NICE)在内的机构都认为,术中血液回收自体输血与白细胞滤器联合使用的情况下,可用于恶性肿瘤手术。意大利输血和免疫协会(SIMTI)建议术中血液回收自体输血与白细胞滤器联合使用,可以用于前列腺癌根治术、根治性膀胱切除术、肝癌切除术、肝移植术、妇科手术等[15]。
综上所述,本研究中回收自体血无论从红细胞形态学、肿瘤细胞病理学方面均提示是安全的,未发现肿瘤细胞,用于大量失血的肿瘤肝移植患者,挽救了患者的生命。由于研究时间短,样本量较少,随访时间短,仍需更大量的样本进一步研究方能得出是否安全的结论。
(致谢:本文得到青岛市中心血站血液研究所冯智慧所长及青岛大学附属医院病理科闫伟华医生的大力协助,在此致谢)。
