氧化石墨烯-羧基碳纳米管-多乙烯多胺三维蜂窝状材料吸附CO2
2016-11-12胡航标张涛崔征唐盛伟
胡航标,张涛,崔征,唐盛伟
(四川大学化学工程学院,四川 成都 610065)
氧化石墨烯-羧基碳纳米管-多乙烯多胺三维蜂窝状材料吸附CO2
胡航标,张涛,崔征,唐盛伟
(四川大学化学工程学院,四川 成都 610065)
以氧化石墨烯-羧基碳纳米管水溶液为原料,葡萄糖酸β内酯为交联促进剂,通过冷冻干燥法制得负载有多乙烯多胺的氧化石墨烯-羧基碳纳米管三维多孔气凝胶。通过在制备过程中改变多乙烯多胺的加入量可以调节其负载量。FTIR、XRD、TG、SEM、XPS、Raman、N2吸脱附等测试表征发现:多乙烯多胺通过酰胺键与基体连接,所得材料呈蜂窝状,且比表面积、孔容和平均孔径随胺类负载量的增加而逐渐降低,引入多乙烯多胺后的气凝胶材料通过化学作用实现CO2吸附。在200kPa、328K下,多乙烯多胺含量为55.8%的改性吸附剂的CO2吸附量可达3.9mmol/g,为相同条件下未改性吸附剂的9.8倍。结果表明,将多乙烯多胺、氧化石墨烯和羧基碳纳米管制备成三维蜂窝状多孔材料能有效提高CO2吸附性能。
纳米材料;二氧化碳;凝胶;吸附
温室效应造成的全球气候问题已成为人类进入21世纪以来面临的最大生存挑战。二氧化碳(CO2)的大量排放被认为是温室效应的主要成因[1-2]。为实现CO2减排,各国科学家着力开展CO2捕集与封存技术(CCS)的研究。常用的CO2捕集技术包括吸收、吸附、膜分离等[3-4]。其中,固态吸附分离因成本低、再生能耗低、温度范围宽等优点,具有良好的经济性和工业发展前景[5]。
吸附剂是影响吸附分离效果的关键因素。目前,对以碳材料、分子筛以及金属有机骨架材料等多孔材料为载体的吸附剂的吸附性能进行了广泛的研究[6-9]。其中,石墨烯因具有优良的力学性能、较大的比表面积和独特的二维平面结构受到广泛关注。然而,单纯的石墨烯主要通过物理作用吸附CO2,因而吸附容量低。对此,通过表面改性在氧化石墨烯上负载相应的碱性化合物或含碱性基团的化合物(如胺类)可以有效增强吸附能力。同时,二维石墨烯材料缺乏孔道结构,在改性及使用过程中易堆叠,使表面积及有效负载量均受到限制,从而制约了CO2的吸附容量。因此建立孔道体系、增加胺类负载量是改善石墨烯材料吸附性能的有效途径。
三维石墨烯气凝胶具有多孔结构和较大的孔道尺寸,传质阻力小,是理想的固体吸附剂载体材料。2013年,SUN等[10]利用石墨烯与碳纳米管制备出了一种超轻全碳气凝胶,该材料结合了石墨烯较大二维平面结构和碳纳米管高机械强度的特点,具有高弹性、高比表面积和高孔隙率,能大量快速地吸附甲苯、原油等有机物。利用三维结构的多孔特性,SUI[11]和ALHWAIGE[12]等也分别将聚乙烯亚胺和壳聚糖负载到氧化石墨烯气凝胶上用于吸附CO2,效果良好。
在载体上负载胺类化合物是增强吸附剂CO2吸附能力的有效途径[13]。YE等[14]将四乙烯五胺(TEPA)负载到多壁碳纳米管上,ZHAO等[15]将乙二胺(EDA)负载到氧化石墨烯上,均取得了较好的CO2吸附效果。多乙烯多胺作为一种对CO2具有极强吸收能力的链状胺类化合物,相比于TEPA和EDA等胺类,具有更高的氨基含量,是理想的交联剂和CO2吸收剂。目前尚较少有关于应用多乙烯多胺制备CO2吸附剂的相关研究。若将多乙烯多胺对CO2的强吸附特性与石墨烯三维材料良好的传质与界面特性相结合,制备新型CO2吸附材料,将可能具有良好的CO2吸附能力。因此,本文通过在高浓度氧化石墨烯-羧基碳纳米管水溶液中加入多乙烯多胺,并以葡萄糖酸β内酯为交联促进剂,制备含有多乙烯多胺的三维孔状结构气凝胶,以获得高性能的CO2吸附材料。
1 实验部分
1.1实验原料
多壁碳纳米管(MWCNTs,纯度>95%) 购自中国科学院成都有机化学有限公司;硫酸(95%~98% H2SO4,分析纯)、硝酸(HNO3,65%~68%,分析纯)和氢氧化钠(NaOH,分析纯),均购自成都科龙化工试剂厂;多乙烯多胺(相对分子质量:275)和葡萄糖酸β内酯(GDL,纯度99%),购自上海阿拉丁试剂。将硝酸与硫酸以体积比1∶3混合配制混酸,以备羧基化使用。
1.2氧化石墨烯-羧基碳纳米管气凝胶的制备
按以下步骤制备氧化石墨烯-羧基碳纳米管气凝胶:以天然石墨粉为原料通过改进Hummers法[16]制备氧化石墨烯(GO),并将其配成13.9mg/mL的氧化石墨烯水溶液。将多壁碳纳米管通过混酸酸化处理制得羧基碳纳米管[17],并将其配成4.0mg/mL的羧基碳纳米管水溶液。在烧杯中分别加入30mL氧化石墨烯水溶液、10mL羧基碳纳米管水溶液以及12mL纯水,机械搅拌3h,将所得混合物通过液氮冷冻,在冷冻干燥机中处理48h,即得氧化石墨烯-羧基碳纳米管气凝胶(记为GO-CNTs)。
1.3多乙烯多胺改性氧化石墨烯气凝胶的制备
如图1所示,在5mL烧杯中加入按1.2节所述方法制备得到的氧化石墨烯-羧基碳纳米管水溶液3mL,边搅拌边逐滴滴加0.3mol/L氢氧化钠溶液约0.3mL,调节其pH为8。然后加入1mL多乙烯多胺溶液(浓度925.7mg/mL),搅拌并超声处理3min,滴入0.1mL,300.0mg/mL葡萄糖酸β内酯水溶液,再次搅拌并超声处理3min,静置24h后得到掺入多乙烯多胺的氧化石墨烯-羧基碳纳米管凝胶。将凝胶浸泡到大量纯水中以洗涤除去未反应的多乙烯多胺。最后,将产品通过液氮冷冻,在冷冻干燥机中处理48h,得到多乙烯多胺改性氧化石墨烯气凝胶。改变多乙烯多胺的加入量可制得不同负载量的多乙烯多胺改性氧化石墨烯气凝胶。加入1mL多乙烯多胺、2mL多乙烯多胺、3mL多乙烯多胺后制备得到的改性氧化石墨烯气凝胶分别记为:GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3。1.4 CO2静态吸附实验
在自制静态吸附装置上进行CO2吸附性能评价研究。实验装置和实验方法参见文献[18]。
1.5表征
红外光谱分析采用Spectrum Two L1600300红外光谱仪(FTIR,珀金埃尔默仪器有限公司),波长范围为:500~4000cm-1。热重分析采用HTG-2微机差热天平(TG,北京恒久科学仪器厂),温度范围50~800℃,N2气氛,升温速率为10℃/min;采用JSM-7500F型扫描电子显微镜(SEM,日本电子株式会社)对GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly3的微观形貌进行观测。拉曼光谱测试采用LabRAM HR型拉曼光谱仪(HORIBA公司,法国)。采用DX-2700X射线衍射仪(丹东方圆仪器有限公司)进行晶面结构分析;表面元素组成及价态分析采用XSAM800型X射线光电子能谱仪(XPS,岛津KRATOS公司,日本);比表面积及孔结构测试采用Trister Ⅱ 3020比表面积及孔结构分析仪(美国麦克仪器公司)。

图1 多乙烯多胺改性氧化石墨烯-羧基碳纳米管气凝胶的制备路线示意图
2 结果及讨论
2.1多乙烯多胺改性氧化石墨烯气凝胶表征结果分析
2.1.1红外光谱
在GO-CNTs的FTIR谱图(图2)中,1730cm-1处出现伸缩振动的特征峰,表明GO-CNTs中含有羧基,主要来自氧化石墨烯和羧基碳纳米管中的相应基团。在GO-CNTs-poly1、GO-CNTs-poly2和GO-CNTs-poly3的FTIR谱图中,1656cm-1、1564cm-1和1446cm-1处均出现特征峰,分别表示伸缩振动、N—H变形振动和C—N伸缩振动。表明在负载过程中,多乙烯多胺中的氨基与氧化石墨烯和羧基碳纳米管上的羧基反应生成了酰胺基团(CONH-)。多乙烯多胺通过化学键在氧化石墨烯和羧基碳纳米管上进行负载。同时可以发现,峰强度随加入的多乙烯多胺量的增加而变强,表明通过增加多乙烯多胺的加入量,增加了其在载体上的有效负载量。在3239cm-1处观察到-NH2中N—H伸缩振动的特征峰,说明存在伯胺基团。

图2 GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3红外谱图
2.1.2X射线衍射
如图3所示,石墨粉是具有较高结晶度的片层结构,在2θ=26.5°处出现(002)面衍射峰,根据谢乐公式,其晶面间距为3.4Å。而对于GO-CNTs,(002)面衍射峰消失,在2θ=10.8°处出现(001)面衍射峰,晶面间距为8.5Å。这是由于在制备氧化石墨烯的过程中引入了大量氧化基团,导致其层间距大于石墨粉的层间距。在GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的XRD谱图中,(002)面和(001)面的衍射峰均消失。这是因为多乙烯多胺通过化学键与氧化石墨烯及羧基碳纳米管相互连接进行负载,多乙烯多胺分子层覆盖在氧化石墨烯片层及羧基碳纳米管上,导致相应的衍射峰消失。说明经过多乙烯多胺改性后的氧化石墨烯-羧基碳纳米管气凝胶的晶面结构发生了较大变化。
2.1.3拉曼光谱
从图4可以看出,GO-CNTs在1352cm-1和1592cm-1出现两个特征峰,分别代表缺陷诱导D带和sp2碳晶格中E2g模的一级散射(G峰)[19]。在GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的谱图中,G峰位置从1592cm-1转移至1583cm-1,出现红移,这可能是由于引入的多乙烯多胺分子增加了石墨烯表面张力导致的[20]。通过计算D带峰和G带峰的强度比值ID/IG可以得到改性前后材料中含碳缺陷位数量的变化情况。通过折线图可以清楚看到,GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、 GO-CNTs-poly3的ID/IG值逐渐增加,说明气凝胶材料中缺陷位的数量随着多乙烯多胺加入量的增多而增多。缺陷的存在说明表面能的不均匀性是导致吸附的原因之一。缺陷位结构数量的增加有助于材料吸附性能的改进。

图3 石墨粉原料、GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的XRD谱图

图4 GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3拉曼谱图
2.1.4热重分析
GO-CNTs的热重曲线在130~308℃温度区间内有一明显的失重峰(图5),其失重率为35.7%,为GO-CNTs中所含羧基等含氧官能团的失重。在GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的热重曲线中,在100~210℃及210~410℃均有失重,且失重率随负载量的增大而增大。100~210℃的失重率分别为20.2%、22.0%、24.7%,主要为游离附着态多乙烯多胺及部分未反应羧基的分解失重;在210~410℃的失重率分别为32.4%、43.4%、45.4%,主要为酰胺基、环氧基等含氧官能团及接枝态多乙烯多胺的分解失重。

图5 GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3热重曲线
负载多乙烯多胺后的GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3失重率高于GO-CNTs的失重率,其差值是由于负载的多乙烯多胺失重导致的,依据失重率差异,可以计算出GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3中多乙烯多胺的含量分别为27.8%、41.2%、55.8%。2.1.5 扫描电镜
图6为不同放大倍率下GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly3的SEM图。从整体外观上看[图6(a)、6(c)],制备得到的各材料均呈现蜂窝状三维结构。比较图6(A)、图6(C)、图6(E)可以发现,在未负载多乙烯多胺时,其呈现非常典型的蜂窝结构[图6(A)],随着多乙烯多胺的负载,蜂窝中的空隙缩小,变得更为紧密[图6(C)]。随着多乙烯多胺负载量的进一步增加,其空隙进一步缩小,结构变得更为紧密[图6(E)]。从更微观的角度可以发现,GO-CNTs由氧化石墨烯片与羧基碳纳米管构成,碳纳米管支撑着石墨烯片从而形成蜂窝状的结构[图6(B)]。从图6(D)中可以发现,负载多乙烯多胺后的GO-CNTs-poly1仍具有较大的空隙率,但石墨烯片明显增厚。在具有更大多乙烯多胺负载量的GO-CNTs-poly3的SEM图中[图6(F)、图6(f)],发现类似于瓦楞堆积的规则孔道和形状,但间隙进一步缩小。从图6中可以看出,通过负载过程,多乙烯多胺均匀负载到氧化石墨烯上,氧化石墨烯片层明显增厚且出现许多缺陷结构,且由于多乙烯多胺的胶黏作用,将原本较分散的、靠范德华力相互作用的氧化石墨烯片层通过化学作用力交联在一起,使得孔道结构更为稳定。虽然多乙烯多胺的负载使孔道尺寸变小,但其载体本身较大的孔道使得负载后的孔道仍然较大。多孔结构和相对较大的孔道尺寸,使得吸附质更容易进入孔道内并与吸附剂相接触,有利于增强吸附容量。

图6 GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly3扫描电镜图
2.1.6XPS
对GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2及GO-CNTs-poly3进行X射线光电子能谱表征,得到样品中C、O、N元素相对含量及价态方面的相关信息(图7中仅给出GO-CNTs、GO-CNTs-poly1的XPS谱图)。结果显示,GO-CNTs中几乎不含有N元素,GO-CNTs-poly1、GO-CNTs-poly2及GO-CNTs-poly3中N元素相对原子分数分别为10.1%、14.2%、17.0%。对于GO-CNTs,C1s峰可以由288.3eV、286.4eV、285.5eV、284.5eV分峰拟合而成,分别代表—COO—、CO、O—C—O以及C—C/CC。从中可以判断,GO-CNTs气凝胶中含有丰富的以羧基、环氧基为代表的含氧官能团。经过改性后,由于多乙烯多胺分子的引入带来了大量氨基,使得材料表面元素相对含量及其化学结合形式发生重大改变。从图7(d)可以看出,GO-CNTs-poly1的N1s峰可以由400.6eV、399.5eV及398.6eV三个分峰拟合得到,分别代表—NH3+、—NH2、—NH—,这也印证了红外分析结果,即氨基与氧化石墨烯及羧基碳纳米管上的羧基通过形成酰胺键结合在一起。此外,400.6eV处分峰表示氨基正离子,说明质子化的氨基与带负电的含氧官能团之间可能存在静电作用力。
2.1.7N2吸附脱附比表面积测试
GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2及GO-CNTs-poly3的N2吸附脱附等温线及各样品的BET比表面积、孔容和平均孔径数据如图8及表1所示。从图8可以看出,GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2及GO-CNTs-poly3的N2吸附等温线在P/P0>0.9处出现吸附量快速上升的现象,这是由于毛细管冷凝现象导致的吸附量急剧增大。此外,由于多乙烯多胺具有胶黏性,会使相邻的氧化石墨烯片层相互交联,且多乙烯多胺的负载会堵塞部分微孔,因此GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2及GO-CNTs-poly3的比表面积、孔容及平均孔径参数均呈现逐渐下降趋势。这与扫描电镜观察到的结构相一致。

图7 GO-CNTs以及GO-CNTs-poly1X射线光电子能谱图
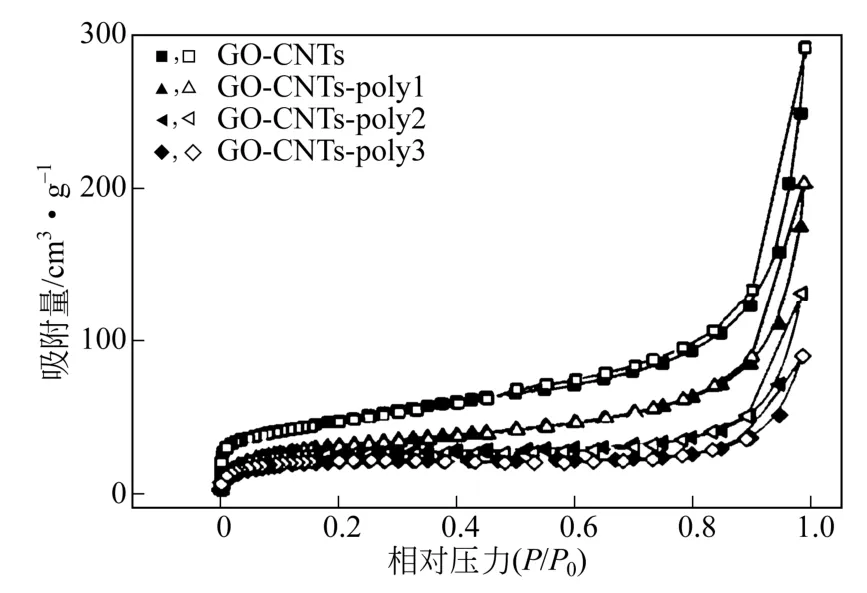
图8 GO-CNTs,GO-CNTs-poly1,GO-CNTs-poly2 和GO-CNTs-poly3的N2吸附脱附等温线

表1 GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的BET比表面积、孔容及平均孔径
2.2CO2吸附性能分析
2.2.1等温吸附曲线
为了考察改性前后氧化石墨烯-羧基碳纳米管气凝胶对CO2的吸附情况以及负载量对吸附性能的影响,在低压(<200kPa)、298K的条件下对改性前后各样品进行CO2静态吸附测试,结果如图9所示。显然,相同压力下的吸附量均呈现GO-CNTs<GO-CNTs-poly1<GO-CNTs-poly2<GOCNTs-poly3的规律。在200kPa、298K下,GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2和GO-CNTs-poly3的吸附量分别为0.6mmol/g、1.8mmol/g、2.4mmol/g和2.8mmol/g。其中GO-CNTs-poly3对CO2的吸附能力超过GO-CNTs吸附能力的4倍。虽然经过多乙烯多胺改性后,材料比表面积、孔容和孔径均有所减小,但其对CO2的吸附能力得到较大提升。这是由于GO-CNTs与CO2之间作用力主要是范德华力,对CO2的吸附呈现物理吸附特征,其吸附力弱,吸附量低。经过改性后,通过红外和XPS分析可知,由于多乙烯多胺的负载有效提高了吸附剂表面的氨基含量,且氨基基团(包括—NH2和—NH—)可以通过与CO2形成氨基甲酸盐实现对CO2的吸附[22],如式(1)、式(2)。

所以,经过多乙烯多胺改性后的吸附剂能较大程度地提高原有吸附材料的吸附性能,且随着负载量的增加,吸附剂表面含有更加丰富的氨基,因此有更多的强吸附位点与CO2分子发生作用,故表现为吸附能力随着负载量的增加而增加。

图9 298.15K下GO-CNTs、GO-CNTs-poly1、GO-CNTs-poly2、GO-CNTs-poly3的CO2等温吸附数据及Freundlich模型拟合曲线
为了考察温度对吸附性能的影响,选取GO-CNTs和GO-CNTs-poly3为吸附剂进行比较分析,分别在298K、308K、318K、328K下进行CO2吸附能力测试,得到不同温度下的吸附等温线。如图10所示。从图10可见,在200kPa、328K下,GO-CNTs-poly3的CO2吸附量为3.9mmol/g,相同条件下GO-CNTs的CO2吸附量为0.4mmol/g,负载多乙烯多胺可使负载量增加8.8倍。
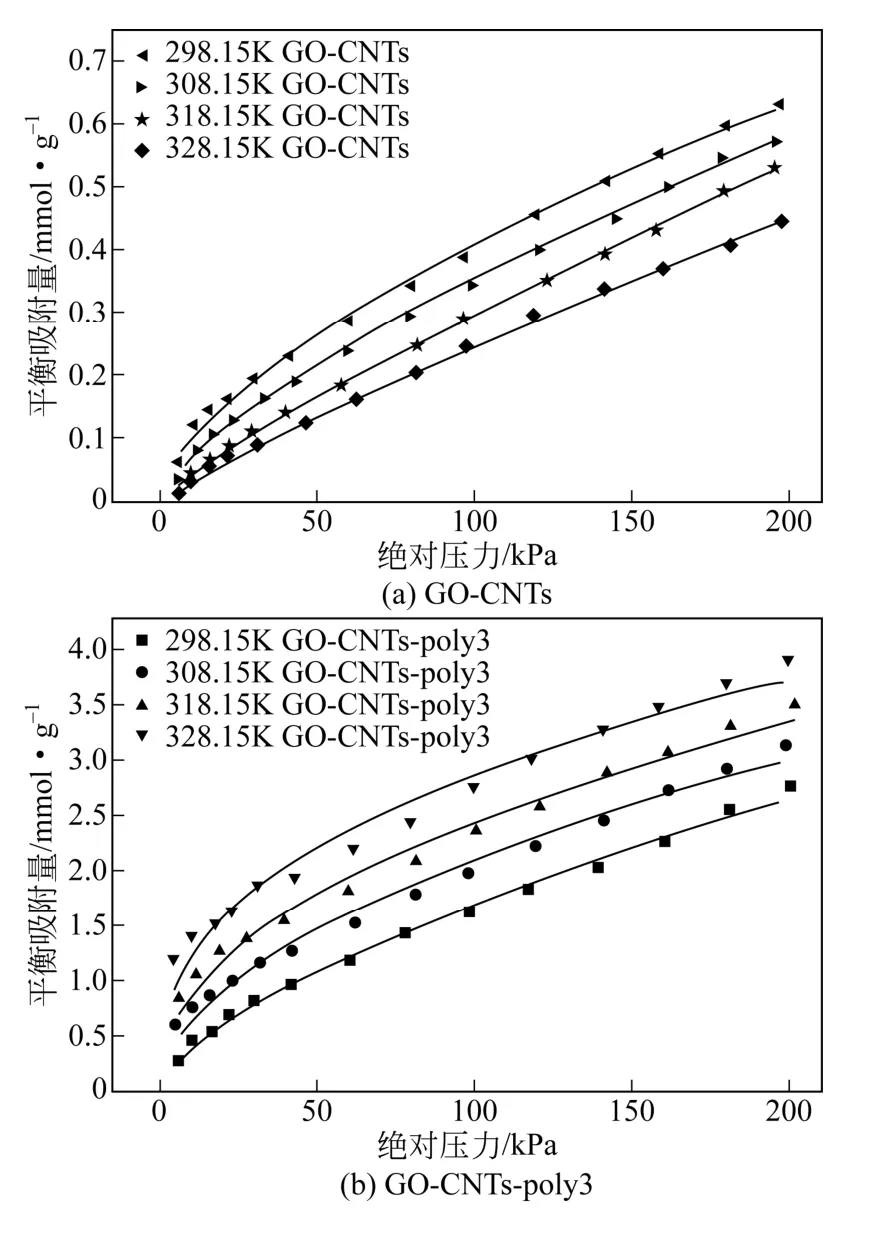
图10 不同温度下GO-CNTs和GO-CNTs-poly3的CO2等温吸附数据及Freundlich模型拟合曲线
从图10可以发现,GO-CNTs和GO-CNTs-poly3对CO2的吸附量随温度升高呈现截然不同的变化趋势。GO-CNTs对CO2的吸附量随着温度的增加逐渐减少,而GO-CNTs-poly3对CO2的吸附量随温度升高而升高。导致这种吸附行为差异的原因在于吸附机理的不同,GO-CNTs与CO2之间依靠物理作用进行吸附,随着温度升高,分子间作用力减弱,因此吸附量随温度升高而降低。负载多乙烯多胺后,GO-CNTs-poly3表面含有丰富的碱性基团,其主要通过上述式(1)、式(2)进行化学反应实现对CO2的吸附。化学吸附需要较高的活化能。随着温度从298K升高到328K,CO2获得的平均能量增加,越来越多的CO2分子成为活化分子,表现为吸附量随着温度的增加而增加。此外,相关文献还提到,在一定范围内升高温度能增强多乙烯多胺的分子柔性,使得一些负载到吸附剂内孔及凹槽上的多乙烯多胺分子有更多的氨基暴露出来,并且与CO2发生有效接触[11]。
分别采用Langmuir模型和Freundlich模型对吸附数据进行曲线拟合,以分析其吸附行为与吸附模型,结果如表2所示。在Langmuir模型中,每个吸附位点对吸附质具有相同的吸附能,是均匀单层吸附;而在Freundlich模型中,吸附位点对吸附质的吸附能不尽相同,是非均匀多层吸附。
Langmuir方程如式(3)。

式中,Qeq表示在平衡压力P下的吸附量,mmol/g;Qmax指实现完全单层分子覆盖后的最大吸附能力,mmol/g;KL是Langmuir等温系数,kPa-1。
Freundlich方程如式(4)。

式中,KF是Freundlich等温系数,mmol/[g·kPa(1/n)];n反映了吸附过程的难易程度。
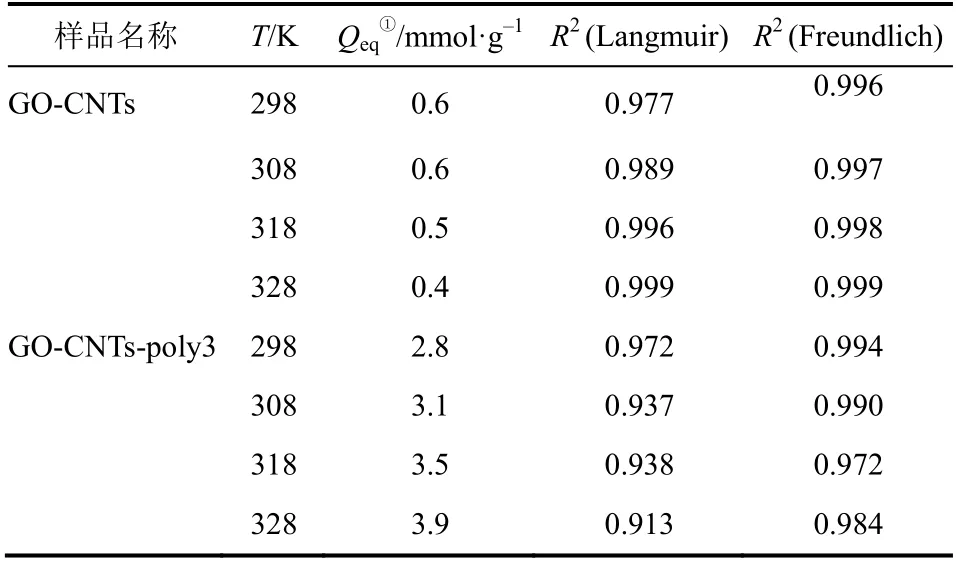
表2 Langmuir模型和Freundlich模型拟合参数
可以看出,Freundlich模型对GO-CNTs以及GO-CNTs-poly3的CO2吸附数据具有更好的拟合效果。说明两种吸附剂对CO2的吸附更倾向于非均匀多层吸附而不是均匀单层吸附。以上结论说明Freundlich模型能较好地描述GO-CNTs及其多乙烯多胺负载改性产品对CO2的吸附行为。
2.2.2吸附热力学
等量吸附热Qst通常定义为吸附过程的焓变。利用克劳修斯-克拉佩龙方程并依据不同温度下的吸附等温线数据可对CO2吸附热值进行计算[12],如式(5)、式(6)。

式中,ΔHad为吸附焓,kJ/mol;n表示CO2吸附量,mmol/g;T为绝对温度,K;P为绝对压力,Pa。
对改性前后吸附剂的lnP和T-1作图可得到吸附等比容曲线,如图11所示。计算得到GO-CNTs以及GO-CNTs-poly3的等量吸附热曲线如图12所示。由于GO-CNTs对CO2的吸附为物理吸附过程,且该过程放热,故GO-CNTs的等比容曲线斜率为负值。GO-CNTs-poly3对CO2的吸附为化学吸附过程,由于温度从298K升到328K的过程正值活化阶段,一方面CO2分子通过吸收热量获得活化能;另一方面,负载到吸附剂内孔及凹槽上的多乙烯多胺分子吸收热量提高了其分子柔性,使得更多的氨基暴露出来并且与CO2发生有效接触,因而促进了GO-CNTs-poly3对CO2的吸附,表现为298~328K范围内,GO-CNTs-poly3对CO2的吸附量随着温度的增加而增加,所以其等比容曲线斜率为正值。
吸附热的大小反映了吸附质与吸附剂之间相互作用的强弱,从图12可以看出,GO-CNTs以及GO-CNTs-poly3的吸附热随着吸附量的增加均呈下降趋势,说明吸附剂与CO2分子间的相互作用力随CO2在吸附剂表面的聚集而减弱。且GO-CNTs在0.3mmol/g下的吸附热不足21kJ/mol,属于物理吸附的范畴,而GO-CNTs-poly3在1.0mmol/g下的吸附热可达53kJ/mol,与有关报道相似[23],说明GO-CNTs-poly3对CO2的吸附以化学吸附为主。

图11 GO-CNTs以及GO-CNTs-poly3的吸附等比容曲线

图12 GO-CNTs以及GO-CNTs-poly3的等量吸附热曲线
3 结 论
以氧化石墨烯-羧基碳纳米管水溶液为原料,采用葡萄糖酸β内酯为交联促进剂,通过冷冻干燥法制备得到负载有多乙烯多胺的氧化石墨烯-羧基碳纳米管三维多孔材料。该三维材料呈蜂窝状,具有相对规则类似瓦墙的孔道,其比表面积、孔容和平均孔径随多乙烯多胺负载量的增加而逐渐降低。未负载多乙烯多胺的氧化石墨烯-羧基碳纳米管三维多孔材料以物理作用进行CO2吸附,吸附力弱,吸附容量小。引入多乙烯多胺后,通过化学作用实现CO2吸附,吸附量增大数倍。且随多乙烯多胺负载量的增大而显著增大。Freundlich模型能较好的描述氧化石墨烯-羧基碳纳米管三维多孔材料及其多乙烯多胺负载改性产品对CO2的吸附行为。结果表明,制备的负载有多乙烯多胺的三维蜂窝状多孔材料,具有良好的界面特性和CO2的吸附性能。
[1] HOUGHTON J T,DING Y,GRIGGS D J,et al. Climate change 2001:the scientific basis Cambridge[R]. UK:Cambridge University Press,2001.
[2] 韦力,蓝任凯,靖宇,等. 五乙烯六胺(PEHA)改性 MCM-41 的制备及其CO2吸附性能[J]. 化工进展,2011,30(s2):143-148.
[3] AARON D,TSOURIS C. Separation of CO2from flue gas:a review[J]. Separation Science and Technology,2005,40(1/2/3):321-348.
[4] 费维扬,艾宁,陈健. 温室气体 CO2的捕集和分离——分离技术面临的挑战与机遇[J]. 化工进展,2005,24(1):1-4.
[5] KHATRI R A,CHUANG S S C,SOONG Y,et al. Thermal and chemical stability of regenerable solid amine sorbent for CO2capture[J]. Energy & Fuels,2006,20(4):1514-1520.
[6] SIRIWARDANE R V,SHEN M S,FISHER E P,et al. Adsorption of CO2on molecular sieves and activated carbon[J]. Energy & Fuels,2001,15(2):279-284.
[7] Na B K,KOO K K,EUM H M,et al. CO2recovery from flue gas by PSA process using activated carbon[J]. Korean Journal of Chemical Engineering,2001,18(2):220-227.
[8] LEE J S,KIM J H,KIM J T,et al. Adsorption equilibria of CO2on zeolite 13X and zeolite X/activated carbon composite[J]. Journal of Chemical & Engineering Data,2002,47(5):1237-1242.
[9] MILLWARD A R,YAGHI O M. Metal-organic frameworks with exceptionally high capacity for storage of carbon dioxide at room temperature[J]. Journal of the American Chemical Society,2005,127(51):17998-17999.
[10] SUN H,XU Z,GAO C. Multifunctional,ultra-flyweight,synergistically assembled carbon aerogels[J]. Advanced Materials,2013,25(18):2554-2560.
[11] SUI Z Y,CUI Y,ZHU J H,et al. Preparation of three-dimensional graphene oxide-polyethylenimine porous materials as dye and gas adsorbents[J]. ACS Applied Materials & Interfaces,2013,5(18):9172-9179.
[12] ALHWAIGE A A,AGAG T,ISHIDA H,et al. Biobased chitosan hybrid aerogels with superior adsorption: role of graphene oxide in CO2capture[J]. RSC Advances,2013,3(36):16011-16020.
[13] 吕伟,杨全红,康飞宇. 碳质吸附剂对CO2的吸附、捕集和分离[J]. 化工进展,2009,28(6):1054-1058.
[14] YE Q,JIANG J,WANG C,et al. Adsorption of low-concentration carbon dioxide on amine-modified carbon nanotubes at ambient temperature[J]. Energy & Fuels,2012,26(4):2497-2504.
[15] ZHAO Y,DING H,ZHONG Q. Preparation and characterization of aminated graphite oxide for CO2capture[J]. Applied Surface Science,2012,258(10):4301-4307.
[16] XU Z,SUN H,ZHAO X,et al. Ultrastrong fibers assembled from giant graphene oxide sheets[J]. Advanced Materials,2013,25(2):188-193.
[17] GAO C,VO C D,JIN Y Z,et al. Multihydroxy polymer-functionalized carbon nanotubes: synthesis,derivatization,and metal loading[J]. Macromolecules,2005,38(21):8634-8648.
[18] JIN K,ZHANG T,JI J,et al. Functionalization of MCM-22 by dual acidic ionic liquid and its paraffin absorption modulation properties[J]. Industrial & Engineering Chemistry Research,2015,54(1):164-170.
[19] FERRARI A C,MRYER J C,SCARDACI V,et al. Raman spectrum of graphene and graphene layers[J]. Physical Review Letters,2006,97(18):187401.
[20] MOHIUDDIN T M G,LOMBARDO A,NAIR R R,et al. Uniaxial strain in graphene by Raman spectroscopy:G peak splitting,Grüneisen parameters,and sample orientation[J]. Physical Review B,2009,79(20):205433.
[21] KRUK M,JARONIEC M. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials[J]. Chemistry of Materials,2001,13(10):3169-3183.
[22] LEE S Y,PARK S J. A review on solid adsorbents for carbon dioxide capture[J]. Journal of Industrial and Engineering Chemistry,2015,23:1-11.
[23] SU F,LU C,KUO S C,et al. Adsorption of CO2on amine-functionalized Y-type zeolites[J]. Energy & Fuels,2010,24(2):1441-1448.
Preparation of three-dimensional honeycomb-like material of graphene oxide -carboxylated carbon nanotube-polyethylenepolyamine to adsorb CO2
HU Hangbiao,ZHANG Tao,CUI Zheng,TANG Shengwei
(College of Chemical Engineering,Sichuan University,Chengdu 610065,Sichuan,China)
Using graphene oxide and carboxylated carbon nanotube as base material and gluconic acid β lactone as crosslinking promoter,we prepared a three-dimensional(3D)porous aerogel material functionalized by polyethylenepolyamine(PEPA)with a freeze-drying method. The PEPA loading was adjusted by changing the PEPA dosage. The as-synthesized 3D porous aerogel material were characterized by FTIR,XRD,TG,SEM,XPS,Raman and N2adsorption-desorption. The results indicated that PEPA was grafted by an amide bond between PEPA and graphene oxide. The 3D porous material had a honeycomb like-appearance. The specific surface area,pore volume and average pore size were decreased with increasing PEPA loading. The adsorption of CO2on the 3D honeycomb-like material was based on a mechanism of chemisorption. At 200kPa and 328K,the CO2adsorption capacity on the 3D porous material with a PEPA content of 55.8% reached up to 3.9mmol/g,which was 9.8 times to that on the aerogel without PEPA loading. The results showed that crosslinking polyethylenepolyamine with graphene oxide sheet and carboxylated carbon nanotube to prepare 3D porous aerogel material effectively improved the CO2adsorption capacity.
nanomaterials;carbon dioxide;gels;adsorption
TQ 424.29
A
1000-6613(2016)11-3576-09
10.16085/j.issn.1000-6613.2016.11.029
2016-03-04;修改稿日期:2016-03-20。
国家自然科学基金项目(21276163、21576168)。
胡航标(1991—),男,硕士研究生。联系人:唐盛伟,教授。E-mail tangdynasty@scu.edu.cn。
