发芽及提取条件对大麦麦芽根中核酸酶活性的影响
2016-11-12刘馨予杨洋朱思齐秦阳李新张洪微高玉荣崔素萍
刘馨予,杨洋,朱思齐,秦阳,李新,张洪微,高玉荣,崔素萍
(黑龙江八一农垦大学食品学院,大庆 163319)
发芽及提取条件对大麦麦芽根中核酸酶活性的影响
刘馨予,杨洋,朱思齐,秦阳,李新,张洪微,高玉荣,崔素萍
(黑龙江八一农垦大学食品学院,大庆163319)
为了从大麦芽根中制备高活性的核酸酶,以麦芽根及成品麦芽根中核酸酶活性为指标,确定了内蒙垦大麦和澳洲大麦的最佳发芽条件。在此基础上,研究了麦芽根中核酸酶的提取条件对核酸酶活性的影响。结果表明:最佳发芽条件是25℃,发芽64 h时,内蒙垦和澳洲麦芽根中核酸梅的活性最高分别为316.7 U·mL-1,364.5 U·mL-1。麦芽根长度为大麦种子1~1.5倍时,澳洲和内蒙垦大麦酶活性最高分别为353.8 U·mL-1,321.0 U·mL-1。60目的麦芽根粉,在浸提温度50℃,pH 5.1,料液比为1∶12,成品麦芽根酶活性最高为543.6 U·mL-1。研究为麦芽根中核酸酶的进一步应用提供了理论基础。
大麦;发芽;麦芽根;核酸酶;酶活力
5′-磷酸二酯酶(Exonuclease)是一种能将单链DNA和RNA水解为5′-核苷酸的核酸水解酶。该酶可以通过动物、植物微生物发酵获得。不同来源的5′-磷酸二酯酶,可能具有不同的分子结构及催化性能[1,2]。目前,核酸酶可用作食品添加剂、生化药物、在农业上可作为植物生长剂[3],在饲料上用做安全高效的添加剂[4]。朱政斌[5]从麦芽根中分离得到了5′-磷酸二酯酶,采用戊二醛为交联剂,将该酶固定到壳聚糖上,用于酵母RNA的催化水解,以制备5′-核苷酸。研究了酶固定化反应的影响因素,在最适条件下,酶活回收率可达53.6%。喻晨[6]通过部分析因试验设计(FFD)、中心组合实验设计(CCD)和响应面分析法(RSM)对桔青霉产核酸酶P1培养基进行优化研究,优化后的培养基发酵酶活力达到563 U·mL-1,比原培养基(202 U·mL-1)提高了64%。但发酵制备磷酸二酯酶的生产过程复杂,且成本较高。如能利用大麦麦芽根中的磷酸二酯酶,可以提高麦芽根的利用率[7],同时减少桔青酶发酵废液的排放,对环境保护和降低成本都具有重要的意义。李祥[8]通过正交试验确定了从麦芽根中提取5′-磷酸二酯酶的最佳工艺条件,5′-磷酸二酯酶活力达到了160 U·mL-1。Beluhan等[9]从麦芽根中提取了一种碱性5′-磷酸二酯酶,提纯后的5′-磷酸二酯酶的酶活达到了30 U·mL-1。
低嘌呤食品的研制为痛风病人摄入均衡的营养具有一定的意义[10]。麦芽根是麦芽生产啤酒过程中生成的主要副产物,含有丰富的磷酸二酯酶,如果能够将麦芽根粉碎后添加到含有高嘌呤的食品中,直接利用麦芽根中的核酸酶水解食品中的核酸,将核酸降解为嘌呤碱和嘧啶碱[11],然后利用吸附剂吸附核酸碱基,从而降低食品中嘌呤含量,对于研制适合于痛风患者食用的高蛋白低嘌呤食品,具有一定的应用价值。
1 材料与方法
1.1材料与仪器
内蒙垦大麦、澳洲大麦及成品麦芽根,均由北大荒农垦麦业提供。
核糖核酸,Sigma公司产品,为生化试剂;钼酸铵、高氯酸、醋酸钠、醋酸、硫酸锌、磷酸二氢钾、磷酸氢二钾均为分析纯级试剂。
DK-S24电热恒温水浴锅,上海森信实验仪器有限公司;SPECORD 210 PLUS紫外可见分光光度计,德国耶拿分析仪器股份公司;TD5A-WS台式低速离心机,湖南湘仪实验室仪器开发有限公司;FW-80万能粉碎,北京市永光明医疗仪器厂;Seven Multi(S40)pH计,瑞士METTLER TOLEDO;DR9082型电热恒温恒湿培养箱,上海森信实验仪器有限公司;CP313电子天平,奥豪斯仪器有限公司。
1.2试验方法
1.2.1大麦的发芽处理
大麦的发芽方法按QB/T3691-1999(箱式大麦发芽系统)方法进行,具体做法如下:
分别挑选金黄色的、颗粒饱满、大小均匀、无虫蛀的优质大麦,用清水洗5遍,去除杂质。取100 g大麦,放入500 mL烧杯中加水浸泡,水面高于麦粒10~ 15 cm,水温15~30℃,浸泡1 h;然后将水温升到26~35℃,继续浸泡30 min,沥出水分,时隔6 h后将麦芽再次浸入约30℃水中,浸泡30 min,反复2次,麦粒增重大约40%~50%。将浸水后的大麦放入铺有湿纱布的托盘中,放入恒温恒湿培养箱时为发芽0 h,温度设为15~30℃,然后每隔4 h淋水1次,每隔8~12 h翻1次。将发芽好的麦芽根剪下放入托盘中,可以自然风干;若人工风干可将其放在烘干箱中:初期为35~40℃、5 h,再逐渐升高温度≤50℃、7 h,即可得到麦芽根。
1.2.2麦芽根中核酸酶活性的研究
1.2.2.1发芽温度与发芽时间对核酸酶活性的影响
大麦发芽温度分别设为15、20、25、30℃,从发芽40 h开始(在发芽40 h之前大麦先长苗,随之长根,根部生长不完全,故在40 h之后开始测核酸酶活性。)每隔6 h检测1次麦芽根中核酸酶活性。
1.2.2.2麦芽根长度与核酸酶活性的关系
从发芽40 h开始,分别取麦芽根长度为种子长度的1至1.5倍、1.5至2倍及2至2.5倍的发芽大麦,测定麦芽根核酸酶活性。
1.2.2.3核酸酶活力测定方法
采用Prentice[12]方法测定核酸酶活力。用0.1 mol·L-1pH 5.0醋酸盐缓冲液溶解底物RNA,使底物质量浓度为1%。取1 mL底物溶液放置于30℃水浴中保温,待温度达到平衡后,加入已恒温(30℃)的酶液1 mL,立刻混匀后计时,反应10 min后取出试管,置于冰浴中震荡,然后在反应体系中加入1 mL沉淀剂(0.25%钼氨酸溶于25%高氯酸溶液中),并在冰浴中保持15 min后过滤,取滤液稀释至合适倍数后于260 nm比色,空白试验先加沉淀剂。
酶活计算公式:
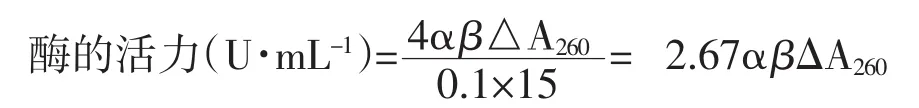
其中α-原酶液的稀释倍数,β-离心清液的稀释倍数,ΔA260-测定的吸光值。
1.2.3麦芽根中核酸酶提取研究
1.2.3.1麦芽根粉粒度与核酸酶活性的关系
将发芽温度为25℃,发芽时间为64 h的两种大麦发芽制备的麦芽根及成品麦芽根粉碎,分别过40、60、80、100目筛。将2.0 g不同目数的麦芽根粉分别放入三角瓶中,分别加入20 mL pH5.1醋酸缓冲液(含0.1 mol·L-1ZnSO4),放入50℃水浴锅中恒温2 h提取,过滤得澄清粗酶液,分别测定核酸酶活性。
1.2.3.2水浴温度对核酸酶活性的影响
取细度为60目,25℃下发芽64 h的麦芽根粉及成品麦芽根粉,分别加入pH5.1的醋酸缓冲液(含0.1 mol·L-1ZnSO4)中,分别在20、30、40、50、60℃水浴30 min,然后对其分别进行过滤,取得澄清酶液,分别测定核酸酶活性。
1.2.3.3料液比对核酸酶活性的影响
称取60目、发芽时间为64 h、发芽温度为25℃自制及成品麦芽根粉2 g,分别加入12、16、20、24、28 mL的pH 5.1醋酸缓冲液(含0.1 mol·L-1ZnSO4),水浴温度50℃进行酶液提取,过滤得澄清酶液,分别测定其核酸酶活性。
1.2.3.4正交试验
通过对麦芽根粉细度、提取温度、料液比等单因素的研究,确定正交试验因素及水平。
1.2.4数据处理
每个处理做三次重复,利用SPSS12.0分析系统对数据进行统计分析。
2 结果与分析
2.1麦芽根中核酸酶活性的研究
2.1.1发芽温度和时间对麦芽根核酸酶活性的影响
内蒙垦大麦和澳洲大麦麦芽根核酸酶活性与发芽温度的关系见图1及图2。

图1 不同发芽温度和时间内蒙垦大麦麦芽根核酸酶活力Fig.1Nuclease activity of Nei Meng ken barely malt root at different germination temperature and germination time

图2 不同发芽温度和时间澳洲大麦麦芽根核酸酶活力Fig.2Australia germinated barley malt roots nuclease activity at different temperature and germination time
由图1、图2可知,在不同发芽温度和时间下,麦芽根中核酸酶活性均有不同。发芽时间为64 h时,不同发芽温度的内蒙垦麦芽根及澳洲麦芽根核酸酶活力均最高,且差异显著(P<0.01)。在发芽温度为25℃,发芽时间为64 h时,内蒙垦麦芽根及澳洲麦芽根核酸酶活力最高分别为316.7 U·mL-1和364.5 U·mL-1。原因可能是温度过低不利于大麦发芽,故酶活性较低;而温度过高,大麦呼吸作用加快,CO2在麦层中的浓度升高,抑制了麦芽生长;另外原因可能是过高温度不利于核酸酶合成[13]。
2.1.2麦芽根长度与核酸酶活性的关系
麦芽根长度与核酸酶活性关系见表1。

表1 麦芽根长度与核酸酶活性的关系Table 1Correlations between malt root length and nuclease activity
由表1可以看出,麦芽根长度为大麦种子本身长度1~1.5倍,有嫩黄色的苗长出时,核酸酶活性最强。其中澳洲大麦麦芽根酶活最高可达353.8 U·mL-1,内蒙垦大麦麦芽根酶活最高可达321.0 U·mL-1。当顶部长出绿色麦芽时,核酸酶活性开始有明显降低,并在后期发芽生长过程中核酸酶活力较为恒定,没有大幅度变化。
2.2麦芽根中核酸酶提取研究
2.2.1麦芽根粉细度与核酸酶活性的关系
麦芽根粉细度与核酸酶活性关系图3。

图3 麦芽根粉细度与核酸酶活性的关系Fig.3Correlations between size of malt root powder particle and nuclease activity
由图3可以看出,三种麦芽根粉细度在60目时,麦芽根中核酸酶活性均最高,且差异显著(p<0.01);不同细度成品麦芽根中核酸酶的活性都明显(p<0.01)高于其他两种发芽麦芽根中核酸酶的活性,成品麦芽根粉为60目时,活性最高为513.3 U·mL-1。麦芽根粉细度过高或过低,核酸酶的活性降低,这可能是由于在粉碎的过程中,粉碎颗粒过小,破坏了麦芽根细胞的组织结构,使酶充分暴露在空气中,酶被氧化失活导致的;颗粒过大,核酸酶在提取液中并没有得到充分溶出,有效的酶浓度降低。由此可见,麦芽粉细度并不是越高越有利于酶活性的提高[12]。
2.2.2提取温度对核酸酶活性的影响
提取温度对核酸酶活性影响见图4。
由图4可知,提取温度对核酸酶活性影响较大,在20~50℃范围内,随着温度升高,提取液中酶活随之升高。同一温度条件下,成品麦芽根酶活力均最高。50℃时,提取液中核酸酶活性达到最大值,其中成品麦芽根活性可达438.2 U·mL-1。当温度低于或高于50℃时,核酸酶活性下降,这可能是核酸酶的最适反应温度是50℃左右,偏离酶促反应最适温度使得部分酶失去活性造成酶活降低[14]。
2.2.3料液比对核酸酶活性的影响
料液比对核酸酶活性影响见图5。
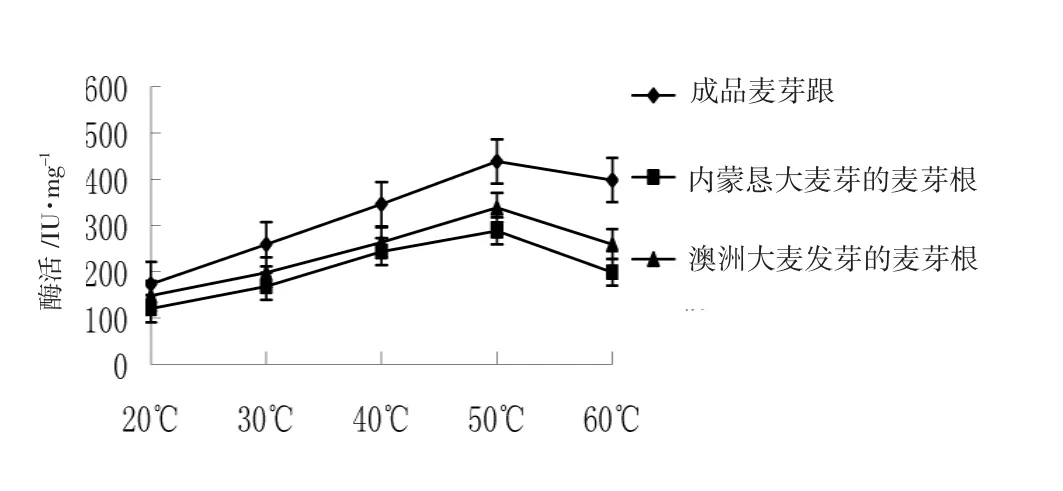
图4 提取温度对核酸酶活性的影响Fig.4Effect of the extraction temperature on nuclease activity
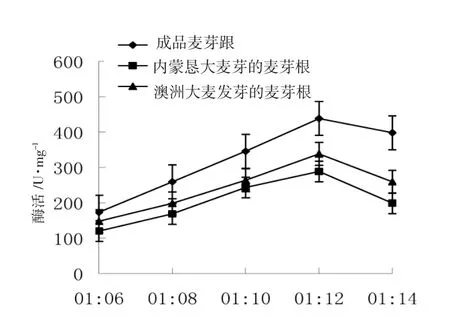
图5 料液比对核酸酶活性的影响Fig.5Effect of the ratio of material to liquid on nuclease activity
由图5可以看出,料液比1∶12时,三种麦芽根核酸酶活性均明显最高;与其他两组比较,成品麦芽根酶活力最高为228.9 U·mL-1。这可能是由于过低料液比可能会导致麦芽根核酸酶溶出不完全。所以,料液比为1∶12最宜,这与郭建华[13]研究结果一致,成品中麦芽根核酸酶活性最高,为228.9 U·mL-1。
通过以上单因素实验结果可知,成品麦芽根核酸酶活性比自制发芽麦芽根核酸酶活力高。因此,将成品麦芽根进行三因素三水平正交试验,确定最佳试验条件。其中,考虑到核酸酶提取时,过高的料液比,会导致酶的回收和废液处理比较困难,正交试验中最高的料液比定为1∶12。正交设计及正交试验结果见表2与表3。
通过极差分析得出,影响核酸酶活性的因素主次顺序是提取温度>细度>料液比,由k值分析得出的组合为A2B2C3,即提取温度50℃,麦芽根粉细度60目,料液比1∶12,核酸酶的活力为543.6 U·mL-1。

表2 正交试验因素与水平表Table 2Factors and levels of orthogonal experiment

表3 正交试验结果Table 3Results of orthogonal experiment
3 讨论
麦芽根中酶类非常丰富,应用价值很高,特别是其中的磷酸二酯酶,因此,麦芽根常被用于提取5'-磷酸二酯酶[15-17]。因此,利用麦芽根中较高的核酸酶活性,可将麦芽根粉用到其他领域中,例如,将其添加到饲料中,促进动物的生长发育;另外,将少量的麦芽根粉添加到含有高嘌呤的食物中,利用麦芽根中核酸酶对食物中嘌呤进行水解,再用吸附剂吸附嘌呤,制备低嘌呤食物,可以提供给痛风人群食用,这样既可以提高啤酒发芽大麦副产物麦芽根的利用率,而且还增加了经济效益[18]。
4 结论
以内蒙垦大麦、澳洲大麦及成品麦芽根为材料,研究了发芽条件,发芽长度、麦芽根粉细度、提取温度、料液比核酸酶活力关系。通过单因素实验研究结果表明,麦芽根中含有较高活性的核酸酶,成品麦芽根中核酸酶活力最高。正交试验的结果表明成品麦芽根粉碎后过60目的筛子,在提取温度为50℃,料液比为1∶12,成品麦芽根活力最高为543.6 U·mL-1。
在后续研究工作中,将把粉碎为60目的成品麦芽根粉,按一定比例添加到脱脂豆粕粉中,利用麦芽根粉中核酸水解酶水解脱脂豆粕粉中的核酸,然后用吸附剂吸附并去除核酸水解后产生的嘌呤碱基,制备低嘌呤脱脂大豆粉。
[1]华杰. 固定化酶膜反应器藕合错流萃取色谱制备5 ′- 核苷酸[D]. 长沙:中南大学,2011.
[2]冯芳,赵祥颖,刘建军. 核苷酸对机体作用及开发利用前景[C]/ /.全国第三届功能性生物制品生产与应用技术交流会论文集. 乌鲁木齐:中国发酵工业协会,2008.
[3]廖明义,陈雯莉. 桔青酶发酵制备核酸酶P1的发酵动力学研究[J]. 食品工业科技,2012,33(3):180-182.
[4]宋春玲,计成,王永杰. 外源核苷酸在畜禽生产中的营养研究进展[J]. 中国畜牧兽医,2005,32(1):10-13.
[5]朱政斌,华杰,许怡学. 麦芽根中5'-磷酸二酯酶的分离提纯及其固定化[J]. 湖南理工学院学报,2013,26(4):61-65.
[6]喻晨,张亚雄,赵劼.响应面法优化桔青霉产核酸酶P1培养基[J]. 食品科学,2011,32(17):283-286.
[7]刘春红.锦灯笼种子油超临界CO2萃取及脂肪酸成分GC/MS分析[J].长春大学学报,2011,21(8):55-56.
[8]李祥. 5′-磷酸二酯酶的制备及其在酵母抽提物生产中的应用[J].中国调味品,2000(4):12-14.
[9]Beluhan S,Karmelic I,Novak S,et al. Partial purification and biochemical characterization of alkaline 5'-phosphodiesterase from barley malt sprouts [J]. Biotechnology Letters,2003,25(1):99-103.
[10]谢微,车康,张丽萍,等. 低嘌呤脱脂豆腐粉凝固剂凝固效果研究[J]. 黑龙江八一农垦大学学报,2012,24(2):71-75.
[11]商曰玲. 啤酒酿造过程中嘌呤含量的变化研究[D]. 泰安:山东农业大学,2009.
[12]Prentice N.Characterization of a nuclease from Malted Barley Roots[J]. Journal of Cereal Science,1987(2):175-187.
[13]郭建华,孙丽华,刘晓兰,等. 利用发芽大麦提取5'-磷酸二酯酶的初步研究[J]. 中国调味品,2010,12(35):32-46.
[14]左锋,怀宝东,李佩然. 耐热丝氨酸蛋白酶改性大豆分离蛋白分散性条件研究[J].黑龙江八一农垦大学学报,2014,26(4):66-70.
[15]Jie Hua,Ke-long Huang. Preparation and Characterization of 5′-Phosphodiesterase from Barley Malt Rootlets[J]. Natural Product Communications,2010,5(2):265-268.
[16]Jie Hua,Ke-long Huang. A reversed phase HPLC method for the analysis of nucleotides to determine 5'-PDE enzyme activity[J]. Bulletin of the Chemical Society of Ethiopia,2010,24(2):167-174.
[17]Anand J D,Rekha S S. 5′-Phosphodiesterase(5′- PDE)from germinated barley for hydrolysis of RNA to produce flavour nucleotides[J]. Bioresource Technology,2003,88(3):245-250.
[18]徐礼鹏,吴正奇,万端极. 超滤膜纯化麦芽根中5'-磷酸二酯酶的工艺研究[J]. 食品科技,2013,38(5):241-243.
Effect of Gemination and Extraction Conditions on the Nuclease Activity of Barely Malt Root
Liu Xinyu,Yang Yang,Zhu Siqi,Qin Yang,Li Xin,Zhang Hongwei,Gao Yurong,Cui Suping
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319)
The optimum germination conditions of Nei Meng ken barley and Australia barley were ascertained by using the nuclease activity of malt root and malt root product as index in order to prepare highly active nuclease from barley malt root.Then,the effect of nuclease extraction conditions of barly malt root on the nuclease activity was studied.The results showed that the best germination temperature was 25℃,germination time was 64 h,the highest nuclease activity in Nei Meng ken barley and Australia barley malt root was316.7 U·mL-1,364.5 U·mL-1,respectively.As the length of barley malt root was 1~1.5 times than that of barely seeds,the highest nuclease activity in Nei Meng ken barley and Australia barley malt root was 353.8 U·mL-1,321.0 U·mL-1,respectively.When the size of malt root powder particle was 60 mesh sieve,the nuclease extraction temperature was 50℃,pH5.1,material/liquid ratio was 1∶12,malt root product nuclease activity was 543.6 U·mL-1.It provided theoretical basis for further application of nuclease of barley malt root.
barley;germination;malt root;nuclease;enzyme activity
Q946.5
A
1002-2090(2016)02-0070-06
10.3969/j.issn.1002-2090.2016.02.014
2015-06-19
黑龙江省大学生创新创业训练项目(201310223027);黑龙江省农垦总局科技局项目(HNK125B-13-03);黑龙江省教育厅项目(JG2012010458)。
刘馨予(1987-),女,黑龙江八一农垦大学食品学院2011级硕士研究生。
崔素萍,女,教授,硕士研究生导师,E-mail:cuisup@163.com。
