贝氏贝诺孢子虫巢式PCR检测方法的建立
2016-11-12王文涛仇建华段红常巧呈路义鑫王春仁彭博
王文涛,仇建华,段红,常巧呈,路义鑫,王春仁,彭博
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.东北农业大学动物医学学院)
贝氏贝诺孢子虫巢式PCR检测方法的建立
王文涛1,2,仇建华1,段红1,常巧呈1,路义鑫2,王春仁1,彭博
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.东北农业大学动物医学学院)
根据GenBank上发表的贝氏贝诺孢子虫核糖体内转录间隔区(ITS)序列,在传统PCR方法的基础上设计一对特异性内引物,提取病牛血液中贝氏贝诺孢子虫基因组DNA,建立了贝氏贝诺孢子虫巢氏PCR检测方法并进行临床样品检测。结果表明,建立的巢式PCR检测方法能检测到贝氏贝诺孢子虫DNA的最低浓度为24.3 ag·μL-1,刚地弓形虫、犬新孢子虫、牛巴贝斯虫、环形泰勒虫、边缘无浆体DNA检测均为阴性。196份临床血液样本,检测出3份阳性,阳性率为1.53%。由此可见,研究所建立的巢氏PCR检测方法具有较高的特异性和敏感性,可用于牛贝诺孢子虫病的早期临床诊断。
贝氏贝诺孢子虫;巢氏PCR;检测;核糖体内转录间隔区
牛贝诺孢子虫病(Bovine besnoitiosis),又称牛球孢子虫病(Bovine cutaneous globidiosis)或橡皮病(elephant skin disease),是由住肉孢子虫科(Sarcocystidae)、贝诺孢子虫属(Besnoitia)的贝氏贝诺孢子虫(Besnoitia besnoiti)寄生于牛眼、皮肤和生殖系统等部位引起的一种原虫病[1]。该病主要引起牛皮肤增厚、龟裂,母牛流产、产奶量下降,公牛精液质量下降,严重时引起死亡,给养牛业造成很严重的经济损失[2]。贝氏贝诺孢子虫(Besnoitia besnoiti)1912年首次由Besnoit和Robin在法国南部发现并报道[3],2010年欧盟食品安全委员会(EFSA)将牛贝诺孢子虫病列为重要的新兴疾病[4]。中国的北京、吉林、黑龙江、内蒙古等地有该病流行的报道[1,5-7]。该病的诊断主要依赖于临床症状和病原检查,但此时急性期已过,失去了治疗价值。目前虽然国外也建立了血清学和分子生物学诊断方法,但是抗原或检测时间及其他原因,国内还未见商品化诊断试剂盒。因此,研究拟建立一种牛贝诺孢子虫巢式PCR检测方法,用于牛贝诺孢子虫急性感染和早期诊断,为该病的临床检测、流行病学调查等提供了一种新型的可靠的检测方法。
1 材料与方法
1.1待检材料与对照虫株
待检材料采自黑龙江省大庆市、哈尔滨市、齐齐哈尔市、农垦北安地区的奶牛群,无菌采集外周血样196份,-20℃保存;贝诺孢子虫DNA由黑龙江八一农垦大学预防兽医实验室保存,对照虫株刚地弓形虫、犬新孢子虫、牛巴贝斯虫、环形泰勒虫和边缘无浆体DNA由国内兄弟院所惠赠。
1.2主要试剂
全血DNA使用TIANamp Genomic DNA Kit试剂盒提取,按照使用说明操作;Ex Taq DNA聚合酶、pMD18-T载体、dNTP mixture(25 mmol each)、DNA Marker等为大连宝生物(Takara)公司产品;其余常规试剂为进口或国产分析纯产品;制备感受态细胞所用的菌种大肠杆菌JM109由黑龙江八一农垦大学寄生虫研究室保存。
1.3引物设计
对GenBank上发表的贝氏贝诺孢子虫ITS基因序列进行比对,寻找到保守区间设计引物。根据相关研究选择(B1:5'-TGA CAT TTA ATA ACA ATC AAC CCT T-3[8]和B2:5'-TCC TCC GCT TAT TGA TAT GC-3[9])作为外引物;应用Oligo 6.0软件设计一对内引物(B3:5'-CCA CCT CCT CAC TCT GCT AT-3,B4:5'-TCC TCT GTG TTC ATT ATT CC-3)。外引物预计扩增片段为1 000 bp,内引物预计扩增片段为400 bp,均由上海生工生物技术服务有限公司合成。
1.4DNA的提取
利用TIANamp Genomic DNA Kit试剂盒,按照使用说明操作提取贝氏贝诺孢子虫基因组DNA。
1.5巢氏PCR扩增
以提取的DNA为模板,利用设计的引物进行扩增,第一轮PCR用外引物B1和B2。反应体系为:10× Ex Taq buffer 2.5 μL,dNTP mixture(2.5 mmol each)2 μL,上、下游引物(25 mM)各0.5 μL,模板DNA 1 μL,Ex Taq(5 U·μL-1)0.2 μL,加水至25 μL。反应条件为94℃5 min,94℃1 min,54.6℃1 min,72℃1 min,35个循环,72℃10 min,-20℃保存。第二轮PCR用内引物B3和B4扩增,以第一轮PCR产物为模板,反应体系为:10×Ex Taq buffer 2.5 μL,dNTP mixture(2.5 mmol each)2 μL,上、下游引物(25 mM)各0.5 μL,模板DNA 1 μL,Ex Taq(5 U·μL-1)0.2 μL,加水至25 μL。反应条件为:94℃5 min,94℃1 min,49.8℃1 min,72℃30 s,35个循环,72℃10 min,-20℃保存。反应结束后,取反应产物5 μL,加入1 μL的6×Loading buffer,混匀后于1%琼脂糖凝胶(EB浓度为5 μg·mL-1)中100 V电压下电泳30 min,使用凝胶成像系统观察并记录结果。
1.6扩增产物的克隆及鉴定
用DNA胶回收试剂盒对PCR产物进行回收与纯化,与pMD18-T于16℃过夜连接,转化感受态细胞JM109,在氨苄抗性平板上筛选出可疑阳性克隆株,送上海生工生物工程公司测序。
1.7特异性实验
以贝氏贝诺孢子虫、刚地弓形虫、犬新孢子虫、牛巴贝斯虫、环形泰勒虫和边缘无浆体总基因组DNA为模板,进行巢氏PCR扩增,同时设阴性对照。
1.8敏感性试验
将测定浓度的贝氏贝诺孢子虫DNA按1∶10连续倍比稀释,分别以不同稀释度DNA为模板进行巢氏PCR扩增,同时设阴性对照。
1.9重复性实验
随机抽取随机3个阳性样品和2个阴性样品,应用建立的巢氏PCR方法进行3次重复扩增。
1.10样品检测
应用所建立的巢氏PCR方法对黑龙江省部分地区196份奶牛血液样品提取DNA并进行检测。
2 结果
2.1目的基因的序列测定
回收的PCR产物与pMD18-T载体连接成功,并转化感受态细胞JM109,对阳性克隆进行测序鉴定,获得800 bp的目的片段,与GenBank收录的贝氏贝诺孢子虫(GenBank NO.AY833646.1)相应片段的同源性为100%。
2.2特异性试验
两轮PCR产物经1.0%凝胶电泳观察,发现只有贝氏贝诺孢子虫在393 bp位置有单一条带,并且与预期的条带相符,其余样品均无条带(图1,2),表明该方法具有良好的特异性。
2.3敏感性实验

图1 贝氏贝诺孢子虫常规PCR特异性检测扩增结果Fig. 1Agarose gel electrophoresis of PCR products of specificity of B.besnoiti samples
单独使用B1/B2引物进行第一轮PCR扩增,在泳道1-7均能扩增出800 bp的单一条带,表明病原检测的最低浓度为24.3 fg·μL-1(图3)。使用引物B3和B4进行第二轮PCR扩增,在泳道1-6均能扩增出393 bp的条带,表明该次检测的病原最低浓度为24.3 ag·μL-1。结果显示,研究的巢式PCR检测灵敏度是单独使用引物B1/B2进行一次PCR扩增检测灵敏度的1 000倍(图4)。

图2 巢式PCR特异性检测扩增结果Fig. 2Agarose gel electrophoresis of nested PCR products of specificity of B.besnoiti samples
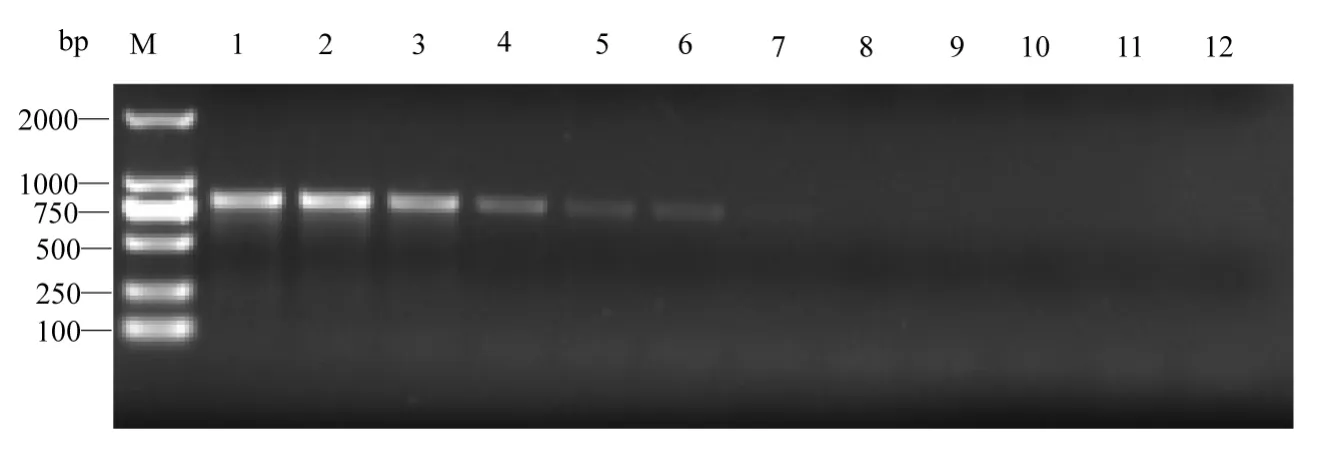
图3 贝诺孢子虫常规PCR敏感性检测扩增结果Fig.3Agarosegel electrophoresis of PCR products of sensitivity of B.besnoiti samples
2.4重复性试验
随机抽取的3份阳性和2阴性样本,用所建立的巢氏PCR方法扩增后,经1%琼脂糖凝胶电泳显示,阳性样本约在393 bp位置处出现了目的基因片段,阴性无条带,重复操作3次后得到的结果完全一致。
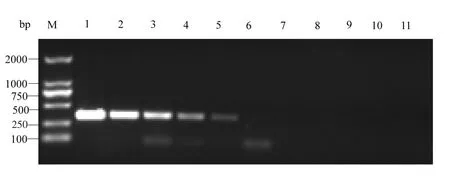
图4 贝诺孢子虫巢式PCR敏感性检测扩增Fig.4Agarose gel electrophoresis of nested PCR products of sensitivity of B.besnoiti samples
2.5临床样品的检测
应用所建立的巢氏PCR方法对黑龙江省部分地区奶牛贝诺孢子虫感染情况进行调查。共检测196份血液样品,结果检出3份阳性样本,感染率为1.53%,但北安地区5个牛场和哈尔滨地区4个牛场均未检出阳性样本,详见表1。检出的3头阳性奶牛均出现了急性或临床症状,有2头还检出了包囊,因此阳性符合率为100%。

表1 黑龙江省部分地区牛贝诺孢子虫的感染情况Table 1The infection of Besnoitia besnoiti at some regions in Heilongjiang Province
3 讨论
与其它重要的寄生虫如弓形虫、疟原虫、锥虫等相比,目前对贝诺孢子虫病的研究还停留在初级阶段,尤其近几年以来该病在世界范围内又出现再次爆发的现象,欧盟食品安全委员会(EFSA)认为该病是“新兴的疾病”[4],尽管每年采取扑杀病牛的措施,但仍然无法根治该病。我国的黑龙江省部分地区也有再次出现的迹象,给畜牧业造成很大损失。所以建立一种快速、敏感、特异的诊断方法,用于病畜筛选和流行病学调查,具有重要意义。
目前对牛贝氏贝诺孢子虫的实验室诊断方法主要有病原学检查、血清学检查和分子生物学诊断。病原学诊断学方法是通过观察包囊内的缓殖子以及血液中的速殖子形态结合临床症状进行诊断;血清学方法主要有间接免疫荧光试验(IFA)、酶联免疫吸附试验(ELISA)和免疫印迹(Western Blot)等方法[2],但这些方法应用的抗原都是贝诺孢子虫的虫体抗原,不利于大规模生产。国外虽然也建立了荧光定量PCR检测牛贝诺孢子虫方法[10-11],但也仍然处于研究阶段,还未见商品用诊断试剂盒。本研究所建立的牛贝诺孢子虫巢式PCR诊断方法DNA来源于血液,血液中速殖子的出现要远远早于皮肤包囊,因此该诊断方法具有早期的特点。同时巢式PCR诊断方法不但提高了PCR反应的特异性,同时也提高了反应的敏感性,检测最低浓度为24.3 ag·μL-1,比普通PCR的敏感性高达1 000倍,适合用来检测病牛感染初期较低拷贝数的模板。因此,研究所建立的巢氏PCR诊断方法具有快速、敏感、特异等优点,适合对牛贝诺孢子虫病的早期诊断。
[1]胡力生,段自芳,湛万山,等. 牛球孢子虫病三例报告[J].吉林畜牧兽医,1981(5):4.
[2]lvarez-Garc G,Frey CF,Mora LMO,et al.A century of bovine besnoitiosis:an unknown disease re-emerging in Europe[J].Trends in Parasitology,2013,29,407-415.
[3]Besnoit C,Robin V. Sarcosporidiose cutanée chez une vache[J]. Revue vétérinaire,1912,37:649-663.
[4]European Food Safety Authority (EFSA). Bovine Besnoitiosis:An emerging disease in Europe [J]. European Food Safety Authority EFSA Journal,2010(2):1499.
[5]刘尔翔. 在北京牛体内发现的贝氏贝诺孢子虫[J]. 动物学报,1957(3):212-220.
[6]柳春华,杨毅昌,于亚强,等. 大庆地区发生奶牛贝诺孢子虫病的报告[J]. 黑龙江畜牧兽医,1992(1):30-33.
[7]刘文多,王祥生. 哲盟地区牛球孢子虫病“厚皮病”的调查研究[J]. 中国兽医杂志,1982(9):10-12.
[8]Cortes H C E,Reis Y,Gottstein B,et al. Application of conventional and real-time fluorescent ITS1 rDNA PCR for detection of Besnoitia besnoiti infections in bovine skin biopsies[J]. Veterinary Parasitology,2007,146(3):352-356.
[9]Schares G,Maksimov A,Basso W G. et al.Quantitative real time polymerase chain reaction assays for the sensitive detection of Besnoitia besnoiti infection in cattle[J]. Veterinary Parasitology 2011,178:208-216.
Establishment of Nested PCR Method for Besnoitia besnoiti
Wang Wentao1,2,Qiu Jianhua1,Duan Hong1,Chang Qiaocheng1,Lu Yixin2,Wang Chunren1,Peng Bo
(1.College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Veterinary Medicine,Northeast Agricultural University)
Based on the ITS rDNA sequence of Besnoitia besnoiti available in GenBank,two specific PCR primers were designed. Total genomic DNA for B.besnoiti was isolated from blood samples of the sick dairy cow,and the nested PCR method for B.besnoiti was established to detect clinical samples.The results showed that using the nested PCR method,the minimum detectable concentration was 24.3 ag·μL-1,and Toxoplasma gondii,Neospora caninum,Babesia bovis,Theileria annulata and Anaplasmataceae marginal pathogens were negative.The positive rate of B.besnoiti was 1.53%in 196 blood samples.The nested PCR method in this study had high sensitivity and specificity and could be used for early diagnosis of Bovine besnoitiosis.
Besnoitia besnoiti;nested PCR;detection;ITS rDNA
Q78
A
1002-2090(2016)02-0045-05
10.3969/j.issn.1002-2090.2016.02.009
2015-09-15
黑龙江省科技攻关项目(GZ13B001);黑龙江省农垦总局科技攻关项目(HNK125B-11-4);大庆市科技局计划项目(SZDFY-2015-21);黑龙江省动物普通疾病防治重点实验室开放课题(120101)。
王文涛(1987-),女,黑龙江八一农垦大学动物科技学院2012级硕士研究生。
王春仁,男,教授,博士研究生导师,E-mail:chunrenwang@sohu.com。
