蓝莓酒渣花色苷提取工艺的研究
2016-11-12王超刘文静郭德军徐婉蒙王成玉李丹丹阮长青
王超,刘文静,郭德军,徐婉蒙,王成玉,李丹丹,阮长青
(黑龙江八一农垦大学食品学院,大庆 163319)
蓝莓酒渣花色苷提取工艺的研究
王超,刘文静,郭德军,徐婉蒙,王成玉,李丹丹,阮长青
(黑龙江八一农垦大学食品学院,大庆163319)
为探究大兴安岭野生蓝莓酒渣中的生物活性成分,以乙醇为提取剂,考察了乙醇浓度、盐酸浓度、料液比、提取时间和提取温度对蓝莓酒渣花色苷提取量的影响,并通过正交实验优化提取条件。结果表明:在乙醇浓度为40%,盐酸浓度为0.1%,提取温度为30℃,提取时间为1 h,料液比为1∶40时为最佳提取条件,此条件下蓝莓酒渣中花色苷含量为3.03 mg·g-1,粗提物经浓缩冻干后为黑色粉末,得率为22.1%,花色苷纯度为1.37%。通过实验可知野生蓝莓酒渣中含有大量花色苷等活性物质,对蓝莓酒渣进行萃取可减少废物排放,提高蓝莓鲜果资源的综合利用率,并为工业化生产提供指导。
野生蓝莓;酒渣;花色苷;提取
蓝莓(blueberry)是一种具有较高经济价值的越橘类浆果,其中除含有常规的糖、蛋白质、膳食纤维外,还富含各种维生素以及铁、锰、锌等微量元素[1-2]。同时,其还含有大量的抗氧化活性物质(如黄酮类、花色苷、多酚类化合物),具有促进视红素再合成、提高免疫力、抗衰老、抗癌等多种生理功效,因此被国际粮农组织列为人类5大健康食品之一[3-6]。
蓝莓已广泛应用于饮料、酿酒等食品行业,但其残渣仍含有大量有效成分未被利用,特别是其中花色苷等多酚物质的开发和利用尚未引起关注。研究发现,蓝莓加工果酒后的残留物,最多可占鲜果重量的20%[7]。其中,花色苷是蓝莓酒渣中主要的活性成分,含量丰富,酿酒过程对花色苷的抗氧化和清除自由基活性影响很小,如果将这一资源加以综合利用,就会大大提高蓝莓产业的经济效益[8]。
目前,蓝莓中花色苷的提取方法常见的有溶剂提取法[9]、超声提取法[12]、微波提取法[10]、酶解法[11]、超临界流体萃取法[14]等。其中溶剂提取法中水提法成本低,但提取率很低;超临界流体萃取法对设备要求较高,生产成本高;超声提取法不适合大规模生产[12-14]。针对国内蓝莓酒渣废弃物未得到有效利用这一问题,探究大兴安岭野生蓝莓酒渣中花色苷的提取方法,并优化提取工艺条件,为蓝莓酒渣中生物活性成分的基础研究以及产品的工业化生产提供指导。
1 材料与方法
1.1试验材料
野生蓝莓酒渣:蓝莓酒发酵后废弃的酒渣,经40℃干燥粉碎过60目筛后4℃冷藏备用。
矢车菊素-3-O-葡萄糖苷,中国科学院成都生物研究所。甲醇,无水乙醇,丙酮,浓盐酸,柠檬酸,乙酸,氯化钾,三水合醋酸钠,以上试剂均为分析纯。
1.2试验主要仪器和设备
722s可见光分光光度计,上海精密科学仪器有限公司制造;SHZ-C水浴恒温振荡器,金坛市荣华仪器制造有限公司;旋转蒸发器,上海亚荣生化仪器厂;ALPHA1-2 LD plus冷冻干燥机,德国Christ公司。
2 试验条件和方法
2.1试验设计与方法
2.1.1提取工艺流程
蓝莓酒渣→40℃烘干至恒重→粉碎过60目筛→提取液提取→过滤→滤液定量测定。
取一定量的蓝莓酒渣粉在不同条件下提取,提取液过滤后定容到一定体积,稀释一定倍数后,用pH示差法测量花色苷吸光值,计算其提取量。
2.1.2蓝莓酒渣粗提物得率计算公式

公式(1)式中:a:蓝莓酒渣粗提物得率;m1:粗提物质量,g;m2:蓝莓渣质量,g。
2.1.3蓝莓酒渣中花色苷纯度计算公式

公式(2)式中:b:蓝莓酒渣粗提物中花色苷纯度;m1:粗提物质量,g;m3:粗提物中花色苷含量,mg。
2.1.4花色苷的测定
研究采用的检测方法是分光光度法,由于植物提取物在520 nm处除了花色苷外还有许多物质都在下存在吸收,所以本实验采用pH示差法来消除其他物质的干扰[15],并根据李安文[16]的方法进行改进,分别各量取样品1 mL 2份,分别加入pH 1.0和pH 1.5的缓冲液至10 mL,在520 nm和700 nm的条件下,检测得到pH值为1.0和4.5时的两组4个吸光度值A1、A2、A3、A4。
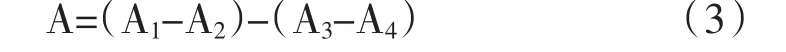
式中:A1、A2分别为pH 1.0和pH 4.5下520 nm的吸光度;
A3、A4分别为pH 1.0和pH 4.5下700 nm的吸光度。
通过公式(3)计算得到花色苷的吸光值A,根据标准曲线y=11.284x+0.008(R2=0.999 5)计算花色苷的提取量。
2.1.5花色苷的提取量
花色苷提取量(mg/g)=(C×Df×V)/m(4)
公式(4)式中:C:粗提液花色苷浓度,mg·ml-1;Df:稀释倍数;V:提取液的总体积,mL;m:蓝莓酒渣质量,g。
2.1.6提取工艺单因素试验
(1)提取剂种类对提取花色苷的影响
分别选择水、甲醇、乙醇、丙酮作为提取剂,加入0.2%的盐酸进行酸化,在30℃,料液比1∶20,转速200 r·min-1的条件下提取l h,过滤后测定花色苷含量,选择最佳提取溶剂。
(2)提取剂浓度对提取花色苷的影响
用0.2%盐酸酸化的0%、20%、40%、60%、80%、100%的最佳溶剂,在30℃,料液比1∶20,转速200 r·min-1的条件下提取1 h,过滤后测定花色苷含量,选择最佳提取剂浓度。
(3)酸种类对提取花色苷的影响
选择最佳浓度的提取剂,分别选择0.2%柠檬酸、乙酸、盐酸作为酸性添加剂,在30℃,料液比1∶20,转速200 r·min-1的条件下提取l h,过滤后测定花色苷含量,选择最佳酸性添加剂。
(4)酸的浓度对提取花色苷的影响
提取剂中分别加入0.00%、0.10%、0.20%、0.30%、0.40%、0.50%适宜的酸,在30℃,料液比1∶20,转速200 r·min-1的条件下提取l h,过滤后测定花色苷含量,选择添加酸的最佳浓度。
(5)料液比对提取花色苷的影响
以上述实验确定的最佳条件,分别设定料液比为1∶10、1∶20、1∶30、1∶40、1∶50(w·v-1),在30℃,转速200 r·min-1的条件下提取1 h,过滤后测定花色苷含量,选择最佳料液比。
(6)提取时间对提取花色苷的影响
在上述实验确定的最佳条件,在30℃、适宜的料液比,转速200 r·min-1的条件下,分别提取1、2、3、4、5、6 h,过滤后测定花色苷含量,确定最佳的提取时间。
(7)提取温度对提取花色苷的影响
在上述实验确定的最佳条件,在30、40、50、60、70、80、90℃条件下提取,过滤后测定花色苷含量,确定最佳的提取温度。
2.1.7提取正交试验
根据正交设计助手II v3.1设计正交实验,由于正交试验表不存在空列,所以设置3个重复试验以进行方差分析。
2.1.8蓝莓酒渣粗提物得率和纯度的计算
根据实验最佳的提取条件对蓝莓酒渣进行提取,之后把提取液浓缩冻干,计算蓝莓酒渣粗提物得率及花色苷的纯度。
3 结果与分析
3.1提取溶剂种类和提取剂浓度对花色苷提取量的影响
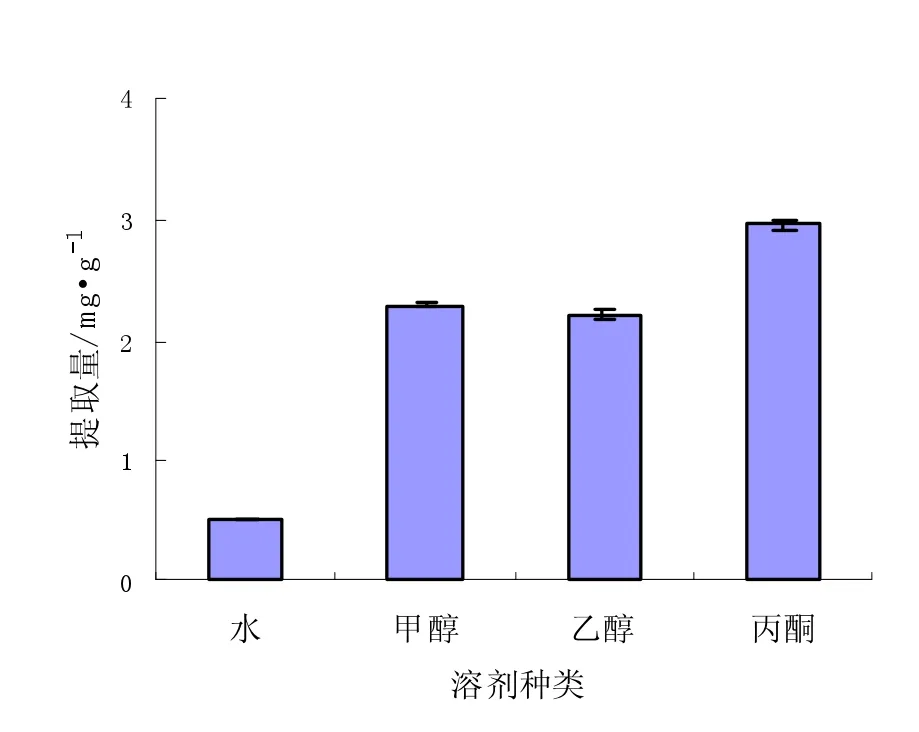
图1 提取溶剂种类对花色苷提取量的影响Fig.1Effects of extraction solvent type on extracted anthocyanin
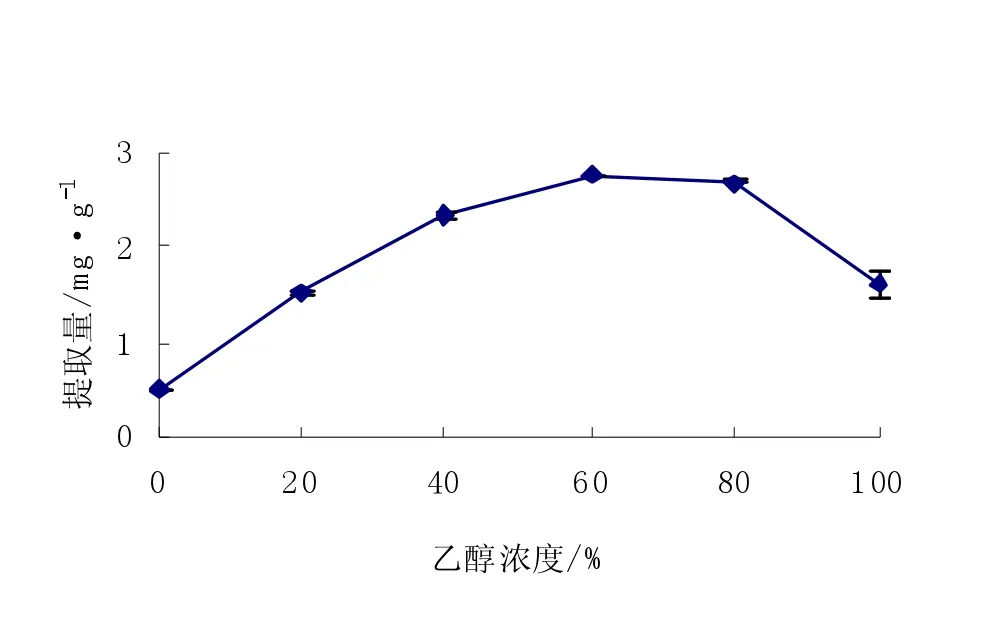
图2 提取剂浓度对花色苷提取量的影响Fig.2Effects of extracting agent on extracted anthocyanin
由图1可知,丙酮的提取效果明显好于甲醇、乙醇和水,甲醇和乙醇的提取效果相近,丙酮的成本较高,不宜大批量使用,甲醇的沸点偏低、导致提取过程中温度不能较高,而且具有毒性,在大规模生产中对设备的密闭性要求较高,所以实验选择提取效果较好并较为安全的乙醇作为提取溶剂。
由图2可知,0.2%盐酸酸化的0%、20%、40%、60%、80%、100%的乙醇溶液提取时,随着乙醇浓度的增加,花色苷含量呈先升高后下降的趋势,当乙醇浓度达到60%的时候,花色苷提取量最高,因为当乙醇浓度过大时,会抑制花色苷的提取。这是由于水也是花色苷类化合物的良好溶剂,自然界中的花色苷能与提取原料中的蛋白质和多糖等物质以氢健等作用力形成复合物[17]。因此,提取溶剂不仅要是良好的花色苷溶剂,还需要水来断裂氢健,因而在水中加入一定量的乙醇形成复合体系更适宜花色苷的提取[18]。综合考虑,选择60%的乙醇作为提取溶剂。
3.2酸的种类和浓度对花色苷提取量的影响

图3 酸的种类对花色苷提取量的影响Fig.3Effects of acid type on extracted anthocyanin
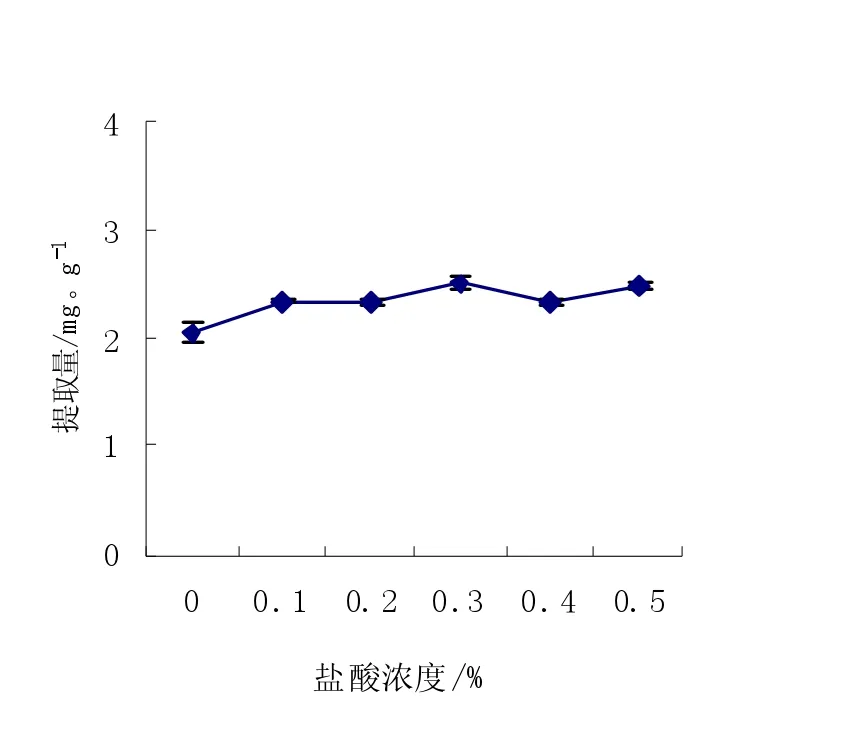
图4 盐酸浓度对花色苷提取量的影响Fig.4Effects of hydrochloric acid concentration on extracted anthocyanin
由图3可知,以60%乙醇作为提取溶剂时,冰乙酸、盐酸和柠檬酸对花色苷提取效果差别不大。因为盐酸中的氯离子有利于花色苷烊离子结构,同时考虑经济问题所以选择盐酸作为酸化剂[19]。
由图4可知,以不同浓度的盐酸乙醇溶液为提取剂时,盐酸浓度的变化对花色苷提取量的影响较小,变化规律不明显,但由于在提取剂中加入少量的盐酸氯离子有利于花色苷烊离子结构形成,增加花色苷的稳定性,所以选择浓度为0.1%的盐酸作为酸化剂。
3.3料液比和提取时间对花色苷提取量的影响
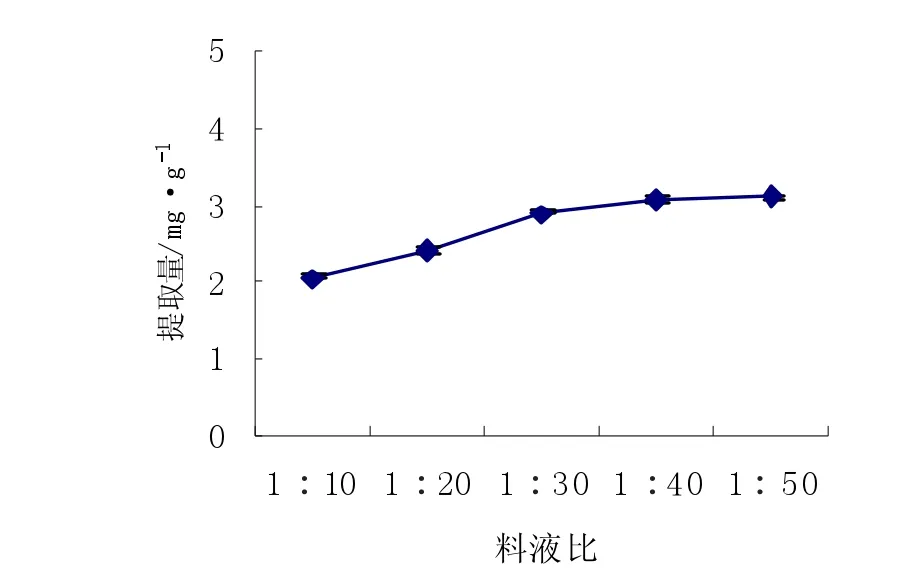
图5 料液比对花色苷提取量的影响Fig.5Effects of solid-liquid ratio on extracted anthocyanin
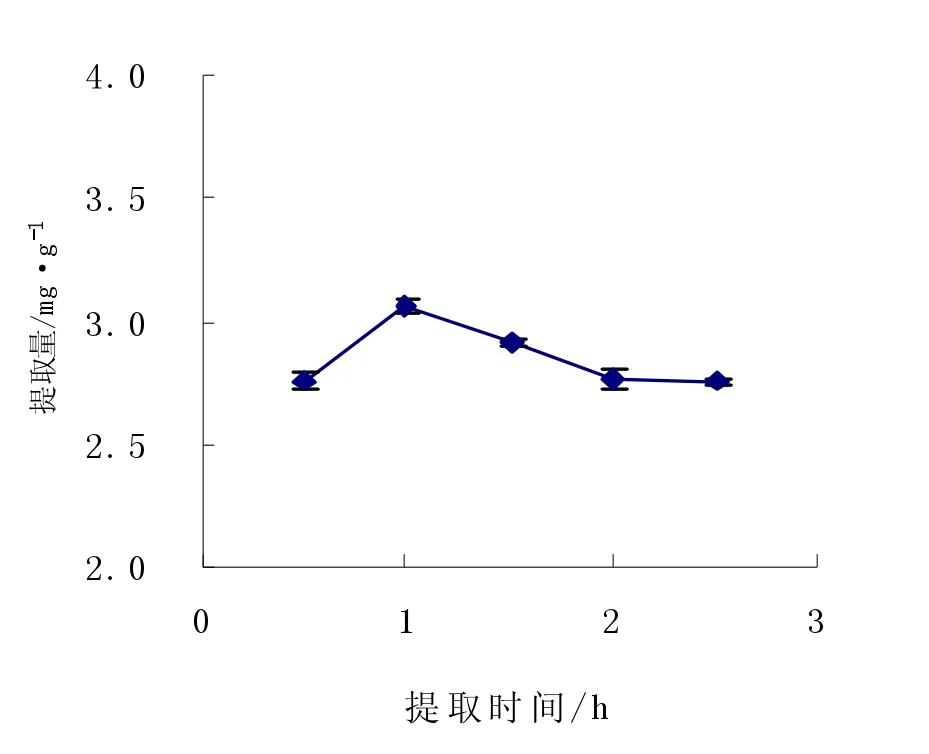
图6 提取时间对花色苷提取量的影响Fig.6Effects of extracting time on extracted anthocyanin
由图5可知,花色苷的提取量随料液比的增加而提高。其中花色苷在料液比1∶30时达到较高值,之后增大料液比花色苷的含量有所增加但差异不显著(P>0.05)。这是由于料液比的增加能提高分子扩散速率、缩短浓度平衡时间,因而使溶解在提取剂中的花色苷增多,增加了提取量,但料液比过大时,会使提取溶剂中的花色苷浓度降低,低浓度的花色苷溶液不利于花色苷的稳定,花色苷反而会有一定的降解与损失[20]。而且料液比过高会使成本升高,所以选择料液比为1∶30。
由图6可知,选择料液比l∶30(w·v-1),提取时间为1 h时,花色苷含量达到最大值。理论上提取时间越长,原料与提取剂的接触越充分,提取量应该越大,但是因为花色苷等多酚类物质性质不稳定,随着提取时间的增加会使已经提取出的花色苷等发生氧化分解而损失,使花色苷含量降低,所以选择1 h为最佳提取时间。
3.4提取温度对花色苷提取量的影响

图7 提取温度花色苷提取量的影响Fig.7Effects of temperature on extracted anthocyanin
由图7可知,随着提取温度的增加,花色苷呈现出先升高后下降的趋势,花色苷提取量在30~60℃之间变化不大,60℃之后下降明显。升高温度能提高花色苷的溶解度和扩散系数,此外较高的温度有利于细胞的破碎、提高细胞膜的通透性,因此升温有助于提取率的提高。但是由于花色苷对热敏感,当温度超过某一临界温度时会加速本身的氧化、降解,而且乙醇的沸点较低,升温容易造成提取剂的挥发,反而使提取率下降。另外,花色苷对于温度是十分敏感的,虽然40℃条件下花色苷的稳定性不会急剧下降,但也会一定程度上造成花色苷的降解和损失[21],所以选择30℃作为提取花色苷的提取温度。花色苷提取量为2.6 mg·g-1。
3.5提取工艺的正交试验
由上述的单因素实验选择对花色苷提取率影响较大的4个因素,即乙醇浓度、提取温度、提取时间和料液比,采用4因素3水平进行9次实验,优化蓝莓酒渣中花色苷的提取工艺。

表1 正交实验因素水平Table 1Design of orthogonal experiment
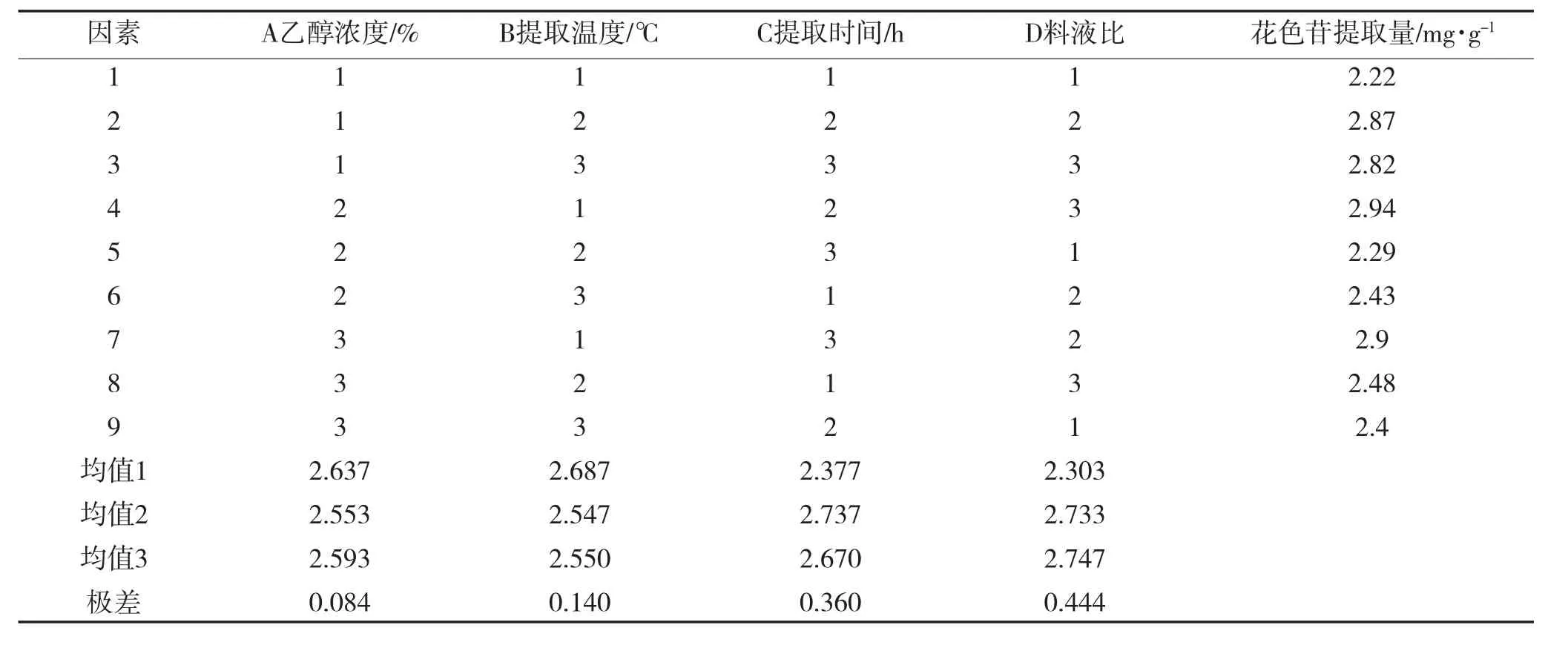
表2 正交试验直观分析Table 2Intuitive analysis of orthogonal experiment
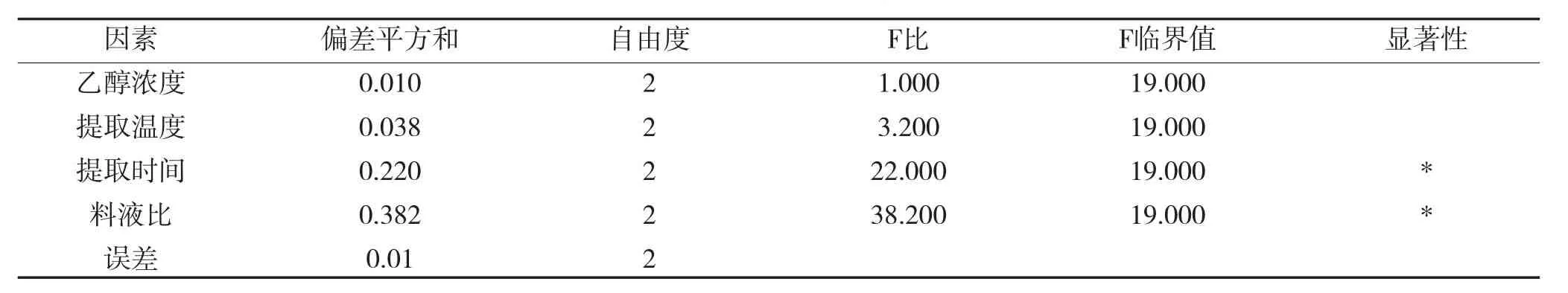
表3 正交实验方差分析Table 3Variance analysis of orthogonal experiment
由极差分析可知,最佳提取工艺为A1B1C2D3,即乙醇浓度为40%,提取温度为30℃,提取时间为1 h,料液比为1∶40,在此设计下进行验证试验,花色苷含量为3.03 mg·g-1。由方差分析得出,料液比和提取时间对正交试验影响显著,乙醇浓度和提取温度影响不显著。
3.6蓝莓酒渣粗提物得率和花色苷纯度
根据公式1计算出提取液粗提物得率为22.1%,根据公式2计算出花色苷纯度为1.37%。
4 结论与讨论
试验以野生蓝莓酒渣为原料,40%乙醇为提取溶剂,0.1%的盐酸酸化,按1 g干燥的酒渣加40 mL溶剂的比例,于30℃提取1 h,提取液中花色苷含量为3.03 mg·g-1,粗提物得率为22.1%,花色苷纯度为1.37%。
蓝莓花色苷在醇溶液中溶解性比较好,在酸性条件下稳定。原料量一定的情况下,溶剂使用量越大花色苷的提取率也越高,但在干燥浓缩时所消耗的能量也越多,所以确定合适的料液比,对降低生产成本,提高生产效率非常重要。随着乙醇体积分数、浸提时间和浸提温度的增加,花色苷的提取率也相应的提高,但增加乙醇体积和提取时间在一定程度上会增加生产成本,且温度过高会造成花色苷的部分降解,不利于其稳定性[22-23]。
在野生蓝莓酒渣中提取花色苷可拓展蓝莓鲜果资源的综合利用,减少废物排放,降低生产成本,为后续蓝莓花色苷的纯化提供数据支持,且为蓝莓酒渣中生物活性成分的基础研究以及产品的工业化生产提供理论指导。
[1]梁海英,李亚东.越橘(蓝莓)生产技术[M].长春:吉林科学技术出版社,2010.
[2]曹雪丹,方修贵,赵凯,等.蓝莓花色苷研究进展[J].中国农学通报,2012,28(15):221-226.
[3]Tsuda T. Dietary anthocyanin-rich plants:biochemicalbasis and recent progress in health benefits studies[J].Mol. Nutr. Food Res,2012,56(1):159-170.
[4]Grace M H,Ribnicky D M,Kuhn P,et al. Antho-cyanins extracted from Chinese blueberry(Vaccinium uliginosum L)and its anticancer effects on DLD-1 and COLO205 cell [J]. Chin Med,2010,123(19):2714-2719.
[5]Kader F,Rovel B. Fractionation and klentification of the phenolic compounds of highbush(Vaccinium Corymbosum L)[J].Food Chem,1996,55(1):35-40.
[6]顾姻,贺善安.蓝浆果与蔓越桔[M].北京:中国农业出版社,2001.
[7]武芸,丁莉,赵黎明.西洋菜中多糖提取工艺研究[J]. 湖北民族学院学报:自然科学版,2015(1):91-94.
[8]Su M S,Chien P J. Antioxidant activity,anthocyanins and phenolics of rabbiteye blueberry(Vaccinium ashei)fluid products as affected by ferentation[J]. Food Chem,2007,104(1):182-187.
[9]杜超,马立志,刘晓燕,等.蓝莓皮、渣中花色苷的非酸化溶剂提取工艺研究[J].食品工业,2014,35(1):156-158.
[10]吕春茂,王新现,董文轩,等.响应面法优化越橘花色苷微波辅助提取工艺参数[J].食品科学,2011,32(6):71-75.
[11]程旺开,彭常安,杨靖东,等.纤维素酶水解蓝莓果渣工艺条件的研究[J].安徽科技学院学报,2013,27(2):34-38.
[12]刘永,王平,吴越,等.蓝莓花色苷超声辅助提取工艺优化及组分分析[J].安徽工程大学学报,2014,29(3):32-36.
[13]张学宁,高志华,刘庆忠,等.蓝莓花色苷提取工艺的优化研究[J].河北工业科技,2013,30(2):69-72.
[14]时海香,仲山民,吴峰华.超临界C02萃取常山胡柚天然色素工艺[J].林业科技开发,2008,22(1):20-23.
[15]Chiriboga C,Francis F J. An anthocyan in recovery system from cranberry pomace [J]. J Am Soc Hortic Sci,1970,95:233-236.
[16]李安文.蓝莓花色苷稳定性及分离纯化技术研究[D].长沙:湖南农业大学,2011.
[17]Cacace J E,Mazza G. Extraction of anthocyanins and other phenolics from black currants with sulfured water [J]. J Agr Food Chem,2003,50(21):5939-5946.
[18]赵秀玲,文飞龙,李长龙.黄山野菊花挥发油体外抗氧化活性[J]. 河北科技师范学院学报,2015,29(1):57-60.
[19]王兆然.蓝莓果渣中花色苷的提取及稳定性研究[D].北京:北京化工大学,2013.
[20]Ito F,Tanaka N,Katsuki A,et al. Why do flavylium salts show so various colors in solution Efiect of concentration and water on the flavylium Scolor changes [J]. J Photoch Photobio A:Chem,2002,150(1-3):153-157.
[21]Dangles O,Brouillard R,Polyphenol I. The copigmentation case:Thermodynamic data from temperature variation and relaxation kinetics. Medium effect [J]. Can J Chem,1992,70(8):2174-2189.
[22]刘海军,孙井坤. 萝卜红色素的提取工艺研究[J].黑龙江八一农垦大学学报,2014,26(4):51-57.
[23]郑影,张珊,王萍.蓝莓花色苷降解动力学研究[J].安徽农业科学,2014,42(21):6929-6930.
Extraction Research on Anthocyanins of Blueberry Wine Pomace
Wang Chao,Liu Wenjing,Guo Dejun,Xu Wanmeng,Wang Chengyu,Li Dandan,Ruan Changqing
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319)
To explore the biological active ingredient in blueberry wine pomace of Da Hinggan Mountains,the effects of the ethanol solution concentration,hydrochloric acid concentration,solid-liquid ratio,time,temperature of the anthocyanins content were investigated in orthogonal experiments.The results showed that the optimal conditions was follows:alcohol 40%,hydrochloric acid concentration 0.1%,the extraction temperature 30℃,extracting time 1 h,and solid-liquid ratio 1∶40.Under the condition of anthocyanins content in slag for 3.03 mg·g-1,the crude extract was black powder after enrichment freeze-drying,and the rate was 22.1%,and anthocyanins purity was 1.37%.This experiment illustrated that residue contains of the wild blueberry wine pomace had lots of anthocyanins.Extracting the biological active components from blueberry wine pomace could reduce waste,improve the comprehensive utilization of blueberry fruit resources,and provide guidance for industrialized production.
wild blueberry;pomace;anthocyanins;extraction optimization
TS261.9
A
1002-2090(2016)02-0064-06
10.3969/j.issn.1002-2090.2016.02.013
2015-02-15
黑龙江八一农垦大学研究生创新基金项目(YJSCX2014-Y49);黑龙江省大学生创新创业训练计划项目(201410223012);黑龙江省农垦总局科技局技术开发项目(HNK13KF-15-01)。
王超(1988-),男,黑龙江八一农垦大学食品学院2012级硕士研究生。
阮长青,男,教授,硕士研究生导师,E-mail:cqruan@163.com。
