油菜黄单胞杆菌AhpC突变对被侵染菜豆叶片光化学反应特性的影响
2016-11-11贾凌云焦青松冯汉青
贾凌云,焦青松 ,李 欣 ,孙 坤*,冯汉青
( 1. 西北师范大学 生命科学学院,兰州 730070;2. 河南科技大学 食品与生物工程学院,河南 洛阳 471000 )
油菜黄单胞杆菌AhpC突变对被侵染菜豆叶片光化学反应特性的影响
贾凌云1,焦青松1,李欣2,孙坤1*,冯汉青1
( 1. 西北师范大学 生命科学学院,兰州 730070;2. 河南科技大学 食品与生物工程学院,河南 洛阳 471000 )
该文研究了两种不同基因型的黄单胞杆菌 [野生型(Xcp-W)和烷基过氧化物还原酶亚基C(AhpC)的缺失突变体(Xcp-ahpC)]侵染菜豆叶片(Phaseolusvulgaris)3 d后,叶片侵染位点以及同一叶片上距侵染位点不同距离处叶绿素荧光参数的变化。结果表明:与对照相比,两种病原菌侵染后叶片被侵染位点以及同叶距侵染位点一定距离处潜在最大光化学效率(Fv/Fm)的变化不显著,而光系统Ⅱ(PSⅡ)实际光化学效率[Y(Ⅱ)]、电子传递速率(ETR)以及光化学猝灭系数(qP和qL)均显著降低。与野生型病原菌Xcp-W的侵染相比,Xcp-ahpC突变型菌株侵染后叶片的以上参数的降低更为明显。野生型病菌Xcp-W侵染对非调节性能量耗散产量[Y(NO)]和调节性能量耗散产量[Y(NPQ)]无显著影响;但Xcp-ahpC型病原菌侵染则导致了(Y(NO)和Y(NPQ)的显著上升。综上可知,白叶枯病菌侵染使得叶片光系统Ⅱ的光能使用效率受到了系统性的抑制,而病原菌烷基过氧化物还原酶亚基C的缺失对叶片光系统Ⅱ的光能使用效率的抑制作用更为强烈,并影响了植物的光能耗散机制。
菜豆,白叶枯病菌,基因型,叶绿素荧光参数,系统性
白叶枯病是一种由黄单胞杆菌属病原菌侵染所引发的常见植物病害。而油菜黄单胞菌的菜豆致病变种(Xanthomonascampestrispv.Phaseoli, Xcp)既是引发白叶枯病常见的病原菌之一,也是世界范围内影响菜豆产量的主要病害(Shi et al, 2012)。在自然界中,病原菌主要从伤口或气孔处侵染植物(Hao et al, 2012)。而当植物受到病原的侵染后,植物的正常代谢会受到明显的抑制,从而导致了植物生长和发育水平的下降(Funayama et al, 1997; Zhou et al, 2004)。光合作用不仅是植物最重要的生理活动,同时也是反映植物对环境变化进行响应的主要生理指标。植物叶片在遭受病原菌侵染后,其光合的光能利用效率会有所下降,而且下降的程度和病原菌的侵染水平或植物病程的发展存在着密切的相关性(Bolton,2009)。叶绿素荧光技术可以在不破坏和损伤叶片的情况下快速检测植物光合作用中光能利用效率(Oxborough, 2004)。近年来许多工作者利用了叶绿素荧光技术来检测病原菌对被侵染位点以及被侵染位点的周围组织光能利用效率的影响,从而作为判断植物病程发展的重要依据(Guo et al, 2005; Bu et al, 2009;Bolton et al, 2009;Horst et al, 2008)。
当植物受到病原菌侵害后,为了减轻病原细菌侵害对其造成的损害,植物体内会产生一系列的抗病反应,而其抗病反应的重要组成部分就是当寄主在病原菌侵染后所导致的活性氧爆发现象(Levine, 1994)。活性氧(ROS)是O2经过持续的单电子还原后而产生的一系列活性产物,其重要成分为半衰期最长的活性氧组分过氧化氢和超氧阴离子等(Turpaev, 2002)。在植物与病原互相作用中不单产生了大量的过氧化氢,同时该产物还具备杀死病原菌的能力(Rolke et al, 2004 ; Thannickal & Fanburg, 2000)。从病原菌自身的角度讲,病原菌的生存和繁育很大程度上取决于其对植物产生的过氧化氢的耐受能力(Nandini et al, 2007)。因此,从理论上推断,病原菌对于过氧化氢的耐受能力在很大程度上影响着植物的代谢水平或病程的发展。
植物光能利用效率的变化是反映植物代谢水平及病程发展的重要依据。但是,植物与病原菌互作过程中植物光能利用效率的变化是否和病原菌自身抵抗过氧化氢的能力有关尚无明确的答案。同时,病原自身抵抗过氧化氢的能力改变后,植物被侵染位点以及被侵染位点周围组织的光能利用效率特性是否均会发生相应的改变更是未见报道。基于此,我们以两种不同基因型的黄单胞杆菌属病原菌,XcpW型(野生型)和XcpahpC型,烷基过氧化物还原酶亚基C(AhpC)缺失大大提升黄单胞菌对过氧化氢的耐受能力(Mongkolsuk et al, 2000; Vattanaviboon et al, 2003),侵染菜豆叶片,并利用叶绿素荧光技术测定了侵染位点以及同一叶片上距侵染位点不同距离处的周围组织叶片的叶绿素荧光参数的变化。相信本研究的进行,将有助于进一步完善病原菌和植物互作过程中的植物光能利用效率的变化内在机制。
1 材料与方法
1.1 材料培养
菜豆(Phaseolusvulgaris)为购自广州市农业科学院的农普12号。材料种子消毒采用次氯酸钠法,将种子置于蒸馏水浇湿的厚纱布中萌发前,用2% 的次氯酸钠和蒸馏水分别浸泡消毒20 min和冲洗5次。发芽后的种子转移载种到塑料盆钵中,每盆1株。培养基质按1份珍珠岩、1份蛭石和3份营养土充分混合。培养室的环境条件:光周期为12 h光照/12 h黑暗,相应温度为25 ℃/20 ℃,光照强度设置为200 μmol·m-2·s-1,为了保持表层培养介质潮湿,每天浇水1次,同时保证空气湿度为45%。选取生长一致且第一对真叶完全展开的幼苗待用。
1.2 处理方法
所使用的两种突变体XcpahpC(油菜黄单胞菌菜豆致病变种的ahpC突变体菌株)和Xcpw(野生型菌株)从泰国Chulabhorn研究院生物工艺学实验室获得,其中与Xcpw型相比,突变体XcpahpC 抵御过氧化氢的杀伤能力更强(Mongkolsuk et al, 2000; Vattanaviboon et al, 2003)。将活化后的菌种接种到27 ℃液体培养基中震荡培养12 h备用。选取长势一致的幼苗,采用注射法在叶片局部接种病原菌,对照组(CK)注射等量不含有病原菌的培养液,之后将其放回原培养处继续培养。测量时将被侵染位点记作1点,在同一叶片上距离侵染点每0.5 cm取一点,连续取8个点,并分别记1、2、…、8。前期实验中,病原菌侵染3 d后开始进入发病期,受侵染的寄主植物在外部形态上出现明显症状。因此,在侵染3 d后分别检测各点的叶绿素荧光参数值,每个点的各个叶绿素荧光参数测定分别在4株独立生长的植物叶片上分别进行测量。
1.3 叶绿素荧光参数测定
使用德国的IMAGING-PAM(Waltz, Germany)对菜豆叶片的叶绿素荧光参数进行测定。参照Demmig-Adams et al (1996)的方法,测定地点在培养室,空气湿度45%,温度23 ℃。测量光化光强度设定为200 μmol·m-2·s-1,测定时以黑布遮挡防止外部光干扰。供试材料暗适应30 min后进行测定,为了测量初始荧光(Fo),先将测量光调节为弱,随后将测量光设置为饱和脉冲光(6 000 μmol·m-2·s-1,脉冲时间为0.8 s)模式,测量暗适应后的最大荧光(Fm);为了测量稳定荧光(Fs)和光适应下最大荧光(Fm′),先将光化光条件调整为200 μmol·m-2·s-1进行测量,再打开饱和脉冲测得Fm′。测量光适应下的最小荧光(Fo′)时,打开远红光的同时关闭光化学光。
通过计算得出以下参数:暗适应下可变荧光(Fv) =Fm-Fo;暗适应下PSⅡ潜在最大光化学效率=Fv/Fm;光适应下PSⅡ实际光化学效率[Y(Ⅱ)]=(Fm′-Fs)/Fm′;光合电子传递速率(ETR) = (Fm′-Fs)/Fm′ ×PAR× 0.84 × 0.5;光化学荧光猝灭系数(qP)=(Fm′-Fs)/(Fm′-Fo′),qL=(Fm′-Fs)/(Fm′-Fo′) ×Fo′/Fs。调节性能量耗散和非调节性能量耗散的量子产量Y(NPQ)=1-Y(Ⅱ)-1/[Fm-Fm′)/Fm′]+1+qL(Fm/Fo-1),Y(NO)=1/[(Fm- Fm′)/Fm′]+1+qL(Fm/Fo-1)。
测定程序结束后导出数据。每个点的各个叶绿素荧光参数测定分别在4株独立生长的植物叶片上分别进行测量,结果为4次独立实验测量值的平均数。
1.4 数据分析
所得数据用Excel分列预处理,整理导出的数据格式并计算出每个参数4次独立实验测量值的平均数及标准差(n-1),使用Origin 9.0统计软件绘图,并进行显著性分析(P<0.05)。
2 结果与分析
2.1 PSⅡ实际光化学效率[Y(Ⅱ)],光化学猝灭系数(qP)及电子传递速率(ETR)的变化
光适应下PSⅡ反应中心的实际光化学效率由Y(Ⅱ)表示。qP为光化学猝灭系数的代表,表明了原初电子受体质体醌A(QA)接受电子的能力,光合电子传递链中的电子传递速率由ETR来表示。和对照相比,两种白叶枯病菌侵染后菜豆叶片侵染位点以及同一叶片上侵染位点周围组织的PSⅡ实际光化学效率[Y(Ⅱ)](图1:A),qP(光化学猝灭系数)(图1:B)及ETR(电子传递速率)(图1:C)均呈现下降趋势。与XcpW型相比,XcpahpC型侵染后的以上各参数的降低更加明显。
2.2 潜在最大光化学效率 (Fv/Fm)的变化
Fv/Fm反映了叶片的潜在最大光化学效率。与对照组相比,在侵染位点及同一叶片上距侵染位点不同距离处,两种不同基因型的病原菌侵染后菜豆叶片的潜在最大光化学效率 (Fv/Fm)有轻微的下降趋势,但并未产生显著性差异(图2)。这说明两种不同基因型的病原菌对菜豆叶片的潜在最大光化学效率和热耗散的影响较小。
2.3 Y(NPQ)(调节性能量耗散)和Y(NO)(非调节性能量耗散)的变化

图 1 PSⅡ实际光化学效率[Y(Ⅱ)],光化学猝灭系数(qP)及电子传递速率(ETR)的变化。结果为4次独立实验测量值的平均数 ± 标准差(n-1)。下同。 测量时选取为被侵染位点记作“1”点,然后每隔0.5 cm取点,连续取8个点,分别记1、2、…、8。不同字母表示在同一距离点上有显著性差异(P<0.05)。下同。Fig.1 Change of actual photochemical efficiency of PSⅡ [Y(Ⅱ)], the coefficient of photochemical fluorescence (qP) and electronic transmission rate (ETR). Each value represents the mean ± SD (vertical bars) of four independent experiments. (The same below). Point“1”stands for the infested site, and then select points every 0.5 cm, taking eight consecutive points, denoted 1,2,...,8. Different letters denote significant differences at the same points (P<0.05). The same below.
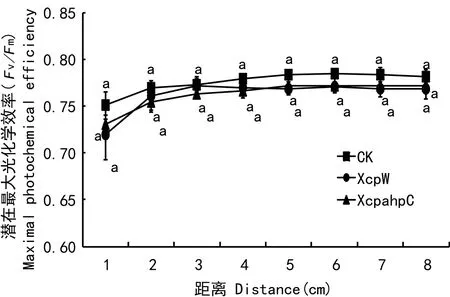
图 2 PSⅡ最大光化学效率 (Fv/Fm) 的变化Fig. 2 Changes of maximal photochemical efficiency of PSⅡ (Fv/Fm).
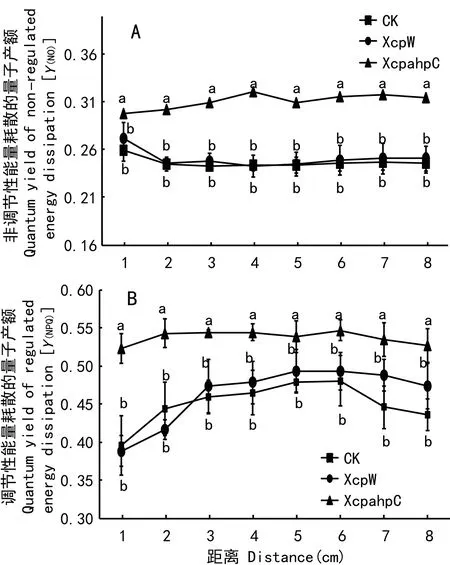
图 3 Y(NPQ)(调节性能量耗散)和Y(NO)(非调节性能量耗散)的变化Fig. 3 Change of quantum yield of regulated energy dissipation Y(NPQ) and quantum yield of non-regulated energy dissipation Y(NO)
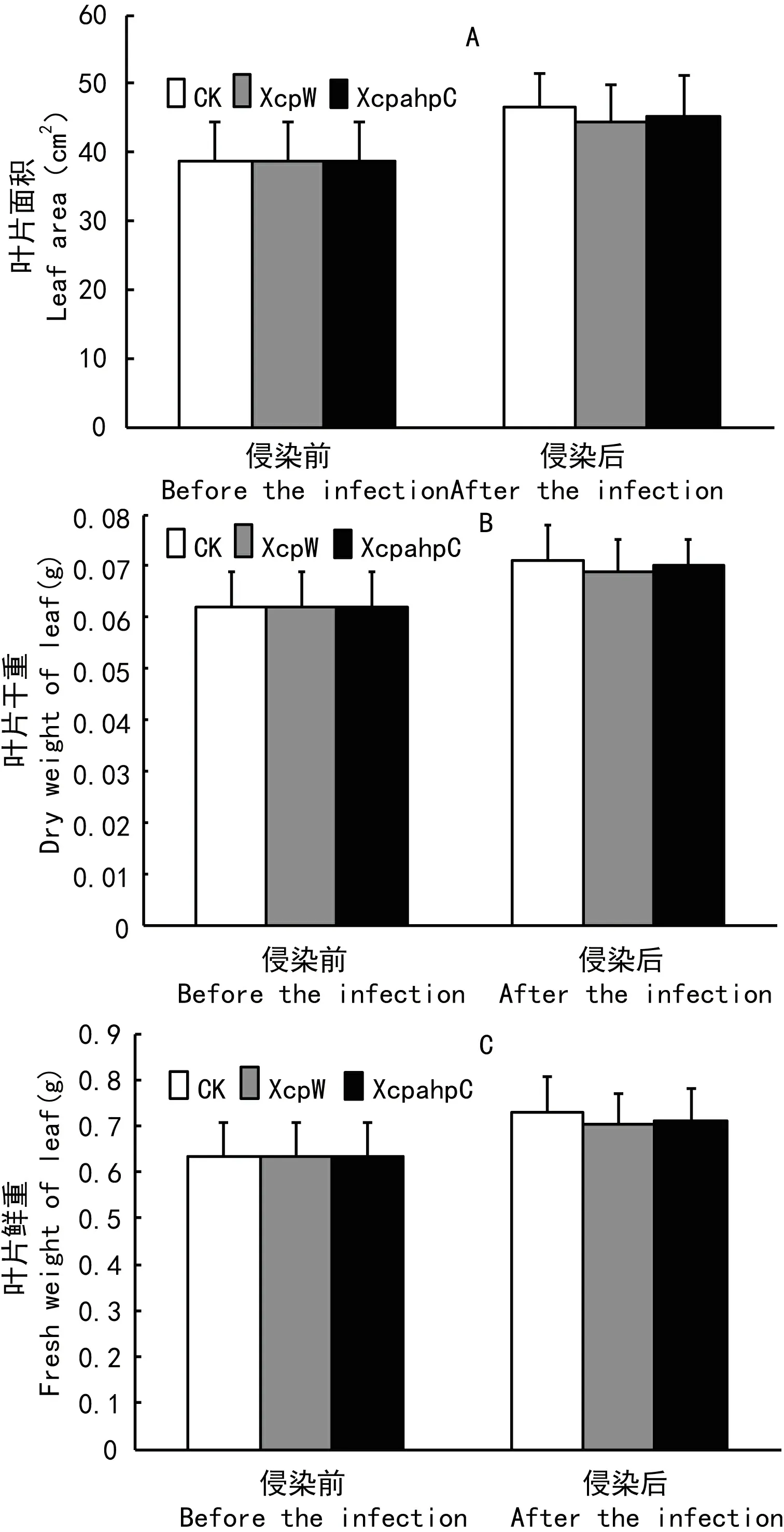
图 4 叶片面积、鲜重和干重的变化Fig. 4 Change of leaf area, leaf fresh weight and leaf dry weight
Y(NPQ)和Y(NO)分别代表调节性能量耗散和非调节性能量耗散的量子产量,是反映植物将无法用于光合电子传递的光能以热的形式耗散的重要指标。与对照相比,在侵染位点及同一叶片上距侵染位点不同距离处,XcpW型病原菌侵染后菜豆的Y(NPQ)和Y(NO)无显著改变。而较之对照,被XcpahpC型病原菌侵染后,叶片Y(NPQ)和Y(NO)值均有显著性上升(图3:A,B)。
2.4 叶片叶面积、鲜重和干重的变化
为进一步分析两种不同的病原菌侵染所导致的叶片光能利用效率的不同是否和叶片的生长差异有关,我们进一步测量了侵染前后叶片叶面积、鲜重和干重的变化。图4结果表明,较之侵染前,叶片的叶面积、鲜重和干重在3 d的生长期内均有上升。被病原菌侵染叶片的叶面积、鲜重和干重略低于对照,但与对照组比尚未达到显著性差异。而两种不同基因型的病原菌侵染后菜豆叶片之间的叶面积、鲜重和干重也无显著性差异。
3 讨论与结论
黄单胞杆菌是一种影响作物产量的主要病害(Jiao et al, 1996)。本研究显示,在黄单胞杆菌侵染位点及同一叶片上距侵染位点不同距离处,菜豆叶片的Fv/Fm变化不显著。叶片在暗适应后测得的Fv/Fm无显著性变化,而该指标表明PSⅡ的潜在最大光化学效率,因此侵染时期内病菌侵染对植物潜在的最大光化学效率并无产生显著影响。然而,与Fv/Fm变化不同的是当两种不同基因型的黄单胞杆菌病原菌侵染后,在侵染位点代表PSⅡ实际光化学效率的Y(Ⅱ),代表光化学猝灭系数的qP及代表电子传递速率的ETR均呈现显著下降趋势。Y(Ⅱ)降低意味着PSⅡ反应中心在实际光化学效率受到了抑制,而qP和ETR的降低则表明PSⅡ反应中心接受电子及线性传递电子的能力受到了影响(Krame et al, 2004;Xue & Liu, 2008)。可见,黄单胞杆菌的侵染影响了受侵染组织光合机构PSⅡ反应中心的功能,使得被侵染组织光合作用过程中的光能利用效率下降。而通过检测同一叶片上距侵染位点不同距离处Y(Ⅱ))和qP的变化,发现较之对照,距侵染位点不同距离处Y(Ⅱ)和qP也有所下降,表明病原菌的侵染对PSⅡ反应中心功能的抑制作用并不局限于侵染位点,同时对叶片侵染位点周围组织PSⅡ反应中心的功能也产生了抑制。
本研究结果表明,通过对比XcpW和XcpahpC两种不同的病原菌对叶片叶绿素荧光参数的变化发现,无论是在侵染位点,还是同一叶片上距侵染位点不同距离处,与XcpW型相比,XcpahpC型侵染后Y(Ⅱ),光化学猝灭系数(qP)及电子传递速率(ETR)的降低更加明显。进一步观察表明,与对照相比,XcpW型病原菌侵染后菜豆叶片的Y(NPQ)和Y(NO)无显著性影响。但与对照和XcpW型相比,Xcp-ahpC型病原菌侵染后Y(NPQ)和Y(NO)在侵染位点及同一叶片上距侵染位点不同距离处均明显上升。Y(NPQ)和Y(NO)表明了植物吸收的光能中无法被用于光合的光能耗散的多少。Xcp-ahpC型病原菌侵染后Y(NO)和Y(NPQ)的上升,说明Xcp-ahpC型白叶枯病菌的侵染使得对菜豆PSⅡ将更多所吸收的光能耗散掉。植物光能耗散的增加是因其光化学效率的下降导致的(Su et al, 2007)。这种变化也与上文中叶片在Xcp-ahpC型病原菌侵染后Y(Ⅱ),qP及ETR等表征 PSⅡ光化学效率的参数降低的变化相吻合。这进一步表明Xcp-ahpC型病原菌侵染会导致植物光能利用效率的下降更加明显。
本研究进一步分析了在侵染前后叶片叶面积、鲜重和干重的变化,发现被病原菌侵染叶片的叶面积、鲜重及干重与对照相比无显著性差异;而两种不同基因型的病原菌侵染后菜豆叶片的上述生长参数也无显著性差异。这表明至少在本研究所观察的短期侵染期间,黄单胞杆菌侵染或两种不同基因型的黄单胞杆菌侵染所导致的叶片光能利用效率的变化和叶片生长无显著性关联,而应是叶片的光能利用效率自身受到了一定的抑制所致。但在长期侵染过程中,叶片光能利用效率是否也会由于生长的差异而受到影响需进一步研究。
突变体菌株XcpahpC 抵御过氧化氢的杀伤能力要比野生Xcpw型的更强((Mongkolsuk et al, 2000; Vattanaviboon et al, 2003)。而植物能够通过产生大量的过氧化氢等活性氧抑制病原菌生长和蔓延 (Rolke et al, 2004 ; Thannickal & Fanburg, 2000)。因而,本研究认为,与XcpW型病原菌相比,XcpahpC型病原菌由于具有更强的抵抗过氧化氢的性能,从而提高了其对植物活性氧的耐受,继而对光能利用效率的影响也更为显著。这与Mongkolsuk et al (2000)的结果一致。
综上所述,油菜黄单胞杆菌侵染后菜豆叶片的光能利用效率受到了一定的系统性的抑制。而具有对过氧化氢较高耐受性的病原菌突变体(XcpahpC)对植物叶片光能利用效率的抑制作用更为明显。
BOLTON MD, 2009. Primary metabolism and plant defense-fuel for the fire [J]. Mol Plant Microb In, 22(5): 487-497.BU JW,YAO G, GAO HY, et al, 2009. Inhibition mechanism of photosynthesis in cucumber leaves infected bySclerotiniasclerotiorum(Lib.) de Bary [J]. Acta Phytopathol Sin, 39(6): 613-621.
DEMMING-ADAMS B, ADAMS WW, BARKER DH, et al. 1996. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation [J]. Physiol Plant, 98(2): 253-264.
FUNAYAMA S, HIKOSAKA K, YAHARA T, 1997. Effects of virus infection and growth irradiance on fitness components and photosynthetic properties ofEupatoriummakinoi(Compositae) [J]. Am J Bot, 84 (6):823-829.
GUO DP, GUO YP, ZHAO JP, et al, 2005. Photosynthetic rate andchlorophyll fluorescence in leaves of stem mustard(Brassicajunceavar.tsatsai)after turnip mosaic virus infection [J]. Plant Sci, 168 (1): 57-63.
HAO M, XING D, XIE B,et al, 2002. Construction of the plasmid vector carrying gfp gene and the expression ofXanthomonasoryzaepv.oryzae(Xoo) in rice [J]. Acta Laser Biol Sin, 11(6): 427-430.
HORSTR.J, ENGELSDORF T, SONNEWALD U, et al, 2008. Infection of maize leaves withUstilagomaydisprevents establishment of C4 photosynthesis [J]. J Plant Physiol, 165: 19-28.
JIAO J, GRODZINSKI B, GOODWIN P, 1996. Photosynthesis and export during steady-state photosynthesis in bean leaves infected with the bacteriumXanthomonascampestrispv.phaseoli[J]. Can J Bot, 74(1): 1-9.KRAMER DM, JOHNSON G, KIIRATS O,et al, 2004. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes [J]. Photosynth Res, 79(2): 209-218.
LEVINE A, TENHAKEN R, DIXON R,et al, 1994. H2O2from oxidative burst orchestrates the plant hypersensitive disease resistance response [J]. Cell, 79: 583-593.
MONGKOLSUK S, WHANGSUK W, VATTANAVIBOON P,et al, 2000. A Xanthomonas alkyl hydroperoxide reductase subunit C (ahpC) mutant showed an altered peroxide stress response and complex regulation of the compensatory response of peroxide detoxification enzymes [J]. J Bacteriol, 182(23): 6845-6849.
NANDINI PS, RAHIM M, HENRIK L, et al, 2007. Role of hydrogen peroxide during the interaction between the hemibiotrophic fungal pathogenSeptoriatriticiand wheat [J]. New Phytol,174(3): 637-647.
OXBOROUGH K, 2004. Imaging of chlorophyll a fluorescence: theoretical and practical aspects of an emerging technique for the monitoring of photosynthetic performance [J]. J Exp Bot, 55(400): 1195-1205.
ROLKE Y, LIU S, QUIDDE T, et al, 2004. Functional analysis of H2O2generating systems in Botrytis cinerea: the major Cu-Zn-superoxide dismutase (BCSOD1) contributes to virulence on French bean, whereas a glucose oxidase (BCGOD1) is dispensable [J]. Mol Plant pathol, 5(1): 17-27.
SHI C, YU K, Perry G, 2012. Development of candidate gene markers associated to common bacterial blight resistance in common bean [J]. Theor Appl Genet, 125(7): 1525-1537.
SU XR, WANG XF, YANG FJ, et al, 2007. Effects of NO3-stress on photosynthetic rate, photochemical efficiency of PS II and light energy allocation in cucumber seedling leaves [J]. J Appl Ecol, 18(7): 1441-1446.
THANNICKAL JV, FANBURG LB, 2000. Reactive oxygen species in cell signaling [J]. Am J Physiol Lung Cell Mol Physiol, 279: 1005-1028.
TURPAEV KT, 2002.Reactive oxygen species and regulation of gene expression [J]. Biochemistry-Moscow, 67(3): 281-292.
VATTANAVIBOON P, WHANGSUK W, MONGKOLSUK SA, 2003. Suppressor of the menadione-hypersensitive phenotype of aXanthomonascampestrispv.phaseolioxyRmutant reveals a novel mechanism of toxicity and the protective role of alkyl hydroperoxide reductase [J]. J Bacteriol, 185(5): 1734-1738.XUE YF, LIU ZP, 2008. Effects of NaCl and Na2CO3stresses on photosynthesis and parameters of chlorophy ll fluorescence inHelianthustuberosusseedlings [J]. J Plant Ecol-UK, 32(1): 161-167.
ZHOU YH, PENG YH, LEI JL,et al, 2004. Effects of potato virus YNTNinfection on gas exchange and photosystem function in leaves ofSolanumtuberosumL. [J]. Photosynthetica, 42 (3): 417-423.
Effects of the infection with Xanthomonas campestris pv.phaseoliwith the mutation in AhpC on chlorophyll fluorescence characteristics of bean leaves
JIA Ling-Yun1, JIAO Qing-Song1, LI Xin2, SUN Kun1*, FENG Han-Qing1
( 1. College of Life Sciences, Northwest Normal University, Lanzhou 730070, China; 2. College of Food andBioengineering,HenanUniversityofScienceandTechnology, Luoyang 471000, Henan,China )
After the bean (Phaseolusvulgaris) leaves were infected with two different genotypes ofXanthomonascampestrispv.phaseoli, either wild-type (Xcp-W) or the mutant lacking Alkyl hydroperoxide reductase subunit C (Xcp-ahpC), the changes of the chlorophyll fluorescence parameters in both the infected site and the locations distant from the infected sites were studied. The results showed that in the infected site and the locations distant from the infected sites, the potential maximal photochemical efficiency (Fv/Fm) did not significantly change, while photosynthesis system Ⅱ (PSⅡ), actual photochemical efficiency [Y(Ⅱ)], electronic transmission rate (ETR), and the coefficient of photochemical quenching (qP) were significantly decreased. The decreases of PSⅡ,Y(Ⅱ),ETR, andqPin the leaves infected with Xcp-ahpC were more drastic than those in the leaves infected with Xcp-W. The quantum yield of non-regulated energy dissipation (Y(NO)) and quantum yield of regulated energy dissipation (Y(NPQ)) of the leaves were not significantly affected by the infection with Xcp-W. But,Y(NO)andY(NPQ)of the leaves were significantly increased by the infection with Xcp-ahpC. These results showed that the infection with bacterial blight pathogen can cause a systemic inhibition of the photochemical efficiency of PSⅡ in bean leaves. And, this inhibition was more drastic when the leaves was infected by the pathogen lacking the Alkyl hydroperoxide reductase subunit C.
bean,Xanthomonascampestrispv.phaseoli, genotype, chlorophyll fluorescence parameters, systemic.
10.11931/guihaia.gxzw201601040
2016-03-25
2016-06-20
国家自然科学基金(31260059,30900105);教育部科学技术研究重点项目(211190);甘肃省财政厅高校基本科研业务费项目;西北师范大学青年教师科研能力提升计划项目(NWNULKQN-12-25) [Supported by the National Natural Science Foundation of China (31260059,30900105); Scientific Research Key Project Fund of Ministry of Education(211190), Fundamental Research Funds for Gansu Finance Department Universities; A Grant For Enhancing the Research Capability of Young Teachers in Northwest Normal University(NWNULKQN-12-25)]。
贾凌云( 1982-),男,甘肃定西人,博士,主要从事植物生理学与细胞生物学研究,(E-mail)lingyunjia1982@126.com。
孙坤,博士,教授,主要从事植物系统学、生物多样性和植物生态学研究,(E-mail) kunsun@nwnu.edu.cn。
Q945.8
A
1000-3142(2016)10-1232-06
贾凌云,焦青松,李欣,等. 油菜黄单胞杆菌AhpC突变对被侵染菜豆叶片光化学反应特性的影响 [J]. 广西植物,2016,36(10):1232-1237
JIA LY, JIAO QS, LI X,et al. Effects of the infection withXanthomonascampestrispv.phaseoliwith the mutation in AhpC on chlorophyll fluorescence characteristics of bean leaves [J]. Guihaia,2016,36(10):1232-1237
