环形椎体肿瘤调强放疗计划剂量学研究
2016-11-11周庆祥刘亚召牛蔚涛吕树庄包超恩翟福山
周庆祥 刘亚召 牛蔚涛 吕树庄 包超恩 翟福山
环形椎体肿瘤调强放疗计划剂量学研究
周庆祥刘亚召牛蔚涛吕树庄包超恩翟福山
目的探讨包绕脊髓的环形椎体肿瘤调强放射治疗计划。方法应用CMS-XiO治疗计划系统制定放疗计划,处方剂量定义为5 000 cGy,要求95%PTV接受处方剂量。等中心选择在靶区中心附近椎体上中心附近,设计一前野加三后野,后三野角度约为140°、180°、220°,前野根据后三野和靶区形状及正常组织间位置关系选择合适的角度,200 cGy/25次。结果在脊髓最大剂量小于4 500 cGy,满足环形靶区5 000 cGy以上,5 000 cGy等剂量线距脊髓大于3 mm。结论应用三维动态调强适形放疗技术可以实现椎体肿瘤环形靶区照射,有效保护脊髓,提高椎体肿瘤的照射剂量。
椎体肿瘤;调强放疗;治疗计划
近1/3的癌症患者会出现骨转移,最易发生骨转移的原发肿瘤有乳腺癌、前列腺癌和肺癌等[1,2]。骨转移中以脊柱转移最为常见,是第三大好发部位,仅次于肺和肝脏。约70%的骨转移患者发生椎体转移,其中椎体转移瘤 70%发生在胸段,20%发生在腰段,10%发生在颈段。椎体是脊椎转移瘤最常受累的部位(60%~70%),其次是椎板和椎弓根[2],在众多治疗椎体转移肿瘤的手段中,放射治疗起着重要的作用,放射治疗可以单独使用,也可以和手术或化学疗法联合使用,对于不适宜进行手术治疗的椎体转移瘤患者,放射治疗是首选疗法。不但可以缓解疼痛、控制神经症状,还可以预防病理性骨折等。常规放射治疗剂量800 cGy/1F,2 000 cGy/5F,3 000 cGy/10F,4 000 cGy/20F[1]是椎体转移瘤缓解疼痛的标准。疼痛缓解的中位时间是3~6个月,且局部肿瘤控制率有限。由于椎体转移瘤非常接近脊髓,甚至包绕脊髓,对于这种复杂的靶区,受脊髓耐受剂量的限制,不可能给予肿瘤足够的照射剂量,传统的三维适形(three dimensional radiotherapy,3DCRT)照射技术和立体定向放射外科(stereotactic radiosurgery,SRS)照射技术无法再进一步提升剂量,调强放疗(intensity modulated radiotherapy,IMRT)是应用CT或MR扫描图像,确定椎体转移瘤的病变区域,根据病变的具体位置决定临床靶区和计划靶区的照射范围,同时勾画出重要器官,如脊髓、肺、肾等重要器官的轮廓,应用多个不同射束方向可以调节强度的射束,采用优化计划设计方式,控制正常组织受照射剂量在最小范围之内的原则,制定出最优的治疗方案。调强放射治疗照射技术能够提供高度适形的剂量分布,并在靶区和脊髓之间提供陡峭的剂量梯度,可以使高剂量区域与肿瘤区域高度适形,避开脊髓敏感区域,在避免脊髓损伤的前提下,给预肿瘤高剂量照射,提高肿瘤局部控制率,改善生活质量,为椎体肿瘤根治性放射治疗提供了技术支持[3]。此外,应用图像引导(image guided radiotherapy,IGRT)可进一步提升放射治疗的精确性和安全性,因此有望提升椎体转移瘤放射治疗剂量,延长疼痛缓解时间以及提高局部肿瘤控制率[4]。
1 资料与方法
1.1一般资料选择2014年1月至2015年3月在我院行IMRT的椎体转移肿瘤患者8例;均经病理证实。接受放疗或同步放化疗;KPS≥70分;患者可保持仰卧体位30 min以上;双臂可以自由上举或水平置于体侧,无强迫体位。其中男5例,女3例;年龄49~65岁,中位年龄57岁;其中1例放疗前手术治疗,椎体中有植入金属螺钉。见表1。
1.2放射治疗设备VARIAN IX 6 MV-X线图像引导直线加速器治疗机,120叶多叶准直器,剂量率选择400 cGy/min。西门子Somotom-sensation Plus-16螺旋CT,LAP移动激光定位系统(移动定位激光灯、数字控制软件和激光灯驱动系统),MEDTEC体位固定架,医用低温热塑记忆体膜,RSG型推拉盖恒温水箱,美国CMS-XiO 4.4计划系统。
1.3体位固定及扫描方式患者取仰卧位,B枕,双臂上举手臂交叉抱肘放置在额部或双臂置于体侧,热塑膜固定体位,在十字激光线的引导下标记患者体表参考摆位标记线,并做体表摆位标记。扫描范围包括病变椎体及其上下至少1个椎体范围,扫描层厚和层间距均为5 mm,获取患者定位图像,CT影像通过局域网络DICOM传输到治疗计划系统,勾画靶区及危及器官。

表1 患者一般临床资料
1.4靶区勾画标准及危及器官定义大体靶区(gross tumor volume,GTV)为CT及MR图像上所示椎体转移痛的病变区域。临床靶区(clinical target volume,CTV):在GTV基础上包括整个病变椎体,并包括病变椎体及其上下一个椎体。计划靶区(planning target volume,PTV):包括CTV上下0.5 cm,同时根据照射范围勾画出危及器官(risk at organs,OARs)如脊髓、左右肾、双侧肺等,脊髓外扩0.3 cm为计划危及器官(planning risk volume,PRV)。
1.5放疗计划优化标准应用CMS-XiO逆向治疗的计划系统制定放疗计划,采用Superposition计算方法,头脚方向、左右方向和胸前背后方向计算栅格均为 0.2 cm。给出肿瘤处方剂量要求及OARs剂量限制,处方剂量定义为5 000 cGy,要求95%PTV接受处方剂量。等中心选择在靶区中心附近椎体上中心附近,设计一前野加三后野,后三野角度约为140°、180°、220°,前野根据后三野和靶区形状及正常组织间位置关系选择合适的角度,共4野非均等角度动态调强计划设计。200~300 cGy/次,5次/周。脊髓外扩0.3 cm PRV最大受量5 000 cGy,脊髓SC最大剂量4 500 cGy,全肺V20≤20%,肾脏V30≤30%。
2 结果
2.1靶区及OARs受照剂量计划设计限制PTV95%接受处方剂量为5 000 cGy,PTV最大剂量为PTVDmax ,PRV最大剂量为PRVDmax,脊髓最大剂量为SCDmax,脊髓接受1 cc高剂量为SC1cc。见表2。

表2 靶区及重要器官受照剂量 cGy
2.2靶区中心层面SP直径和5 000 cGy等剂量线内环直径脊髓最大剂量小于4 500 cGy环绕脊髓,5 000 cGy环距离脊髓距离见表3。

表3 靶区中心层面SP直径和5 000 cGy等剂量线内环直径 cm
2.3横断面和沿脊髓横轴剂量分布见图1、2。
3 讨论
骨转移癌的主要症状是顽固性骨痛,难以缓解,常令患者难以忍受。放射治疗骨转移癌的目的是消除或减轻骨痛,提高生存质量,延长生存期,减低病理性骨折等并发症发生的危险[5]。椎体是肿瘤骨转移发生的常见部位之一,对于椎体的转移性肿瘤,放射治疗是首选治疗方案,甚至是某些预后差的患者唯一的治疗手段。当患者无或仅有轻微的神经功能受损,且不伴有骨性不稳定和神经压迫症状,肿瘤对放疗治疗敏感,单独放射治疗即可取得良好的治疗效果,包括缓解疼痛、缩小瘤体、抑制肿瘤的生长[6]。对椎体转移瘤的放疗与其他部位骨转移瘤不同,由于椎体转移病变邻近或包绕脊髓,脊髓受照射难以避免,正常脊髓组织的耐受剂量为4 500~5 000 cGy,超过此数值可能会造成放射性脊髓病[7],常规分次放疗脊髓受量达5 000 cGy时,5年内发生梗塞、坏死的比率为25%~50%[8];故常规放射治疗椎体转移瘤的最大安全照射剂量为4 500 cGy,而这一剂量显然无法彻底消灭肿瘤,加之其照射野较大,发生放射性食道炎、骨髓抑制的发生率高,存在明显不足[6]。放疗不良反应与照射剂量有直接关系,椎体放疗计划设计时由于不同位置脊髓的解剖结构及周围相邻器官不同,颈段椎管宽,含丰富的运动神经元,不易承受高剂量照射。易出现脊髓损伤;胸段脊柱后凸,胸段主要邻近肺、食管,在放疗过程应避免出现放射性肺炎。腰椎邻近肾脏、小肠,应避免出现放射性肾损伤及肠炎[9]。放射治疗引起的脊髓损伤与接受的最大剂量密切相关,脊髓作为串行器官,任何部位遭受大剂量的照射,都将导致整个脊髓的炎症,甚至瘫痪。Lo等[10]报道,单纯放射性脊髓炎发生的原因可能有:(1)直接外部辐射损伤椎管内中枢神经细胞;(2)内皮细胞放射性炎性改变,引起的动脉水肿改变,静脉阻塞,由于缺血而导致椎管内中枢神经坏死;(3)放疗辐射引起的过敏反应。椎管内中枢神经对辐射的敏感性从上到下逐渐降低[11]。椎体肿瘤放射治疗计划设计,高剂量区应尽量远离椎管内中枢神经,必须严格控制脊髓受照剂量,采用调强放射治疗,优化治疗计划可控制高剂量区域的位置,减少放疗并发症。
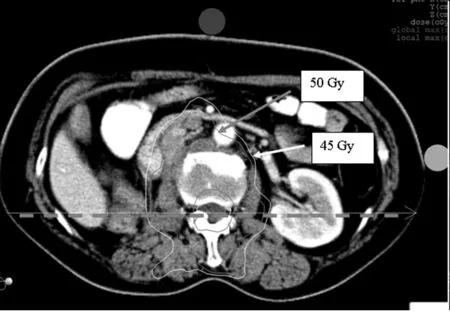
图1 横断面剂量分布
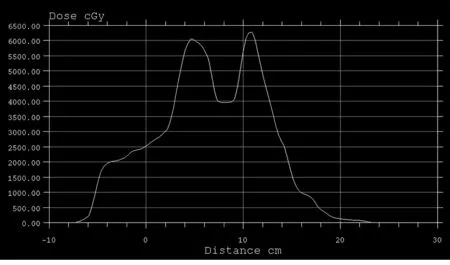
图2 沿脊髓横轴剂量分布图
国内外在对椎体肿瘤单次放疗剂量的问题上一直争议不断[7],在照射体积、照射剂量、分次剂量等方面均缺乏统一模式。传统放疗技术受限于危及器官放射耐受水平,对骨转移灶照射剂量较低[12]。常规放疗中脊髓受量与靶区处方剂量相当,所以限制了肿瘤放疗剂量的提高,难以得到满意的治疗效果,在保护脊髓的基础上增加靶区照射剂量是提高椎体转移瘤控制率的关键。对于常规放疗由于剂量限制很难既达到止痛效果同时提高肿瘤控制率的目的。常规骨转移瘤放射治疗剂量单次大剂量为800 cGy/F,采用多次分割高剂量照射,剂量分别为200 cGy/次,共20次;300 cGy/次,共10次;400 cGy/次,共7次;500 cGy/次,共5次。椎体转移瘤的放疗剂量-时间分割,目前尚无统一方案,宋大安等[13]对放射治疗椎体骨转移瘤放疗原则应根据病情及预计生存期的长短来决定。对一般情况好, 预计生存期长的患者,应采取积极的治疗, 给予常规分割4 000~5 000 cGy,4~5周,共20~25次。单次放射适应于非中线骨转移;行动不便急需解决骨痛的患者,对大多数无椎体骨或重要结构骨转移的初治骨转移瘤患者,可推荐单次大剂量放疗,但再放疗和病理性骨折的发生率高于分次放疗,推荐单次放疗用于活动及搬运困难的晚期乳腺癌骨转移患者。对于因其他治疗止痛无效而因疼痛需要放疗的骨转移患者,或有骨折风险患者,多选择多分次放射治疗。椎体骨转移应尽早治疗, 才可能保全或恢复患者的神经功能[13]。常规分割总的止痛效果明显优于大分割, 但大分割照射的止痛起效时间却明显快于常规分割照射。对于预期生存期超过1 年的患者, 建议采用常规分割止痛以取得最佳疗效; 不合并内脏转移及原发灶得到控制者生存期相对较长;对于不伴有内脏等重要部位转移的单纯性骨转移, 努力控制骨转移灶仍有积极意义[14],提高肿瘤剂量,以期提高肿瘤局部控制率。应用IMRT有望改善此问题,IMRT在三维方向上实现了高剂量区与靶区形状一致,通过逆向计划设计,能够处理复杂的临床病灶,最大限度地保护靶区内敏感的脊髓组织和靶区外重要器官,将高剂量区最大可能避开脊髓,减少脊髓受量,提高靶区剂量,增加局部控制率而不增加脊髓神经并发症[9,15]。本研究中所有患者PTV95%处方剂量均能达到为5 000 cGy以上,从剂量分布图(图1和2)中可以看出脊髓最大剂量在4 500 cGy以下,不仅能够有效的保护重要器官,同时根据临床需要给予肿瘤以治疗剂量,与传统的放射治疗方式不同,剂量梯度变化大,治疗精度高,从表3看出中心平面处脊髓边缘剂量梯度变化1 000~1 790 cGy/cm,从处方剂量到脊髓限量处即靶区外剂量跌落迅速,剂量梯度大,在保证处方剂量和靶区适形度及95%处方剂量覆盖靶区的同时降低脊髓照射剂量,给予脊髓最大的保护。靶区边缘剂量跌落梯度的变化,不仅可以用于评价计划的好坏,而且也可用于选择不同的治疗方案。剂量梯度变化可以分为靶区内剂量变化越小越好,从处方剂量到脊髓限量处剂量梯度变化越大越好,在脊髓限量之外剂量梯度变化略有所增大,根据靶区周围危及器官(脊髓)限量越严格,剂量差越大,剂量变化间距越小,剂量跌落梯度越快。调强放疗的目的就是要在靶区达到处方剂量的同时保证周围重要器官和正常组织的受量达到最低,王金媛等[16]报道对胸椎转移瘤患者的射波刀(Cyberknife)计划进行研究,由于椎体转移瘤紧挨脊髓,对脊髓的剂量限值要求严格,因此从处方剂量到脊髓限量处剂量跌落的速度最快,4 000 cGy组为(0.175±0.026)mm/100cGy,3 300 cGy组为(0.255±0.042)mm/100 cGy;从脊髓限量到处方剂量30%处的速度就有所下降,导致整体水平较脊髓方向有所降低,4 000 cGy组为(0.208±0.085)mm/100 cGy,3 300 cGy组为(0.311±0.089)mm/100 cGy。同传统放疗不同,调强放疗剂量梯度 变化陡峭 ,因此对治疗精度有极高的要求。传统放疗单一依靠体表标记线作为治疗摆位的参考,因此治疗误差较大,通常认为摆位误差可达0.5~1 cm[12]。对于摆位误差1 cm 可能使脊髓落到高剂量区范围内从而导致严重后果。图像引导放射 治疗 (image guide radiation therapy,IGRT)是减少摆位误差的有效手段[17],纠正摆位误差,保证治疗精度。
对于放疗前已接受手术治疗,有内置金属物或内置骨水泥的患者,在放疗前准备及靶区勾画时需考虑内置物的影响。放疗前CT扫描定位时内置物金属出现较明显伪影.使得内置物金属处椎体图像不能清晰,影响病变椎体的靶区勾画及脊髓勾画,金属内置物对放射线具有局部反射,内置物周围组织器官存在局部散射剂量[9,18],椎体内植入物对放射治疗剂量的影响主要原因是,射线穿过椎体内植入物时会有较大程度的衰减,进而影响治疗肿瘤的放射剂量,以及椎体内植入物的散射能引起其入射面表面剂量的增加。王建平等[19]报道在能量6 MV X线、不同放射剂量(300、600、1 200 cGy)下,对于前路钛网骨水泥+前路钛合金钉板系统模型,椎体前缘、椎管前壁、椎管中央、椎管后壁和棘突中部的放射剂量值逐渐增加。对椎体内有金属内置物椎体转移瘤的放疗剂量应适当降低单次剂量,增加肿瘤照射总剂量,提高肿瘤局部控制率。
随着IMRT技术的临床应用,放射治疗技术所追求的目的就是要在靶区达到处方剂量的同时保证周围组织的受量达到最低。而靶区外剂量跌落的迅速,陡峭的剂量梯度,在保证最佳的处方剂量分布、靶区适形度以及靶区覆盖度的同时,给予脊髓最大的保护和最低的照射剂量[16]。对椎体肿瘤特别是环绕脊髓的椎体肿瘤,采用调强放射治疗可有效地避免脊髓损伤,在减低脊髓受照射剂量同时提升椎体肿瘤照射剂量,从而提高椎体肿瘤局部控制率。
1孟娜,王俊杰.椎体转移瘤放射治疗进展.癌症进展,2012,10:53-56.
2蒋伟刚,刘耀升,刘蜀彬.脊柱转移瘤放射治疗的研究进展.中国骨与关节杂志, 2015,4:822-825.
3杨军,马林.椎骨及椎旁转移瘤立体定向放射治疗进展, 解放军医学院学报,2013,34:1300-1302.
4Guckenberger M,Hawkins M,Flentje M,et al.Fractionated radiosurgery for painful spinal metastases:DOSIS-a phase II trial.BioMed central Cancer,2012,19:530-539.
5刘晓川,何方琦.放射治疗脊椎(胸椎、腰椎)转移癌的疗效观察.中国医疗前沿,2013,8:46.
6李爱民,曹旭晨.脊柱转移性肿瘤的评分和局部治疗.中国肿瘤临床杂志,2013,40:869-872.
7沈永刚,徐万龙,杨辉,等.脊柱图像引导放射治疗方案优化的实验研究.中国脊柱脊髓杂志,2013,23:827-832.
8Bartels RH,van der Linden YM,van der Graaf WT.Spinal extra-dural metastasis:review of current treatment options.CA CancerJ Clin,2008,58:245-259.
9锡林宝勒日,刘婷,王义海,等. 调强放射治疗对不同节段脊柱转移瘤靶区制定的意义及疗效评价.中华骨科杂志,2011,31:670-675.
10Lo YC,Mobride WH,Withers HR.Effect of single does of radiation on mouse spinalcord.Radiat Oncology Biol Phys,1992,22:57-63.
11祝淑钗,李娟,邱嵘,等.三维适形放射治疗计划评价食管癌根治术后预防性照射野.中华放射肿瘤学杂志,2004,13:21-25.
12刘志凯,杨波,孙显松,等.图像引导下的大分割调强放射治疗骨转移癌临床研究.中国疼痛医学杂志,2014,20:576-579.
13宋大安,王庆夕.40例椎体骨转移癌的放射治疗观察.河南肿瘤学杂志,2004,17:346-347.
14顾科,张军宁.转移性骨肿瘤放射治疗临床分析.中华放射医学与防护杂志,2006,26:595-597.
15韩守云,夏火生,李苹,等.脊椎转移癌的三维适形放射治疗.中国骨肿瘤骨病,2006,5:151-153.
16王金媛,鞠忠建,王小深,等.椎体转移瘤立体定向放射治疗剂量跌落梯度分析.中国医学装备,2015,12:1-5.
17Guckenberger M,Meyer J,Wilbert J,et al,Precision required for dose-escalated treatment of spinal metastases and implications for image-guided radiation therapy(IGRT).Radiotherapy and Oncology,2007,84:56-63.
18刘明,李兴德,牛庆国,等.体内金属植入物对放疗剂量分布影响.中华放射肿瘤学杂志,2010,19:459-462.
19王建平,李景峰,蔡林,等.不同照射条件下脊柱内固定系统对脊柱肿瘤放射治疗的影响.中华实验外科杂志,2015,32:1544-1546.
10.3969/j.issn.1002-7386.2016.21.012
项目来源:河北省医学科学研究重点课题计划(编号:1120140175)
050051石家庄市,河北医科大学第三医院
翟福山,050051石家庄市,河北医科大学第三医院;E-mail:zhaifushan@126.com
R 445
A
1002-7386(2016)21-3244-04
2016-04-17)
